La infección crónica por el virus de la hepatitis C (VHC) es un factor de riesgo para desarrollar placas de ateroma, aunque se desconoce el posible efecto al eliminar el virus. Nuestro objetivo fue analizar si tras 12 meses de la erradicación del VHC por antivirales de acción directa (AAD) mejoraba la ateromatosis subclínica y existía modificación en la composición de las placas.
Materiales y métodosEstudio prospectivo que incluyó 85 pacientes con infección crónica por VHC en diferentes estadios de fibrosis, sometidos a AAD. Se excluyeron pacientes con antecedentes cardiovasculares, diabetes y enfermedad renal. Se realizó ecografía arterial (carótidas y femorales) para diagnosticar placa de ateroma (definida como grosor íntima-media≥1,5mm) y se analizó su composición (porcentaje de lípidos, fibrosis y calcio con software HEMODYN4) al inicio del estudio y tras 12 meses de finalizar la terapia.
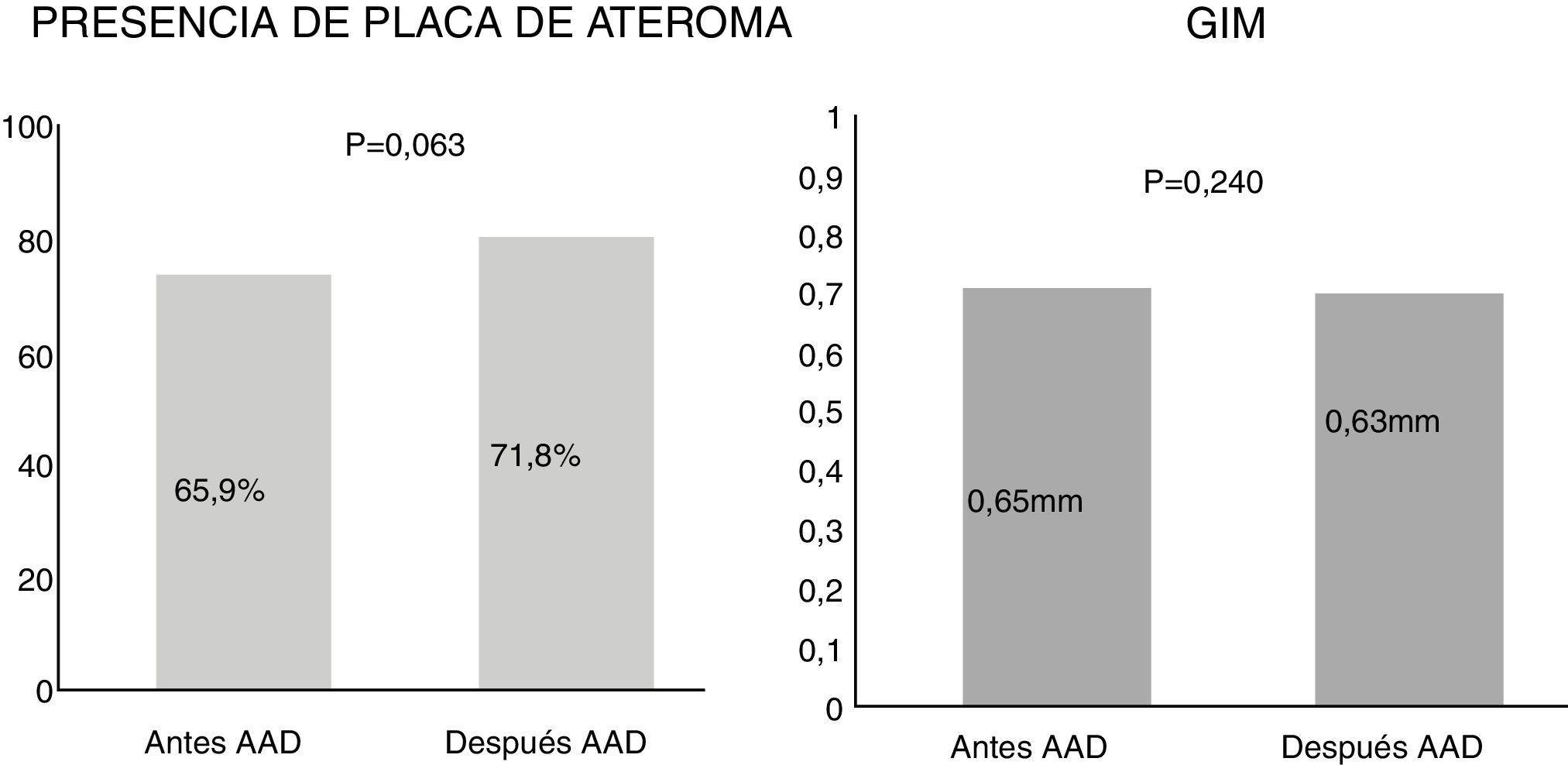
ResultadosTras el seguimiento no se detectaron cambios en el grosor íntima-media (0,65mm vs. 0,63mm, p=0,240) ni en la presencia de placas (65,9%vs. 71,8%, p=0,063). Tampoco hubo modificación significativa en la composición de las mismas ni del territorio vascular afecto, observándose un aumento del perfil lipídico en sangre (p<0,001) tras 12 meses del tratamiento. Estos resultados se confirmaron en subgrupos por gravedad de enfermedad hepática.
DiscusiónLa erradicación del VHC por AAD no mejora las placas de ateroma ni varía su composición, independientemente de la fibrosis hepática. Se precisan más estudios prospectivos que evalúen el riesgo residual cardiovascular tras la erradicación viral.
Chronic infection with hepatitis C virus is a risk factor for developing atheromatous plaques, although the possible effect of virus clearance is unknown. Our aim was to determine whether or not subclinical atheromatosis improved and there was any modification in the composition of the plaques 12 months after eradication of hepatitis C virus by direct-acting antiviral agents.
Materials and methodsProspective study that included 85 patients with chronic hepatitis C virus infection in different stages of fibrosis who were on direct-acting antiviral agents. Patients with a cardiovascular history, diabetes and kidney disease were excluded. An arterial ultrasound (carotid and femoral) was performed to diagnose atheromatous plaques (defined as intima-media thickness ≥1.5mm) and the composition (percentage of lipids, fibrosis and calcium with HEMODYN4 software) was analysed at the beginning of the study and 12 months after stopping the therapy.
ResultsAfter follow-up no changes were detected in the intima-media thickness (0.65mm vs. 0.63mm, P=.240) or in the presence of plaques (65.9% vs 71.8%, P=.063). There was also no significant change in their composition or affected vascular territory, with an increase in blood lipid profile (P<.001) after 12 months of treatment. These results were confirmed in subgroups by severity of liver disease.
DiscussionThe eradication of hepatitis C virus by direct-acting antiviral agents does not improve the atheroma plaques and nor does it vary their composition, regardless of liver fibrosis. More prospective studies are needed to evaluate residual cardiovascular risk after virus eradication.
El virus de la hepatitis C (VHC) continúa siendo una enfermedad prevalente en el mundo, de 2,3% a 1,5% según la distribución geográfica. Los nuevos antivirales de acción directa (AAD) obtienen tasas de respuesta viral sostenida (RVS) del 95-99%1. En España, desde la implantación del Plan Estratégico Nacional para el abordaje de la hepatitis C en 2015, alrededor de unos 100.000 pacientes han conseguido eliminar el virus2.
La infección crónica por VHC no solo produce mayor riesgo de mortalidad y complicaciones por la afectación hepática, sino también por las manifestaciones extrahepáticas3. Múltiples estudios destacan que los pacientes infectados por VHC presentan mayor número de manifestaciones relacionadas con disfunción del sistema inmune y alteraciones metabólicas en comparación con la población sin infección4.
En los últimos años se ha publicado que la infección por VHC provoca mayor riesgo de arteriosclerosis carotídea, enfermedad arterial periférica, coronaria, eventos cerebrovasculares y mortalidad cardiovascular5–7. Estos datos se han contrastado en un reciente metaanálisis, que respalda una posible asociación entre la infección por VHC y el riesgo de enfermedad cardiovascular; sin embargo, se requiere una mejor comprensión de esta asociación, dado la heterogenicidad de los estudios8.
Actualmente, las enfermedades cardiovasculares representan uno de los principales motivos de morbimortalidad, por lo que se precisa del estudio vascular ecográfico para conocer el riesgo cardiovascular en cada población. El grosor de la capa íntima-media (GIM) y la presencia de placas en las arterias carótidas y femorales son marcadores subclínicos de arteriosclerosis, y se consideran predictores independientes de eventos cardiovasculares9. Otro predictor es la vulnerabilidad de la placa10 medida por el área de la placa o el grado de estenosis, y la composición o mediana de los niveles de grises ecográfica de la placa. Está aceptado que placas oscuras y homogéneas suponen presencia de lípidos y que representan placas más vulnerables11.
Los mecanismos aterogénicos del VHC no son del todo conocidos, pero parecen estar relacionados con el estado de inflamación crónica sistémica y el efecto patógeno del virus sobre los vasos12,13. El estrés oxidativo que genera el VHC modifica las lipoproteínas de baja densidad, depositándolas más fácilmente en las paredes arteriales, disminuyendo los niveles séricos de colesterol14, por lo que estos pacientes desarrollan arteromatosis sin presentar el patrón clásico de dislipidemia15.
Estos mecanismos, diferentes a los de la población general, podrían modificar la composición de las placas de ateroma en los pacientes infectados por VHC, aunque por el momento no existen estudios al respecto. Diferentes publicaciones en población general, defienden que las placas fibro-calcificadas son más estables, mientras que las placas lipídicas son más vulnerables, y provocan con mayor frecuencia eventos cardiovasculares9–11,16–20. También se ha detectado que las placas lipídicas revierten más fácilmente con tratamiento hipolipidemiante intensivo, disminuyendo el core lipídico, que las placas fibro-calcificadas21.
El uso de fármacos AAD eficaces y seguros para la curación de VHC plantea la cuestión de si la erradicación del virus también puede mejorar las manifestaciones cardiovasculares. La mayoría de los datos disponibles son de pacientes tratados con terapias basadas en interferón (IFN), y sugieren que la respuesta viral sostenida reduce el riesgo cardiovascular22–25, aunque el diseño de estos estudios no permite discernir si este efecto se debe a la eliminación del virus o al propio uso del IFN, existiendo sesgos en estos resultados.
Con el fin de resolver esta cuestión realizamos este estudio, donde evaluamos el impacto tras 12 meses de obtención de RVS del VHC sobre las placas de ateroma, tanto en territorio vascular carotídeo como femoral en una cohorte de pacientes con hepatitis crónica C que se trataron con AAD, estratificando el efecto según la gravedad de la enfermedad hepática y los diferentes factores de riesgo cardiovascular. También analizamos la composición de las placas detectadas por escala de grises ecográfica, y valoramos si se produjo alguna modificación del porcentaje de lípidos, fibrosis y calcio tras la curación del virus.
Pacientes y métodosSe trata de un estudio prospectivo realizado en 2 hospitales de Lleida (Hospital Universitario Arnau de Vilanova y Hospital Universitario de Santa María) en colaboración con la Unidad de Detección y Tratamiento de Enfermedades Aterotrombóticas (UDETMA) del Hospital Universitario Arnau de Vilanova de Lleida durante el periodo de 2015 a 2018.
Inicialmente se incluyeron 185 pacientes con infección crónica por VHC que no tenían criterios de exclusión para el estudio expuestos en el párrafo inferior. Estos pacientes se trataron con antivirales de acción directa según los protocolos European Association Study of Liver26, Asociación Española para el Estudio del Hígado27 y la guía de tratamiento del VHC del Institut Català de Salut 28 vigentes durante el estudio (2015-2018). Tras el periodo de seguimiento (12 meses tras la curación del virus con el tratamiento) solo 85 pacientes (un 45% de la muestra inicial) se realizaron la segunda ecografía vascular. Aunque hubo pérdidas en el seguimiento, se mantuvieron similares las características de los pacientes en cuanto a factores de riesgo CV, genotipo viral y gravedad de la enfermedad hepática. Se confirmó la presencia de infección crónica por VHC con anticuerpos antiVHC y ARN del virus (ARN VHC: reacción en cadena de la polimerasa con trascripción inversa con límite de detección de 12IU/ml) de cualquier genotipo y grado de fibrosis hepática. Las mediciones de ARN del VHC se repitieron después de 4 semanas de terapia, al final de la misma y a las 12 semanas de concluir el tratamiento. La RVS se definió como el ARN del VHC indetectable después de 12 semanas del final la terapia con AAD.
Los criterios de exclusión incluyeron: 1) edad<30 o>75 años; 2) cirrosis descompensada; 3) presencia de carcinoma hepatocelular u otros tumores; 4) enfermedad hepática crónica no VHC (por alcohol, virus de la hepatitis B, enfermedad autoinmune o por depósito de hierro); 5) infección por el VIH; 6) enfermedad inflamatoria o infecciosa aguda o crónica; 7) antecedentes de eventos cardiovasculares previos según la Clasificación Internacional de Enfermedades, 10.ª revisión (ICD10-CM): —a) enfermedad cerebrovascular: ataque isquémico transitorio y/o accidente cerebrovascular estable; b) enfermedad cardíaca isquémica: infarto agudo de miocardio, angina de pecho inestable, arritmias y/o insuficiencia cardiaca congestiva; y c) enfermedad arterial periférica de las extremidades inferiores o aneurisma aórtico—; 8) insuficiencia renal crónica (ecuación CKD-EPI<60ml/min/1,73m2); 9) diagnóstico de diabetes mellitus; 10) pacientes con dislipidemia tratados con hipolipidemiantes; y 11) antecedentes de hipertensión arterial en tratamiento.
El estudio fue evaluado y aprobado por el comité de ética de los hospitales participantes, y todos los pacientes firmaron el consentimiento informado del mismo.
Datos clínicos y analíticosLos datos clínicos y analíticos de los pacientes se recogieron en la consulta de hepatología, antes y tras 12 meses de finalizar el tratamiento antiviral de acción directa.
Se utilizaron muestras de sangre en ayunas para medir los siguientes parámetros séricos: glucosa, colesterol total (CT), colesterol LDL y HDL, triglicéridos (TG), creatinina y transaminasas hepáticas (AST y ALT). Se calcularon los coeficientes lipídicos: colesterol no HDL (colesterol total- HDL colesterol), TG/HDL colesterol (indicador de resistencia a la insulina) y CT/HDL colesterol (índice aterogénico), realizando todas las determinaciones antes y después del tratamiento en el mismo laboratorio. Se detectó el ARN del VHC (RT-PCR: límite 12IU/ml) y el genotipo del virus (INNO-liPA HVC II, Bayer®). A todos los pacientes se les realizó elastografía de transición (Fibroscan®, Echosens, Paris, Francia) para valorar el grado de fibrosis hepática clasificándolo según lo establecido (menor de 7,5KPas —no fibrosis [F0-1], de 7,6-9,5 KPas, fibrosis moderada [F2], de 9,6-12,5 KPas— fibrosis significativa (F3) y mayor de 12,5KPas cirrosis hepática [F4]). Se determinaron los niveles de transaminasas antes y después del tratamiento para valorar la presencia de esteatosis hepática, con el Hepatic Steatosis Index (HSI=8×ALT/AST+IMC+2 [si diabetes mellitus]+2 [si mujer]>36).
Los datos antropométricos para el cálculo de índice de masa corporal (IMC) y diagnóstico de hipertensión se recogieron en la UDETMA antes y tras 12 semanas de terapia y de realizar la ecografía-Doppler vascular. Se midió el peso (kilogramos) y la altura (centímetros), realizándose una clasificación de los paciente por IMC (peso normal: IMC=18,5-24,9kg/m2; sobrepeso: IMC=25-29,9 y obesidad: IMC>30). El diagnóstico de hipertensión arterial (presión arterial sistólica>135mmHg y/o presión arterial diastólica>85mmHg) se midió 3 veces con una diferencia de unos 30minutos entre cada medición, con un esfigmomanómetro braquial. Se indagó en la historia de tabaquismo en todos los pacientes, clasificándolos como fumadores (cuantificando el número de cigarrillos consumidos al día), exfumadores o no fumadores, evaluando así factores de riesgo clásicos de enfermedad ateromatosa.
Evaluación de ateromatosis carotídea y femoralSe definió ateromatosis subclínica como el aumento de GIM y la presencia de una o más placas de ateroma (GIM>1,5mm) en cualquiera de los territorios estudiados.
La ateromatosis subclínica fue analizada por 2 expertos técnicos de la UDETMA con un ecógrafo de General Electric, modelo vivid-i con una sonda vascular 12L-RS, siguiendo un protocolo estandarizado con un coeficiente interobservador Kappa de 1. Las imágenes fueron analizadas de forma ciega por un solo lector de la UDETMA29. El estudio ecográfico se realizó en 2 ocasiones: en el momento de inclusión en el estudio (antes del tratamiento con AAD) y después de 12 meses tras alcanzar RVS.
La carga ateromatosa se evaluó en diferentes territorios vasculares: arterias carotídeas (carótida común, bulbo y carótida interna de ambos lados: derecho e izquierdo) y de arterias femorales (común y superficial, también de ambos lados). Se analizó GIM y la presencia de placa (definida como la diferencia de la luz de la íntima y la adventicia de la pared arterial a partir de 1,5mm [GIM>1,5mm]) en cada uno de estos 10 segmentos, mediante ecografía-Doppler color vascular modo b de alta resolución, según el consenso de Mannheim30. El GIM se midió en la pared distal en todos los territorios vasculares mencionados, siempre que no hubiera presencia de placa de ateroma. El valor de GIM fue el valor medio de todos los valores. Tanto el aumento del GIM como la presencia de placa en arterias carótidas y femorales en pacientes asintomáticos son factores predictores independientes de enfermedad cardiovascular19. Otro marcador ecográfico de eventos cardiovasculares es la vulnerabilidad de la placa de ateroma, midiendo el área y la composición por escala de grises según su ecogenicidad16.
Las placas se midieron en todos los territorios explorados, siendo el área total de placa el sumatorio de todos los valores obtenidos (carótidas y femorales). El número de píxeles dentro del contorno de la placa se utilizó para estimar el tamaño en ese corte ecográfico (140píxeles/cm).
En el estudio de la composición de la placa de ateroma se utilizó un software (HEMODYN 4M, Dinap SRL, Argentina) que permitió calcular el porcentaje de lípidos, tejido fibroso y calcio presente en las diferentes placas exploradas. Se basa en un análisis computarizado de escala de mediana de grises según la ecogenicidad, realizando un mapeo de los píxeles de la placa, obteniendo resultados más cuantitativos, objetivos y menos observador-dependientes16. Esta caracterización se ha demostrado que tiene buena correlación con los componentes histológicos de la placa de ateroma17,18.
Análisis estadísticoSe realizó un análisis descriptivo que incluyó frecuencias y porcentajes para las variables cualitativas, comparadas entre ellas con la prueba de Chi-cuadrado de Pearson; medias y desviaciones estándar para los datos cuantitativos. Para evaluar la relación entre las placas de ateroma antes del tratamiento y después del tratamiento hicimos una regresión logística con los parámetros clínicos y bioquímicos en toda la cohorte de pacientes con infección por VHC. Para la modificación de placa de ateroma (GIM>1,5mm, variable dicotómica) antes y después de tratamiento antiviral se utilizó el test de McNeman. En la modificación de GIM (medida solo en los pacientes que no presentaban placa de ateroma GIM>1,5mm, cuantitativa) y de los diferentes parámetros analíticos se utilizó la «t» Student para datos apareados en las variables que siguen una distribución normal, y el test de Willcoxon en variables con distribución no normal. Se valoró de forma segmentada las modificaciones según los grados de fibrosis y los diferentes factores de riesgo cardiovascular. La significación estadística se fijó en un valor de p<0,05. Todos los análisis se realizaron utilizando el software SPSS (versión 24).
ResultadosCaracterísticas de los pacientes infectados con el virus de la hepatitis C antes del tratamiento con antivirales de acción directaLas características de los 85 pacientes estudiados se resumen en la tabla 1. El 47% eran hombres y la media de edad de 55 años. Solo el 16,5% de los pacientes era mayor de 65 años. Al evaluar los factores de riesgo clásicos de enfermedad ateromatosa observamos que el 25,9% eran obesos (IMC>30kg/m2), 14,1% hipertensos, 3,5% presentaban dislipidemia. Ninguno de los pacientes tenía diabetes mellitus. Un 62,4% contaba hábito tabáquico. Un 57,6% de la muestra presentaba esteatosis hepática según la fórmula HSI. Los valores medios de presión arterial, glucosa, creatinina, perfil lipídico y el índice de insulina resistencia (medido con el coeficiente TG/HDL) estaban dentro del rango de la normalidad. La mayoría de los pacientes estaban infectados por genotipo 1. Un 57,5% de pacientes presentaba enfermedad hepática crónica avanzada (F3-F4), siendo el 34% de los mismos cirróticos.
Características de los pacientes VHC tratados con antivirales de acción directa (AAD)
| VHC positivo(n=85) | |
|---|---|
| Sexo masculino | 40 (47,1%) |
| Edad (años) | 54,78 (33-75) |
| Hábito tabáquico | |
| No fumadorExfumadorFumador<10 cigarrillos/díaFumador>10 cigarrillos/día | 32 (37,6%)27 (31,8%)16 (18,8%)10 (11,8%) |
| Esteatosis Hepatica (HSI) | 49 (57,6%) |
| GIM (mm)a | 0,65±0,10 |
| Placa de ateroma | 56 (65,9%) |
| Genotipo | |
| 1234 | 59 (69,4%)6 (7,1%)8 (9,4%)12 (14,1%) |
| Carga viral (UI/ml) | 16,5.106±3,0.106 |
| Tiempo de evolución de infección por VHC (años) | 10,3±4,7 |
Variable cuantitativa: media±DE (rango); variable cualitativa: n (%).
GIM: grosor íntima-media carotídeo; HSI: hepatic steatosis index; VHC: virus de hepatitis crónica C.
aEn pacientes que no presentan placa de ateroma (29 pacientes).
En el momento del reclutamiento el 61,2% de los pacientes era naive y el 38,8% era no respondedor a biterapia (IFN pegilado y ribavirina). Todos ellos se trataron con AAD siguiendo las directrices de la guía de tratamiento del VHC según los criterios del Institut Català de Salut en el periodo 2015-2018: 51,6% con sofosbuvir/ledipasvir±ribavirina durante 12-24 semanas, 17,6% con sofosbuvir-simeprevir±ribavirina durante 12 semanas, 4,7% sofosbuvir±ribavirina durante 24 semanas, 7,1% con sofosvubir-daclatasvir±ribavirina durante 12semanas y 19% con ombitasvir-paritaprevir-ritonavir y dasabuvir±ribavirina durante 12-24 semanas. Un 8,2% fue no respondedor a inhibidores de proteasas de primera generación (boceprevir/ telaprevir), tratándose posteriormente con inhibidores de las proteasas de segunda generación, alcanzando respuesta viral sostenida.
Ateromatosis subclínica y factores de riesgo al inicio del estudioEn 29 pacientes (34,1%) no se observaron placas de ateroma, hallándose un GIM medio de 0,65±0,10mm. Por el contrario, en 56 pacientes (65,9%) se detectaron placas en algún territorio vascular (tanto carotídeo como femoral). Ninguno de los participantes del estudio tenía estenosis vascular clínicamente significativa (definida como estrechamiento de la luz vascular por placa de ateroma>60%) ni ulceración de la placa.
Se observó que el sexo masculino, la historia de tabaquismo previo, el genotipo, la fibrosis, el índice de masa corporal, la tensión arterial sistólica, los niveles de HDL colesterol, triglicéridos y el índice de insulinorresistencia se asociaban de forma significativa con presencia de placa de ateroma. En el modelo de regresión multivariante solo el sexo (OR: 6,02 [IC: 1,46-24,78]; p=0,013) y el genotipo viral (OR: 2,56 [IC: 1,13-5,77]; p=0,024) eran factores independientes de presencia de placa en los pacientes infectados con VHC.
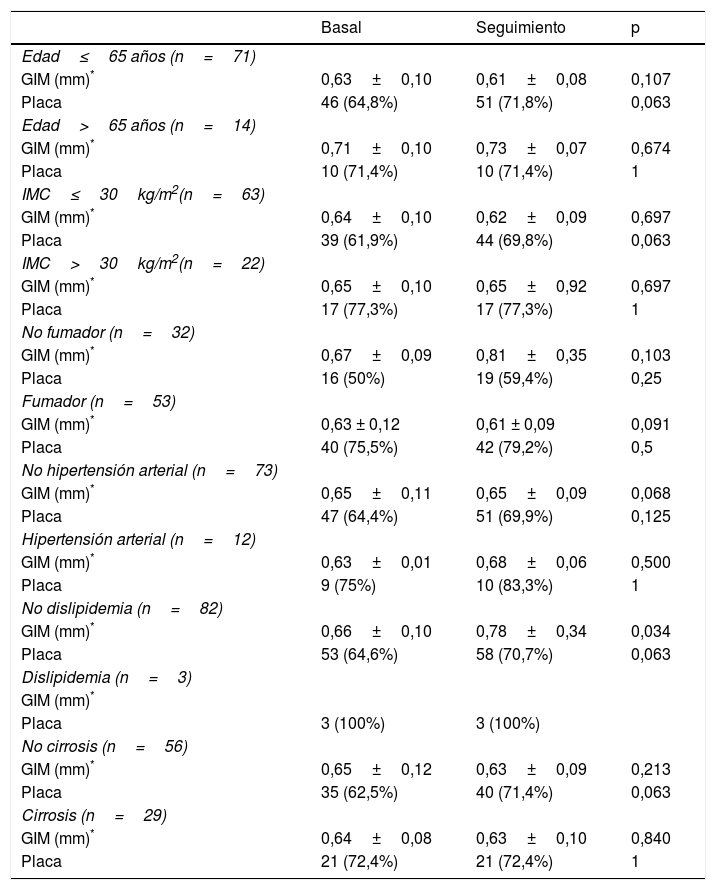
Ateromatosis subclínica después de la terapia antiviralAl analizar la media de GIM tras 12 meses de tratamiento antiviral observamos una tendencia a la mejoría, pero sin ser significativa (0,65mm vs. 0,63mm). Tampoco detectamos diferencias relevantes en la presencia de placas de ateroma tras un año del tratamiento (65,9% vs. 71,8%, p=0,063) (fig. 1). Antes de la terapia antiviral se analizó el GIM en 29 pacientes (que no presentaban placas), tras el tratamiento en el periodo de seguimiento el GIM se analizó en 24 pacientes, ya que se observó más placa de ateroma.
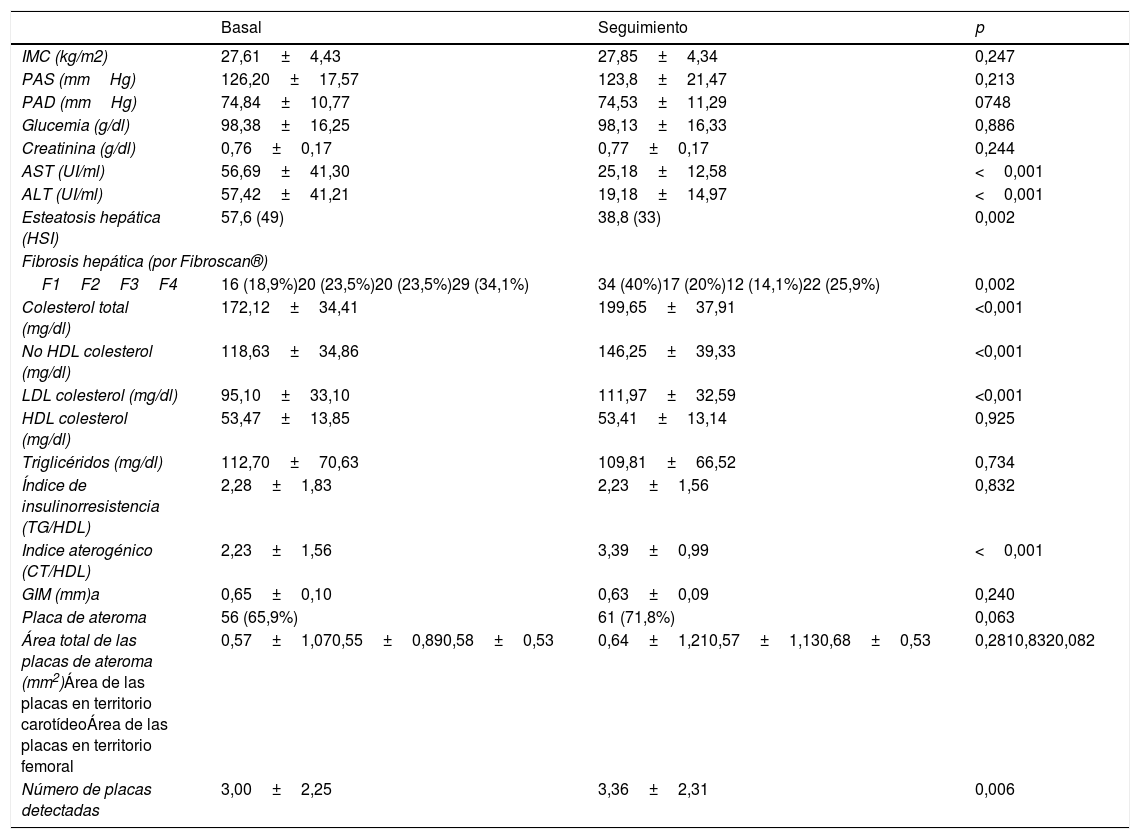
Respecto a los parámetros de hepatopatía hallamos una reducción en los niveles de transaminasas, tanto AST (56,69UI/ml vs. 25,18UI/ml, p<0,001) y ALT (57,42UI/ml vs. 19,18UI/ml, p<0,001), así como de la presencia de esteatosis hepática calculada con el HSI (57,6% antes de AAD vs. 38,8% después de AAD, p=0,002). También se observó mejoría de la fibrosis hepática medida con elastografía hepática (Fibroscan®) tras 12 meses del tratamiento (F1=18,8%, F2=23,5%, F3=23,5%, F4=34,1% vs. F1=40%, F2=20%, F3=14,1%, F4=25,9%; p<0,001).
No se objetivaron modificaciones en el IMC, la presión arterial sistólica, diastólica ni los niveles de glucemia. Se observó un empeoramiento significativo en el perfil lipídico tras los 12 meses de tratamiento antiviral (colesterol total 172,12mg/dL vs. 199,65mg/dL, p<0,001; no HDL-colesterol 118,63mg/dL vs. 146,25mg/dL, p<0,001, y LDL colesterol 95,10mg/dL vs. 111,97mg/dL, p<0,001), detectándose un aumento significativo del índice aterogénico (CT/HDL) en el primer año en los pacientes que habían recibido tratamiento antiviral (2,23±1,56 vs. 3.39±0,99; p<0,001). No hubo modificación en los niveles de HDL colesterol ni triglicéridos ni en el coeficiente de insulinorresistencia (TG/HDL) (tabla 2).
Características de los pacientes VHC antes y después de 12meses de tratamiento con antivirales de acción directa (AAD)
| Basal | Seguimiento | p | |
|---|---|---|---|
| IMC (kg/m2) | 27,61±4,43 | 27,85±4,34 | 0,247 |
| PAS (mmHg) | 126,20±17,57 | 123,8±21,47 | 0,213 |
| PAD (mmHg) | 74,84±10,77 | 74,53±11,29 | 0748 |
| Glucemia (g/dl) | 98,38±16,25 | 98,13±16,33 | 0,886 |
| Creatinina (g/dl) | 0,76±0,17 | 0,77±0,17 | 0,244 |
| AST (UI/ml) | 56,69±41,30 | 25,18±12,58 | <0,001 |
| ALT (UI/ml) | 57,42±41,21 | 19,18±14,97 | <0,001 |
| Esteatosis hepática (HSI) | 57,6 (49) | 38,8 (33) | 0,002 |
| Fibrosis hepática (por Fibroscan®) | |||
| F1F2F3F4 | 16 (18,9%)20 (23,5%)20 (23,5%)29 (34,1%) | 34 (40%)17 (20%)12 (14,1%)22 (25,9%) | 0,002 |
| Colesterol total (mg/dl) | 172,12±34,41 | 199,65±37,91 | <0,001 |
| No HDL colesterol (mg/dl) | 118,63±34,86 | 146,25±39,33 | <0,001 |
| LDL colesterol (mg/dl) | 95,10±33,10 | 111,97±32,59 | <0,001 |
| HDL colesterol (mg/dl) | 53,47±13,85 | 53,41±13,14 | 0,925 |
| Triglicéridos (mg/dl) | 112,70±70,63 | 109,81±66,52 | 0,734 |
| Índice de insulinorresistencia (TG/HDL) | 2,28±1,83 | 2,23±1,56 | 0,832 |
| Indice aterogénico (CT/HDL) | 2,23±1,56 | 3,39±0,99 | <0,001 |
| GIM (mm)a | 0,65±0,10 | 0,63±0,09 | 0,240 |
| Placa de ateroma | 56 (65,9%) | 61 (71,8%) | 0,063 |
| Área total de las placas de ateroma (mm2)Área de las placas en territorio carotídeoÁrea de las placas en territorio femoral | 0,57±1,070,55±0,890,58±0,53 | 0,64±1,210,57±1,130,68±0,53 | 0,2810,8320,082 |
| Número de placas detectadas | 3,00±2,25 | 3,36±2,31 | 0,006 |
ALT: alanino-aminotransminasa; AST: aspartato-aminotransaminasa; CT: colesterol total; GIM: grosor íntimo-media carotídeo; HDL: lipoproteína de alta densidad; HSI: Hepatic Steatosis Index; IMC: índice de masa corporal; LDL: lipoproteína de baja densidad; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos.
aEn pacientes que no presentan placa de ateroma (basal=29 pacientes/seguimiento=24 pacientes).
Variable cuantitativa: media±DE; variable cualitativa: n (%).
Umbral significativo: p<0,05.
Tras 12 meses del tratamiento con AAD, tampoco se hallaron diferencias en el área total de las placas detectadas (p=0,281), ni en territorio carotídeo ni femoral, pero sí mayor detección de número de placas en este periodo de tiempo (p=0,006).
En particular, al observar los factores asociados a la diferencia de GIM y la presencia de placa postratamiento, ninguno de los parámetros basales ni cambios analíticos se encontraban asociados (p>0,10). De acuerdo con estos resultados, la no variación del GIM ni la presencia de placa de ateroma fue confirmado en los subgrupos de pacientes divididos según factores de riesgo cardiovascular y severidad de la enfermedad hepática (tabla 3). Se detectó tendencia a la mejoría sin ser significativo del GIM en pacientes menores de 65 años, no obesos, no fumadores, no hipertensos ni dislipidémicos, tanto en pacientes cirróticos como no cirróticos. Sin embargo, la fuerza de este análisis está limitada por el pequeño número de pacientes en cada subgrupo.
Cambios del GIM y la presencia de placa de ateroma antes y tras 12 meses de tratamiento con AAD por subgrupos de acuerdo a los factores de riesgo cardiovascular
| Basal | Seguimiento | p | |
|---|---|---|---|
| Edad≤65 años (n=71) | |||
| GIM (mm)* | 0,63±0,10 | 0,61±0,08 | 0,107 |
| Placa | 46 (64,8%) | 51 (71,8%) | 0,063 |
| Edad>65 años (n=14) | |||
| GIM (mm)* | 0,71±0,10 | 0,73±0,07 | 0,674 |
| Placa | 10 (71,4%) | 10 (71,4%) | 1 |
| IMC≤30kg/m2(n=63) | |||
| GIM (mm)* | 0,64±0,10 | 0,62±0,09 | 0,697 |
| Placa | 39 (61,9%) | 44 (69,8%) | 0,063 |
| IMC>30kg/m2(n=22) | |||
| GIM (mm)* | 0,65±0,10 | 0,65±0,92 | 0,697 |
| Placa | 17 (77,3%) | 17 (77,3%) | 1 |
| No fumador (n=32) | |||
| GIM (mm)* | 0,67±0,09 | 0,81±0,35 | 0,103 |
| Placa | 16 (50%) | 19 (59,4%) | 0,25 |
| Fumador (n=53) | |||
| GIM (mm)* | 0,63 ± 0,12 | 0,61 ± 0,09 | 0,091 |
| Placa | 40 (75,5%) | 42 (79,2%) | 0,5 |
| No hipertensión arterial (n=73) | |||
| GIM (mm)* | 0,65±0,11 | 0,65±0,09 | 0,068 |
| Placa | 47 (64,4%) | 51 (69,9%) | 0,125 |
| Hipertensión arterial (n=12) | |||
| GIM (mm)* | 0,63±0,01 | 0,68±0,06 | 0,500 |
| Placa | 9 (75%) | 10 (83,3%) | 1 |
| No dislipidemia (n=82) | |||
| GIM (mm)* | 0,66±0,10 | 0,78±0,34 | 0,034 |
| Placa | 53 (64,6%) | 58 (70,7%) | 0,063 |
| Dislipidemia (n=3) | |||
| GIM (mm)* | |||
| Placa | 3 (100%) | 3 (100%) | |
| No cirrosis (n=56) | |||
| GIM (mm)* | 0,65±0,12 | 0,63±0,09 | 0,213 |
| Placa | 35 (62,5%) | 40 (71,4%) | 0,063 |
| Cirrosis (n=29) | |||
| GIM (mm)* | 0,64±0,08 | 0,63±0,10 | 0,840 |
| Placa | 21 (72,4%) | 21 (72,4%) | 1 |
GIM: grosor íntima-media carotídeo; IMC: índice de masa corporal.
*En pacientes que no presentan placa de ateroma (basal=29 pacientes/seguimiento=24 pacientes).
Variable cuantitativa: media±DE; variable cualitativa: n (%); umbral significativo: p<0,05.
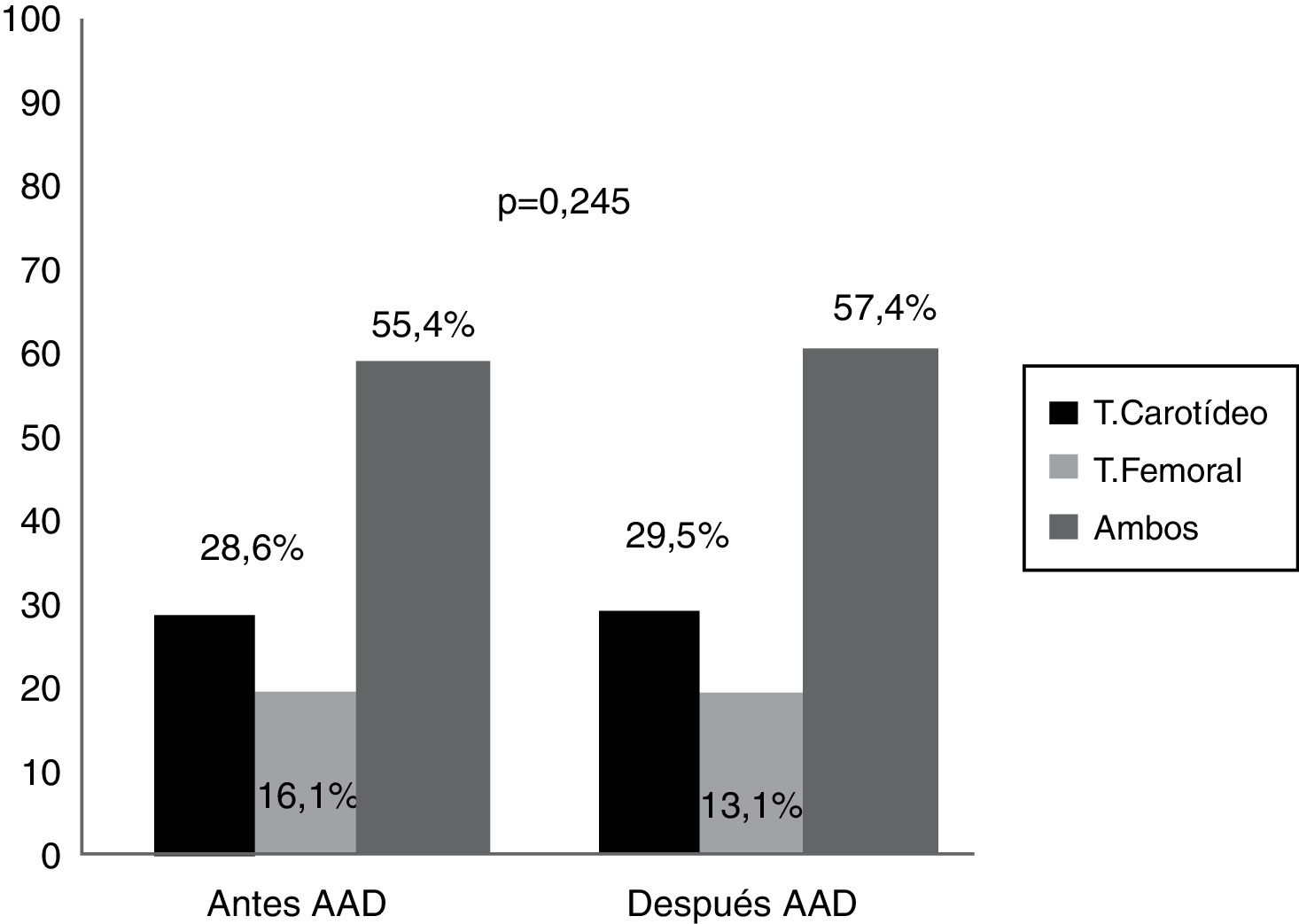
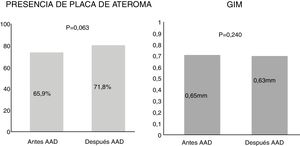
Al analizar la distribución vascular de las placas no se observaron diferencias significativas ni en el territorio carotídeo, femoral ni en ambas zonas vasculares previo al inicio y a los 12 meses tras la finalización de la terapia (p=0,245) (fig. 2).
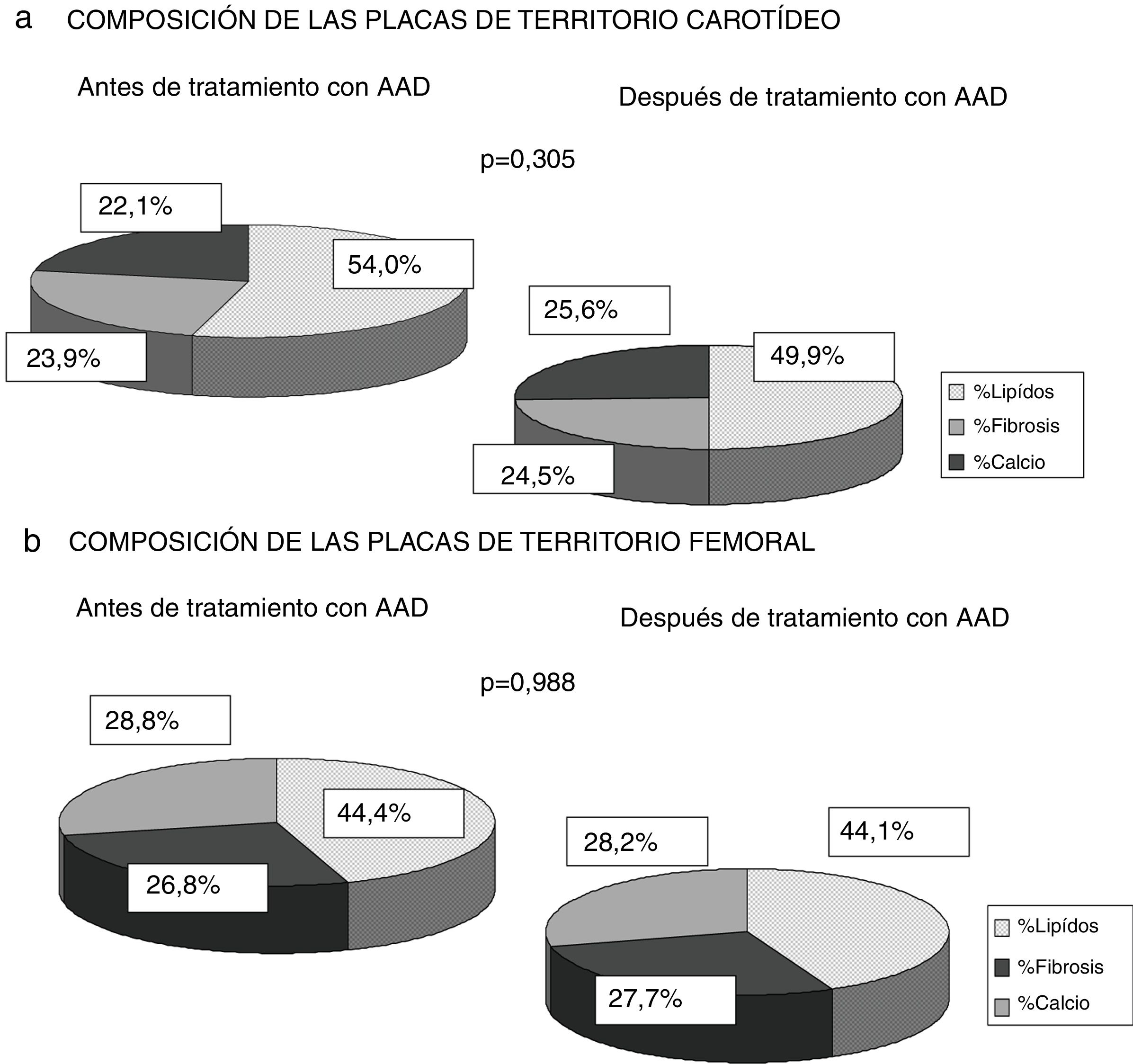
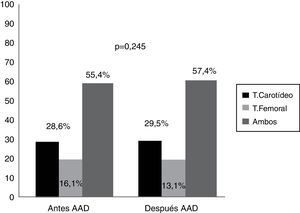
Finalmente, evaluamos si existía modificación en la composición de las placas de ateroma medido por escala de grises ecográfica antes y tras 12 meses del tratamiento antiviral, sin identificar alteraciones significativas ni en el porcentaje de lípidos, fibrosis ni calcio de las placas del territorio carotídeo ni femoral (p=0,305; p=0,988). Se observó una tendencia a la disminución del porcentaje lipídico de las placas carotídeas (antes de AAD 54,1% vs. 49,9% después de 12 meses del tratamiento) aumentando el porcentaje de fibrosis y calcio (23,9% vs. 24,5% y 22,1% vs. 25.6%) mientras que en las placas del territorio femoral no existió variación en los porcentajes (fig. 3).
DiscusiónEn nuestro estudio no detectamos modificación del GIM ni de la presencia de placas de ateroma en ningún territorio vascular estudiado (carotídeo y femoral) tras 12 meses del tratamiento con antivirales de acción directa en pacientes con infección crónica por el VHC. Como muestra la figura 1, existe una leve tendencia a la mejoría del GIM y un aumento del 6% en la presencia de placas de ateroma, pero sin ser significativo (p=0,063). Estas diferencias no se observaron de forma global, ni al subdividir a los pacientes en grupos según los factores de riesgo cardiovascular y severidad de la enfermedad hepática (tabla 3).
Estos resultados contrastan con estudios donde el aclaramiento virológico, ya sea espontáneo o en su mayoría obtenido con regímenes de tratamiento basados en IFN22–25, pueden mejorar los resultados cardiovasculares, aunque no está claro si el efecto positivo observado se debe a la eliminación del virus, o fue impulsado por el IFN o por un sesgo de selección, ya que son poblaciones muy seleccionadas.
Nuestros datos cuantifican la placa en el territorio carotídeo, y además en el territorio femoral, no habiéndose realizado previamente en otros trabajos. Aunque no se detectaron diferencias significativas, en la distribución por territorios de las placas tras el tratamiento, tal y como muestra la figura 2, se observa un leve aumento de placa en ambos territorios: carotídeo y femoral (de un 55,4% antes de tratamiento a un 57,4% tras el tratamiento, p=0,245). Esta ampliación del estudio ecográfico, tanto en vasos carotídeos como femorales, en estudios poblacionales aumenta la probabilidad de detectar ateromatosis29.
En el presente trabajo detectamos que la erradicación del virus produce un aumento del colesterol total, colesterol LDL y colesterol no HDL (descritas como partículas más aterogénicas) tras los 12 meses del tratamiento antiviral. Estos datos apoyan lo publicado en pacientes tratados con IFN21 y explica, además, la capacidad que tiene el virus de interferir en el metabolismo lipídico11–14. No se observan diferencias significativas ni de los niveles de glucosa ni del índice de insulinorresistencia medido por el coeficiente TG/HDL (tabla 2). Observamos una mejoría significativa en los niveles de transaminasas, en la esteatosis hepática medida por el Hepatic Steatosis Index y de la rigidez hepática medida por elastografía hepática, confirmando lo que se ha comentado en diferentes estudios, que la erradicación del virus no solo supone la curación de la infección, sino que además mejora la enfermedad hepática a corto y medio plazo22.
Nuestro trabajo involucra la única cohorte española de pacientes monoinfectados con VHC crónica tras 12 meses de erradicación del virus con AAD. Cuenta con las limitaciones intrínsecas de un diseño longitudinal o de seguimiento, ya que hubo pérdidas de pacientes que no acudieron a realizarse el control ecográfico tras los 12 meses de la terapia, por lo que el tamaño muestral fue pequeño (de 185 pacientes que iniciaron el estudio solo 85 lo concluyeron). La razón de estas pérdidas se debe a la distribución geográfica de nuestra provincia; los pacientes de áreas periféricas tenían dificultad para acudir al centro hospitalario por la distancia a los pueblos, ausentándose tras la curación del VHC. Además, presenta un sesgo de selección, ya que se excluyeron pacientes con diabetes mellitus en el momento del estudio para evitar factores confusionales que predispusieran al desarrollo de placas de ateroma. Los estudios previos demuestran un mayor efecto del control del metabolismo glucémico24 en estos pacientes que nosotros por este motivo no hemos podido valorar.
Como fortaleza de nuestro trabajo destacar que es el primer trabajo donde se analiza la composición de las placas de ateroma medidas por escala de grises ecográfica. Identificamos que los pacientes infectados presentan placas con mayor porcentaje lipídico (placas carotídeas 54,6% y placas femorales 44,4%). Este hallazgo podría deberse a la influencia sobre el metabolismo lipídico que produce el VHC, ya que hay estudios que demuestran que el virus se transporta en sangre unido a las partículas LDL, modificándolas y favoreciendo su depósito sobre el endotelio vascular12–14. Como se representa en la figura 3 tampoco hubo diferencias significativas tras 12 meses de la erradicación del VHC con AAD. Pero observamos una tendencia de las placas carotídeas a disminuir el porcentaje de lípidos (54,55% antes del tratamiento frente a 50,96% después del tratamiento), aumentando el porcentaje de fibrosis y calcio, sin ser estadísticamente significativo, si bien en estudios poblacionales se ha observado que las placas menos lipídicas son más estables, provocando menos eventos cardiovasculares15,18. Los trabajos publicados de pacientes VHC tratados con IFN22–25 observan menor mortalidad cardiovascular, lo cual podría deberse a que las placas están más organizadas y son menos vulnerables, y no por la desaparición de las placas de ateroma, aunque esto no se ha analizado en ninguna publicación por el momento.
En conclusión, contamos con pocos datos sobre el efecto que pueden tener los nuevos tratamientos antivirales sobre la presencia y la composición de la placa de ateroma. Según nuestros resultados este efecto parece ser muy leve, ya que tras 12 meses de la erradicación del VHC con AAD, no detectamos modificación del GIM ni de la presencia de placa en territorio carotídeo y/o femoral, si bien se trata de una muestra pequeña y desconocemos si puede existir mejoría a más largo plazo. Estos datos podrían apoyar la necesidad del uso rutinario de pruebas cardiovasculares no invasivas, como la ecografía arterial, la cual mejoraría la estratificación del riesgo en esta población, aun tras la eliminación del virus. Además no existen datos sobre los tratamientos hipolipidemiantes en estos pacientes para facilitar la regresión de las placas, mejorando el pronóstico cardiovascular a largo plazo, por lo que sería necesario realizar más estudios prospectivos que evalúen el riesgo residual cardiovascular tras la erradicación del virus.
Conflictos de interesesLos autores declaran que no tienen ningún conflicto de intereses con respecto al contenido de este manuscrito.
Los autores desean agradecer a todo el equipo de UDETMA la realización de las ecografías arteriales para la detección de la ateromatosis subclínica.