La enfermedad hepática alcohólica (EHA) es la causa más prevalente de enfermedad hepática avanzada y cirrosis hepática en Europa incluyendo a España. De acuerdo con la Organización Mundial de la Salud la fracción de cirrosis hepática atribuible al uso de alcohol en España es del 73,8% entre varones y del 56,3% entre mujeres. La EHA incluye diversos estadios como la esteatohepatitis, la cirrosis y el cáncer hepatocelular. Además, enfermos con EHA de base e ingesta abundante de alcohol pueden desarrollar hepatitis alcohólica, que cursa con una elevada mortalidad. Hasta la fecha, el único tratamiento efectivo para tratar la EHA es la abstinencia prolongada. No existen tratamientos específicos, y el único tratamiento que aumenta la esperanza de vida en la hepatitis alcohólica es la prednisolona. Para enfermos con hepatitis alcohólica que no responden al tratamiento, algunos centros ofrecen la posibilidad de un trasplante precoz. Estas guías de práctica clínica tienen como objetivo proponer recomendaciones sobre la EHA teniendo en cuenta su relevancia como causa de hepatopatía crónica avanzada y cirrosis hepática en nuestro medio. En el presente trabajo se propone como objetivo responder las preguntas claves para la práctica clínica de Gastroenterología, Hepatología, así como de Medicina Interna y centros de salud primaria, poniendo al servicio del profesional de la salud la información más actualizada respecto al manejo y tratamiento de la EHA. Estas guías proporcionan recomendaciones basadas en la evidencia para el manejo clínico de esta enfermedad.
Alcohol-related liver disease (ARLD) is the most prevalent cause of advanced liver disease and liver cirrhosis in Europe, including Spain. According to the World Health Organization the fraction of liver cirrhosis attributable to alcohol use in Spain is 73.8% among men and 56.3% among women. ARLD includes various stages such as steatohepatitis, cirrhosis and hepatocellular cancer. In addition, patients with underlying ARLD and heavy alcohol intake may develop alcoholic hepatitis, which is associated with high mortality. To date, the only effective treatment to treat ARLD is prolonged withdrawal. There are no specific treatments, and the only treatment that increases life expectancy in alcoholic hepatitis is prednisolone. For patients with alcoholic hepatitis who do not respond to treatment, some centres offer the possibility of an early transplant. These clinical practice guidelines aim to propose recommendations on ARLD taking into account their relevance as a cause of advanced chronic liver disease and liver cirrhosis in our setting. This paper aims to answer the key questions for the clinical practice of Gastroenterology, Hepatology, as well as Internal Medicine and Primary Health Centres, making the most up-to-date information regarding the management and treatment of ARLD available to health professionals. These guidelines provide evidence-based recommendations for the clinical management of this disease.
Estas guías han sido elaboradas y actualizadas tras la I Reunión de Consenso sobre hígado graso no alcohólico (HGNA) y enfermedad hepática alcohólica (EHA) celebrada en mayo del 2016 en Sevilla, bajo el auspicio de la Asociación Española para el Estudio del Hígado (AEEH) y con la colaboración de un panel de expertos nacionales e internacionales en ambas enfermedades. Las guías han sido sometidas a un proceso de revisión y todos los autores han declarado sus potenciales conflictos de interés.
MetodologíaLa evidencia y las recomendaciones en esta guía han sido establecidas de acuerdo con el sistema Grading of Recommendations Assessment Development and Evaluation (GRADE). Los principios del sistema GRADE han sido publicados previamente1. La calidad de la evidencia y de las recomendaciones han sido establecidas de acuerdo a niveles: A (alto), B (moderado), C (bajo); y grados: fuerte1, débil2 (tabla 1).
Descripción y codificación de la clasificación de la evidencia y recomendación
| Observaciones | Grado | |
|---|---|---|
| Calidad de la evidencia | ||
| Alto | Investigaciones nuevas tienen poca probabilidad de cambiar nuestra confianza en la estimación del efecto | A |
| Moderado | Es probable que nuevas investigaciones tengan un impacto importante en nuestra confianza en la estimación del efecto y por tanto podrían cambiar la estimación | B |
| Bajo | Estudios adicionales es probable que tengan un impacto importante en la confianza para estimar el efecto. Cualquier cambio en la estimación es incierto | C |
| Recomendación | ||
| Fuerte | Factores que influyen en la fuerza de las recomendaciones incluyen la calidad de las pruebas, resultados potencialmente importantes para los pacientes y el coste | 1 |
| Débil | Existe variabilidad en las preferencias y valores, o son más inciertos. La recomendación se realiza con menos certeza, mayor coste y consumo de recursos | 2 |
Las recomendaciones iniciales tras la Reunión de Consenso sobre el grado de evidencia científica fueron evaluadas posteriormente por un comité independiente de expertos para asegurar la mayor objetividad posible de las mismas.
Terminología utilizada en esta guía| Terminología anterior | Nueva terminología | Abreviación |
|---|---|---|
| Alcohólico | Trastorno por consumo de alcohol | TCA |
| Enfermedad hepática alcohólica | Enfermedad hepática relacionada con el alcohol | EHA |
| Cirrosis por alcohol | Cirrosis por enfermedad hepática relacionada con el alcohol | Cirrosis por EHA |
| Esteatohepatitis alcohólica | Esteatohepatitis por enfermedad hepática relacionada con el alcohol | ------ |
| Fibrosis por alcohol | Fibrosis por enfermedad hepática relacionada con el alcohol | Fibrosis por EHA |
| Hepatitis alcohólica | Hepatitis alcohólica | HA |
La EHA es la causa más prevalente de enfermedad hepática avanzada y cirrosis hepática (CH) en Europa incluyendo España2–4. Junto con la HGNA5,6, se convertirán en las causas más prevalentes de hepatopatía crónica. Por el contrario, debido a los avances en la prevención y en el tratamiento de las hepatitis virales B y C, su prevalencia ha empezado a disminuir en nuestro medio, en especial como causa de hepatopatía7. En países como Estados Unidos, la tasa anual de mortalidad debida a enfermedad hepática crónica ajustada por edad ha aumentado entre los pacientes con EHA y HGNA a partir de 2013, coincidiendo con una disminución entre aquellos afectados por virus de la hepatitis C y de forma más discreta entre los afectados por virus de la hepatitis B8. A pesar de su elevada prevalencia, existen relativamente pocos estudios sobre la detección precoz, diagnóstico y tratamiento de la EHA en comparación con la HGNA o las hepatopatías virales9.
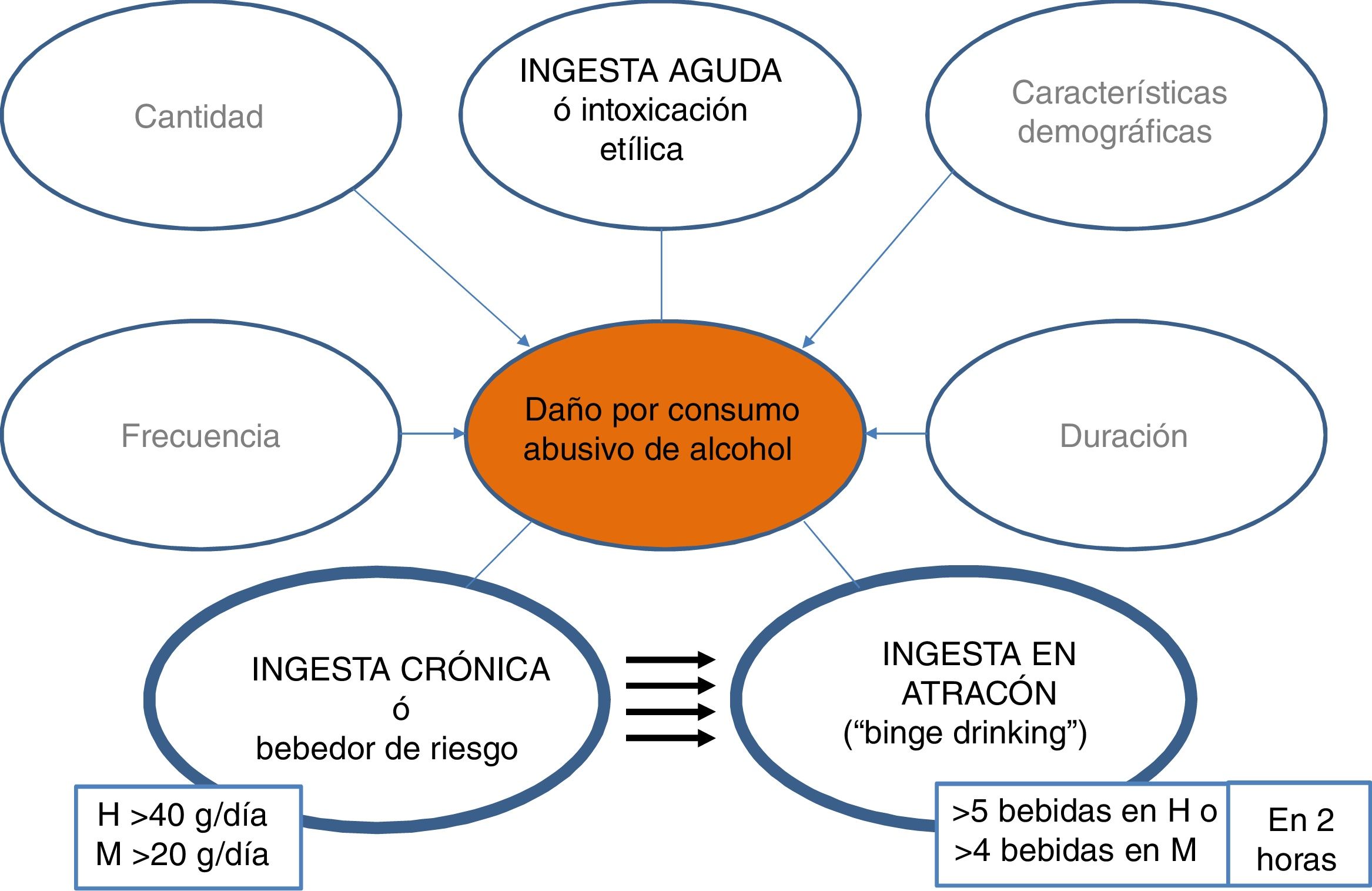
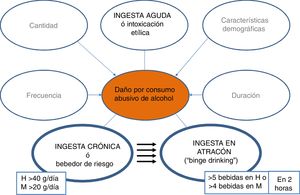
La historia natural y los factores que modifican la EHA no son bien conocidos. Debido a la inexistencia de programas de cribado y detección precoz, los pacientes no son diagnosticados hasta fases tardías de la enfermedad, cuando desarrollan ictericia o complicaciones. Un estudio reciente a nivel mundial demuestra que la EHA es, de largo, la causa de enfermedad hepática con menos porcentaje de detección precoz. En España, por cada 9 pacientes diagnosticados en fase tardía, un enfermo es visitado en estadios precoces10. Es por tanto esencial lanzar campañas para detectar esta enfermedad en fases menos avanzadas. Para ello es de vital importancia cuantificar el consumo de alcohol en todos los pacientes, y se recomiendo estandarizar la cuantificación a gramos de alcohol o utilizar la unidad de bebida estándar (UBE), cada UBE equivale a 10g de alcohol.
La EHA incluye un amplio rango de estadios que van desde la esteatosis hepática simple, la esteatohepatitis alcohólica con o sin fibrosis, la cirrosis y el carcinoma hepatocelular (CHC). Comparado con el HGNA, la EHA cursa con una fibrosis hepática más agresiva, que es el mayor determinante de mortalidad a largo plazo11.Además, los pacientes con EHA de base que siguen bebiendo alcohol pueden presentar una entidad clínica muy grave llamada hepatitis alcohólica (HA). La HA se caracteriza por una rápida elevación de la bilirrubina y el desarrollo de descompensaciones12. Su prevalencia no es bien conocida y se presenta en ocasiones en pacientes jóvenes. La HA grave se asocia al desarrollo de infecciones bacterianas, fallo multiorgánico y a una alta mortalidad a corto plazo13. Hasta la fecha, el único tratamiento que aumenta ligeramente la supervivencia a corto plazo en la HA es la prednisolona14. Hay una necesidad urgente de desarrollar nuevas terapias para esta forma tan grave de hepatopatía.
El trasplante hepático es el único tratamiento curativo para las hepatopatías avanzadas que no mejoran tras la abstinencia alcohólica. La evaluación de estos enfermos es compleja e incluye evaluación del riesgo de recidiva. En los últimos años, algunos centros están ofreciendo trasplante precoz a enfermos altamente seleccionados con HA grave que no responden al tratamiento estándar.
Prevalencia¿Cuál es la prevalencia de la EHA y el patrón de consumo de alcohol en nuestro medio?La prevalencia de la EHA ha experimentado un progresivo incremento a lo largo de los años, aunque porcentualmente pequeño en países industrializados, manteniéndose estable en la última década15–17. Aun así, cifras estimadas del 2% en la población general son relevantes y convierten a la EHA en un problema de salud pública. Además, datos de diferentes países vecinos, como Reino Unido, indican que a pesar de la tendencia general a la disminución de la mortalidad de las causas frecuentes (p. ej., cardiopatía isquémica, diabetes, causas respiratorias, cerebrovasculares) hay un alarmante incremento en la mortalidad entre 1970 y 2010 atribuido a causas hepáticas, de las que 2 terceras partes son atribuibles al alcohol. La tasa de mortalidad por causa hepática también está aumentando en otros países como Finlandia o Irlanda, mientras que se mantiene estable en Noruega y Suecia y baja en Francia e Italia. En España, la fracción de CH atribuible al uso de alcohol en 2016 fue del 73,8% entre varones y del 56,3% entre mujeres18.
En España, según la Organización Mundial de la Salud, la media de consumo de litros de alcohol puro per cápita en mayores de 15 años entre 2015-2017 es de 10l, habiéndose reducido 0,5l respecto al periodo 2009-201118. Se objetivan cambios notables en el patrón de consumo entre jóvenes, especialmente entre las mujeres18. Cabe destacar que un 28% de la población entre 15-19 años realizan episodios de ingesta excesiva de alcohol (≥60g de alcohol al menos en una ocasión una vez por mes)18. Además, en la última década se ha incrementado hasta 3 veces el patrón del consumo en atracón (5 bebidas de 14g/unidad o 4 en la mujer en 2h), y disminuido el patrón de consumo de riesgo elevado (>20g/día mujer, >40g/día hombre)19,20. Es importante mencionar que se desconoce el impacto que los nuevos patrones de consumo tendrán en la tasa de mortalidad por enfermedad hepática dependiente de alcohol, siendo necesarios nuevos estudios para aclarar esta cuestión21–23. Esta conducta de consumo, que está aumentando en todos los países industrializados, se asocia a efectos negativos en la esfera de la seguridad y salud, y es probable que también impacte negativamente en el hígado.
Conclusión- •
La EHA es la causa más frecuente de CH en España, por lo que constituye un importante problema de salud pública. (A1).
- •
Dada la prevalencia del 2% de EHA, junto con el cambio en el patrón de consumo de alcohol en nuestro país, es necesaria la puesta en marcha de medidas preventivas a distintos niveles para evitar el consumo abusivo de alcohol. (A1).
En la EHA, diferentes marcadores bioquímicos pueden apoyar la sospecha clínica basada en una adecuada anamnesis y exploración física. Aunque ningún marcador bioquímico es capaz de determinar por sí mismo el consumo crónico de alcohol, la combinación de marcadores clásicos, como la elevación de aspartato aminotransferasa (AST) (sensibilidad 43-68% y especificidad 56-95%), volumen corpuscular medio (sensibilidad 24-75% y especificidad 56-96%), o la gammaglutamiltranspeptidasa (sensibilidad 42-86% y especificidad 40-84%), es útil para establecer la sospecha clínica24–26. Otros marcadores como la determinación de transferrina deficiente en hidratos de carbono pueden ayudar en el cribado de un consumo crónico de alcohol con una sensibilidad del 88%27,28.
Recomendación- •
Los marcadores clásicos, como la elevación del volumen corpuscular medio, la AST y la gammaglutamiltranspeptidasa, junto con otros como la determinación de transferrina deficiente en hidratos de carbono pueden ayudar en el cribado de un consumo perjudicial de alcohol en pacientes en los que exista esta sospecha clínica. (B2).
La CH es la principal causa de mortalidad por alcohol en Europa29,30. Sin embargo, la tendencia ha sido descendente en la mayoría de los países incluido España desde finales de la década de los años 70, a excepción de algunos países nórdicos, Reino Unido, Irlanda y países del este en los que prevalece el patrón de consumo episódico. En España, tal y como se ha comentado en la sección anterior, la fracción de CH atribuible al uso de alcohol en 2016 fue del 73,8% entre varones y del 56,3% entre mujeres, representando un incremento del 8,6% entre varones y una disminución del 7,6% entre mujeres18. En Europa, las muertes atribuibles al consumo de alcohol abusivo se cifran en el 6%, siendo la CH la principal causa de mortalidad por alcohol, aunque fluctúan entre los distintos países integrantes de la Unión Europea29–31.
Aun así, en España, según el informe de Indicadores de Salud 2013, se contabiliza una tasa de mortalidad por enfermedad crónica del hígado del 15,2 para el hombre y del 5,6 para la mujer por 100.000 habitantes31. En otro estudio se estimó que, en España, entre el segmento de la población de 15 y 64 años el 12,3% de todas las causas de muerte en hombres y el 8,4% en mujeres eran atribuibles al alcohol. Además, se estima que uno de cada 8 hombres y una de cada 12 mujeres fallecen de forma prematura antes de los 65 años, debido al consumo excesivo de alcohol31.
Conclusión- •
El consumo excesivo de alcohol es una de las principales causas de mortalidad por CH en el mundo incluida Europa y España. Es de esperar que la mortalidad por otras enfermedades hepáticas (virales y esteatohepatitis no alcohólica [EHNA]) cambie en los próximos años, y que el impacto de EHA sobre la mortalidad de causa hepática sea más elevada. (A1).
- •
Se desconoce el impacto que el cambiante patrón de consumo puede tener sobre la mortalidad de causa hepática en nuestro país, pero la evidencia actual hace recomendable que se establezcan estudios que evalúen dicha asociación. (B1).
El consumo excesivo de alcohol es un factor de riesgo para la CH y tiene un impacto mucho mayor sobre la mortalidad32 por cirrosis en comparación con la morbilidad. Además, la misma cantidad de ingesta media se relaciona con mayor riesgo de CH en mujeres que en hombres. Es posible que ello se deba a la diferente metabolización del alcohol, que es menor en mujeres33. Existe una relación dosis-respuesta entre cantidad de alcohol y la cirrosis por EHA. Cantidades diarias de 20-30g de alcohol aumentan el riesgo de desarrollar CH34. Datos más recientes indican que beber a diario parece aumentar el riesgo de cirrosis por EHA, independientemente de la cantidad de alcohol, especialmente entre hombres35. El inicio de consumo en edades tempranas es el factor de riesgo más importante para desarrollar cirrosis36,37.
Recomendación- •
Un consumo de alcohol mayor de 30g/día aumenta el riesgo de CH, en especial si el consumo se inicia a una edad temprana. La anamnesis debe hacer especial énfasis en preguntas sobre el consumo de alcohol incluyendo cuantificación y frecuencia del mismo. Se debe insistir y aconsejar en una ingesta por debajo del nivel de consumo de riesgo. (A1).
En pacientes que han sufrido un episodio de HA, la abstinencia al alcohol es el factor más importante que influye sobre la mortalidad a medio y largo plazo38. Ingestas moderadas (14 UBE/semana para mujeres y 21 UBE para hombres), se asocian a mayor mortalidad38. Por tanto, el principal objetivo con estos pacientes es lograr una abstinencia total. Estos resultados refuerzan la importancia de promover y apoyar la abstinencia en este grupo de pacientes desde el momento del ingreso. El tratamiento multidisciplinar combinado con las unidades de adicciones para la adquisición de consciencia de dependencia y trabajar la prevención de recaídas es imprescindible para el mantenimiento de la abstinencia38.
Recomendación- •
Tras un episodio de HA, se recomiendo abstinencia absoluta del alcohol. Ingestas moderadas se asocian a mayor mortalidad. Se recomienda evaluar y tratar el problema del alcohol desde el ingreso mediante el trabajo multidisciplinar con unidades de adicciones. (A2).
La EHA incluye el desarrollo de esteatosis (por lo general microvesicular) junto con daño hepático (balonización y desarrollo de cuerpos de Mallory-Denk) e infiltrado inflamatorio (típicamente pro neutrófilos). Estas lesiones, parecidas a la EHNA, suelen cursar con fibrosis pericelular y pueden progresar a CH y CHC39 (fig. 1). Debido a su curso silente, pocos pacientes con EHA precoz son diagnosticados y tratados en nuestro medio10. Esta forma precoz de la enfermedad no está bien caracterizada en humanos, existiendo una necesidad urgente de definir la historia natural y los factores pronósticos, así como de desarrollar biomarcadores para la detección precoz. A pesar de que las características histológicas que definen la EHA no difieren de aquellas que definen la EHNA, las lesiones de la esteatohepatitis alcohólica son normalmente más graves. Un estudio reciente muestra una alta prevalencia de fibrosis avanzada entre pacientes con EHA, que influye negativamente en la mortalidad a largo plazo40. Existen pocos estudios sobre la historia natural de la EHA. El 90% de los bebedores crónicos desarrollan una esteatosis simple y solo una minoría progresa a esteatohepatitis41, desarrollando una CH entre el 10% y el 20% del total de casos.
Una característica única de la EHA es el posible desarrollo de episodio(s) de HA, caracterizada por ictericia y descompensaciones. La mayoría de los episodios de HA ocurren en pacientes con fibrosis avanzada o CH establecida, pero pueden producirse en cualquier fase de la enfermedad42. En España, la HA cursa con una mortalidad a corto plazo del 20-30% y del 50% al año (ABIC). El mayor determinante de la supervivencia a medio y largo plazo es la abstinencia alcohólica38.
Los pacientes con cirrosis alcohólica suelen ser diagnosticados con un MELD elevado y su curso natural y supervivencia están altamente condicionados por la abstinencia alcohólica38. Aunque la incidencia de CHC en la cirrosis alcohólica es menor que en otras etiológicas, este es diagnosticado en fases más avanzadas y suele cursar con una elevada mortalidad43.
Conclusiones- •
La mayoría de los bebedores crónicos desarrollan una esteatosis simple, aunque solo un 10-20% acabará desarrollando esteatohepatitis alcohólica, CH y CHC. (A1).
- •
El desarrollo de fibrosis avanzada es el determinante histológico más importante de mortalidad en pacientes con EHA. (A2).
- •
Se recomienda poner especial atención al diagnóstico de la EHA durante las fases precoces. Dicho diagnóstico se debe realizar a través de la anamnesis, exploración física en busca de estigmas de consumo de alcohol y marcadores bioquímicos dado el curso silente. (A2).
- •
En pacientes con un consumo de alcohol de riesgo que presentan una descompensación hepática se debe considerar la HA como parte del diagnóstico diferencial. (A2).
La susceptibilidad individual a desarrollar diferentes fenotipos de la EHA depende de la interacción de factores conductuales, genéticos y ambientales44. Se ha sugerido una posible correlación entre el grado de la ingesta de alcohol y la fibrosis hepática, pero las lesiones histológicas producidas por el alcohol exhiben una gran variabilidad interindividual45. Por lo general, ingestas superiores a 30g/día en mujeres y 40g/día en hombres predisponen al desarrollo de EHA. Existe controversia sobre si beber un sola bebida al día, en especial de vino, podría ser protector sobre la fibrosis hepática46.Un amplio estudio reciente muestra que incluso la ingesta de una sola bebida alcohólica al día puede ser perjudicial para la salud, pues aumenta el riesgo de cáncer47,48. Se ha indicado también que el patrón de ingesta alcohólica, especialmente el patrón en atracón, puede ser un factor de riesgo para el desarrollo de EHA avanzada, especialmente entre la población con síndrome metabólico21. No obstante, no todos los estudios son concordantes y las poblaciones de estudio son muy diversas22. Los principales factores ambientales que intervienen en la progresión de la EHA incluyen la obesidad, factor de riesgo independiente de fibrosis49 y el consumo de tabaco que favorece la progresión a cirrosis49.
Existen factores genéticos que influyen en la susceptibilidad individual a desarrollar EHA, como han sugerido estudios en gemelos50. La susceptibilidad genética impacta a múltiples niveles, influyendo la ingesta de alcohol y la metabolización del mismo en el desarrollo de cirrosis. Variaciones en genes relacionados con neurotransmisores51 y modificadores del metabolismo del alcohol, como la alcohol deshidrogenasa (ADH) y la aldehído deshidrogenasa predisponen al desarrollo de alcoholismo44. El segundo grupo de genes modifica la historia natural de la EHA a través de distintos mecanismos como el estrés oxidativo y la modificación de la actividad de endotoxinas y citoquinas. Variaciones del patatin-like phospholipase domain-containing protein 3 (PNPLA3), transmembrane 6 superfamily member 2 (TM6SF2) y membrane-bound O-acyltransferase domain 7 (MBOAT7) predisponen a la cirrosis por EHA52–57. El hecho de que estos genes también influyen la EHNA indica que ambas enfermedades comparten mecanismos patogénicos.
Conclusión- •
La EHA tiene una relación dosis-respuesta con la cantidad de alcohol ingerido, pero también influyen factores genéticos y ambientales. (A1).
- •
La abstinencia permanente al consumo de alcohol es el único factor capaz de modificar la historia natural de la EHA. La obesidad y el alcohol presentan un efecto aditivo. (A1).
- •
Durante la evaluación de la EHA hay que potenciar y aconsejar la abstinencia permanente así como tener en cuenta otros factores como el consumo de tabaco o la obesidad. (A1).
Los costes socioeconómicos del consumo abusivo de alcohol incluyen accidentes, violencia, gasto hospitalario y baja productividad. Así, en 2007 se estimó en España en más de 10.463 millones de euros (1% del producto interior bruto)58. Aunque esta cifra aglutina los costes sanitarios directos (hospitalizaciones) y costes indirectos (atribuibles a la mortalidad y absentismo laboral por hospitalización) de forma general atribuible al alcohol, el porcentaje debido a la enfermedad hepática no se conoce específicamente.
Debido a que la EHA es la causa más frecuente de cirrosis descompensada en España, el coste que supone para el sistema sanitario es muy elevado. Otros países occidentales presentan un incremento de los costes económicos de hasta un 40% en tan solo una década, representando como en España el 1% del producto interior bruto16,59.
Recomendación- •
Dada la elevada carga económica que supone el consumo excesivo de alcohol sobre el desarrollo de enfermedades hepáticas avanzadas, es necesario el desarrollo de políticas activas que prevengan el consumo abusivo. (A1).
En 2010, el consumo abusivo de alcohol provoco 4,9 muertes por 100.000 habitantes atribuibles a cáncer (0,15% del total de muertes). Además de aumentar el riesgo de cáncer orofaríngeo, de esófago y de páncreas, el consumo abusivo de alcohol aumenta la incidencia de CHC. La cantidad diaria de alcohol consumida impacta en el riesgo de desarrollar un CHC60.
El alcohol en consumo excesivo es un carcinógeno hepático que impacta directamente y sinérgicamente con otros factores como la obesidad o las hepatitis virales61–63. Así, el consumo de más de 3 bebidas al día en pacientes con un índice de masa corporal (IMC)>30 aumenta la incidencia de CHH61. Asimismo, el consumo de alcohol es un frecuente cofactor en más de la mitad de enfermos con hepatitis C que desarrollan un CHC.
El riesgo relativo de CHC para pacientes con EHA es de 4,06, que es menor que en las hepatitis virales y la EHNA60,61. En los últimos años ha habido una larga controversia respecto al coste-efectividad del cribado para CHC entre individuos con CH por EHA. Algunos estudios poblaciones realizados en Dinamarca y Reino Unido habían descrito un riesgo anual del 1%, por debajo del 1,5% a partir del cual se recomienda el cribado64,65. No obstante, un estudio prospectivo reciente ha mostrado una incidencia anual de CHC entre esta población del 2,9%66, justificando el cribado67.
Es importante destacar que el CHC es diagnosticado en pacientes con EHA en fases más avanzadas, con menos posibilidades curativas, y por ello conlleva una mayor mortalidad que en pacientes con otros tipos de hepatopatías18. Es por ello esencial recomendar cribado en cirrosis alcohólica y motivar y asistir al paciente para asegurar un correcto seguimiento de la enfermedad.
Recomendaciones- •
La cirrosis por EHA es un factor de riesgo para el desarrollo de CHC, y se recomienda realizar una ecografía cada 6 meses para su detección precoz. (A2).
- •
La coexistencia de consumo abusivo de alcohol, hepatitis viral y obesidad incrementa el riesgo de CHC. La identificación y tratamiento de múltiples etiologías es recomendable en todo paciente con cirrosis. (A1).
Sí, el consumo de riesgo de alcohol (>4-5UBE/día en hombres [o>21UBE por semana] y >3UBE/día en mujeres [o>14UBE por semana]) se ha mostrado asociado a sobrepeso y obesidad68. Sin embargo, consumos por debajo de estas cantidades no han mostrado asociación alguna. Asimismo, algunos patrones de consumo como el «binge drinking» o el aumento en la frecuencia (p. ej.,>7 veces/semana)69 parecen promover la ganancia de peso y obesidad70.
Recomendación- •
Debe desaconsejar el consumo de riesgo de alcohol (>4-5UBE/día en hombres [o >21UBE por semana] y >3UBE/día en mujeres [o >14 UBE por semana]) dado que se ha mostrado asociado a sobrepeso y obesidad. (B1).
Sí, datos de estudios transversales a nivel poblacional en los Estados Unidos han mostrado asociación positiva entre el consumo de alcohol y la obesidad. En presencia de sobrepeso (IMC 25-<30kg/m2) y obesidad (IMC>30kg/m2) los niveles anormalmente elevados de transaminasas deben valorarse como un posible marcador subrogado de hepatopatía alcohólica, dado que el consumo de más de 2 bebidas/día entre pacientes con sobrepeso y de una bebida/día en pacientes con obesidad incrementa el riesgo de elevación de AST. No obstante, hay que tener en cuenta que los pacientes obesos tienen también una razón de riesgo más elevada para presentar niveles altos de alanino aminotransferasa (ALT) incluso cuando no consumen alcohol o solo consumen una bebida al día71. Los resultados del 3rd National Health and Nutrition Examination Survey (NHANES III) mostraron que la prevalencia de transaminasas elevadas se incrementaba con aumentos del IMC desde un 4,4% en sujetos con peso normal hasta un 7,3% en aquellos con sobrepeso y un 12% en obesos72,73
Recomendación- •
Existe una asociación positiva entre el consumo de alcohol, el IMC y los niveles elevados de transaminasas. Se recomienda tratar ambos factores en enfermos con hepatopatías crónicas. (B1).
Sí. Resultados de estudios transversales que incluían a bebedores de alto riesgo (>50g/día) han mostrado una asociación independiente del IMC con la presencia de>10% de esteatosis en la biopsia hepática70. En pacientes con alcoholismo y consumo de alcohol de alto riesgo una historia de sobrepeso en los últimos 10 años se ha asociado con la presencia de cirrosis y esteatohepatitis73,74. Además, se ha encontrado que el tejido adiposo de pacientes con HA expresa niveles elevados de citoquinas proinflamatorias (p. ej., TNF-α e interleuquina 10) y que estos están correlacionados con el grado de los hallazgos patológicos en el hígado75.
Recomendación- •
Existe asociación entre el IMC y el grado de esteatosis. Además, en pacientes con consumo de alcohol de alto riesgo una historia de sobrepeso se ha asociado con la presencia de cirrosis y esteatohepatitis por lo que se recomienda abordar el sobrepeso como parte del tratamiento. (B1).
Sí. Los datos del último metaanálisis de estudios observacionales incluyendo a más de 1.000.000 de individuos ha mostrado un efecto sinérgico y de riesgo en aquellas personas que consumen más de 63g/día de alcohol y el riesgo de desarrollar diabetes. No existen hasta la fecha estudios longitudinales a largo plazo evaluando la prevalencia de resistencia a la insulina o diabetes específicamente en pacientes con enfermedad hepática por alcohol76. Sin embargo, son numerosos los estudios transversales asociando el riesgo de complicaciones diabéticas (p. ej., miocardiopatía diabética, nefropatía diabética, neuropatía diabética y retinopatía diabética) con el consumo de riesgo de alcohol.
Recomendación- •
Existe un efecto sinérgico entre el consumo de riesgo de alcohol y el desarrollo de diabetes por lo que se recomienda evaluar la presencia de diabetes y resistencia a la insulina. (B1).
No disponemos de una información precisa del consumo moderado de alcohol77. Con la evidencia disponible no se puede recomendar como seguro un consumo de alcohol superior a 2UBE/día en pacientes con sobrepeso, obesos o pacientes con diabetes78. En este grupo de pacientes es prudente evitar el consumo de alcohol diario y/o frecuente, así como el consumo por «atracón». Finalmente, es probable que el consumo de alcohol esporádico en cantidades moderadas pudiera ser aceptable en pacientes con obesidad o diabetes sin evidencias de hígado graso.
Recomendación- •
En el momento actual no se puede recomendar como ingesta segura un consumo de alcohol superior a 2UBE/día en pacientes obesos o pacientes con diabetes. Es probable que el consumo de alcohol esporádico en cantidades moderadas pudiera ser aceptable en pacientes con obesidad y/o diabetes sin evidencia de hígado graso. (B1).
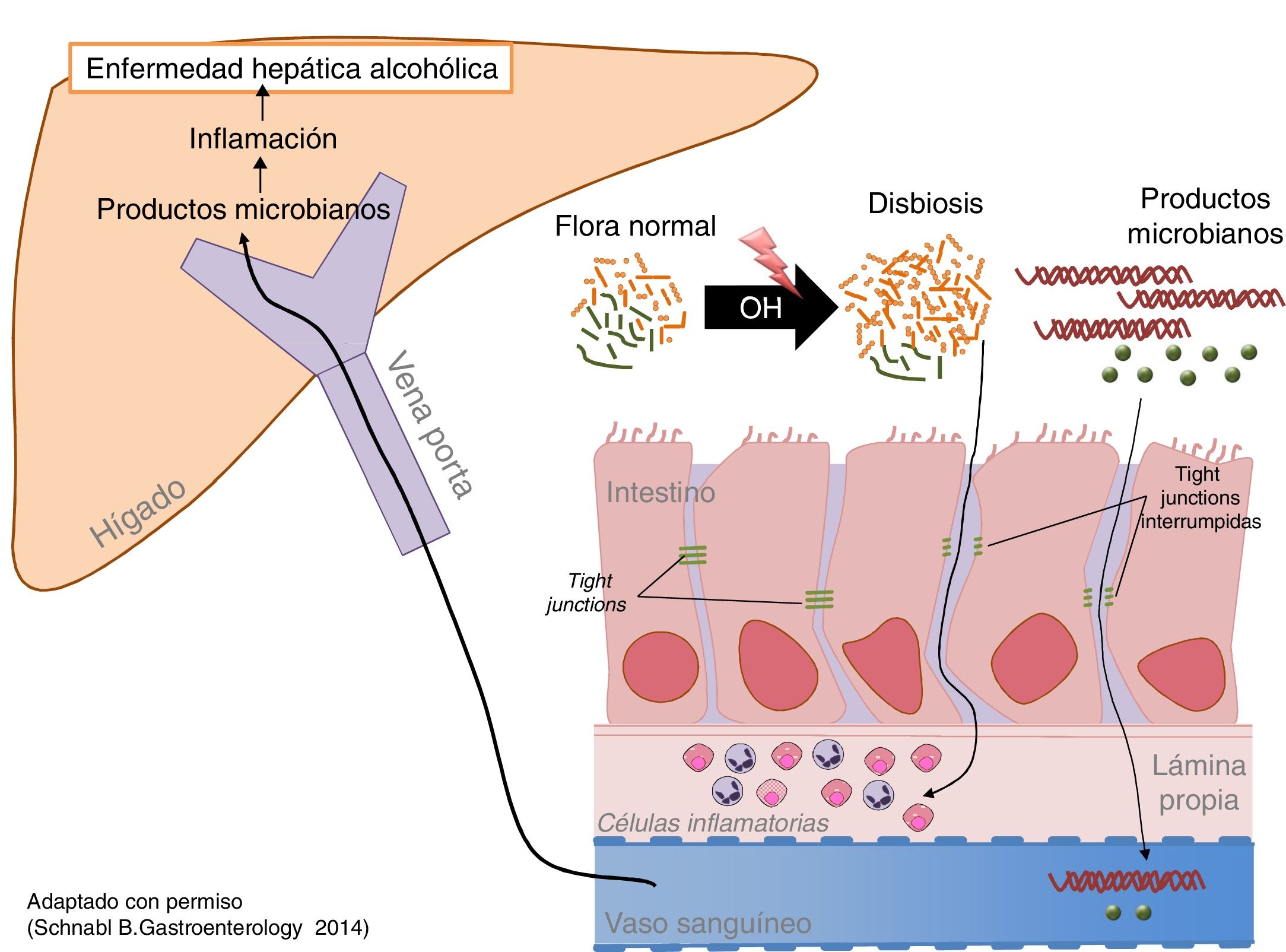
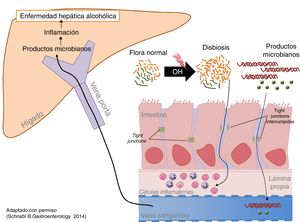
La ingesta excesiva de alcohol se asocia a un aumento en la carga bacteriana (sobrecrecimiento) y a disbiosis intestinal79. Aumentan tanto las bacterias aerobias como las anaerobias y lo hacen en todo el intestino, pero de forma más marcada en el intestino delgado proximal. La ingesta excesiva y prolongada de alcohol también causa disbiosis intestinal. El hallazgo más constante es el aumento relativo de los phylumBacteroidetes y Proteobacteria en detrimento del Firmicutes. Más específicamente, se observa una disminución de las especies comensales beneficiosas como los Lactobacillus spp. y aumentan los comensales potencialmente patogénicos, como Enterobacteriaceae80. (fig. 2)
Conclusiones- •
La ingesta de alcohol de forma crónica aumenta el contenido de bacterias intestinales y modifica su composición. (B1).
El alcohol daña la barrera intestinal y aumenta la permeabilidad intestinal, facilitando el paso a la circulación y a los órganos de productos bacterianos presentes únicamente en la luz intestinal, como la endotoxina81. La determinación directa de estos productos es el mejor modo de demostrar el aumento de la permeabilidad intestinal. Los mediadores del daño son la inflamación intestinal y la toxicidad del etanol en las células del epitelio intestinal. La inflamación intestinal subclínica se objetiva por un aumento de monocitos/macrófagos productores de TNF-α en la lámina propia del intestino delgado82. Además, el etanol y el acetaldehído dañan las uniones entre las células epiteliales (tight junctions) causando redistribución y fosforilación de sus proteínas.
Recomendación- •
El alcohol daña la barrera intestinal y aumenta la permeabilidad intestinal, facilitando el paso a la circulación de productos bacterianos; este factor debe tenerse en cuenta a la hora realizar estudios en pacientes con EHA. (B2).
Los productos microbianos ejercen un efecto sinérgico con el alcohol en la progresión de la enfermedad hepática. El aumento de la carga bacteriana y la disbiosis intestinal genera un exceso de PAMP (pathogen-associated molecular patern), como la endotoxina, que alcanzan el hígado por la sangre portal, donde estimulan a los receptores de reconocimiento de patrones, como los toll-like receptors, promoviendo la inflamación y la fibrogénesis hepática. La enfermedad hepática por alcohol en modelos experimentales mejora con descontaminación intestinal y usando mutantes que expresan moléculas no funcionales de la vía de señalización toll-like receptor82.
Recomendación- •
Los productos microbianos ejercen un efecto sinérgico con el alcohol en la progresión de la enfermedad hepática. La enfermedad hepática por alcohol en modelos experimentales mejora con la de contaminación intestinal (B2). No existe en estos momentos una recomendación sobre la descontaminación intestinal fuera de los ensayos clínicos.
La ecografía es una técnica sencilla y barata, pero con baja sensibilidad para detectar esteatosis leve. La tomografía computarizada (TC) es similar a la ecografía, pero más costosa; el gran inconveniente de la TC es la radiación a la que se somete al paciente durante el procedimiento. El parámetro de atenuación controlada es un método no invasivo que tiene la ventaja de ir asociado a la elastografía de transición y permitir la valoración simultánea de la fibrosis, además posee una mayor sensibilidad y puede cuantificar el grado de esteatosis83. El parámetro de atenuación controlada evalúa la esteatosis hepática a partir de un software que interpreta las ondas de la ecografía. Tanto la espectroscopia por resonancia magnética (RM) (1H-RME), como la RM con distintos métodos que analizan la proton density fat fraction, poseen una elevada sensibilidad y capacidad diagnóstica84. La 1H-RME se considera la mejor técnica para cuantificar la grasa hepática, pero es muy costosa85.
Recomendaciones- •
La ecografía abdominal es una buena técnica de imagen para la evaluación inicial de pacientes con sospecha de enfermedad hepática con esteatosis, proporcionando además información adicional sobre otros parámetros. (A1).
- •
El parámetro de atenuación controlada se puede usar de forma simultánea con la elastografía de transición para la evaluación de la esteatosis (detección y cuantificación), especialmente en poblaciones con alta prevalencia (obesos, diabéticos). (B1).
- •
Las técnicas de RM (imagen y espectroscopia) tienen una elevada capacidad diagnóstica y permiten cuantificar la grasa de manera precisa. Son muy útiles para estudios clínicos y ensayos terapéuticos. (A1).
Los paneles serológicos de fibrosis tienen en general un alto valor predictivo negativo para el diagnóstico de fibrosis avanzada y son útiles para la exclusión de enfermedad avanzada, teniendo una menor utilidad en estadios iniciales de fibrosis86.
Test específicos para la EHA como el APRI tienen una utilidad limitada en sujetos con altos niveles de AST y los paneles patentados requieren de validación. Estos paneles pueden predecir la mortalidad de origen hepático en este grupo de enfermos.
Recomendaciones- •
Los paneles serológicos de fibrosis basados en biomarcadores son útiles en la exclusión de fibrosis avanzada, pudiendo en ocasiones evitar la realización de una biopsia hepática. (B2).
- •
Aunque la mayoría de la información sobre detección de esteatosis por técnicas de imagen proviene de estudios con HGNA, es probable que los datos puedan extrapolarse a la EHA. (B2).
La presencia de inflamación asociada a la esteatosis identifica a los pacientes con EHA que presentan un riesgo más elevado de fibrosis y progresión de la enfermedad. La presencia de fibrosis es un signo indirecto de existencia de inflamación86. Con las técnicas de imagen habituales (ecografía, TC, RM, elastografía) no se puede distinguir una esteatosis simple de una esteatohepatitis.
Recomendación- •
No existe ninguna técnica de imagen que permita identificar y monitorizar a aquellos pacientes con EHA que presentan inflamación o esteatohepatitis. Por lo tanto no se recomienda utilizar pruebas de imagen con este objetivo. (C2).
Las técnicas de imagen convencionales (ecografía, TC, RM) no son capaces de cuantificar el estadio de fibrosis. Únicamente la elastografía proporciona una estimación del estadio de fibrosis de utilidad clínica y es útil para monitorizar su progresión87. De forma general, la elastografía tiene más precisión diagnóstica para estadios avanzados de fibrosis (F3-F4) que iniciales (F1-2), y es globalmente mejor para descartar fibrosis avanzada (valor predictivo negativo) que para confirmarla (valor predictivo positivo)87-90. El consumo reciente de alcohol, la existencia de una esteatohepatitis marcada (AST>200UL) y los niveles de bilirrubina pueden influir aumentando los valores de elasticidad, por lo que deben ser tenidos en cuenta90,91; estos factores conjuntamente con las prevalencia pretest de la enfermedad hacen difícil establecer un punto de corte definitivo.
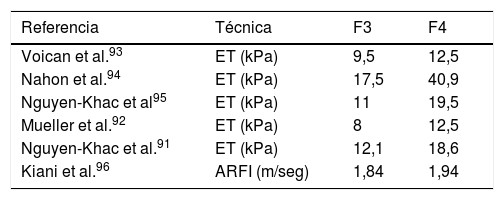
Los puntos de corte más aceptados para la estatificación de la fibrosis hepática en la EHA se detallan en la tabla 2.
Puntos de corte más aceptados para la estatificación de la fibrosis hepática en la EHA
| Referencia | Técnica | F3 | F4 |
|---|---|---|---|
| Voican et al.93 | ET (kPa) | 9,5 | 12,5 |
| Nahon et al.94 | ET (kPa) | 17,5 | 40,9 |
| Nguyen-Khac et al95 | ET (kPa) | 11 | 19,5 |
| Mueller et al.92 | ET (kPa) | 8 | 12,5 |
| Nguyen-Khac et al.91 | ET (kPa) | 12,1 | 18,6 |
| Kiani et al.96 | ARFI (m/seg) | 1,84 | 1,94 |
| Referencia | Técnica | Ishak≥3 | Ishak≥4 |
|---|---|---|---|
| Thiele et al.89 | 2D-SWE (kPa) | 10,2 | 16,4 |
| Thiele et al.89 | ET (kPa) | 11,5 | 65,2 |
ARFI: Accustic Radiation Rorcé Impulse; ET: elastografía de transición; 2D-SWE: Two Dimension Share Wave elastografy.
La frecuencia de las determinaciones no está definida, pero parece aconsejable realizar determinaciones periódicas de la rigidez hepática de forma anual en los pacientes en fases más avanzadas (≥F3) y cada 3 años en los pacientes en fases más iniciales.
- •
Se recomienda la elastografía de transición como herramienta para identificar a pacientes con EHA con riesgo muy bajo de presentar fibrosis avanzada (F3) y CH (F4). (A1).
- •
Las otras técnicas elastográficas basadas en ecografía tienen un rendimiento similar a la elastografía de transición y se pueden utilizar con el mismo propósito. (B2).
- •
Se recomienda la utilización de la elastografía como herramienta para el seguimiento de los pacientes con EHA, repitiendo las determinaciones a intervalos de 1-3 años, según el grado de fibrosis basal. (C2).
La presencia de CH con hipertensión portal o de enfermedad hepática crónica avanzada compensada en los pacientes con HGNA o EHA tiene importantes implicaciones pronósticas y de recomendaciones de cribado. Las pruebas de imagen (ecografía, TC y RM) pueden indicar la presencia de CH al detectar un hígado de superficie nodular, esplenomegalia y circulación colateral. La detección de circulación colateral es un signo inequívoco de hipertensión portal clínicamente significativa96.
En pacientes con EHA compensada que presentan un número de plaquetas>150.000 y una rigidez hepática<20kPa, la endoscopia diagnóstica puede evitarse por el bajo riesgo de tener varices grandes. Este criterio está más validado para enfermedad hepática avanzada compensada de etiología viral, pero es también aplicable a pacientes con EHA97.
Recomendaciones- •
Se debe sospechar la presencia de CH con hipertensión portal en los pacientes con HGNA o con EHA mediante el hallazgo de signos indirectos (hígado nodular, esplenomegalia, circulación colateral) en las técnicas de imagen (ecografía, TC, RM). (B2).
- •
Se debe sospechar de la existencia de hipertensión portal clínicamente significativa en un paciente con HGNA o EHA que presente circulación colateral abdominal. (B2).
- •
Se puede evitar la endoscopia de cribado de varices a los pacientes con hepatopatía avanzada compensada por HGNA o por EHA que presentan plaquetas>150.000 y rigidez hepática<20kPa. (B1).
La HA es una entidad clínica caracterizada por el desarrollo rápido de ictericia (bilirrubina total>3mg/dl) y de la elevación de AST>ALT en pacientes con consumo excesivo y activo de alcohol. La biopsia suele mostrar esteatohepatitis, con esteatosis macrovesicular y suele acompañarse como mínimo de uno de los siguientes hallazgos: infiltrado neutrofílico, lesión hepatocitaria (balonización) y cuerpos de Mallory-Denk. Además, estos pacientes presentan fibrosis en forma de fibrosis pericelular y bilirrubinostasis. Finalmente, destacar que la mayoría de los pacientes con AH grave presentan cirrosis al diagnóstico41. Se desconoce la cantidad de alcohol que puede llevar al individuo a desarrollar una HA; no obstante, se considera necesaria una ingesta mínima de más de 3 bebidas alcohólicas (∼40g) en mujeres y 4 bebidas alcohólicas (∼60g) en varones de promedio para poder realizar el diagnóstico de HA. Es frecuente que los individuos que desarrollan una HA hayan consumido alcohol de forma excesiva durante un periodo de más de 5 años, no obstante, pueden existir periodos de abstinencia. Para poder realizar el diagnóstico de HA se espera que el individuo haya presentado un consumo excesivo de alcohol durante un mínimo de 6 meses previos al diagnóstico y que no presente más de 60 días de abstinencia antes de la aparición de la ictericia. Los pacientes con HA suelen presentar al diagnóstico hepatomegalia dolorosa, así como mal estado general, además la HA se suele acompañar de descompensaciones hepáticas (encefalopatía, ascitis, hemorragia digestiva por varices, infecciones bacterianas).
A nivel analítico los pacientes presentan una bilirrubina total>3mg/dl, AST (>50UI/mL) con una ratio AST/ALT>1,5 y usualmente los niveles de AST y ALT no suelen superar las 400UI/mL. Se debe realizar una prueba de imagen para descartar patología biliar. Finalmente, se deben descartar hepatitis virales, hepatitis autoinmunes y enfermedad de Wilson con las correspondientes pruebas98. La biopsia hepática puede ser útil para confirmar el diagnóstico especialmente cuando existen dudas sobre el mismo y también por su utilidad pronóstica41,99.
No todos los pacientes con cirrosis alcohólica e ictericia y/o descompensación padecen una HA. Por ejemplo, pacientes con cirrosis alcohólica y sepsis pueden presentar un cuadro de acute-on-chronic liver failure (ACLF) que no corresponde a una HA. En casos de duda diagnóstica, la biopsia hepática transyugular también puede ser útil.
Recomendación- •
En ausencia de factores de confusión (p. ej., sospecha de hepatotoxicidad por fármacos, hepatitis isquémica, sepsis al ingreso, dudas sobre alcoholismo activo, etc.), se puede alcanzar el diagnóstico de HA por criterios clínico-analíticos. El diagnóstico definitivo, sin embargo, requiere una biopsia hepática, ya que no existen marcadores no invasivos validados. En pacientes con factores de confusión, el diagnóstico requiere una biopsia hepática transyugular. (C3).
Existen numerosos índices pronósticos (tabla 3) basados en datos obtenidos al ingreso que permiten identificar a pacientes con HA grave que necesitan terapia específica (prednisolona en la mayoría de los casos)100. El más utilizado es el Factor Discriminante de Maddrey (DF>32)101. Sin embargo, existen datos que indican que el MELD (>21)102 y el índice ABIC (>6,7)103 identifican mejor a los enfermos con HA grave104. Además, el cálculo del Factor Discriminante de Maddrey requiere el tiempo de protrombina en segundos, mientras en la mayoría de análisis la información viene recogida como INR103.
Puntos de corte de los índices pronósticos más utilizados
| Índice pronóstico | Hepatitis alcohólica no grave | Hepatitis alcohólica grave valorar corticoides |
|---|---|---|
| MELD | ≤21 | >21 |
| ABIC | <6,71 | >6,71-8,99 |
| GAHS | <9 | ≥9 |
| Función discriminante de Maddrey | <32 | ≥32 |
ABIC: age, bilirubin, international normalised ratio, creatinine score; GAHS: Glasgow alcoholic hepatitis score; MELD: Model for end stage liver disease score.
- •
Se recomienda utilizar el MELD (>21) y/o el índice ABIC (>6,7) para la identificación de enfermos con HA grave en los que hay que considerar la administración de prednisolona. (B2).
Estudios controlados y metaanálisis de datos individuales indican que la prednisolona (40mg/día durante 4 semanas) mejora la supervivencia a corto plazo en pacientes con HA grave comparado con pentoxifilina o placebo14,105,106. El reciente estudio STOPAH demostró que este efecto solo es evidente en el primer mes107. Aunque estudios iniciales sugirieron que la pentoxifilina podría ser eficaz para prevenir el fallo renal, estos resultados no han sido reproducidos, por lo que no existe evidencia clara para recomendar la utilización de pentoxifilina.
Recomendación- •
En pacientes con HA severa (MELD≥21 o con índice ABIC≥6,7) se recomienda iniciar prednisolona 40mg/día durante 4 semanas, tras lo que puede suspenderse el tratamiento de manera abrupta o en descenso progresivo de la dosis durante una semana. Si existe sepsis al ingreso, se recomienda iniciar este tratamiento una vez controlada la infección. No existe evidencia clara de que la pentoxifilina aumente la supervivencia en estos pacientes. (A1).
Existe evidencia de que el descenso de los niveles séricos de bilirrubina durante la primera semana del tratamiento con prednisolona permite evaluar la eficacia del mismo (índice de Lille)108,109. En ausencia de disminución significativa de la bilirrubina (índice de Lille>0,45), no existe evidencia de que la prolongación del tratamiento se asocie a una mejoría de la supervivencia. Para no respondedores al tratamiento con prednisolona no existe terapia farmacológica eficaz de rescate (p. ej., pentoxifilina)110. El único tratamiento que ha mostrado eficacia es el trasplante «precoz» en enfermos altamente seleccionados. Esta indicación, aunque cada vez más aceptada, debe ser considerada con prudencia en cada centro hasta que existan estudios en el ámbito español que ayuden a identificar las indicaciones precisas y una selección adecuada de los pacientes111–113.
Recomendaciones- •
Los enfermos en tratamiento con prednisolona deben ser evaluados al cabo de una semana mediante el índice de Lille. En ausencia de disminución significativa de la bilirrubina (índice de Lille≥0,45), debe retirarse la prednisolona. No se recomienda añadir ningún otro tratamiento farmacológico en los no respondedores. (B2).
- •
Para no respondedores al tratamiento con prednisolona, y dependiendo de la política de cada centro, puede plantearse la posible candidatura para un trasplante hepático en ausencia de una abstinencia prolongada. En el caso de que esta indicación esté aprobada en un centro de trasplante, se recomienda una evaluación exhaustiva por medio de un equipo multidisciplinar compuesto por hepatólogos, cirujanos, especialistas en adicciones y trabajadores sociales. En casos muy seleccionados, el trasplante hepático aumenta la supervivencia de los pacientes con HA no respondedores a prednisolona. (A1).
Existen estudios aislados que han demostrado que el tratamiento concomitante de prednisolona con N-acetil cisteína114 y con factor de crecimiento de colonias de granulocitos (G-CSF) mejora la supervivencia de enfermos con HA115. Sin embargo, estos resultados deben ser confirmados en estudios más amplios. Otro fármaco antioxidante bajo investigación clínica es la S-adenosilmetionina. Se está evaluando nuevas terapias con diversos suplementos nutricionales, como el cinc en combinación con otros fármacos, la metodoxina116,117 o el colostrum bovino. El eje hepatointestinal es clave en el desarrollo de la EHA y de la HA y por dicho motivo diferentes terapias tienen este eje como objetivo terapéutico; hay distintos estudios en marcha que evalúan la seguridad y eficacia de probióticos como el Lactobacillus rhamnosus118 y antibióticos como la rifaximina, la amoxicilina-clavulámico y el ciprofloxacino. Finalmente, existen estudios que han evaluado la eficacia del trasplante fecal con resultados prometedores119. Otros fármacos en fase de investigación son los agonistas selectivos del receptor del farnesoide X, en concreto el ácido obeticólico. Mediadores de la inflamación como el anakinra (un receptor de la interleuquina-1) también ha presentado resultados prometedores y será testado en combinación con cinc en un ensayo clínico con varias ramas. Otro grupo de medicamentos bajo investigación son los moduladores de la regeneración hepática, entre ellos los estimuladores de colonias circulantes pluripotenciales derivadas de la médula ósea115, el emricasan (un inhibidor pan-caspasa) y la interleuquina 22 sola o en combinación con F-652 (una proteína recombinante formada por interleuquina 22 e inmunoglobulina G2). Finalmente cabe destacar los estudios que se han realizado hasta la fecha con hígados bioartificiales (p. ej., ELAD)100,120.
Recomendación- •
Aunque existen estudios prometedores de que diversas modalidades farmacológicas (p. ej., la N-acetil cisteína o G-CSF) pudieran aumentar los efectos beneficiosos de la prednisolona, no puede recomendarse todavía ninguno de estos tratamientos hasta que los estudios clínicos hayan sido ampliamente confirmados. (C2).
Existe poca información para responder de forma adecuada a la pregunta de si el ACLF debido a cirrosis por EHA tiene una evolución distinta del ACLF debido a otras etiologías de la cirrosis 121. Los datos disponibles indican que tanto el tipo de órganos afectados como el grado de ACLF y el pronóstico son similares en el ACLF de causa alcohólica con respecto a otras etiologías122.
Conclusiones- •
El pronóstico del ACLF debido a enfermedad alcohólica no parece ser distinto del debido a enfermedad no alcohólica. (B2).
La realización de una biopsia hepática a pacientes con ACLF presumiblemente debido a enfermedad alcohólica tiene 2 ventajas potenciales. La primera es que permite determinar si existen datos histológicos compatibles con HA. Este aspecto es importante, de él puede derivarse un tratamiento específico, así como información pronóstica41. En segundo lugar, permite descartar una etiología de enfermedad hepática previamente no reconocida (tóxica, autoinmune, etc.)123. Es importante recalcar que no todos los enfermos con hepatopatía alcohólica e ictericia tienen un episodio de HA.
Recomendación- •
Es recomendable la realización de una biopsia hepática a los pacientes con ACLF debido a enfermedad alcohólica para confirmar el diagnóstico de hepatitis aguda alcohólica y descartar otras etiologías. Esta recomendación está sujeta a la disponibilidad y experiencia de la técnica de biopsia transyugular en caso de que sea necesaria. (B2).
Hasta el momento actual no se dispone de ningún tratamiento específico eficaz ni para el ACLF en general ni tampoco para el ACLF debido a etiología alcohólica, exceptuando los corticosteroides si existe HA grave106. El enfoque terapéutico actual se basa en tratamiento y prevención de las complicaciones, cuando sea posible, y soporte para el fallo multiorgánico. Estudios recientes indican que la administración de G-CSF115 puede ser eficaz en el ACLF y reducir la mortalidad. No obstante, los estudios disponibles son de series pequeñas de pacientes y excluyen a pacientes con ACLF grave. Por tanto, se requiere nuevos estudios en series más amplias de pacientes de etiología alcohólica antes de poder recomendar la utilización del G-CSF en la práctica clínica115.
Recomendación- •
El único tratamiento específico que se ha demostrado eficaz para el tratamiento del ACLF debido a enfermedad alcohólica son los corticosteroides si existe HA grave. (B2).
El trasplante hepático es un procedimiento terapéutico muy eficaz teóricamente indicado en los pacientes con ACLF debido a la elevada mortalidad de este síndrome. No obstante, la indicación de trasplante en ACLF de etiología alcohólica tiene implicaciones especiales, en particular para los pacientes cuyo alcoholismo no ha podido ser evaluado de forma protocolizada antes del desarrollo del ACLF. La toma rápida de una decisión sobre la potencial evolución del alcoholismo después del trasplante en el contexto de la gravedad del ACLF es arriesgada y comporta problemas éticos. Además, la indicación de trasplante en estos pacientes contraviene la regla existente en muchos países sobre el periodo de 6 meses de abstinencia antes del trasplante. Algunos estudios han demostrado una buena evolución postrasplante y baja incidencia de recidiva alcohólica si se realiza una selección restrictiva de pacientes con HA grave (que en su mayoría presentan ACLF) en base a un buen soporte familiar, ausencia de comorbilidades y un compromiso claro de abstinencia postrasplante121. El porcentaje de pacientes que podrían beneficiarse de este enfoque es inferior al 5%124.
Recomendación- •
El trasplante hepático está indicado en pacientes con ACLF asociado a EHA cuyo alcoholismo no presenta contraindicaciones para el trasplante. El trasplante no está indicado en los pacientes con HA grave o en aquellos con ACLF debido a otro desencadenante en los cuales el alcoholismo no ha sido evaluado de forma adecuada. (B2).
Las benzodiacepinas (BZD) son el tratamiento de elección para el síndrome de abstinencia alcohólica, por su eficacia para reducir los síntomas de abstinencia, el riesgo de convulsiones y/o «delirium tremens»125. Las BZD de acción prolongada (diazepam, clordiazepóxido) proporcionan más protección contra las convulsiones y delirio, pero las de acción corta e intermedia (p. ej., lorazepam, oxazepam) son más seguras en pacientes ancianos126. Los neurolépticos no deben utilizarse como monoterapia, ya que no reducen el delirio y aumentan las convulsiones. Pueden valorarse en combinación con BZD para la agitación marcada o alucinaciones. Sin embargo, no existe estudios sobre la seguridad de la utilización de BZD en pacientes con cirrosis por EHA o HA. Estos fármacos se han de utilizar con prudencia debido al riesgo de encefalopatía y de aspiración.
Recomendación- •
Las BZD son de elección para la abstinencia, reducir el riesgo de convulsiones y «delirium tremens». Las de acción intermedia son más seguras en ancianos. Se pueden dar neurolépticos en combinación con BZD para la agitación marcada o alucinaciones. El uso de BZD en pacientes con cirrosis o HA puede inducir encefalopatía, por lo que deben usarse de manera prudente. (B2).
Existen pocos estudios sobre la eficacia y seguridad de estos fármacos en pacientes con hepatopatía avanzada. Se están evaluando varios fármacos que pueden reducir las ansias de beber alcohol («craving») y, en consecuencia, pueden aumentar la abstinencia y evitar la recaída127,128. El disulfiram, la naltrexona y el nalmefene deben utilizarse con extrema precaución en caso de hepatopatía y están contraindicados en caso de insuficiencia hepática grave según sus respectivas fichas técnicas. El acamprosato, el topiramato y el baclofeno, con menos metabolización hepática parecen más recomendados. El baclofeno es el único de estos fármacos que se ha mostrado útil y seguro en enfermos con cirrosis alcohólica129. La dosis recomendada es de entre 30 y 60mg/día con dosis máxima de 100mg/día, siendo segura la administración durante periodos prolongados.
Recomendación- •
Existen pocos datos sobre la eficacia y seguridad de fármacos reductores de las ansias de alcohol en pacientes con hepatopatía avanzada. El disulfiram, la naltrexona y el nalmefene están contraindicados en hepatopatía grave. El baclofeno es el único fármaco que se ha probado eficaz y seguro en pacientes con cirrosis por EHA. (B2).
Un periodo de abstinencia pretrasplante como herramienta única de predicción de una abstinencia duradera es inadecuado130. Se debe tener presente que un tiempo de abstinencia antes del trasplante es importante por la reversibilidad de la disfunción hepática y su mejoría, ya que en algunos casos hace que el candidato a trasplante deje de tener indicación131. La predicción de abstinencia duradera después del trasplante está influida, además de por el tiempo de abstinencia, por otros factores como la consciencia de enfermedad, existencia de comorbilidades psiquiátricas o de otras adicciones, existencia de intentos repetidos de deshabituación y del apoyo sociofamiliar. Es importante la evaluación minuciosa e integral de todos estos factores por un equipo multidisciplinar incluidos especialistas en adicciones y psiquiatras132–134.
Recomendación- •
Todo candidato a trasplante por EHA debe recibir una evaluación psicosocial integral. La aplicabilidad del trasplante debe de ser establecida en base al grado de dependencia alcohólica, así como la existencia de factores favorables para una abstinencia duradera. (A1).
El abordaje multidisciplinar con la participación de diferentes especialistas como hepatólogos, especialistas en adicciones, trabajadores sociales etc. es esencial para abordar de forma adecuada el problema de la recaída en el consumo alcohólico135. Este abordaje permite prevenir la recidiva, interpretar mejor las diferentes conductas de recaída y su adecuado tratamiento136,137.
Recomendación- •
En el manejo del paciente con trastorno por consumo de alcohol trabajar estrechamente con unidades y especialistas en adicciones ayuda a reducir la recaída en el consumo y disminuye la mortalidad. (B2).
Esta cuestión ha sido abordada en el apartado “¿Qué tratamientos de rescate son eficaces para pacientes no respondedores a la terapia específica?”, la recomendación se puede encontrar en dicha sección: “Para no respondedores al tratamiento con prednisolona, y dependiendo de la política de cada centro, puede plantearse la posible candidatura para un trasplante hepático en ausencia de una abstinencia prolongada. En el caso de que esta indicación esté aprobada en un centro de trasplante, se recomienda una evaluación exhaustiva por medio de un equipo multidisciplinar compuesto por hepatólogos, cirujanos, especialistas en adicciones y trabajadores sociales. En casos muy seleccionados, el trasplante hepático aumenta la supervivencia de los pacientes con HA no respondedores a prednisolona. (A1)”.
En el seguimiento del trasplantado por EHA, ¿qué medidas se deben implementar con el objetivo de reducir la mortalidad?La medida más importante es prevenir la recurrencia del consumo abusivo de alcohol. Según la definición de recurrencia, esta ocurre entre el 20-40% de enfermos138,139. La recurrencia no se asocia a un aumento de la mortalidad140,141, no obstante sí que hay consecuencia negativas para el injerto además de un incremento de otras patologías inducidas por el alcohol. Por ello es importante detectar precozmente la recidiva y tratarla con la ayuda de un equipo multidisciplinar. El uso de biomarcadores que detectan el uso reciente de alcohol (p. ej., etilglucurónido en orina) puede ser útil142.
El paciente trasplantado por EHA presenta mayor riesgo cardiovascular que otras etiologías y es especialmente propenso a desarrollar cáncer de cabeza y cuello y pulmón. Por tanto, se deben evitar factores de riesgo especialmente modificables como el consumo de tabaco, la obesidad y el sedentarismo143–145.
Recomendaciones- •
En todo paciente trasplantado por EHA se ha de prevenir, diagnosticar precozmente y tratar la recidiva alcohólica. En casos de recidiva grave disminuye la supervivencia del injerto y del paciente. (A1).
- •
Se debe prestar especial atención a los factores de riesgo cardiovascular y específicamente al consumo de tabaco y alcohol, y al desarrollo de neoplasias de novo de cabeza y cuello y digestivas en el paciente con trastorno por consumo de alcohol. (A1).
La EHA es la causa más prevalente de CH en Europa incluido España29–31. La mayoría de los bebedores crónicos desarrollan una esteatosis simple, aunque entre un 10-20% acabará desarrollando estehatohepatitis alcohólica, CH y CHC41,42,60. La abstinencia continuada de alcohol es el único factor capaz de mejorar la supervivencia a largo plazo69. La obesidad y el síndrome metabólico tienen un efecto aditivo70 que puede incrementar el riesgo de cirrosis y de CHC59,61, por lo que siendo entidades potencialmente evitables se debe actuar con políticas activas preventivas.
Con una prevalencia estimada del 2% de EHA, sumado al cambio en el patrón de consumo de alcohol15,19, la EHA en un problema de salud pública, precisando la puesta en marcha de medidas preventivas a distintos niveles. Se desconoce el impacto que el cambiante patrón de consumo (consumo por «atracón» y consumo entre adolescentes) puede tener sobre la mortalidad de causa hepática en nuestro país19, pero la evidencia actual hace recomendable que se diseñen estudios que evalúen dicha asociación20.
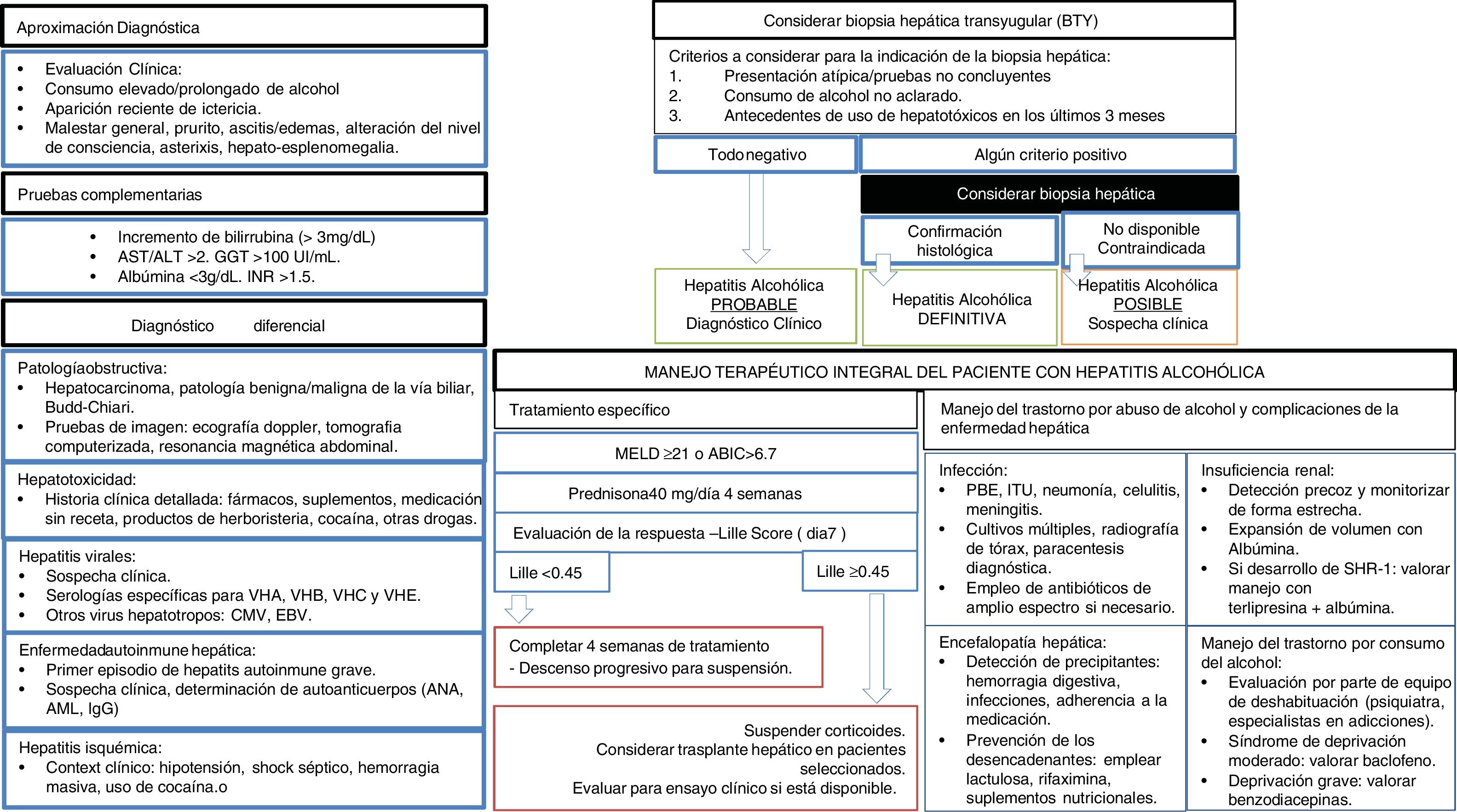
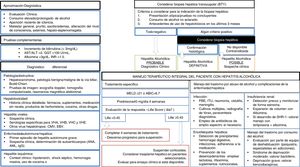
Desde el punto de vista clínico, la mayoría de los pacientes son identificados en fases tardías de la enfermedad, y el desarrollo de campañas de detección precoz es una necesidad urgente. La HA es la entidad clínica que ha recibido más atención desde el punto de vista de investigación clínica98. En pacientes con HA grave se recomienda iniciar prednisolona105,106. No existe evidencia de que la pentoxifilina aumente la supervivencia en estos pacientes107. En casos muy seleccionados, un número creciente de centros están ofreciendo la posibilidad de un trasplante hepático precoz, aunque se requiere estudios prospectivos para identificar a aquellos pacientes con menor riesgo de recidiva111. Se debe promover la abstinencia absoluta en pacientes con HA previa, ya que ingestas moderadas se asocian a mayor mortalidad135. La figura 3 resume el manejo diagnóstico y terapéutico de la HA.
Algoritmo de manejo integral del paciente con hepatitis alcohólica. Evaluación diagnóstica, tratamiento específico, complicaciones hepáticas y abordaje del trastorno por cosumo de alcohol. AST: aspartato-transaminasa. ALT: alanin-transaminasa. GGT: ganmaglutamil-transferasa. INR: internationa normalized ratio. VHA: virus de hepatitis A. VHB: virus de hepatitis B. VHC: virus de hepatitis C. VHE: virus de la hepatitis E. CMV: citomegalovirus. EBV: Epsteinbar Virus. ANA: anticuerpos antinucleares. AML: anticuerpos anti-músculo liso. MEDL: model of end stage liver disease. ABIC: Age, bilirubin, INR, creatinine score. PBE: peritonitis bacteriana espontánea. ITU: infección del tracto urinario. SHR: síndrome hepatorrenal.
El tratamiento multidisciplinar combinado con las unidades de adicciones para la adquisición de consciencia de dependencia y trabajar la prevención de recaídas es de gran importancia para el mantenimiento de la abstinencia, aunque se desconoce el beneficio de esta medida en pacientes con hepatopatía avanzada136,137. Todo candidato a trasplante por EHA debe recibir una evaluación psicosocial completa. La aplicabilidad del trasplante debe de ser establecida en base al grado de dependencia alcohólica, así como la existencia de factores favorables para una abstinencia duradera136.
En conclusión, las presentes guías de práctica clínica sobre la EHA proporcionan la mejor evidencia disponible en la actualidad para el adecuado manejo y tratamiento para nuestros pacientes.
Conflicto de interesesRamón Bataller ha recibido honorarios de Echosens por seminarios.
El resto de los autores declaran no tener conflicto de intereses.