Infliximab (IFX) es efectivo en la colitis ulcerosa (CU) y en obtener la curación de la mucosa (CM). Se conoce poco el papel que juega la CM en la evolución posterior de la enfermedad y qué ocurre una vez se interrumpe el tratamiento.
ObjetivosConocer las características y evolución de pacientes con CU tratados con IFX, que, tras obtener remisión profunda, suspenden el tratamiento.
MétodosEstudio observacional, prospectivo, de pacientes con CU moderada a grave, corticorresistente/corticodependiente, naïves a anti-TNF. Pauta de administración: IFX: 5mg/kg a 0-2-6 semanas y cada 8 después, hasta semana 54. En los pacientes que alcanzaron la CM, el tratamiento se interrumpió, con seguimiento posterior de al menos 20 meses. Remisión clínica (RC): puntuación Mayo<2; respuesta clínica: disminución de 3 puntos; CM: puntuación Mayo 0-1. Remisión profunda: paciente con RC y CM.
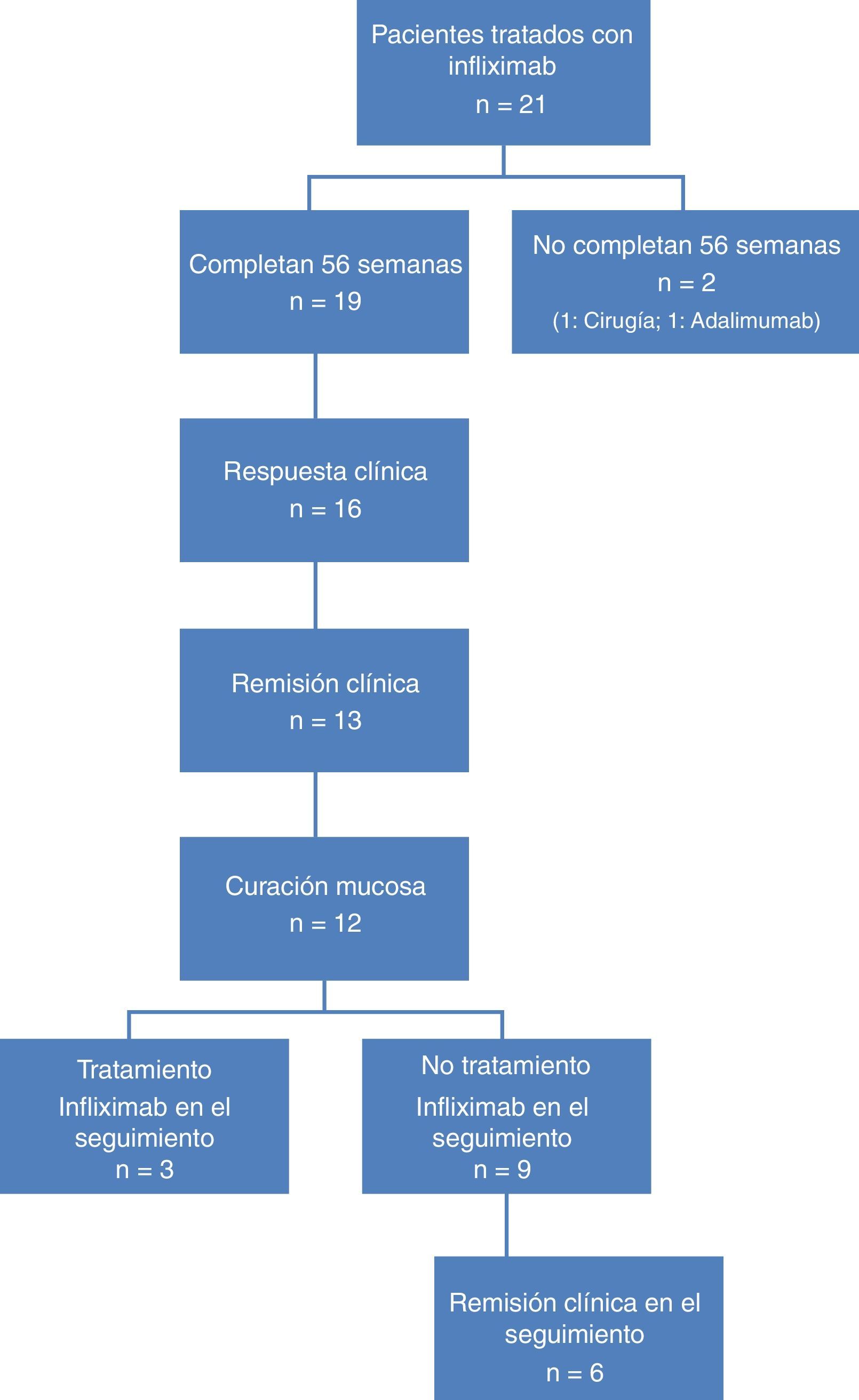
ResultadosDe los 21 pacientes incluidos, 19 completaron el estudio (colectomía=1; no respondedor=1). Edad media: 47,8 años. CU: grave (n=13); moderada (n=6), la mayoría, corticorresistentes (n=11). Un 57,8% recibieron tratamiento combinado con inmunosupresores y en el 31,5% el tratamiento se intensificó. Semana 54: 16 pacientes (84,2%) presentaron respuesta clínica, 13 (68,4%) RC y 12 (63,2%) remisión profunda. De ellos, 6 (50%) tuvieron un nuevo episodio de CU y 3 (25%) fueron tratados de nuevo con IFX. Estos últimos, en las 12 primeras semanas de la retirada del fármaco y todos respondieron de nuevo. El 91,7% de los pacientes permanecían libres de IFX a las 8 semanas y el 75% a las 12, manteniéndose en esta situación durante el tiempo de seguimiento. Ninguno de los pacientes precisó ingreso ni cirugía durante el seguimiento.
ConclusionesLos pacientes con CU que obtuvieron RM con IFX, tras suspender el tratamiento presentaron nuevo brote en la mitad de los casos y el 25% precisaron tratamiento de nuevo con IFX.
Infliximab (IFX) is effective in treating ulcerative colitis (UC) and in achieving mucosal healing (MH). Little is known about the role of mucosal healing (MH) in the subsequent evolution of the disease and the consequences of discontinuing treatment.
AimsTo evaluate the characteristics and evolution of patients with UC treated with IFX who discontinued treatment after disease remission.
MethodsObservational, prospective study of patients with moderate to severe UC, corticosteroid-resistant/corticosteroid-dependent, naïve to anti-TNF. IFX administration regimen: 5 mg/kg at 0-2-6 weeks and every 8 weeks thereafter until week 54. In patients achieving MH, IFX was discontinued and the patients were followed-up for at least 20 months. Clinical remission (CR): mayo score <2; Clinical response: decrease in mayo score of 3 points; MH: mayo score 0-1; Deep remission: patient with CR and MH.
ResultsOf the 21 patients enrolled, 19 completed the study (colectomy, n = 1; non-responder, n = 1). Mean age: 47.8 years. UC: severe (n = 13) and moderate (n = 6); most patients (n = 11) were steroid-resistant; 57.8% received combined treatment with immunosuppressants, and 31.5% intensified treatment. Week 54: 16 patients (84.2%) showed clinical response, 13 (68.4%) showed CR, and 12 (63.2%) deep remission. Of these, 6 (25%) presented a new episode of UC, and in 3 (25%) IFX was restarted within 12 weeks of discontinuation, with all patients responding. Of the total sample, 91.7% remained IFX-free at week 8, and 75% at week 12, with no remission during follow-up. None of the patients required hospitalization or surgery.
ConclusionsHalf of patients with deep remission of UC with IFX therapy presented a new episode after treatment discontinuation, and in 25% IFX therapy was restarted.
La colitis ulcerosa (CU) es una enfermedad inflamatoria intestinal crónica que afecta al recto y a una extensión variable del colon, y que se caracteriza por aparecer, generalmente, en individuos jóvenes y cursar en forma de brotes y remisión. Los síntomas más frecuentes son diarrea con sangre, urgencia defecatoria y tenesmo rectal1.
A pesar de que los corticoides son el tratamiento clásico en el brote de CU moderada-severa y más tarde se incorporó la ciclosporina como tratamiento de rescate, la necesidad de colectomía precoz en la CU parece que se ha mantenido inalterable8.
La búsqueda de otras opciones de tratamiento para la CU se ha incrementado de forma significativa en los últimos 10 años, con la llegada de los fármacos biológicos. Infliximab (IFX) fue el primer fármaco anti-TNF que mostró eficacia en el tratamiento de la CU moderada-severa, en pacientes que no habían respondido o eran dependientes de corticoides, con o sin inmunosupresores2.
Además del control de la actividad clínica, la curación de la mucosa (CM) podría considerarse hoy día como un objetivo del tratamiento en la CU, dado que es un parámetro objetivo del control de la inflamación intestinal. También se la ha relacionado con una evolución clínica favorable, así como con una menor necesidad de hospitalización y de cirugía en estos pacientes3.
Consideramos como CM a la falta de friabilidad, de sangre, de erosiones y de úlceras en cualquier segmento de la mucosa intestinal1. IFX también ha demostrado eficacia para obtener la CM de estos pacientes2.
En este sentido, los resultados del estudio ACT1 demostraron que el tratamiento con IFX permitía alcanzar la CM en la semana 54 en más de la mitad de los pacientes (60,3%) y que la evolución clínica posterior fue mejor en estos que en los pacientes sin CM4.
Una vez alcanzado el objetivo de tratamiento, la conducta a seguir frente al tratamiento con anti-TNF en la CU no está todavía definida, mientras que en la enfermedad de Crohn sí se ha estudiado la evolución de pacientes en remisión después de un año en tratamiento con IFX. Aproximadamente la mitad de los pacientes en el estudio de Louis presentaron recidiva al año de suspender el tratamiento. Los autores encontraron que factores como ser varón, no haber sufrido resección quirúrgica previa, tener leucocitos>6×109/l, hemoglobina≤145g/l, PCR≥5mg/l y calprotectina fecal ≥300μg/g se asociaban a riesgo de recidiva. En los pacientes con 2 factores o menos, la recidiva fue solo de un 15% al año de suspender el fármaco5.
Aunque la CU es un proceso de naturaleza crónica, los posibles efectos secundarios de los fármacos biológicos a largo plazo y su elevado coste pueden hacer considerar su retirada una vez alcanzado el objetivo terapéutico5. Sin embargo, en la práctica clínica disponemos de pocos datos sobre el papel que juega la remisión profunda en la evolución posterior de la enfermedad y, más aún, qué sucede en estos pacientes después de suspender el anti-TNF o si estos pacientes requieren de nuevo ser tratados con este fármaco.
Objetivos del estudio: a) objetivo primario: conocer la evolución clínica después de suspender IFX en los pacientes con CU que han alcanzado la remisión profunda; b) objetivos secundarios: valoración de los factores asociados con la remisión; respuesta al retratamiento con IFX y evolución libre de colectomía y de hospitalización.
Material y métodosDiseño y objetivos del estudioDiseño: Estudio prospectivo y observacional en pacientes con CU moderada o grave, corticorresistente/corticodependiente, naïves a anti-TNF. El estudio se ha realizado en el Servicio de Digestivo del Hospital Universitario de Basurto, entre abril de 2010 y febrero de 2014, en pacientes hospitalizados o ambulatorios. Tanto el protocolo del estudio como el consentimiento informado fueron aprobados por el Comité Ético del Hospital y todos los pacientes dieron su autorización por escrito.
El estudio se realizó en 2 tiempos:
- 1.
Primer tiempo: Los pacientes diagnosticados de CU recibieron tratamiento con IFX 5mg/kg semanas 0, 2, 6, y posteriormente, al menos cada 8 semanas hasta las 54 semanas. La intensificación se realizó acortando el tiempo de infusión de 8 a 6 semanas. Todos los pacientes recibieron premedicación antes de recibir IFX con 100mg de hidrocortisona y 5mg de dexclorfeniramina intravenosa. Se realizó endoscopia inmediatamente antes de iniciar tratamiento y después de finalizar el tratamiento en la semana 54.
- 2.
Segundo tiempo: A los pacientes que alcanzaron remisión profunda en la semana 54, se les suspendió el tratamiento con IFX y fueron seguidos clínicamente cada 3 meses durante al menos 20 meses. La valoración clínica se realizó mediante el subíndice Mayo de 0 a 9.
Se incluyó a pacientes adultos diagnosticados de CU, moderada o grave, refractaria al tratamiento convencional con corticoides orales o intravenosos o dependientes de corticoides con o sin inmunosupresores tiopurínicos (6-mercaptopurina/azatioprina) asociados, que no hubiesen recibido previamente anti-TNF. Se excluyó a aquellos pacientes tratados mediante cirugía de colon previa.
Diagnóstico de CU: se realizó siguiendo los criterios de Lennard-Jones1.
Extensión de la enfermedad: se determinó de acuerdo con la clasificación de Montreal, y se clasificaron en 3 categorías: rectitis, colitis izquierda y colitis extensa6.
Corticorresistencia: se definió como resistencia de la actividad de la enfermedad a pesar del tratamiento con 0,75mg/kg/día de prednisona oral durante 2 semanas. En los pacientes graves que reciban corticoides por vía intravenosa, se considera corticorresistencia si no hay respuesta en los primeros 5 días7.
Corticodependencia: se definió como imposibilidad de reducir la dosis de corticoides equivalente a 10mg de prednisona al día durante 3 meses desde el inicio del tratamiento con esteroides sin recaída, o recaída tras la supresión de los corticoides en 3 meses8.
Valoración de los pacientesPara realizar la valoración clínica se empleó el índice Mayo (rango: 0-12): Su valor es la suma de las puntuaciones de 4 variables, 3 clínicas: frecuencia de deposiciones mayor de lo normal (0-3), sangrado rectal (0-3) y estado general (0-3) que constituyen el subíndice clínico, que puede tener un valor sumatorio de entre 0 y 99. La cuarta variable es la endoscópica, que se puntúa de 0 a 3, y que se considera un subíndice endoscópico10.
El índice Mayo se siguió en las semanas 0 y 54 y, posteriormente, con el subíndice Mayo cada 12 semanas o antes si el paciente presentaba síntomas.
Definiciones: 1) RC: subíndice Mayo<2 y sangre en heces 0; 2) respuesta clínica: caída en el subíndice Mayo de al menos 3 puntos y sangre en heces 0 o 1; 3) remisión o respuesta mantenida: obtenida en la semana 8 y en la semana 52; 3) 4) recidiva: necesidad de tratamiento con corticoides, nuevo tratamiento con IFX o necesidad de cirugía. La mucosa se valoró con el subíndice Mayo endoscópico (0-3) al inicio del estudio; 5) CM: subíndice Mayo endoscópico de 0 o 1; 6) remisión profunda: paciente con RC y CM.
Análisis estadísticoSe llevó a cabo un estudio descriptivo. Las variables cuantitativas se representaron con la media correspondiente y los rangos mínimos y máximos entre paréntesis. Las variables categóricas se presentaron con sus frecuencias y el porcentaje, con intervalo de confianza del 95% (IC 95%). Asimismo, se empleó el test de chi cuadrado para el análisis univariante y la correlación de Pearson para variables dependientes. En los pacientes con remisión profunda se aplicó una curva de supervivencia de Kaplan-Meier para valorar la evolución libre de tratamiento anti-TNF. Mediante la regresión de Cox se analizaron las variables asociadas a la evolución libre de anti-TNF, como: sexo, edad, hábito tabáquico, años de evolución de la enfermedad, extensión, grado de lesión mucosa en el momento de la suspensión de IFX y el tratamiento con inmunomoduladores. El análisis de los resultados se llevó a cabo con el programa SPSS, versión 20.0. Se consideró el valor de p<0,05 para la significación estadística.
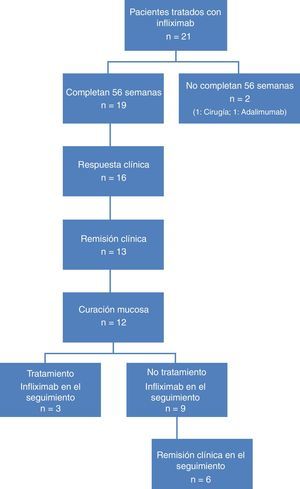
ResultadosCaracterísticas de los pacientesSe incluyó a un total de 21 pacientes, de los cuales 19 completaron las 54 semanas de tratamiento con IFX. Las causas para no completarlo fueron colectomía en la semana 12 en un paciente y no respuesta al tratamiento en la semana 24 en otro. Doce pacientes eran hombres (63,1%), con una edad media de 47,8 años (rango: 31-82).
En el momento de la inclusión, un total de 13 (68,4%) pacientes presentaban CU grave y 6 (31,6%) CU moderada. La figura 1 muestra el algoritmo de flujo de los pacientes analizados.
El tratamiento se indicó por corticorresistencia en 11 casos (57,8%) y más de la mitad de los pacientes (n =11, 57,8%) recibieron tratamiento combinado con inmunosupresores. La intensificación del tratamiento con IFX se llevó a cabo en 6 pacientes (31,6%).
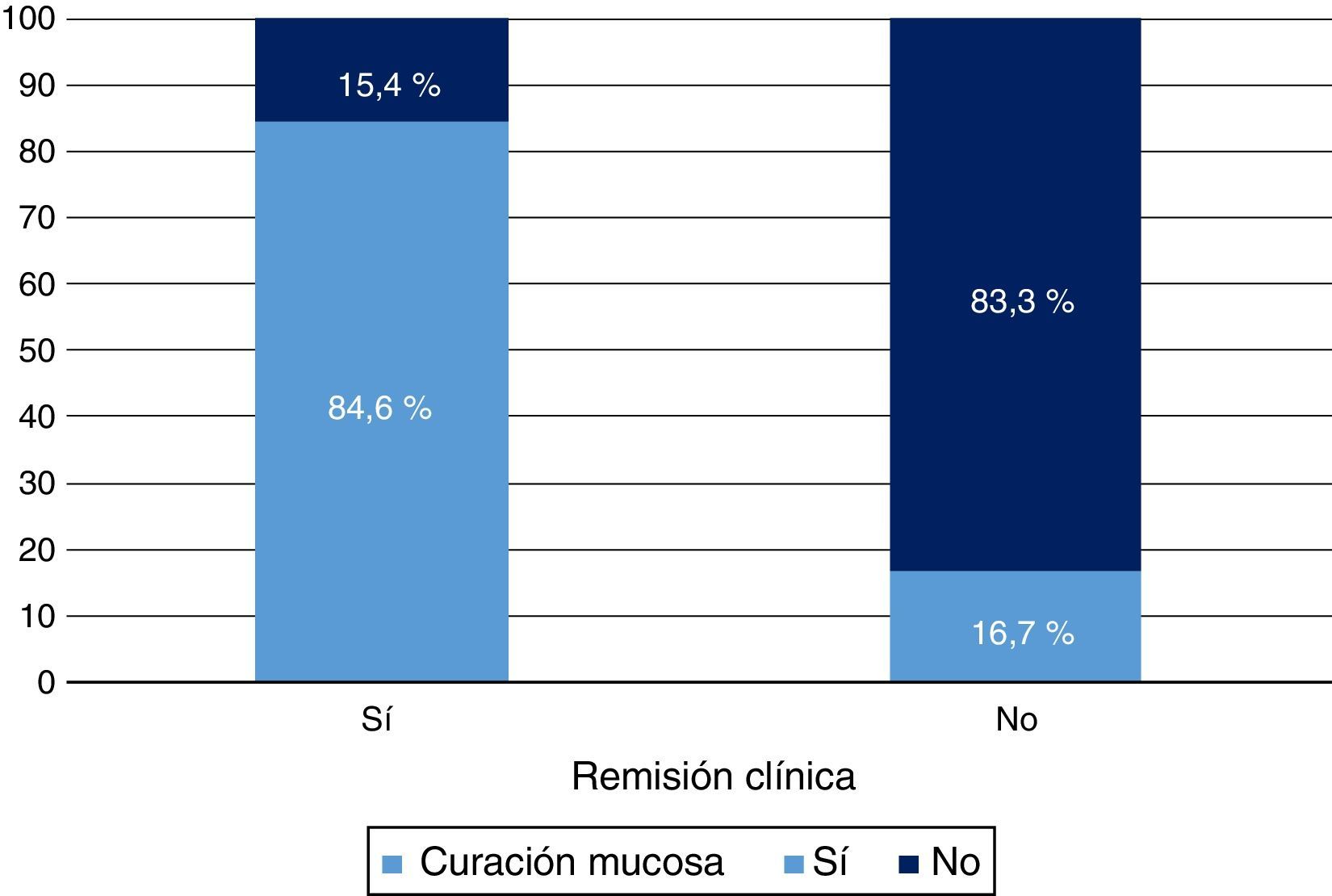
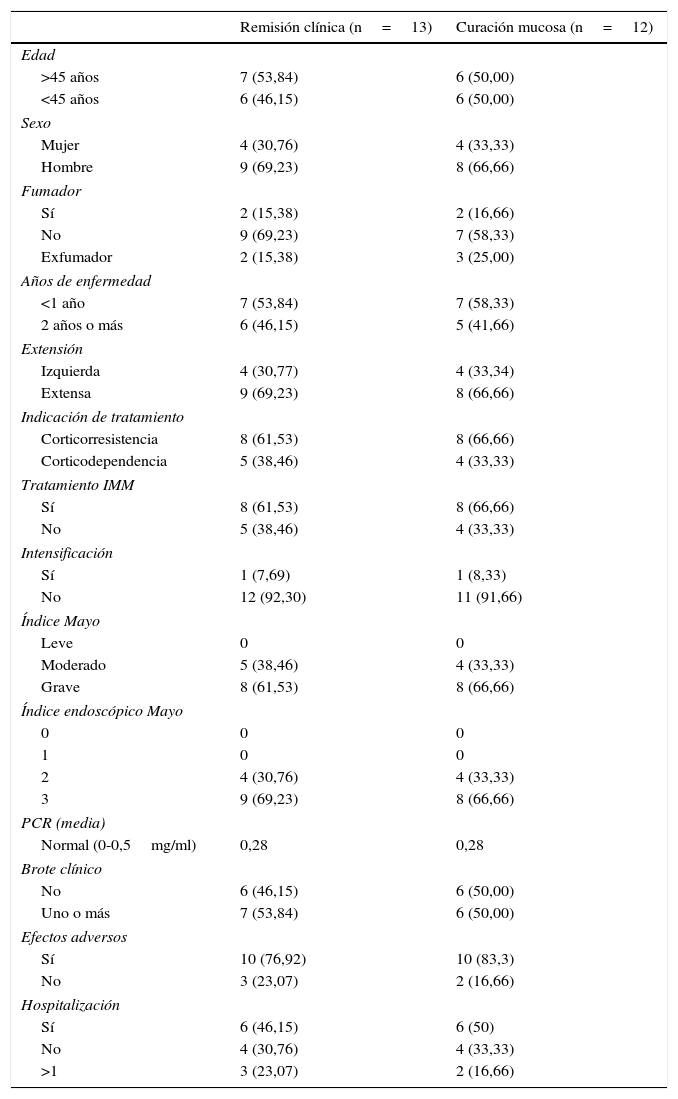
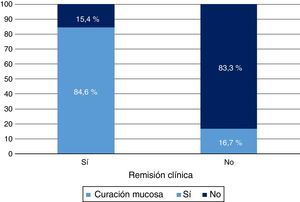
Respuesta clínica y curación mucosa al año de tratamiento con infliximabEn la semana 54, un total de 13 pacientes presentaron RC (68,4%; IC 95%: 47,5-89,3) y 16 (84,2%; IC 95%: 67,8-100) respuesta clínica. Respecto a la mucosa, 12 pacientes (63,2%; IC 95%: 41,5-84,9) presentaron remisión profunda (RM y remisión clínica [RC]) (tabla 1 y fig. 2).
Características clínicas de los pacientes con remisión y curación de mucosa
| Remisión clínica (n=13) | Curación mucosa (n=12) | |
|---|---|---|
| Edad | ||
| >45 años | 7 (53,84) | 6 (50,00) |
| <45 años | 6 (46,15) | 6 (50,00) |
| Sexo | ||
| Mujer | 4 (30,76) | 4 (33,33) |
| Hombre | 9 (69,23) | 8 (66,66) |
| Fumador | ||
| Sí | 2 (15,38) | 2 (16,66) |
| No | 9 (69,23) | 7 (58,33) |
| Exfumador | 2 (15,38) | 3 (25,00) |
| Años de enfermedad | ||
| <1 año | 7 (53,84) | 7 (58,33) |
| 2 años o más | 6 (46,15) | 5 (41,66) |
| Extensión | ||
| Izquierda | 4 (30,77) | 4 (33,34) |
| Extensa | 9 (69,23) | 8 (66,66) |
| Indicación de tratamiento | ||
| Corticorresistencia | 8 (61,53) | 8 (66,66) |
| Corticodependencia | 5 (38,46) | 4 (33,33) |
| Tratamiento IMM | ||
| Sí | 8 (61,53) | 8 (66,66) |
| No | 5 (38,46) | 4 (33,33) |
| Intensificación | ||
| Sí | 1 (7,69) | 1 (8,33) |
| No | 12 (92,30) | 11 (91,66) |
| Índice Mayo | ||
| Leve | 0 | 0 |
| Moderado | 5 (38,46) | 4 (33,33) |
| Grave | 8 (61,53) | 8 (66,66) |
| Índice endoscópico Mayo | ||
| 0 | 0 | 0 |
| 1 | 0 | 0 |
| 2 | 4 (30,76) | 4 (33,33) |
| 3 | 9 (69,23) | 8 (66,66) |
| PCR (media) | ||
| Normal (0-0,5mg/ml) | 0,28 | 0,28 |
| Brote clínico | ||
| No | 6 (46,15) | 6 (50,00) |
| Uno o más | 7 (53,84) | 6 (50,00) |
| Efectos adversos | ||
| Sí | 10 (76,92) | 10 (83,3) |
| No | 3 (23,07) | 2 (16,66) |
| Hospitalización | ||
| Sí | 6 (46,15) | 6 (50) |
| No | 4 (30,76) | 4 (33,33) |
| >1 | 3 (23,07) | 2 (16,66) |
Efectos adversos: infecciones, manifestaciones cutáneas, artralgias.
Se observó una relación significativa entre las variables RC y CM tanto con la respuesta clínica (p<0,05) como con el valor de PCR (p<0,01). La intensificación del tratamiento fue un factor predictivo de no respuesta ni de CM (p<0,01).
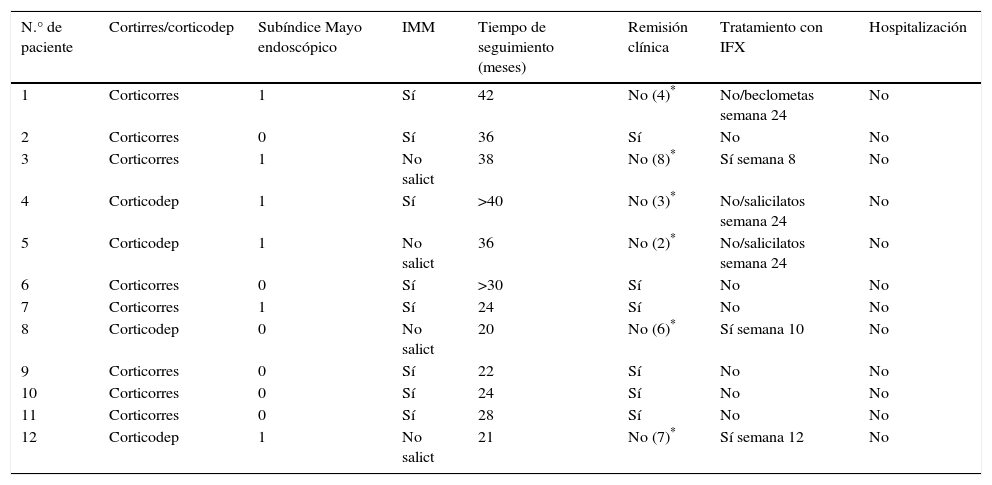
Evolución de los pacientes con remisión profunda tras suspender tratamiento con infliximabDe los 12 pacientes que presentaron remisión profunda en la semana 54, la mitad presentó un nuevo episodio de CU en los 30,1 (42-20) meses de seguimiento tras suspender IFX. Tres de ellos (25%) con brote grave (subíndice Mayo: 8, 6 y 7) fueron tratados de nuevo con IFX, uno en la semana 8, otro en la semana 10 y el otro en la semana 12 del seguimiento. En los 3 casos hubo de nuevo respuesta al tratamiento con IFX
Los otros 3 pacientes que recidivaron, 2 en la semana 12 y uno en la semana 24, presentaron brote leve-moderado (subíndice Mayo: 2, 3 y 4) y respondieron al tratamiento con salicilatos en 2 casos y beclometasona en el tercero.
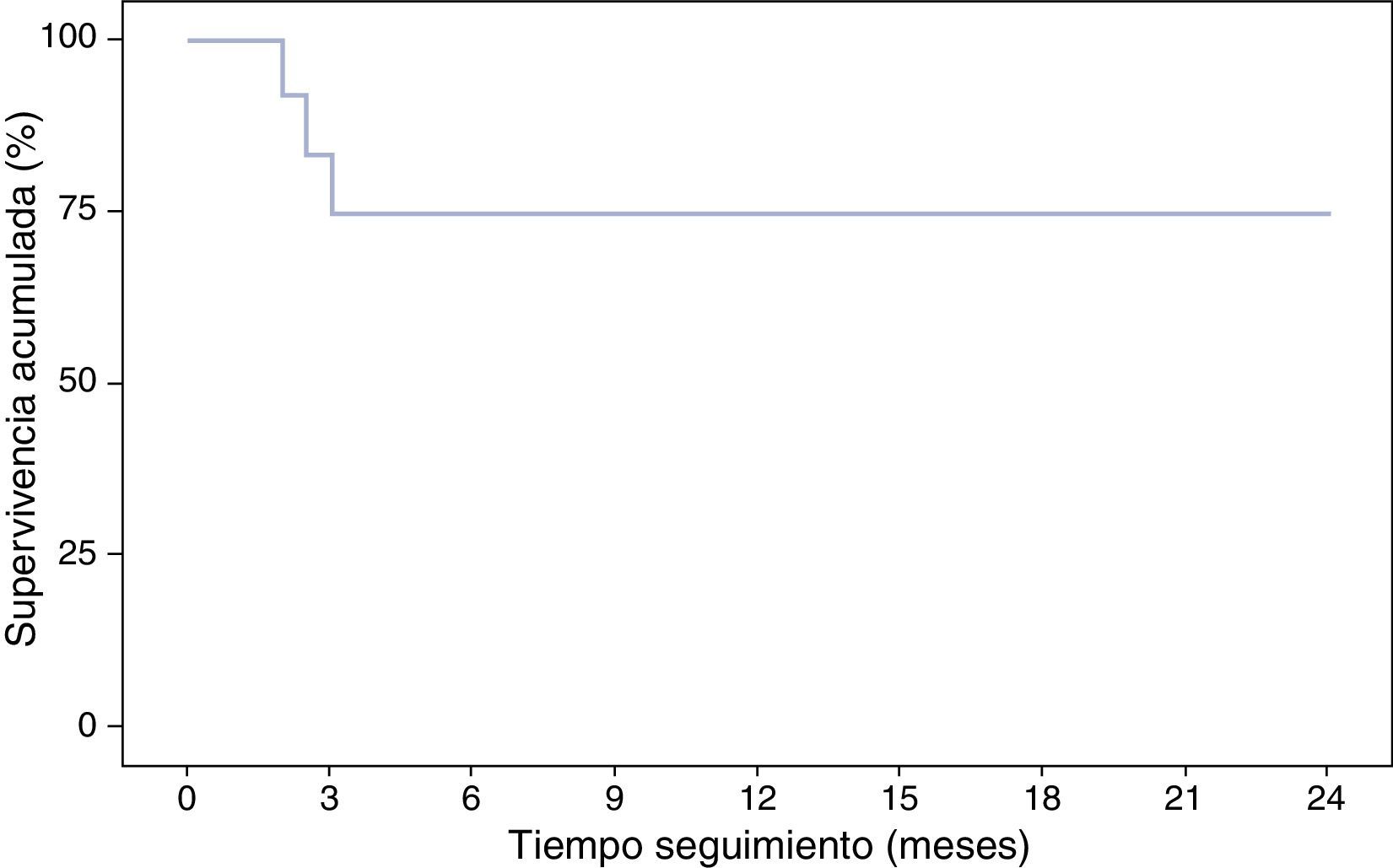
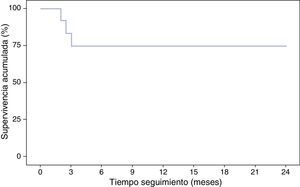
Con respecto a la interrupción del tratamiento biológico, el porcentaje de pacientes que continuaban libres de tratamiento con IFX fue del 91,7% en la semana 8 y del 75% en la semana 12, que se mantuvieron en los meses de seguimiento. En este tiempo ningún paciente precisó ingreso hospitalario ni cirugía (tabla 2, fig. 3). Ninguna de las variables analizadas, sexo, edad, tabaco, extensión de la enfermedad, grado de lesión mucosa al suspender IFX o el tratamiento asociado con inmunomoduladores tuvieron valor significativo (p>0,05).
Evolución a largo plazo tras suspender IFX en pacientes con remisión profunda
| N.° de paciente | Cortirres/corticodep | Subíndice Mayo endoscópico | IMM | Tiempo de seguimiento (meses) | Remisión clínica | Tratamiento con IFX | Hospitalización |
|---|---|---|---|---|---|---|---|
| 1 | Corticorres | 1 | Sí | 42 | No (4)* | No/beclometas semana 24 | No |
| 2 | Corticorres | 0 | Sí | 36 | Sí | No | No |
| 3 | Corticorres | 1 | No salict | 38 | No (8)* | Sí semana 8 | No |
| 4 | Corticodep | 1 | Sí | >40 | No (3)* | No/salicilatos semana 24 | No |
| 5 | Corticodep | 1 | No salict | 36 | No (2)* | No/salicilatos semana 24 | No |
| 6 | Corticorres | 0 | Sí | >30 | Sí | No | No |
| 7 | Corticorres | 1 | Sí | 24 | Sí | No | No |
| 8 | Corticodep | 0 | No salict | 20 | No (6)* | Sí semana 10 | No |
| 9 | Corticorres | 0 | Sí | 22 | Sí | No | No |
| 10 | Corticorres | 0 | Sí | 24 | Sí | No | No |
| 11 | Corticorres | 0 | Sí | 28 | Sí | No | No |
| 12 | Corticodep | 1 | No salict | 21 | No (7)* | Sí semana 12 | No |
Corticodep: corticodependiente; Corticorres: corticorresistente; IMM: inmunomoduladores; Salict: salicilatos.
El presente estudio se ha llevado a cabo en pacientes con CU que, tras un año de tratamiento con IFX, se encontraban en remisión profunda. Se seleccionó dicho subgrupo de pacientes ya que se consideró que tenían bajo riesgo de recidiva tras la supresión del tratamiento11. Durante el tiempo de seguimiento, el 50% de los pacientes presentó actividad de la enfermedad, pero solamente el 25% precisó de nuevo tratamiento con IFX.
En otro estudio clínico, que incluía pacientes tanto con enfermedad de Crohn como con colitis, el 40% de los pacientes con remisión profunda continuaron en remisión en los 20 meses de seguimiento12.
IFX es un fármaco eficaz en el tratamiento de los pacientes con CU que no han respondido al tratamiento con corticoides ni inmunosupresores, así como para obtener la curación mucosa2,13. Una vez alcanzado el objetivo terapéutico, y dado que se trata de fármacos con elevado coste y que, en algunos casos, comportan efectos secundarios, se podría valorar la retirada del fármaco. Sin embargo, todavía no disponemos de suficientes evidencias para saber cuándo y a qué pacientes se les pueden retirar. Como en ocasiones previas, esta situación se ha planteado en pacientes tratados con fármacos biológicos en Reumatología, y se ha encontrado que es posible mantener a más de la mitad de los pacientes inactivos después de la retirada del fármaco biológico14.
La CM se considera hoy como un objetivo de tratamiento, ya que se relaciona con una evolución favorable tanto a corto3 como a largo plazo15. Ya en la era previa a los biológicos, los resultados de un estudio multicéntrico llevado a cabo por el grupo Ibsen demostraron que los pacientes con CM después de un año de tratamiento tenían menos actividad clínica y menor necesidad de tratamiento16,17, aunque otros estudios clínicos han encontrado resultados discordantes a este respecto18.
Aunque no disponemos de un índice endoscópico validado para valorar la CM19 hemos seguido, como en los estudios pivotales, el subíndice Mayo2. Se define CM como un valor<1 (mucosa normal o con pérdida del patrón vascular, pero sin friabilidad mucosa)20.
En este estudio se definió CM como valores endoscópicos 0 (mucosa normal) o 1 (inflamación leve) del índice Mayo. Tal como describe Colombel en un subanálisis del estudio ACT-1, el grado de CM tiene relación con la evolución clínica, y es mejor en el grado 0 que en el 13. En nuestro caso, 4 de los 6 pacientes que nuevamente presentaron actividad clínica y 2 de los 3 que fueron retratados con IFX tuvieron un índice endoscópico 1. Aunque al ser tan escaso el número de pacientes no podemos extraer conclusiones, sí muestra una tendencia a una evolución peor. En cualquier caso, el grado de CM puede ser un factor de interés a tener en cuenta para futuros estudios.
En el presente estudio se estimó el tiempo de un año de tratamiento con IFX considerando como referencia los estudios Stori et al. y con otros estudios clínicos21, que encontraron la idoneidad de esta conducta terapéutica5. Sin embargo, recientemente, un comité de expertos ha recomendado esperar al menos 2 años en remisión profunda antes de retirar el tratamiento en estos pacientes22.
En el subgrupo de 12 pacientes con CM, 4 intensificaron el tratamiento con IFX, pasando de 8 a 6 semanas para obtener la remisión profunda. Respecto al tratamiento combinado, IFX y azatioprina, se ha demostrado que es más eficaz para alcanzar la CM23. En el presente estudio, el tratamiento combinado se llevó a cabo en 8 de los 12 pacientes. De los 4 no tratados con inmunomoduladores, uno presentó un brote leve que respondió a salicilatos y los 3 restantes precisaron retratamiento con IFX. Nuevamente el escaso número de pacientes estudiados no permite obtener conclusiones pero podrían señalar un papel protector del tratamiento combinado frente a la necesidad de retratamiento con IFX, como se ha descrito recientemente. La ausencia de inmumoduladores fue el único factor predictivo de recidiva en pacientes con enfermedad inflamatoria intestinal24. En otros estudios no se ha encontrado esta relación, aunque pueden estar limitados también por el número de pacientes25,26. En nuestro estudio no encontramos ningún factor relacionado con la recidiva, posiblemente limitado por el pequeño número de pacientes.
En cuanto a la necesidad de retratamiento con IFX, los resultados de nuestro estudio son similares a los descritos por otros autores. Así, en 3 estudios retrospectivos en los que se suspendió IFX tras la RC, el porcentaje de pacientes que fueron retratados al año osciló entre el 25 27 y el 35%28,29.
Aunque en el este estudio la proporción de pacientes libres de tratamiento con IFX se mantuvo estable en el 75% durante el seguimiento, otros autores observan una pérdida progresiva en la supervivencia libre del tratamiento con 76, 69 y 65% a los 12, 24 y 36 meses, respectivamente30.
En nuestros pacientes las recidivas se presentaron de manera precoz, ya que tuvieron lugar en las primeras 12 semanas de la suspensión de IFX. Esta circunstancia también se describe en el estudio Stori, en el que la mayor parte de las recaídas se observaron en el primer año5. Datos similares se han descrito recientemente en pacientes con enfermedad inflamatoria intestinal que también se encontraban, como en estos pacientes, en remisión profunda29.
En cuanto a la respuesta al nuevo tratamiento con IFX, los datos son favorables en diversos estudios con respuestas del 71 27, del 93 29 o del 100%, como en nuestros pacientes. En este sentido, Laharie encuentra que los pacientes con CM después de tratamiento con IFX presentan menos fracasos con nuevos tratamientos28. También en esta situación se ha encontrado un papel protector de los inmunosupresores, ya que los pacientes que seguían tratamiento con ellos tras la retirada de IFX presentaron menos reacciones infusionales en el retratamiento30.
Otro de los factores de buena evolución en nuestros pacientes es que en ningún caso se precisó colectomía y que no hubo reingresos hospitalarios durante el tiempo del estudio.
De nuevo, en el estudio de Laharie, se encontró que la ausencia de CM (índice Mayo 2-3) era el único factor relacionado con la colectomía28.
Aunque este estudio está limitado por el pequeño número de pacientes, podemos concluir que, durante el periodo de seguimiento en nuestros pacientes con remisión profunda, el 50% se mantuvieron en remisión de la enfermedad y solo el 25% precisaron un nuevo tratamiento con IFX. Además, los 3 pacientes del estudio que requirieron retratamiento con IFX de nuevo alcanzaron respuesta clínica, sin precisar ingreso hospitalario ni colectomía en ningún caso.
Resumiendo, los pacientes con CU tratados con IFX que alcanzan remisión profunda presentan un curso favorable tras la retirada del fármaco, y los casos que requieren nuevamente tratamiento con IFX vuelven a alcanzar la RC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés.
Agradecemos la colaboración de la Dra. Sofía Perea en la redacción del manuscrito y a Merck Sharp & Dohme España el soporte financiero para dicha redacción.