En los últimos años se han producido avances en el manejo de la hemorragia digestiva alta no varicosa que han permitido disminuir la recidiva hemorrágica y la mortalidad. El presente documento de posicionamiento de la Societat Catalana de Digestologia es una actualización de las recomendaciones basadas en la evidencia sobre el manejo de la hemorragia digestiva por úlcera péptica.
In recent years there have been advances in the management of non-variceal upper gastrointestinal bleeding that have helped reduce rebleeding and mortality. This document positioning of the Catalan Society of Digestologia is an update of evidence-based recommendations on management of gastrointestinal bleeding peptic ulcer.
La hemorragia digestiva alta no varicosa (HDA) y en especial, la hemorragia por úlcera péptica es uno de los motivos más frecuentes de hospitalización en patología digestiva, y representa una importante carga económica y asistencial. En los últimos años se han producido importantes avances en el manejo de esta urgencia gastroenterológica que han permitido disminuir la recidiva hemorrágica y la mortalidad1,2.
El presente documento de posicionamiento es una actualización de las recomendaciones basadas en la evidencia sobre manejo de la hemorragia digestiva por úlcera péptica. Desde la Societat Catalana de Digestologia se invitó a los autores listados a participar en la redacción y posterior revisión del documento sobre el manejo de la HDA. Dos gastroenterólogos (RCF y PGI) actuaron de coordinadores. Entre los autores se incluyeron gastroenterólogos/endoscopistas/médicos de urgencia y cirujanos. Se redactaron preguntas clave/recomendaciones que se revisaron y aprobaron por los participantes. El equipo coordinador formó cuatro subgrupos de trabajo (medidas iniciales, tratamiento endoscópico, manejo hospitalario y seguimento tras el alta hospitalaria) cada uno con su propio coordinador. Se dividieron las preguntas clave/recomendaciones entre estos cuatro subgrupos de trabajo para su redacción. Las recomendaciones se presentan de forma cronológica, de acuerdo a cómo se aplican en la práctica clínica, incluyendo el grado de evidencia según la clasificación GRADE (grado de recomendación (GR) fuerte o débil; calidad de la evidencia (CE) alta, moderada, baja o muy baja)3. Finalmente el manuscrito fue revisado y aceptado por todos los autores y publicado en la página web de la Societat Catalana de Digestologia como Document de Posicionament.
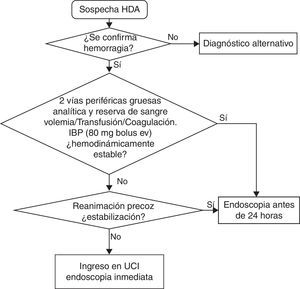
Medidas inicialesLa mayoría de los pacientes mueren por causas no relacionadas con la hemorragia. La descompensación cardiopulmonar representa el 37% de las causas de mortalidad no relacionada con la hemorragia4,5. Por eso una rápida y apropiada resucitación inicial debe preceder cualquier medida diagnóstica (GR: fuerte, CE: moderada).
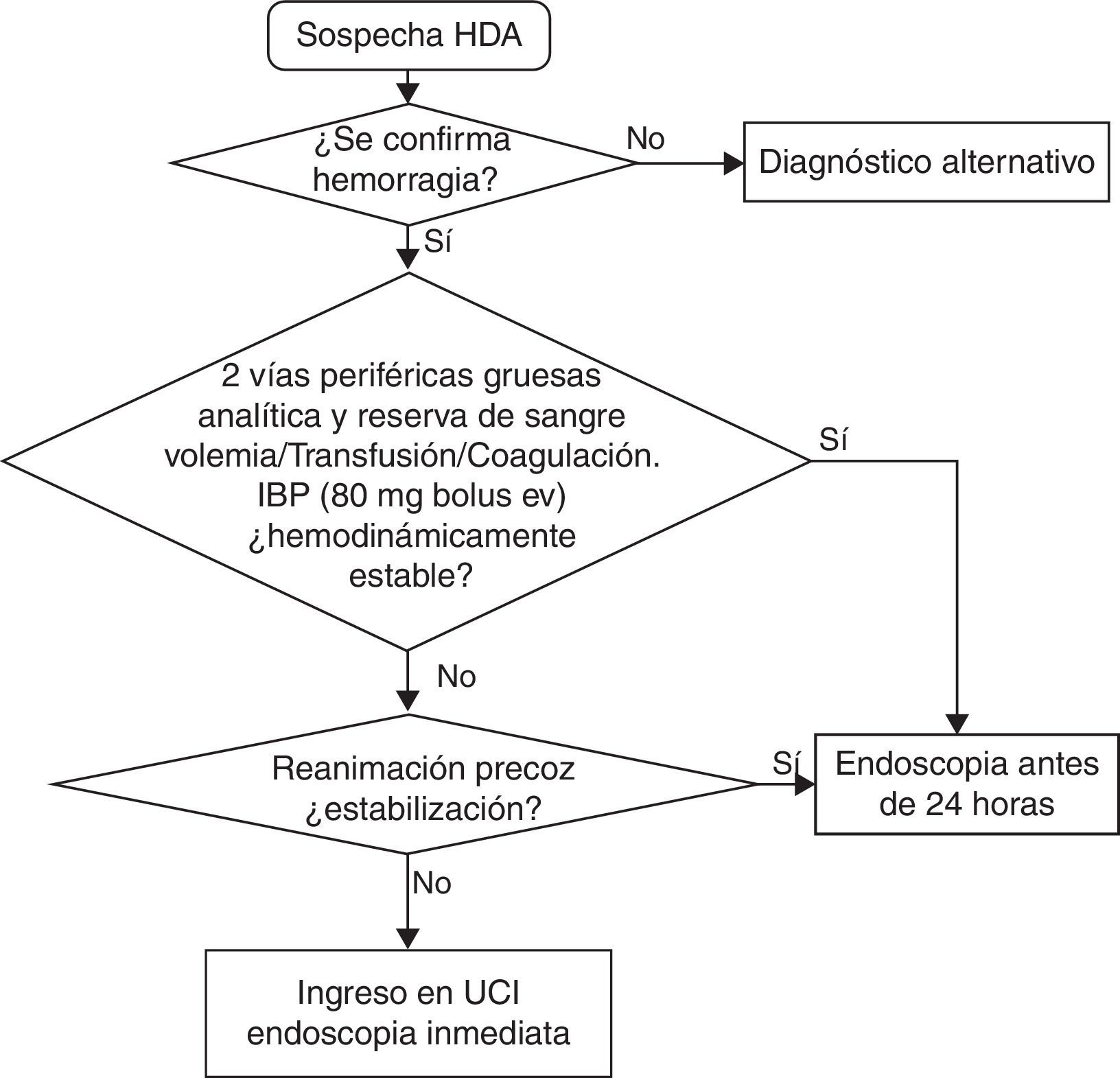
Las medidas a realizar inmediatamente después del ingreso se resumen en la tabla 1 y figura 1.
Medidas iniciales en la HDA
| Actuaciones iniciales | Anamnesis, confirmar HDA y evaluación hemodinámica Poner 2 vías periféricas gruesas Reserva de 2 concentrados de hematíes Analítica con pruebas de coagulación Tacto rectal/no SNG Reposición de la volemia Dieta absoluta Estratificar el riesgo de la HDA Valorar saturación de O2 Estado de conciencia para valorar IOT |
| Transfusión | Hb≤ 7g/dl, sin patología cardiovascular (mantener Hb entre 7 y 9g/l) Hb≤ 10g/dl y patología cardiovascular (mantener Hb entre 9 y 10g/dl) |
| Coagulación | INR supraterapéutico: corrección INR en el rango terapéutico: no hay evidencia; individualizar, pero no retrasar la gastroscopia: - Hemorragia no activa: vitamina K 20mg iv - Hemorragia activa: vitamina K iv y concentrados de factores protrombínicos Dabigatrán y rivaroxaban. Suspender tratamiento. En hemorragia grave valorar infusión de concentrado de factores protrombínicos |
La anamnesis inicial debe incluir la valoración de:
- a.
Forma de presentación de la hemorragia: «poso de café» o hematemesis, asociado o no a melenas.
- b.
Repercusión hemodinámica y gravedad: hematemesis masiva, sudoración, pérdida de conciencia (síncope o lipotimia).
- c.
Comorbilidad: teniendo en cuenta los antecedentes o datos clínicos sugestivos de hepatopatía (los pacientes con hemorragia digestiva por varices esófago-gástricas requieren un manejo diferente) y los antecedentes de patología cardiovascular.
- d.
Interrogar sobre el uso de antiinflamatorios no esteroideos (AINE) y de antiagregantes o anticoagulantes incluyendo los anticoagulantes orales de acción directa (ACOD): dabigatrán, rivaroxaban, apixaban y edoxaban.
La exploración física inicial debe incluir:
- a.
Confirmar la hemorragia:
- 1.
Tacto rectal (si hay dudas).
- 2.
Sonda nasogástrica (SNG) raramente modifica el manejo y es muy molesta para el paciente. Se debe utilizar de manera muy restringida. La colocación de la SNG en pacientes con sospecha de HDA no tiene capacidad de predecir la necesidad de tratamiento endoscópico, no tiene impacto en los resultados, no cambia actitudes clínicas y por último puede asociarse a complicaciones6. Por todos estos motivos, no se debe usar rutinariamente a pesar de que algún paciente muy seleccionado podría beneficiarse de su colocación. En caso de que se decida colocarla, tendremos que registrar en la historia clínica del paciente el resultado obtenido del aspirado como indicador de calidad en el manejo de los pacientes con HDA (GR: fuerte, CE: moderada). La SNG debe retirarse después de evaluar el aspecto del aspirado gástrico. No se recomiendan los lavados con suero frío y no hay evidencia clara de que el lavado gástrico a través de la SNG mejore la rentabilidad diagnóstica o terapéutica de la endoscopia7–9 (GR: fuerte, CE: baja).
- 1.
- b.
Evaluar el estado hemodinámico: tensión arterial sistólica y frecuencia cardiaca, así como signos de hipoperfusión periférica. La gravedad de la hemorragia se establece de acuerdo a estos datos. La saturación de oxígeno y nivel de conciencia son también de utilidad en la evaluación inicial del paciente con HDA.
- c.
Descartar cirrosis hepática (valorar estigmas de hepatopatía crónica y la presencia de encefalopatía y/o ascitis).
Después de esta evaluación inicial y una vez se ha iniciado la estabilización hemodinámica del paciente se recomienda completar la anamnesis y la exploración física.
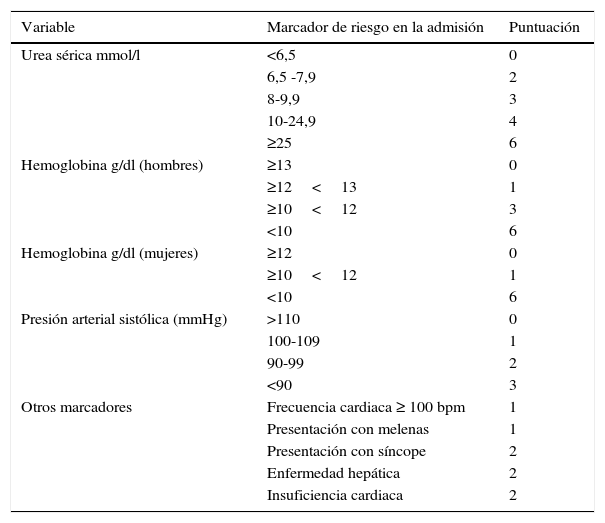
Se recomienda el uso de clasificaciones validadas para estratificar a los pacientes en grupos de alto y bajo riesgo. La estratificación del riesgo puede ayudar en decisiones como el momento de la endoscopia y el alta hospitalaria (GR: fuerte, CE: moderada). En este sentido, se recomienda el uso de la puntuación de Glasgow-Blatchford para la estratificación del riesgo preendoscópico (tabla 2). Los pacientes con riesgo muy bajo (puntuación 0: presión arterial sistólica ≥110mmHg, frecuencia cardiaca<100 lpm, Hb 13g/dl en hombres o 12g/dl para mujeres, BUN<6,5mmol/l y ausencia de melenas, sin síncope, enfermedad hepática o fallo cardiaco), no requieren endoscopia urgente ni ingreso hospitalario10 (GR: fuerte, CE: moderada).
Escala de Glasgow-Blatchford
| Variable | Marcador de riesgo en la admisión | Puntuación |
|---|---|---|
| Urea sérica mmol/l | <6,5 | 0 |
| 6,5 -7,9 | 2 | |
| 8-9,9 | 3 | |
| 10-24,9 | 4 | |
| ≥25 | 6 | |
| Hemoglobina g/dl (hombres) | ≥13 | 0 |
| ≥12<13 | 1 | |
| ≥10<12 | 3 | |
| <10 | 6 | |
| Hemoglobina g/dl (mujeres) | ≥12 | 0 |
| ≥10<12 | 1 | |
| <10 | 6 | |
| Presión arterial sistólica (mmHg) | >110 | 0 |
| 100-109 | 1 | |
| 90-99 | 2 | |
| <90 | 3 | |
| Otros marcadores | Frecuencia cardiaca ≥ 100 bpm | 1 |
| Presentación con melenas | 1 | |
| Presentación con síncope | 2 | |
| Enfermedad hepática | 2 | |
| Insuficiencia cardiaca | 2 |
El punto de corte para pacientes de bajo riesgo se ha situado entre 0 y 3 puntos, en función del estudio.
La corrección precoz de la hipotensión es la medida inicial más eficaz para reducir de manera significativa la mortalidad de la HDA (GR: fuerte, CE: moderada)5.
Manejo inicial y estabilización hemodinámica- 1.
Poner 2 vías periféricas gruesas que permitan la infusión rápida de cristaloides (reposición de la volemia) o derivados sanguíneos si es necesario. Los catéteres venosos de 16G o 18G tienen un flujo máximo de infusión de 220ml/min y 105ml/min respectivamente. Este flujo es mucho mayor que la suma del flujo máximo de las tres luces de un catéter central, unos 70ml/min11,12.
- 2.
Se obtendrá una analítica (hemograma, pruebas de coagulación, función hepática y función renal con ionograma). El aumento de la urea con cifras de creatinina normales es un dato sugestivo de HDA, aunque su fiabilidad es solamente moderada13,14.
- 3.
Sangre en reserva (al menos 2 concentrados de hematíes).
- 4.
Reponer la volemia con cristaloides. No hay evidencia de que los coloides sean superiores al suero fisiológico (GR: fuerte, CE: alta)15.
- 5.
Indicar dieta absoluta en los casos que sea necesaria la realización de endoscopia.
En pacientes con evidencia de hemorragia grave y shock a pesar de la reposición inicial de la volemia, el hematocrito no refleja el grado de pérdida hemática. En estos casos se recomienda administrar conjuntamente concentrados de hematíes y cristaloides. Además; los criterios transfusionales deberán ser liberales hasta estabilizar al paciente.
En pacientes estables sin patología cardiovascular ni hemorragia activa, con hemoglobina ≤ 7g/dl se recomienda una transfusión restrictiva para mantener la hemoglobina entre 7 y 9g/dl. (GR: fuerte, CE: moderada). Sin embargo, en pacientes jóvenes, sin patología de base, hemodinámicamente estables y sin evidencia de sangrado activo, puede mantener conducta expectante con cifras de hemoglobina inferiores a 7g/dl, si la anemia se tolera bien16.
En pacientes con patología cardiovascular y/o hemorragia activa se recomienda transfusión para mantener la hemoglobina al menos entre 9 y 10g/dl (GR: fuerte, CE: baja).
Corrección de los trastornos de coagulaciónSe recomienda corregir los trastornos de coagulación en pacientes tratados con anticoagulantes y hemorragia aguda (GR: fuerte, CE: baja).
- -
Dicumarínicos:
En pacientes con niveles supraterapéuticos de INR se recomienda la corrección de la coagulación hasta niveles terapéuticos, incluso antes de intervenciones diagnóstico-terapéuticas como la endoscopia. En caso de hemorragia activa e inestabilidad hemodinámica, la corrección se realizará de forma urgente, administrando vitamina K y concentrado de factores protrombínicos17,18. Como segunda opción, podría utilizarse el plasma fresco congelado (10ml/kg). En caso de hemorragia no activa, se puede administrar vitamina K (20mg iv. en dosis única). Si la situación clínica lo permite, se recomienda mejorar el INR hasta que sea<2,5 antes de realizar la endoscopia con o sin tratamiento hemostásico (GR: débil, CE: moderada)19.
En los pacientes con un INR dentro de intervalo terapéutico, no hay evidencia sobre la utilidad de corregir la anticoagulación. No se han demostrado diferencias en la tasa de recidiva hemorrágica, cirugía o mortalidad de estos pacientes cuando se compara corregir con mantener la anticoagulación en rango terapéutico, aunque hay escasos estudios y con muestras pequeñas. En estos casos, se debe individualizar el riesgo-beneficio de suspender el tratamiento anticoagulante. En todo caso, la presencia de un INR dentro del rango terapéutico no debe retrasar la realización de la endoscopia20,21.
Hay que valorar el riesgo-beneficio de mantener la anticoagulación en todos los pacientes. En pacientes con hemorragia moderada a grave se recomienda, como medida general, revertir la anticoagulación con dicumarínicos.
- -
ACOD:
Se recomienda suspender temporalmente los ACOD en pacientes con sospecha de hemorragia aguda en coordinación con el hematólogo y/o el cardiólogo (GR: fuerte, CE: baja). Se puede considerar el uso de concentrados de complejo de protrombina. Hay datos experimentales y clínicos que avalan la eficacia de estos derivados sanguíneos para la reversión de los efectos anticoagulantes.
Dabigatrán se elimina por vía renal, por lo que es importante mantener una diuresis adecuada. En casos de hemorragia grave no controlada, sobre todo en pacientes con insuficiencia renal, la hemodiálisis podría resultar eficaz. Además es el único con un antídoto específico comercializado: idarucizumab22–24.
Procinéticos (metoclopramida/eritromicina vía endovenosa):
No se debe indicar su uso de manera sistemática antes de la endoscopia. La eritromicina intravenosa (dosis única, 250mg administrada 30-120 min antes de la endoscopia) podría ser útil en pacientes seleccionados (con sospecha de presencia de sangre y/o coágulos en el estómago) para mejorar el rendimiento diagnóstico de la endoscopia urgente. La eritromicina mejora significativamente la visibilidad durante la endoscopia, reduce la necesidad de una segunda exploración, disminuye el número de unidades de sangre transfundida, y reduce la duración de la estancia hospitalaria (GR: fuerte, CE: alta)25,26. Otra indicación es administrarla antes de repetir la endoscopia en pacientes en los que la sangre en el estómago impidió la adecuada visualización de la mucosa gástrica (GR: fuerte, CE: moderada).
Inhibidores de la bomba de protones (IBP) por vía intravenosa:
Su administración intravenosa antes de la endoscopia disminuye el sangrado activo y los estigmas de alto riesgo, la necesidad de tratamiento endoscópico y la estancia media del paciente (GR: fuerte, CE: moderada), pero no ha demostrado que disminuya la recidiva, la necesidad de cirugía o la mortalidad27.
Su administración no debe retrasar la endoscopia (GR: fuerte, CE: moderada).
Es especialmente importante administrar el IBP intravenoso si se prevé que la endoscopia no se realizará de manera inmediata. La dosis inicial no está clara, dada la falta de estudios aleatorizados. La dosis recomendada es un bolo de 80mg de IBP intravenoso, seguido de una perfusión de 8mg/h disuelto en suero fisiológico (precipita en suero glucosado). Debe cambiarse la perfusión cada 12 h debido a la baja estabilidad de la molécula en solución. El único estudio aleatorizado utilizó esomeprazol por lo que, aunque es probable que todos los IBP sean equivalentes, se desconoce si otros IBP serán igualmente eficaces27,28.
Otros fármacos:
No se recomienda el uso de ácido tranexámico, de somatostatina, o su análogo octreotide en pacientes con HDA (GR: fuerte, CE: baja)29,30.
EndoscopiaLos protocolos específicos para el manejo de la HDA deben incluir la disponibilidad de una endoscopia urgente, de un endoscopista capacitado en la realización de técnicas hemostáticas endoscópicas y además una enfermera entrenada en la realización de endoscopias urgentes (GR: fuerte, CE: baja).
Priorización de la endoscopiaSe recomienda la realización de una endoscopia precoz (dentro de las primeras 24 h del ingreso) porque posibilita la estratificación del riesgo de recidiva y el alta precoz de los pacientes de bajo riesgo. Además permite la realización temprana del tratamiento endoscópico en los pacientes de alto riesgo (GR: fuerte, CE: moderada)1,31.
El análisis de subgrupos en estudios básicamente observacionales sugiere que en pacientes de muy alto riesgo la endoscopia muy precoz, dentro de las primeras 12 h reduce la estancia hospitalaria (GR: fuerte, CE: baja)32–35.
Es posible que los pacientes de muy alto riesgo (con inestabilidad hemodinámica persistente) puedan beneficiarse de una endoscopia dentro de las 6 primeras h que permita la aplicación de un tratamiento hemostático endoscópico más precoz. No hay estudios que confirmen esta afirmación (GR: fuerte, CE: muy baja).
Es recomendable evaluar de forma individualizada el riesgo/beneficio de la realización de la endoscopia sobre todo en aquellos pacientes con riesgo de presentar complicaciones como los que presentan un síndrome coronario agudo, con perforación o en aquellos con inestabilidad hemodinámica persistente (GR: fuerte, CE: baja).
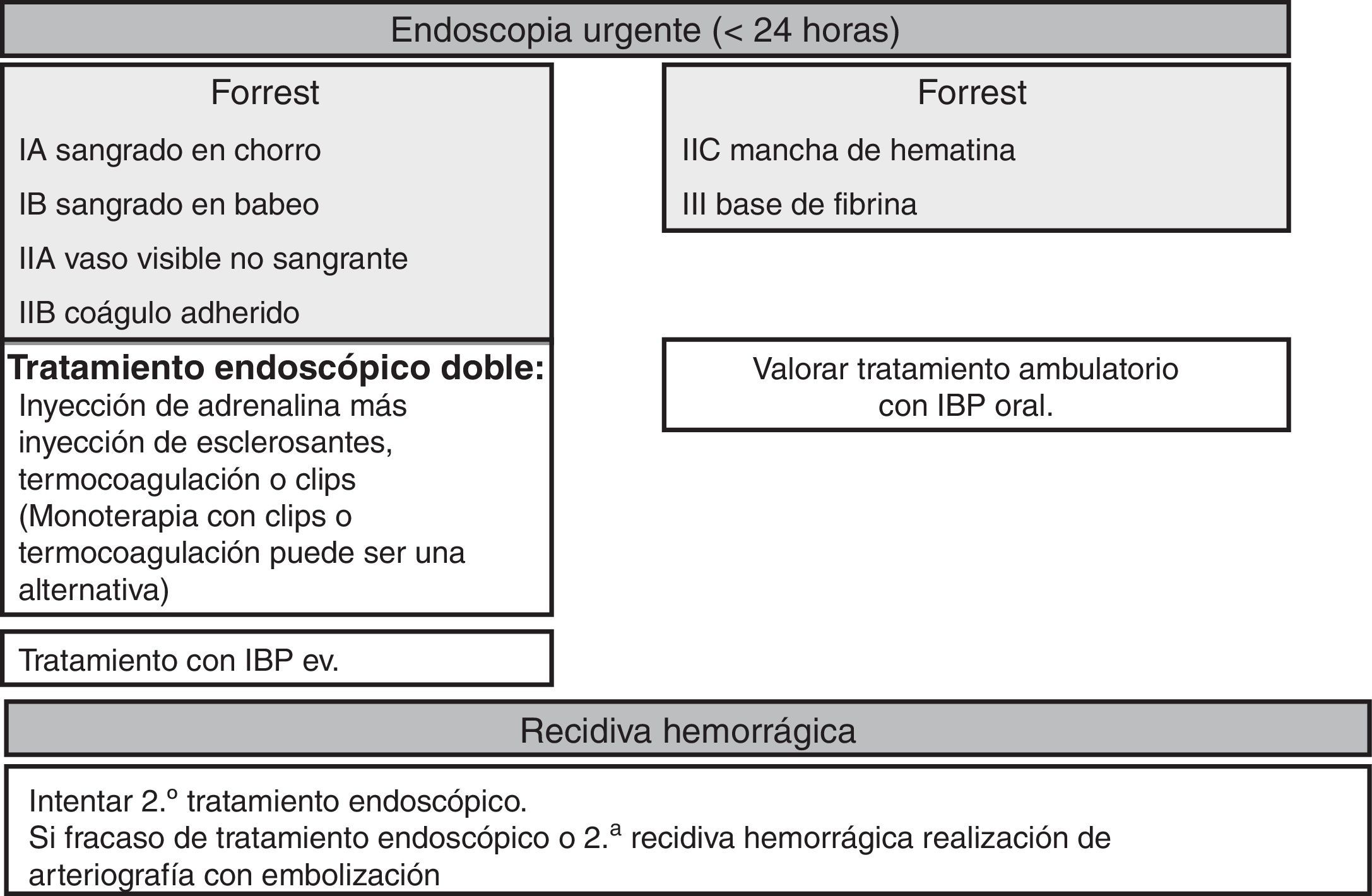
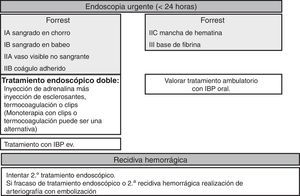
Tratamiento endoscópicoLa endoscopia debe especificar la presencia y el tipo de estigma de hemorragia reciente ya que predicen el riesgo de persistencia o de recidiva hemorrágica y determinan la indicación o no de tratamiento hemostático endoscópico. El tratamiento endoscópico no estará indicado en pacientes con estigmas de bajo riesgo (úlcera con base de fibrina o con mancha de hematina) dado el buen pronóstico de estas lesiones con una probabilidad de recidiva inferior al 5% (GR: fuerte, CE: alta)36. Cuando se detecta un coágulo adherido en una úlcera se deberán realizar lavados para desprenderlo y hacer si es necesario tratamiento endoscópico de la lesión subyacente. En el caso que el coágulo no se desprenda el tratamiento endoscópico aplicado en la base del coágulo es seguro y puede reducir la tasa de recidiva hemorrágica particularmente en los pacientes con mayor riesgo hemorrágico (edad avanzada, presencia de comorbilidades, etc.), aunque no existe evidencia que este tratamiento sea superior al uso de altas dosis de IBP (GR: fuerte, CE: alta)37.
Los pacientes con sangrado activo (chorro o babeo) o con vaso visible no sangrante tienen indicación de tratamiento endoscópico (GR: fuerte, CE: alta)38. El objetivo del tratamiento endoscópico consiste en obtener la hemostasia permanente es decir conseguir el control inicial de la hemorragia y prevenir el resangrado.
Estudios controlados han demostrado que el tratamiento endoscópico con métodos térmicos o de inyección consiguen este objetivo de forma efectiva y se acompaña de un descenso significativo en los requerimientos de cirugía urgente con una mejoría en la supervivencia del paciente (GR: fuerte, CE: alta)39.
En relación al tratamiento endoscópico en la actualidad existe una sólida evidencia que la monoterapia con inyección de adrenalina no consigue resultados óptimos ya que aunque resulta efectiva para la obtención de la hemostasia inicial, cuando se usa como monoterapia se asocia con tasas de recidiva superiores al tratamiento doble (GR: fuerte, CE: alta). Cuando se utilice la inyección de adrenalina se debe asociar un segundo tratamiento hemostático endoscópico como la colocación de clips, aplicación de termocoagulación (con electrocoagulación bipolar o «heaterprobe») o inyección de esclerosantes (alcohol absoluto, polidocanol o etanolamina), de trombina o de adhesivo tisular40,41. Los clips y la termocoagulación pueden usarse también como monoterapia porque en los estudios comparativos el tratamiento combinado no es claramente superior a su uso en monoterapia42 (GR: débil, CE: moderada). No obstante el poder estadístico de estos estudios es cuestionable.
Por eso en la práctica clínica puede resultar útil la preinyección de adrenalina, particularmente en el caso de sangrado activo, ya que así se puede obtener la hemostasia inicial permitiendo una aplicación técnica más satisfactoria del tratamiento definitivo con termocoagulación o clips. En estudios comparativos, los clips han obtenido resultados similares a los métodos térmicos o la inyección de agentes esclerosantes aunque con resultados heterogéneos. En la actualidad se dispone de nuevos tipos de clips que ofrecen ventajas técnicas como tener diferente tamaño, posibilidad de orientar la colocación y una mayor rigidez y estabilidad en la adherencia un vez que han sido liberados. No obstante aún no hay estudios que evalúen su beneficio en la práctica clínica. Respecto a otros métodos endoscópicos como los térmicos o la inyección, los clips tienen la ventaja de no producir lesión tisular por lo que podrían ser preferibles en pacientes anticoagulados o antiagregados, aunque esta posibilidad no ha sido adecuadamente evaluada (GR: débil, CE: muy baja). El láser, el gas argón, la electrocoagulación monopolar o la inyección de trombina o de adhesivos tisulares no son recomendables como tratamientos endoscópicos de primera línea ya que no han resultado más efectivos que otros métodos y se asocian a un riesgo potencial de complicaciones severas38. No obstante, tampoco la electrocoagulación bipolar, el «heaterprobe» o la inyección de esclerosantes están exentos de estos riesgos. No se dispone de estudios controlados que permitan hacer recomendaciones sobre el uso de Hemospray®, a pesar de que su uso podría considerarse en situaciones específicas de rescate (por ejemplo en úlceras con mal acceso o en lesiones con sangrado difuso)43,44.
«Second look»No se recomienda la realización sistemática de un «second-look» endoscópico porque en estudios controlados no se ha demostrado que comporten beneficios en la práctica clínica (GR: fuerte, CE: alta). Sin embargo, estos estudios también sugieren que podría ser útil en pacientes seleccionados de muy alto riesgo, pero se deberían hacer estudios adecuados con escalas pronósticas que permitan detectar de forma sensible y específica a estos pacientes (GR: débil, CE: baja). Además los estudios que evalúan la realización de un «second-look» son antiguos y no incluyen el tratamiento antisecretor adecuado ni, en muchos casos, estrategias óptimas de tratamiento hemostático45–47. En este sentido un estudio randomizado reciente48 halla que tras la realización de tratamiento endoscópico, la infusión de IBP en dosis altas no es inferior al second look con IBP iv en bolus en la prevención de la recidiva hemorrágica. Sin embargo en un estudio realizado en población asiática, con elección arbitraria de margen de no inferioridad y sin mostrar si el aumento de pH intragástrico fue suficiente.
Manejo hospitalarioEscalas pronósticas y actuación de acuerdo con el pronósticoSe recomienda el uso de escalas pronósticas postendoscopia para estratificar a los pacientes en diferentes grupos según el riesgo de recidiva y de mortalidad y así optimizar el manejo clínico (GR: débil, CE: moderada)49. Además el uso de trayectorias clínicas puede optimizar el manejo multidisciplinar protocolizado de los pacientes con HDA y reducir la estancia hospitalaria.
Entre las escalas disponibles el índice de Rockall50 (tabla 3) es el más reconocido y validado en diferentes estudios. Permite identificar a los pacientes con más bajo riesgo de recidiva y mortalidad y que pueden beneficiarse de un tratamiento ambulatorio. También identifica a los pacientes de más alto riesgo a los que se debería ofrecer una adecuada asistencia para así minimizar la morbimortalidad. Los pacientes de bajo riesgo y baja comorbilidad pueden iniciar dieta y ser dados de alta después de la endoscopia (GR: fuerte, CE: alta). Se puede usar el juicio clínico basado en los siguientes parámetros: estabilidad hemodinámica, ausencia de comorbilidades, úlcera de base limpia o con mancha de hematina y adecuado soporte familiar en el domicilio del paciente. Los pacientes con alto riesgo de recidiva y de mortalidad, tanto por criterios clínicos (edad avanzada, shock hipovolémico y comorbilidad grave) como endoscópicos (Forrest Ia-IIb) deberían ingresar un mínimo de 72 h y mantener en ayunas durante las primeras 24 -48 h por si fuera necesario un segundo tratamiento endoscópico o quirúrgico.
Índice de Rockall
| 0 | 1 | 2 | 3 | |
|---|---|---|---|---|
| Edad (años) | < 60 | 60-79 | > 80 | |
| Comorbilidad | No mayor | ICC, cardiopatía isquémica | Insuficiencia renal, enfermedad hepática, cáncer metastásico | |
| Shock | No | Frecuencia cardiaca>100 lpm | TA sistólica<100mmHg | |
| Origen de la hemorragia | Mallory-Weiss | Todos los demás (esofagitis, gastritis, úlcera péptica, varices) | Neoplasia | |
| Estigma de sangrado | Ninguno | Coágulo adherido, sangrado pulsátil |
Mortalidad baja (0-2), intermedia (3-4) o alta (≥5).
Después de la endoscopia, en pacientes con una alta probabilidad de recidiva hemorrágica y después de un tratamiento endoscópico eficaz, la administración de un IBP (80mg en bolus intravenoso seguido de una perfusión contínua de 8mg/h)ha demostrado reducir el resangrado, la necesidad de cirugía y la mortalidad (GR: fuerte CE: alta)51. Igualmente podría administrase un IBP en forma de bolus intravenoso durante las 72 h posteriores a la realización de la endoscopia52 o bien si los pacientes están en condiciones de iniciar dieta oral, se pueden administrar dosis altas por vía oral53 (GR: débil, CE: moderada). Se pueden mantener dosis altas de IBP pasadas las 72 h en pacientes con alto riesgo de recidiva. En pacientes con lesiones de bajo riesgo se puede administrar un IBP a la dosis habitual una vez al día.
Tratamiento de la recidivaLa recidiva de la hemorragia se define como la presencia de hematemesis y/o melenas asociadas a signos de hipovolemia (tensión arterial sistólica<100mmHg y/o frecuencia cardiaca>100 latidos por minuto) y/o anemización (descenso de la hemoglobina>2g/l) en un periodo<12 h. El tratamiento endoscópico es de primera elección en aquellos pacientes que presenten recidiva de la hemorragia, tanto si habían sido tratados previamente como si no (GR: fuerte, CE: moderada). Disponemos de un único estudio publicado hace años que muestra claramente que un segundo tratamiento endoscópico puede evitar la cirugía en más de un 70% de los pacientes con resangrado sin que se objetive un aumento de la mortalidad o las complicaciones. No obstante se recomienda comentar con el equipo de guardia de cirugía todos los pacientes que presenten una recidiva hemorrágica durante el ingreso hospitalario (GR: fuerte, CE: baja)54. En caso de fracaso de un segundo tratamiento endoscópico se debería considerar la cirugía urgente de rescate o la arteriografía con embolización. La angiografía percutánea con embolización supraselectiva del vaso sangrante se puede considerar una alternativa al tratamiento quirúrgico en aquellos paciente con fracaso del tratamiento endoscópico o cuando no es posible usarlo (GR: débil, CE: baja)55.
En aquellos centros que no dispongan de radiología intervencionista, se puede optar por el tratamiento quirúrgico o el traslado del paciente a un centro que disponga de servicio especializado de radiología intervencionista.
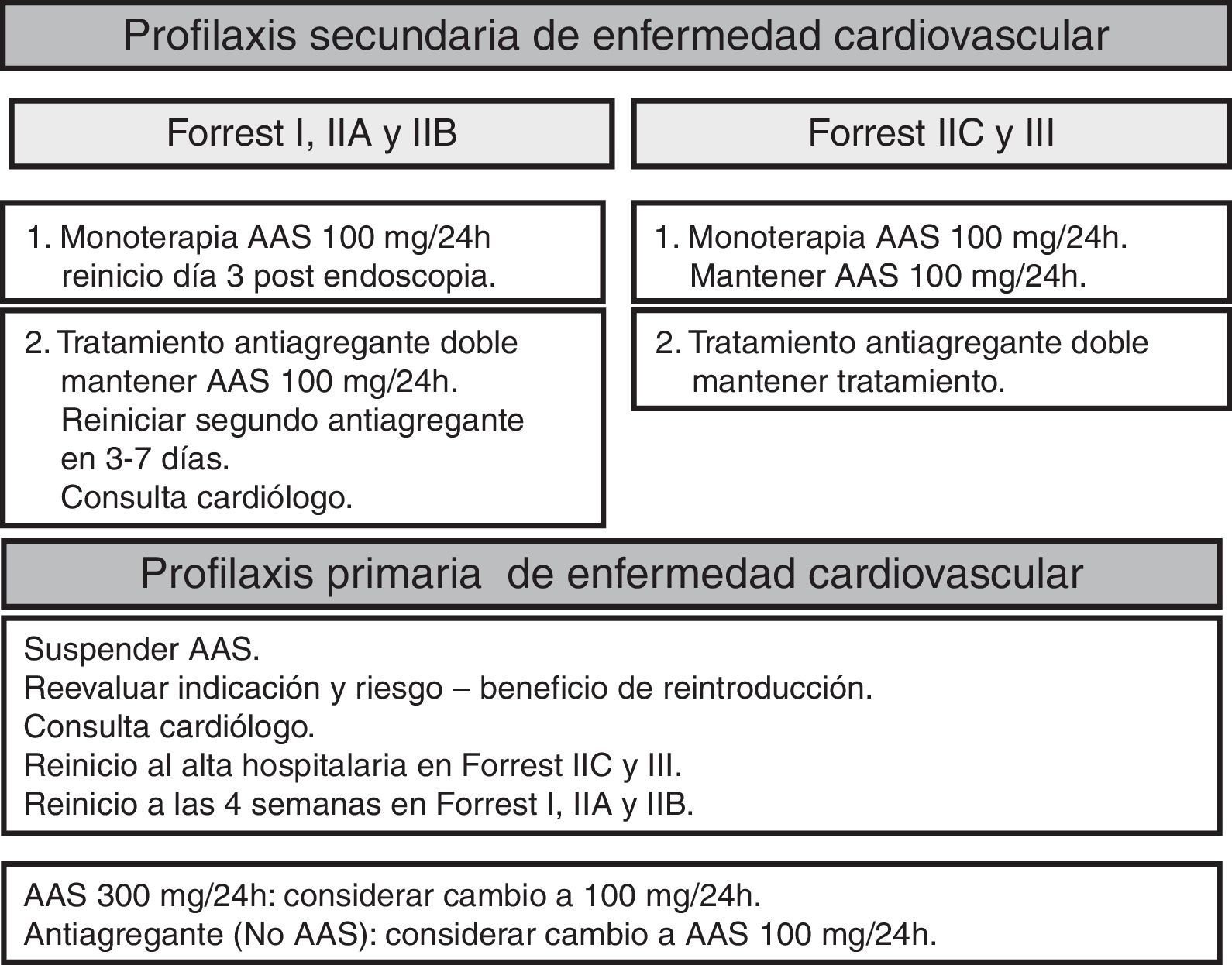
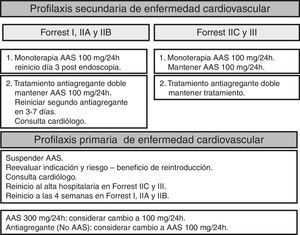
Uso de antiagregantes y anticoagulantesEl reinicio precoz del tratamiento antiagregante tras el control de la hemorragia disminuye el riesgo de mortalidad cardiovascular sin aumentar significativamente el riesgo de resangrado. En los pacientes con estigmas de hemostasia reciente puede hacerse de forma segura a partir del tercer día después de la endoscopia. Si no hay estigmas de hemostasia reciente puede hacerse inmediatamente (GR fuerte, CE moderada)56–59.
Los pacientes con doble tratamiento antiagregante se consideran un grupo de alto riesgo tromboembólico. Se recomienda mantener la antiagregación con ácido acetilsalicílico (AAS) y suspender el clopidogrel durante un periodo corto de tiempo ya que esto no aumenta significativamente el riesgo de complicaciones cardiovasculares (GR fuerte, CE moderada). En los pacientes con inserción muy reciente (<1 mes) de stents fármacoactivos debe valorarse conjuntamente con el cardiólogo la necesidad de mantener la doble antiagregación (fig. 2).
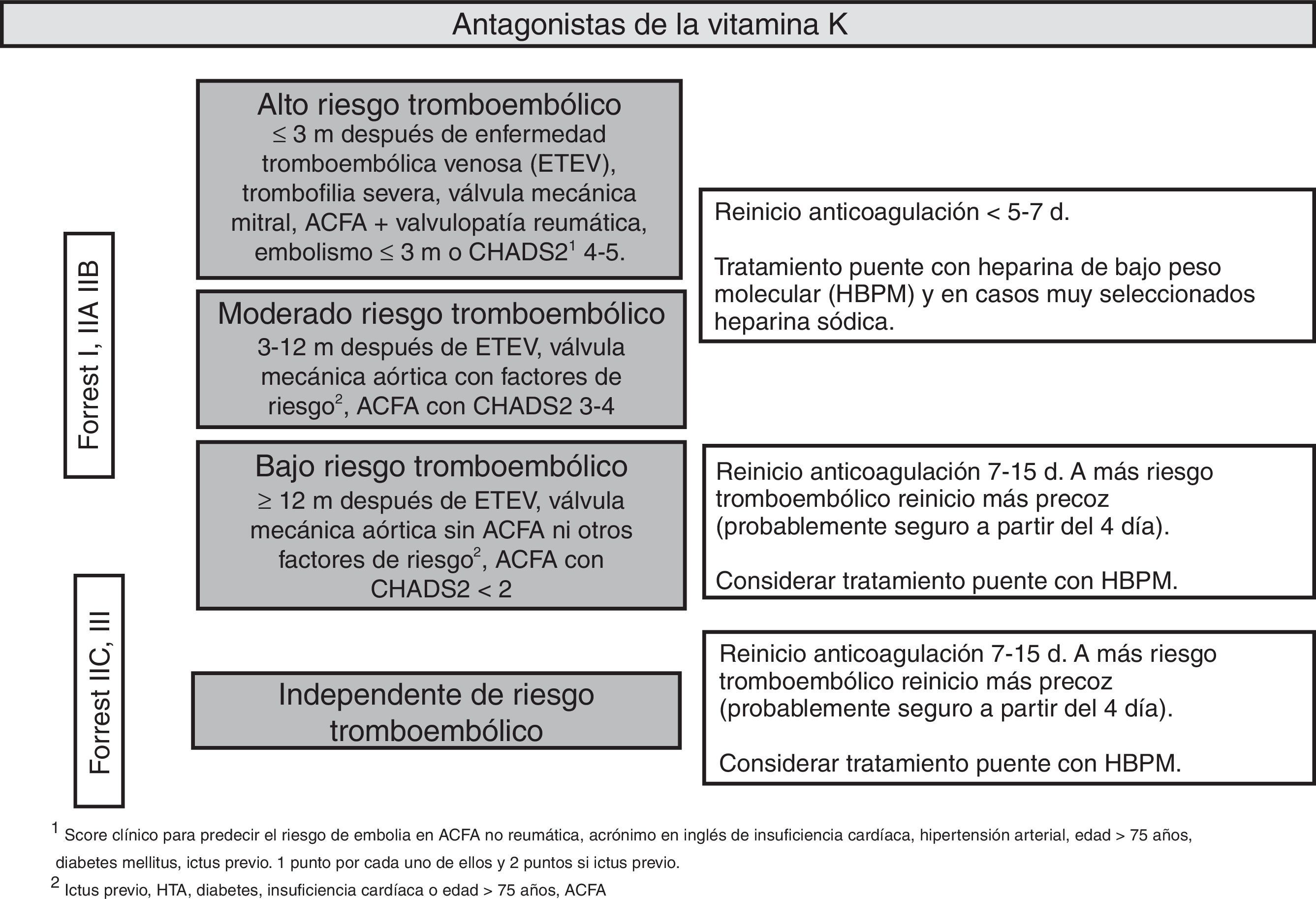
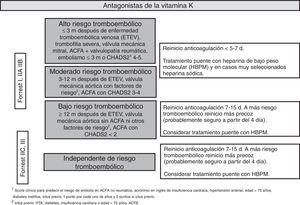
Tras un episodio de HDA está indicado reiniciar el tratamiento anticoagulante a largo plazo porque disminuye la mortalidad por causas cardiovasculares. Sin embargo, la evidencia sobre cuál es el momento más adecuado para el reinicio es limitada60,61. Después de la endoscopia se debe valorar individualmente el riesgo tromboembólico asociado a la suspensión del tratamiento anticoagulante. Se recomienda reiniciar el tratamiento anticoagulante entre los días 7 y 15 del episodio hemorrágico. Con este periodo no aumenta el riesgo de hemorragia y se mantiene la disminución del riesgo tromboembólico y de la mortalidad62. El reinicio de la anticoagulación durante los 7 primeros días podría aumentar moderadamente el riesgo de hemorragia pero disminuye el riesgo de trombosis y la mortalidad por esta causa63,64. Los pacientes con un riesgo tromboembólico moderado o alto (fig. 3) son los que se podrían beneficiar del reinicio más precoz de la anticoagulación65 (GR fuerte, CE moderada).
Durante el ingreso se recomienda administrar heparina de bajo peso molecular como tratamiento puente. La heparina sódica estaría indicada solo en casos excepcionales de muy alto riesgo (por ejemplo, válvulas protésica mitrales con mecanismo de jaula) (GR fuerte, CE bajo).
Para los ACOD parece razonable actuar de la misma manera que con los dicumarínicos, aunque en estos casos podría evitarse el tratamiento puente con heparina. Es fundamental actuar de acuerdo con Cardiología ya que no se dispone de datos para realizar una recomendación firme. Tras el episodio de HDA podría valorarse el cambio a un nuevo anticoagulante oral con menos riesgo de hemorragia gastrointestinal como apixaban o edoxaban66 (GR fuerte, CE bajo).
En la figura 4 se resume el manejo hospitalario en la HDA.
Seguimiento después del altaTratamiento de la úlceraTras el alta, los pacientes con úlcera gastroduodenal asociada a Helicobacter pylori (Hp) deben tomar un IBP según la pauta de erradicación prescrita67. Posteriormente, deben continuar con IBP 4 semanas en caso de úlcera duodenal o hasta completar 8 semanas si se trata de una úlcera gástrica68,69 (GR: fuerte, CE: alta).
En caso de úlcera gástrica sin información sobre Hp el tratamiento con IBP debe proseguir hasta poder comprobar la cicatrización de la úlcera mediante endoscopia. En caso de úlceras sin infección por Hp ni toma previa de AINE/antiagregantes o úlceras refractarias se recomienda prescribir dosis doble de IBP70 (GR: moderado, CE: fuerte).
La diferenciación entre úlcera gástrica benigna y maligna resulta más difícil en el contexto de una HDA, y siempre deben tomarse biopsias en la endoscopia inicial si es posible. En cualquier caso, debe confirmarse la cicatrización de la úlcera con toma de biopsias incluso si la úlcera se halla cicatrizada71,72. Entre un 2-6% de los casos, la ausencia de malignidad en el estudio anatomopatológico inicial puede ser un resultado falso negativo71–73 (GR débil, CE: moderada). El momento adecuado para la revisión endoscópica de las úlceras gástricas es entre las 6 y 8 semanas, ya que el tratamiento estándar con IBP consigue cicatrizar la mayoría de las úlceras en este periodo74 (GR: fuerte, CE: alta).
Infección por Helicobacter pyloriEn todos los pacientes con HDA secundaria a úlcera péptica es necesario investigar la infección por Hp de manera precoz (fase aguda) y tras el posterior tratamiento con la terapia antibiótica apropiada (GR: fuerte, CE: alta) La erradicación de Hp elimina en casi su totalidad el riesgo de recidiva hemorrágica9,75–77.
Existe una elevada tasa de resultados falsamente negativos, cuando las pruebas de detección de Hp se realizan durante el episodio agudo de hemorragia, por ello es necesario repetir dichas pruebas cuando el resultado inicial es negativo (GR: fuerte, CE: alta). La tasa de falsos negativos de las pruebas diagnósticas de Hp en el episodio de sangrado es elevado (25-55%)31,77,78. La realización de una endoscopia en el episodio de hemorragia permite la realización de test de la ureasa (rápido y sencillo), aunque en esta situación presenta poca sensibilidad diagnóstica79. Parece ser más rentable, en estos casos, realizar el examen histológico de biopsias gástricas (antro y cuerpo) con menor pérdida de sensibilidad, o simultáneamente test de la ureasa e histología. Por este motivo cuando el resultado inicial es negativo80,81, se debe investigar entre las 4-8 semanas del episodio agudo de nuevo la infección Hp mediante el test del aliento con urea marcada con C12 utilizando el protocolo europeo que incluye la administración previa de ácido cítrico82. Aunque el consenso europeo de Maastricht IV también recomienda el uso de la prueba del antígeno en heces (ELISA monoclonal)83 como alternativa diagnóstica al test del aliento, la fiabilidad de los distintos métodos de detección en heces varía según el fabricante y la técnica empleada y los resultados en nuestro medio son inferiores al test del aliento84,85.
Tratamiento con antiinflamatorios no esteroideosNingún AINE ha demostrado ser superior a otro en términos de eficacia para el control del dolor por lo que si hablamos de respuesta clínica no se puede recomendar ningún fármaco específicamente86–88.
No obstante, hemos de tener en cuenta dos aspectos importantes cuando se recomiende tratamiento con AINE en pacientes con antecedente de HDA: en primer lugar reevaluar cuidadosamente la adecuada indicación del uso de los AINE y en segundo lugar el riesgo cardiovascular y el riesgo gastrointestinal del paciente. Al tratarse de pacientes con antecedentes de HDA se considerarán siempre de alto riesgo gastrointestinal y por tanto solo debemos valorar su riesgo cardiovascular89.
La mayoría de los AINE no selectivos incrementan el riesgo cardiovascular y especialmente el diclofenaco con un riesgo relativo (RR) de 1,40 IC95% (1,27 - 1,55). Los inhibidores COX-2 lo hacen en menor medida con un RR para celecoxib de 1,26 IC95% (1,09 - 1,47) salvo etoricoxib se asocia con un riesgo de eventos cardiovasculares trombóticos comparable con diclofenaco90,91.
Los inhibidores selectivos de la COX-2 tienen respecto a los AINE no selectivos una disminución del 50% del riesgo de complicaciones gastrointestinales siendo el RR de diclofenaco 3,34 IC95% (2,79 - 3,99) versus el RR de celecoxib 1,45 IC 95% (1,17 - 1,81)92,93.
Por ello la recomendación es que en los pacientes de alto riesgo cardiovascular debe evitarse el uso de AINE si es posible o administrar dosis bajas de celecoxib con un IBP y en caso de bajo riesgo cardiovascular celecoxib con IBP. Esta combinación reduce sustancialmente aunque no elimina del todo el riesgo de resangrado. (GR: fuerte, CE: alta)89,94–97.
Tratamiento con ácido acetilsalicílico y/o clopidogrelEl AAS, clopidogrel, prasugrel y ticagrelor aumentan el riesgo de HDA98–100. Los pacientes que en tratamientos con estos fármacos tengan historia de HDA deberán recibir tratamiento con un IBP101–104.
Los pacientes que presentan una HDA y estén en tratamiento con clopidogrel por su patología cardiovascular presentan un riesgo elevado de recidiva hemorrágica y este riesgo es superior a la combinación de AAS y un IBP102 (GR: fuerte, CE moderada).
Diversos estudios farmacológicos han postulado que los IBP podrían inhibir competitivamente la activación de clopidogrel por el enzima CYP2C19, incrementando el riesgo de eventos isquémicos en los pacientes tratados conjuntamente con IBP y clopidogrel105,106. En estudios clínicos observacionales, la significación clínica de la interacción entre los dos fármacos ha sido contradictoria107. Un reciente metaanálisis limitado a estudios clínicos randomizados para evaluar la interacción entre clopidogrel e IBP no mostró diferencias en la aparición de eventos cardiovasculares, pero evidenció una reducción significativa del número de episodios de hemorragia digestiva en el grupo de enfermos tratados con IBP108.
La evidencia de mejor calidad sugiere que la interacción farmacológica entre IBP y clopidogrel no tiene consecuencias clínicas relevantes y por tanto el beneficio de la prevención secundaria de la hemorragia con un IBP, sobrepasaría claramente el riesgo cardiovascular que podría suponer la interacción entre los IBP y el clopidogrel108 (GR: fuerte, CE: moderada).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.