El cuerpo humano está poblado por miríadas de microorganismos en toda su superficie y en las cavidades conectadas con el exterior. Los colonizadores microbianos del intestino (microbiota) son parte funcional y no prescindible del organismo humano: aportan genes (microbioma) y funciones adicionales a los recursos de nuestra especie, y participan en múltiples procesos fisiológicos (desarrollo somático, nutrición, inmunidad, etc.). Algunas enfermedades crónicas no transmisibles de la sociedad desarrollada (atopias, síndrome metabólico, enfermedades inflamatorias, cáncer y algunos trastornos de la conducta) se asocian a disbiosis: pérdida de riqueza de especies en la microbiota intestinal y desviación del entorno microbiano ancestral. Los cambios en la transmisión vertical del microbioma, el uso de antisépticos y antibióticos y los hábitos dietéticos de la sociedad industrializada parecen estar en el origen de la disbiosis. Generar y mantener diversidad en la microbiota es un nuevo objetivo clínico para la promoción de salud y la prevención de enfermedades.
The human body is populated by myriads of microorganisms throughout its surface and in the cavities connected to the outside. The microbial colonisers of the intestine (microbiota) are a functional and non-expendable part of the human organism: they provide genes (microbiome) and additional functions to the resources of our species and participate in multiple physiological processes (somatic development, nutrition, immunity, etc.). Some chronic non-communicable diseases of developed society (atopias, metabolic syndrome, inflammatory diseases, cancer and some behaviour disorders) are associated with dysbiosis: loss of species richness in the intestinal microbiota and deviation from the ancestral microbial environment. Changes in the vertical transmission of the microbiome, the use of antiseptics and antibiotics, and dietary habits in industrialised society appear to be at the origin of dysbiosis. Generating and maintaining diversity in the microbiota is a new clinical target for health promotion and disease prevention.
La salud de un individuo depende de su biología (genética, desarrollo, envejecimiento), estilo de vida (alimentación, ejercicio, consumo de fármacos, hábitos tóxicos, etc.), medio ambiente (factores externos físicos, químicos, biológicos, psicosociales, socioculturales, etc.) y del sistema sanitario que le atiende (utilización de servicios, eficacia, eficiencia, etc.). La colonización microbiana está implicada, de un modo u otro, en muchas de esas variables. En concreto, la investigación experimental y clínica de la última década ha subrayado el impacto funcional de las comunidades microbianas que habitan el intestino de los animales, incluyendo el ser humano. La microbiota intestinal juega un papel relevante en la salud y en la enfermedad. Aunque todavía no tenemos respuestas definitivas para describir cómo es la simbiosis óptima entre microorganismos y hospedador, o cuál es la proporción o combinación de microorganismos más adecuada para cada individuo, existen evidencias científicas básicas que el médico debe conocer y aplicar en su práctica clínica.
Composición y funciones de la microbiota intestinalLa colonización microbiana y el desarrollo de una microbiota intestinal propiamente dicha comienza en el parto, aun cuando pueda existir una exposición limitada a microorganismos durante la etapa fetal1. La microbiota intestinal es clave para el desarrollo del sistema inmunitario y la homeostasis del individuo2, y las primeras fases de colonización son cruciales. Experimentos en animales libres de gérmenes demuestran que la colonización microbiana en etapas tempranas de la vida induce funciones tróficas e inmunitarias, pero esto ya no ocurre si la colonización se retrasa a la edad adulta3,4.
La adquisición de la microbiota está influida por numerosos factores5: tipo de parto, edad gestacional, alimentación inicial, exposición a antibióticos, etc. Los bebes nacidos por parto vaginal tienen una microbiota inicial que se asemeja a la de la vagina materna, mientras que los nacidos mediante cesárea muestran perfiles propios de la piel o del ambiente6. Los recién nacidos prematuros presentan niveles reducidos de anaerobios, como Bifidobacterium o Bacteroides, y niveles más elevados de enterobacterias, que incluyen patógenos potenciales (Escherichia coli o Klebsiella pneumoniae)7. Los antibióticos, incluso los administrados a la madre en forma de profilaxis, alteran la adquisición de la microbiota intestinal8.
La microbiota de los niños con lactancia materna exclusiva muestra dominancia de microorganismos beneficiosos, como las bifidobacterias, en comparación con los niños alimentados con fórmulas9. Otros factores como la presencia de hermanos mayores, mascotas o el ambiente rural o urbano también influyen5. Con la introducción de la alimentación sólida y la retirada de la lactancia hay cambios importantes, y los filos Bacteroidetes y Firmicutes pasan a ser dominantes para el resto de la vida. Aumenta progresivamente la diversidad microbiana, la capacidad para degradar hidratos de carbono complejos y xenobióticos, y la de producir vitaminas. A los 3 años, la microbiota se asemeja a la del adulto5, aunque algunos grupos microbianos alcanzan sus niveles definitivos en la adolescencia10.
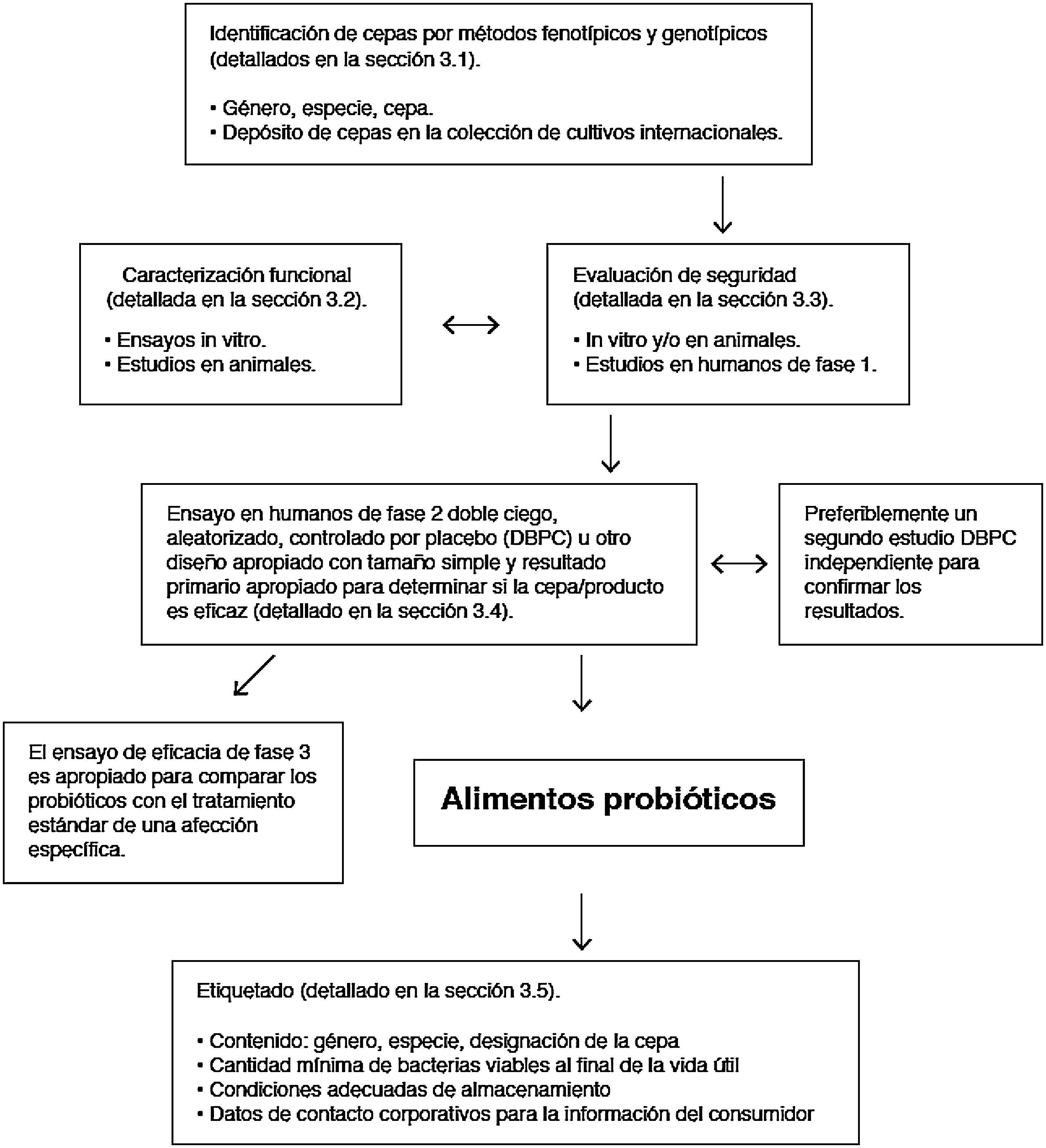
En el adulto, el 90% de las bacterias intestinales pertenecen a 2 filos: Bacteroidetes y Firmicutes. Las Proteobacterias, Actinobacterias, Fusobacterias y Verrucomicrobia completan el 10% restante junto con pocas especies del dominio Arquea11. La microbiota intestinal humana incluye también levaduras, fagos y protistas. El componente viral está dominado por bacteriófagos. Se sabe que juegan un papel crucial en la configuración del ecosistema, mediante el control de la proliferación de especies dominantes y la transferencia horizontal de genes, pero la gran mayoría de las secuencias virales comparten poca o ninguna homología con las bases de datos de referencia12. Las levaduras forman una comunidad relativamente poco diversa, se identifican menos de 20 especies en el intestino del adulto sano, su abundancia relativa es 4 a 5 órdenes de magnitud menor que la de las bacterias, pero tienen tamaño celular y genoma mucho mayor, aportando recursos funcionales que se integran en el ecosistema13.
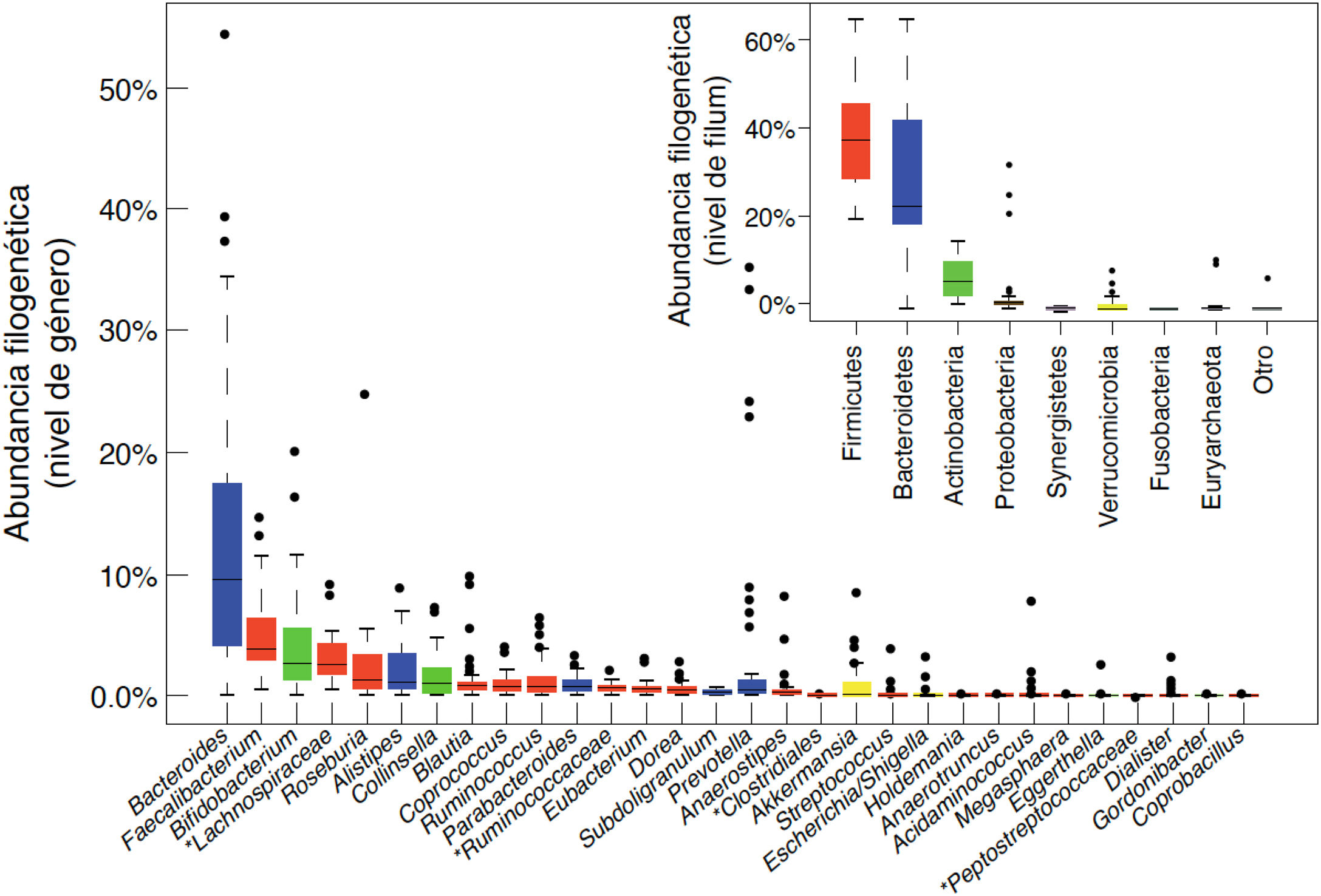
Los géneros bacterianos principales se muestran en la figura 1. A nivel de cepa, cada individuo alberga un patrón distintivo de comunidades microbianas con muchas cepas únicas que no se encuentran en otros individuos. Hay diferencias entre los distintos tramos del tubo digestivo, y también entre las heces y la mucosa intestinal de un mismo individuo, aunque generalmente se detectan las mismas cepas en proporciones distintas. Los estudios longitudinales demuestran que factores tales como la dieta, la ingesta de fármacos, los viajes o el tiempo de tránsito colónico, generan variabilidad en la composición microbiana de las muestras fecales de un mismo individuo, pero las diferencias entre distintos sujetos son mucho mayores que las variaciones intra-individuales. Estas fluctuaciones pueden ser notables, pero el ecosistema microbiano tiende a volver a su patrón típico. La resiliencia es una característica importante de un ecosistema microbiano intestinal sano y consiste en la capacidad de volver al estado previo a la perturbación, por ejemplo, después de un episodio de diarrea aguda o después de un tratamiento con antibióticos14.
Composición bacteriana de la microbiota intestinal a nivel de género y a nivel de fílum o clase, obtenida mediante secuenciación masiva de ADN extraido de muestras fecales de individuos españoles y daneses de la cohorte MetaHIT (datos publicados en la referencia Arumugam et al.11).
Aunque cada individuo alberga una composición distintiva, la estructura global conforma unos patrones que se repiten en distintos individuos y se definieron como enterotipos. El concepto de enterotipo sugiere que el ecosistema microbiano en el intestino humano conforma estados internos de simbiosis entre los distintos miembros de la comunidad microbiana, probablemente determinados por las propias redes metabólicas o sociales en las que se integran. Estas interacciones explican la estabilidad y la resiliencia de un ecosistema sujeto a fluctuaciones. Los individuos del enterotipo 1 se caracterizan por la dominancia de Bacteroides, los del enterotipo 2 por la de Prevotella y los del enterotipo 3 por la de Ruminococcus o Bifidobacterium11. La dieta es uno de los principales condicionantes de los enterotipos (sección 5.1).
Con la llegada de la senescencia se inicia un nuevo periodo de inestabilidad. El envejecimiento se asocia a pérdida de diversidad microbiana y cambios en los niveles de algunos microorganismos15,16. Los cambios se correlacionan con una disfunción inmunitaria que se ha denominado «inflammaging», con incremento del estado inflamatorio y detrimento de la capacidad de generar respuestas inmunitarias adaptativas. Los niveles de microorganismos con capacidad antiinflamatoria, como Faecalibacterium prausnitzii, y otros microorganismos beneficiosos como las bifidobacterias, están disminuidos17. La modulación del microbioma o la administración de algunos de estos microorganismos, podría contribuir a frenar el declive fisiológico relacionado con el envejecimiento. De hecho, la administración de Akkermansia muciniphila es capaz de reducir síntomas degenerativos y prolongar la vida en un modelo de progeria18.
Digestión y metabolismoLa microbiota intestinal ejerce un papel clave en el proceso digestivo y la regulación metabólica del hospedador. Parte de los alimentos no se degradan completamente por enzimas humanos, y los residuos que no se absorben llegan al colon donde hay alta densidad de microorganismos con recursos metabólicos adicionales. El proceso más común es la fermentación de hidratos de carbono complejos, que generan ácidos grasos de cadena corta (AGCC), principalmente ácido acético, propiónico y butírico, que son utilizados por los enterocitos como fuente de energía o pasan al torrente circulatorio alcanzando órganos distales y ejerciendo importantes funciones19. Es también importante la producción de compuestos bioactivos como vitaminas del grupo B o la vitamina K20,21.
La microbiota intestinal transforma compuestos dietéticos inactivos en moléculas bioactivas. Un ejemplo es la trasformación de algunas isoflavonas de la soja en compuestos con actividad estrogénica como el equol22. La microbiota también puede generar compuestos potencialmente tóxicos, como la formación de trimetilamina a partir de colina y carnitina presentes en la dieta23. La trimetilamina, que se absorbe y se transforma en óxido de trimetilamina (TMAO) en el hígado, es factor de riesgo de enfermedad cardiovascular24.
La extracción microbiana de energía a partir de un alimento es variable y depende de la composición microbiana. La microbiota también regula el almacenamiento de lípidos, por lo que su papel en la obesidad y el síndrome metabólico está siendo objeto de investigación25. El trasplante fecal de ratones obesos a ratones normopeso es capaz de transferir el fenotipo, haciendo que los últimos ganen más peso y almacenen más grasa26. Por tanto, la microbiota intestinal ejerce un papel regulador relevante para la homeostasis metabólica del individuo.
Maduración y regulación de la función de barrera y del sistema inmunitarioEl tracto gastrointestinal (TGI) ha desarrollado mecanismos de defensa frente a agentes ambientales adversos a los que está expuesto por vía oral (alérgenos, contaminantes, patógenos, etc.), manteniendo, al mismo tiempo, tolerancia hacia la microbiota comensal residente o las proteínas de la dieta. Los microorganismos intestinales influyen en el desarrollo y en la función del sistema inmunológico, y la rotura de este equilibrio con su anfitrión puede dar lugar a desregulación inmunológica, y contribuir a la aparición de trastornos inflamatorios y autoinmunes crónicos27.
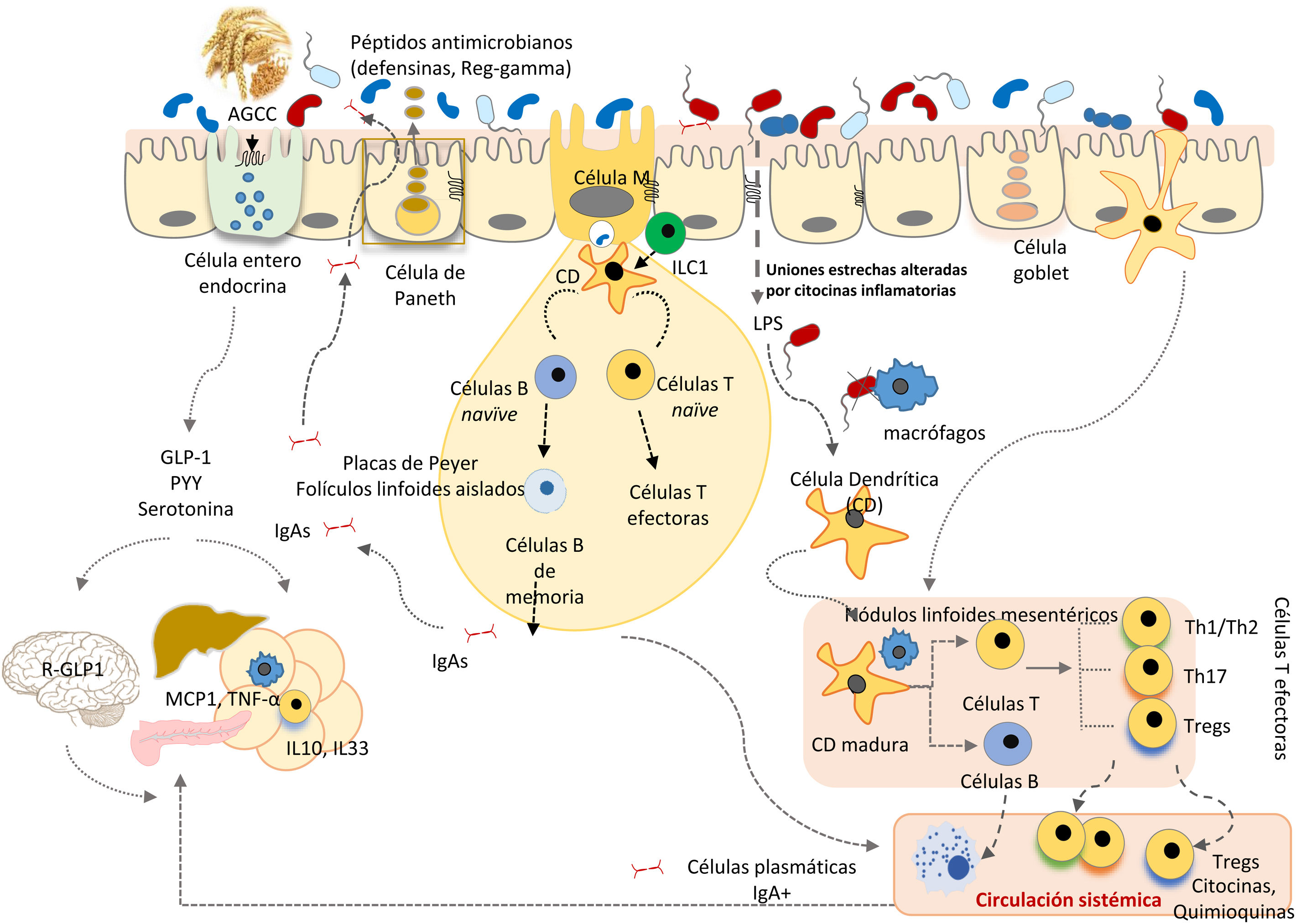
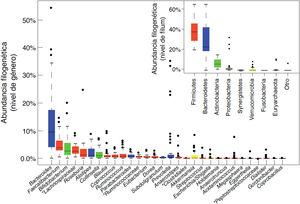
El TGI es una barrera selectiva constituida por células epiteliales, que limitan el contacto directo de microorganismos, residentes o transeúntes, con células inmunes especializadas de la lámina propia, y su propagación sistémica, contribuyendo a la homeostasis inmunológica (fig. 2). Esta barrera incluye enterocitos (90-95%), células enteroendocrinas, células caliciformes (goblet), células M que participan en la captura de antígenos y células Paneth. Las células caliciformes secretan glicoproteínas de mucina, que en el intestino grueso se ensamblan generando 2 capas de moco y, a través de la más externa, se atrapa a un gran número de microbios, evitando su acceso al epitelio y facilitando su eliminación en las heces28. En el intestino delgado se encuentran las células Paneth responsables de la secreción de péptidos antimicrobianos (defensinas, Reg-gamma, etc.), que inhiben el crecimiento de determinadas bacterias e impiden su contacto directo con el epitelio29. A su vez, las bacterias comensales regulan la expresión de los genes que codifican la mucina (MUC-2, MUC-3) y modifican su patrón de glicosilación, así como la producción de péptidos antimicrobianos, contribuyendo a regular la adhesión, colonización e invasión microbiana27,29.
La microbiota comensal también tiene un efecto trófico, influyendo en la proliferación de las células epiteliales y el mantenimiento de las uniones intercelulares estrechas y, de este modo, contribuye a fortalecer la función del epitelio como barrera física frente a la entrada de agentes exógenos30. La producción de inmunoglobulina A secretora (IgAs) constituye otro mecanismo defensivo que limita el acceso de bacterias a la mucosa. Las células dendríticas reconocen y capturan pequeñas cantidades de bacterias e interaccionan con las células B y T de las placas de Peyer, activando la producción de IgA específicas. Estas IgAs son transportadas a través del epitelio y, una vez en la luz, se une a bacterias intestinales contribuyendo al control de patógenos, neutralizando toxinas y favoreciendo su eliminación31.
En la lámina propia, los macrófagos fagocitan y eliminan los microorganismos que hubieran penetrado a través del epitelio intestinal. Las células dendríticas parecen estar más implicadas en la coordinación entre inmunidad innata y adaptativa. Las bacterias u otros antígenos capturados por células dendríticas son llevados a ganglios linfáticos mesentéricos, donde pueden influir en la diferenciación de los linfocitos T en células efectoras o reguladoras, según el tipo de estímulo antigénico y el tono inflamatorio. La homeostasis intestinal se mantiene mediante un sistema de controles y equilibrios entre las células T efectoras inflamatorias, que incluyen las células Th1 (CD4+ y CD8+ que migran al epitelio convirtiéndose en linfocitos intraepiteliales), las células Th17 y las células T reguladoras Foxp3+ antiinflamatorias (Tregs) que participan en el desarrollo de tolerancia. Las bacterias comensales están implicadas en el desarrollo de células Tregs, la ausencia de respuesta por parte de las células T efectoras y la inducción de apoptosis o anergia de las células T, evitando la inflamación crónica y los fenómenos autoinmunes. Además, las células dendríticas activadas interactúan con células B y T de las placas de Peyer, induciendo la producción de inmunoblogulinas, tanto las secretoras como las que ejercen una protección sistémica27.
Las células linfoides innatas (CLI) se localizan en el epitelio intestinal y la lámina propia32, y están involucradas en el mantenimiento de respuestas inmunes apropiadas a los distintos microorganismos, potenciando la inmunidad adaptativa, y regulando la inflamación y la reparación de tejidos en la mucosa intestinal. Las funciones de las CLI también están reguladas por la microbiota comensal.
Las interacciones entre la microbiota y las células del sistema inmune innato se producen a través de receptores de reconocimiento de patrones moleculares microbianos (TLR, NODs, inflamasomas, etc.) o de metabolitos (triptófano, indoles, butirato) producidos por la microbiota (receptor de hidrocarburos de arilo [AhR], receptores acoplados a proteínas G [GPRs]). Estos estímulos activan tanto las funciones de barrera anteriormente descritas, como la síntesis de otros mediadores (citocinas, moléculas co-estimuladoras, etc.) que regulan la respuesta de células inmunes especializadas del tejido linfoide asociado al intestino, coordinando sus acciones para evitar la invasión de patógenos y favorecer el desarrollo de tolerancia a antígenos inocuos. Por ejemplo, la activación del TLR2 por ácidos lipoteicoicos de bacterias Gram-positivas regula uniones estrechas entre enterocitos y contribuye a impedir aumentos de permeabilidad paracelular, que podrían provocar excesiva activación inmunológica e inflamación sistémica. Clostridios de los grupos IV y XIVa inducen expansión de células T reguladoras en la lamina propia y a nivel sistémico, presumiblemente a través de la producción de AGCC, que actúan sobre receptores acoplados a proteínas G modulando la función de las células inmunes33.
Influencia sobre el sistema neuroendocrinoLa microbiota y los metabolitos que se generan en el intestino a partir de la dieta, configuran señales neurales y endocrinas que influyen en órganos y tejidos distantes. De este modo, la microbiota contribuye a funciones tan diversas como la regulación del balance energético (ingesta, gasto energético, metabolismo de la glucosa, etc.), así como otras que dependen del sistema nervioso, incluyendo funciones cognitivas, estado de ánimo y comportamiento (eje microbiota-intestino-cerebro).
La microbiota comensal, a través de la generación de AGCC, ejerce efectos tróficos sobre la mucosa intestinal y activan diversos receptores (GPR41 y GPR43), que estimulan la producción de hormonas enteroendocrinas por parte de las células L, como el péptido similar al glucagón (GLP-1) o el péptido tirosina-tirosina (PYY). Los AGCC y los péptidos enteroendocrinos contribuyen a regular la homeostasis energética, modulando aspectos como el metabolismo de la glucosa, la sensibilidad a la insulina, la termogénesis y el apetito, a través de efectos endocrinos sobre órganos periféricos (hígado y el tejido adiposo blanco y marrón), y mediante vías señalización neural (sistema nervioso entérico y autónomo) que llegan al sistema nervioso central, donde se integran las señales que regulan el balance energético a corto (GLP-1) y largo plazo (insulina, leptina)34. Más recientemente se ha sugerido que otros metabolitos resultantes de la actividad metabólica de la microbiota sobre la dieta, como los indoles, pueden incrementar la sensibilidad de las neuronas aferentes del colon al GLP-1, contribuyendo a los efectos de esta hormona sobre la homeostasis energética34. Además, la microbiota intestinal participa en el metabolismo y en la circulación entero-hepática de las sales biliares, y contribuye a la generación de ácidos biliares secundarios, que interaccionan con el receptor TGR5, induciendo diferenciación y aumento de células L y secreción de GLP-1, lo que también influye beneficiosamente en la tolerancia oral a la glucosa35.
Las células epiteliales también están implicadas en la síntesis de glucocorticoides, que desempeñan una función anti-inflamatoria y endocrina, y tanto su síntesis como la expresión de sus receptores puede verse modificada por la composición de la microbiota intestinal36. Las bacterias comensales participan en la regulación circadiana de los glucocorticoides de forma dependiente del eje hipotalámico-hipofisario-adrenal. La depleción de la microbiota intestinal interrumpe la expresión de los genes implicados en los ritmos de producción de corticosterona en el íleon y esto conlleva importantes alteraciones como la hipersecreción sostenida de corticosterona a nivel sistémico y, a su vez, un estado de hiperglucemia, resistencia a insulina e hipertrigliceridemia37.
La microbiota también interviene de forma directa o indirecta en la síntesis de compuestos neuroactivos, incluidos distintos neurotransmisores (serotonina, dopamina, ácido γ-aminobutírico [GABA], etc.) que influyen en las funciones cerebrales, el comportamiento, el metabolismo y la inmunidad. La influencia de la microbiota en la síntesis de serotonina parece particularmente relevante ya que hasta un 90% de este neurotransmisor, que ejerce funciones claves a nivel central y periférico, se sintetiza en el intestino. A nivel del sistema nervioso central, la serotonina es clave en la regulación del estado de ánimo, el apetito y las funciones cognitivas y a nivel intestinal regula la inflamación y la motilidad38. La microbiota intestinal puede estar implicada tanto en la reducción de los niveles de serotonina (por su capacidad de metabolizar el triptófano que actúa como precursor), como en su producción estimulando la expresión de los genes del hospedador (triptófano 1 hidroxilasa) implicados en su síntesis, posiblemente a través del efecto estimulador de los AGCC39. La desregulación del sistema serotoninérgico también está relacionada con enfermedades inflamatorias crónicas y con la obesidad inducida por la dieta. La modulación microbiana de la biosíntesis de serotonina y de la expresión de sus receptores mitiga la inflamación intestinal y los síntomas depresivos38.
Diversas bacterias intestinales codifican tirosinasas capaces de transformar la tirosina en L-dihidroxifenilalanina (L-DOPA), que a su vez conduciría a la síntesis de catecolaminas, como dopamina, norepinefrina y epinefrina. La dopamina tiene una importante función en el sistema de recompensa, implicado en la regulación del comportamiento alimentario y también en el estado de ánimo. Por otro lado, la microbiota de algunos individuos puede degradar el fármaco L-DOPA reduciendo su biodisponibiliad y la efectividad de su uso en el tratamiento del Parkinson40.
El GABA es producido por diversas bacterias intestinales a través de la descarboxilación del glutamato por acción de la enzima glutamato descarboxilasa, implicada en la tolerancia al pH ácido y el mantenimiento de la homeostasis intracelular bacteriana. El GABA es un importante neurotransmisor con efectos inhibidores en el cerebro, y su disfunción está implicada en enfermedades como el autismo y la esquizofrenia. Estudios pre-clínicos indican que la administración de ciertas bacterias probióticas o prebióticos pueden elevar las concentraciones de GABA o sus receptores en el cerebro, pudiendo contribuir a la mejoría de estos trastornos41.
Eubiosis y disbiosisLas comunidades microbianas que habitan establemente un nicho viven en un estado de equilibrio que se caracteriza por la abundancia de especies que tienen una relación de comensalismo y mutualismo con el hospedador, de modo que tanto el hospedador como sus huéspedes se ven beneficiados por la simbiosis. Esta situación se conoce como «eubiosis». En contraste, el término «disbiosis» define un desequilibrio que implica perturbación del estado de simbiosis y se reconoce por cambios cualitativos y/o cuantitativos en la composición y funciones de la microbiota. No obstante, determinar qué es una microbiota «normal», tanto en composición como en funciones, no es tarea fácil por los múltiples factores que influyen en su configuración, tal y como se ha comentado anteriormente, y por la gran variabilidad inter e intra-individual en condiciones fisiológicas42.
Los estados de disbiosis generalmente se caracterizan por la pérdida o la representación insuficiente de especies beneficiosas que habitualmente son dominantes y a un aumento de la abundancia de especies minoritarias que, a menudo, incluyen patobiontes o patógenos oportunistas. Los cambios pueden ser específicos de cada nicho y de cada enfermedad, y pueden conllevar alteración global de la estructura de la microbiota, o pérdida o adquisición de especies concretas. Por ejemplo, en las enfermedades inflamatorias intestinales suele observarse pérdida de bacterias productoras de butirato (Faecalibacterium, Roseburia, Eubacterium)43 que, en el caso de diarreas asociadas a antibioterapia coincide con sobrecrecimiento de especies oportunistas, por ejemplo, Clostridioides difficile en la colitis seudomembranosa44. En el cáncer colorrectal es frecuente el aumento de abundancia relativa de Fusobacterium en las heces, un género propio de la microbiota bucal45.
Múltiples factores como el uso de antibióticos y otros medicamentos, estrés, factores genéticos, dieta, estilo de vida, etc., se han implicado en el origen de la disbiosis. Si el factor desencadenante es intenso o persistente en el tiempo, el proceso puede conducir a enfermedad, generalmente de tipo crónico o recurrente y de patrón inflamatorio. En los primeros años de vida, la disbiosis de la madre puede conducir a transferencia vertical alterada, y afectar a la adquisición inicial de microbiota intestinal, con posibles consecuencias a corto y largo plazo5.
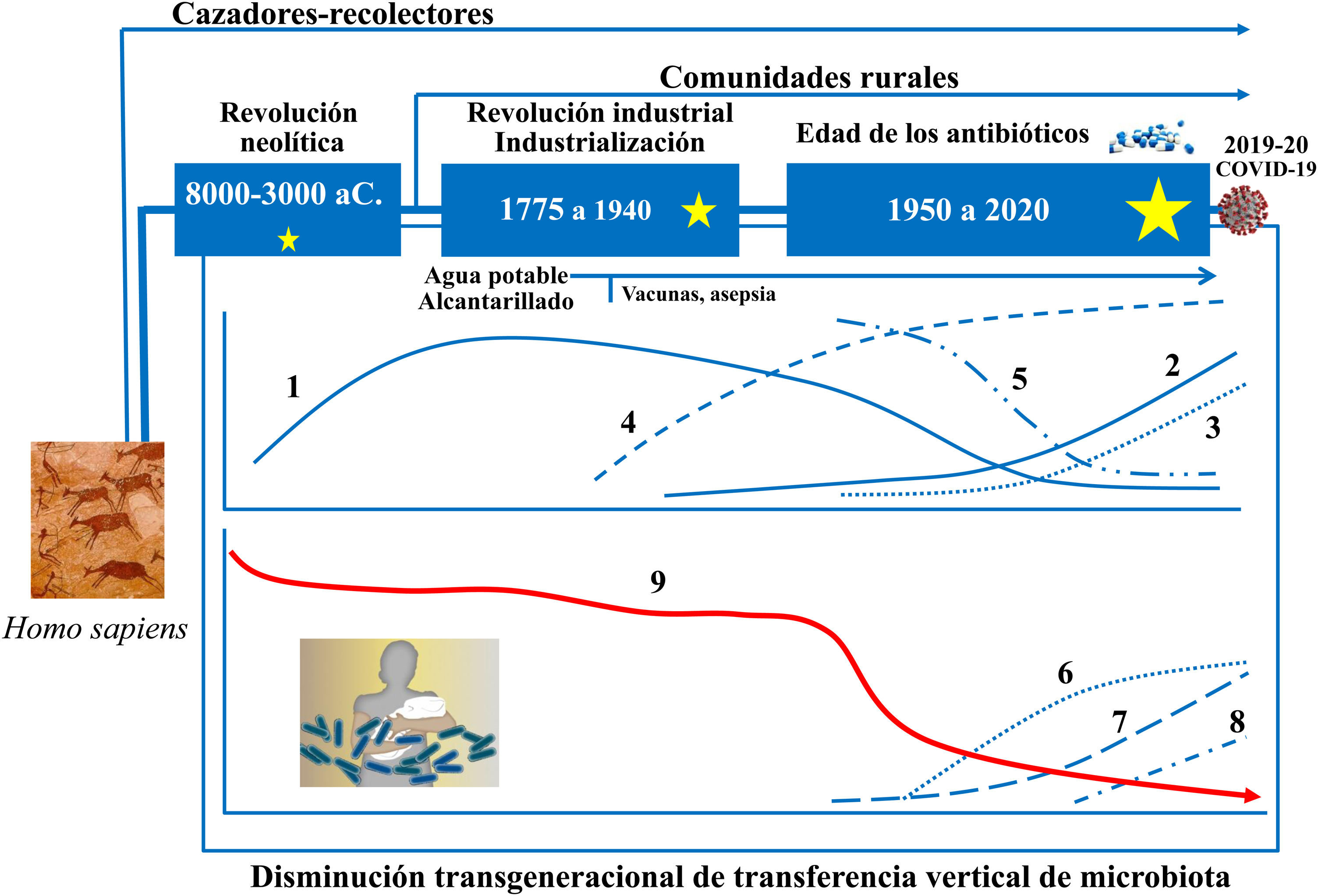
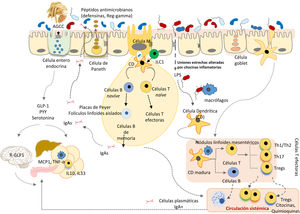
Evolución de la microbiota intestinal humanaLos recientes avances en ecología y genómica microbiana muestran que las grandes perturbaciones de las poblaciones microbianas humanas se corresponden estrechamente con las grandes fases del antropoceno: a) el «paleoantropoceno» que comenzó con el surgimiento de la agricultura y la ganadería en el neolítico; b) la revolución industrial, a finales del siglo XVIII, y c) la «gran aceleración» desde la década de 1950 hasta la actualidad46,47 (fig. 3).
La microbiota asociada ancestralmente al Homo sapiens ha ido cambiando a lo largo del tiempo, así como su transmisión vertical de padres a hijos. El esquema cronológico muestra las sucesivas etapas, los principales factores y las consecuencias potencialmente derivadas de los cambios. 1: Tasa de enfermedades infecciosas: 2: Tasa de enfermedades alérgicas y autoinmunes; 3: Pasteurización y nuevos sistemas de conservación de alimentos; 4: Uso de antibióticos; 5: Actividad física; 6: Uso de fórmulas infantiles; 7: Consumo de alimentos procesados y/o ricos en grasas, azúcar y/o sal; 8: Tasa de cesáreas; 9: Diversidad de la microbiota asociada al cuerpo humano. Las estrellas indican grandes cambios en la composición de la microbiota intestinal, mayores cuando mayor es el tamaño de la estrella (diseño original de Juan Miguel Rodríguez).
El neolítico fue un proceso gradual en el que la humanidad fue transitando de una economía cazadora-recolectora a sistemas planificados de producción de alimentos mediante domesticación de especies vegetales, animales y microbianas. La garantía de un suministro más continuo y estable de alimentos redujo la diversidad de la dieta neolítica y también de la microbiota intestinal. El análisis del microbioma conservado en coprolitos ha confirmado que la dieta afectó drásticamente a la composición del microbioma ya que los microbiomas «neolíticos» son similares a los de las comunidades rurales modernas que conservan dietas ricas en fibra y polisacáridos48–50, pero distintos de los de las tribus cazadoras-recolectoras que han perdurado hasta nuestros días51.
La revolución industrial propició el segundo gran cambio en la colonización microbiana de los seres humanos por el paso de una economía rural a una de carácter urbano, industrializada y mecanizada. El éxodo a la ciudad generó barriadas sin infraestructura sanitaria básica densamente pobladas por personas con poco acceso a alimentos frescos. Tuberculosis, difteria, tos ferina, sarampión, viruela, cólera, fiebres tifoideas y otras muchas enfermedades infecciosas se propagaron fácilmente provocando altas tasas de mortalidad.
Pasteur y Koch demostraron que las infecciones estaban causadas por microrganismos, y Joseph Lister y otros generalizaron el uso de métodos de asepsia y antisepsia en cirugía y medicina. Los avances médicos y farmacológicos (antibióticos), y las medidas de salud pública para proveer suministro de agua potable, prevenir contaminación de alimentos, etc., han logrado el control de las grandes plagas infecciosas que asolaban a nuestros antepasados hace apenas unas décadas. Pero las nuevas medidas sanitarias han provocado el tercer gran cambio, quizá irreversible, en la colonización microbiana del hombre moderno52. Sus consecuencias se relacionan con la incidencia creciente de las nuevas plagas: las enfermedades crónicas no transmisibles52.
Hipótesis de la higieneLa hipótesis fue propuesta por Strachan en 1989 al observar una correlación inversa entre la fiebre del heno y el número de hermanos mayores en una población de 17.000 niños británicos nacidos en 195853. Asumiendo que más niños en una casa significan más «gérmenes» compartidos, Strachan sugirió que las infecciones de la primera infancia protegían contra las enfermedades alérgicas. La palabra «higiene» únicamente aparecía en el título de su artículo, pero fue suficiente para acuñar el nombre de una hipótesis. Posteriormente, Bach54 propuso que era posible extender la hipótesis desde el campo de la alergia al de las enfermedades autoinmunes. Incluso se encontró una explicación científica para respaldar la hipótesis de la higiene: la pérdida o reducción del contacto con agentes infecciosos reduce la actividad Th1 (relacionada con la respuesta a las infecciones bacterianas), lo que resulta en un aumento en la actividad de las células Th2, un sello distintivo de los trastornos alérgicos.
Hipótesis de los viejos amigosLos estudios epidemiológicos comenzaron a romper el presunto vínculo entre las infecciones y un riesgo reducido de alergia: el sarampión y otras infecciones que afectan a la mucosa respiratoria no solo no protegen frente a las enfermedades alérgicas, sino que, en muchos casos, aumentan el riesgo55. Descuidar la higiene personal no tendría un impacto relevante en la incidencia de trastornos inflamatorios y alérgicos crónicos, sino que aumentaría las infecciones. Las evidencias epidemiológicas y experimentales respaldan una hipótesis diferente, la de «los viejos amigos»56. Según esta hipótesis, lo conveniente para el correcto desarrollo del sistema inmunitario no son las infecciones por patógenos en la primera infancia, sino la exposición temprana y regular a una amplia gama de microbios inofensivos o «viejos amigos», presentes a lo largo de la evolución humana y reconocidos por el sistema inmunitario, que lo entrenan para que reaccione adecuadamente ante los distintos estímulos o amenazas. Las mejoras sanitarias introducidas gradualmente a partir del siglo XIX habrían implicado una reducción de nuestra exposición a los microbios que ancestralmente convivían en simbiosis con el ser humano (fig. 3).
Globalmente, los cambios en la microbiota de los individuos de los países industrializados son el resultado de múltiples factores entre los cuales la dieta habitual y el uso excesivo de antibióticos merecen atención especial, ya que ofrecen oportunidades para mejorar el curso de acontecimientos. A pesar del gran éxito de los antibióticos en la lucha contra las infecciones, su uso intensivo ha provocado dos grandes problemas: a) la propagación de bacterias multirresistentes, especialmente a partir de la década de los 80, que actualmente se considera una de las amenazas más graves para la salud pública57, y b) su impacto negativo e indiscriminado sobre el microbioma57,58. Muchos aspectos de la fisiología humana, desde la defensa inmunitaria o el metabolismo hasta el comportamiento, parecen estar alterados en ausencia de una pléyade de genes microbianos. Estudios epidemiológicos y experimentales han mostrado correlación positiva entre la exposición a antibióticos y el desarrollo de prácticamente todas las «plagas modernas», cuyo despegue epidémico se remonta a la década de 1940, es decir, al momento en el que se inició la generalización del uso de los antibióticos58. Conviene recordar que los primeros 2 años de vida son el periodo en que el uso de antibióticos per cápita es mayor59.
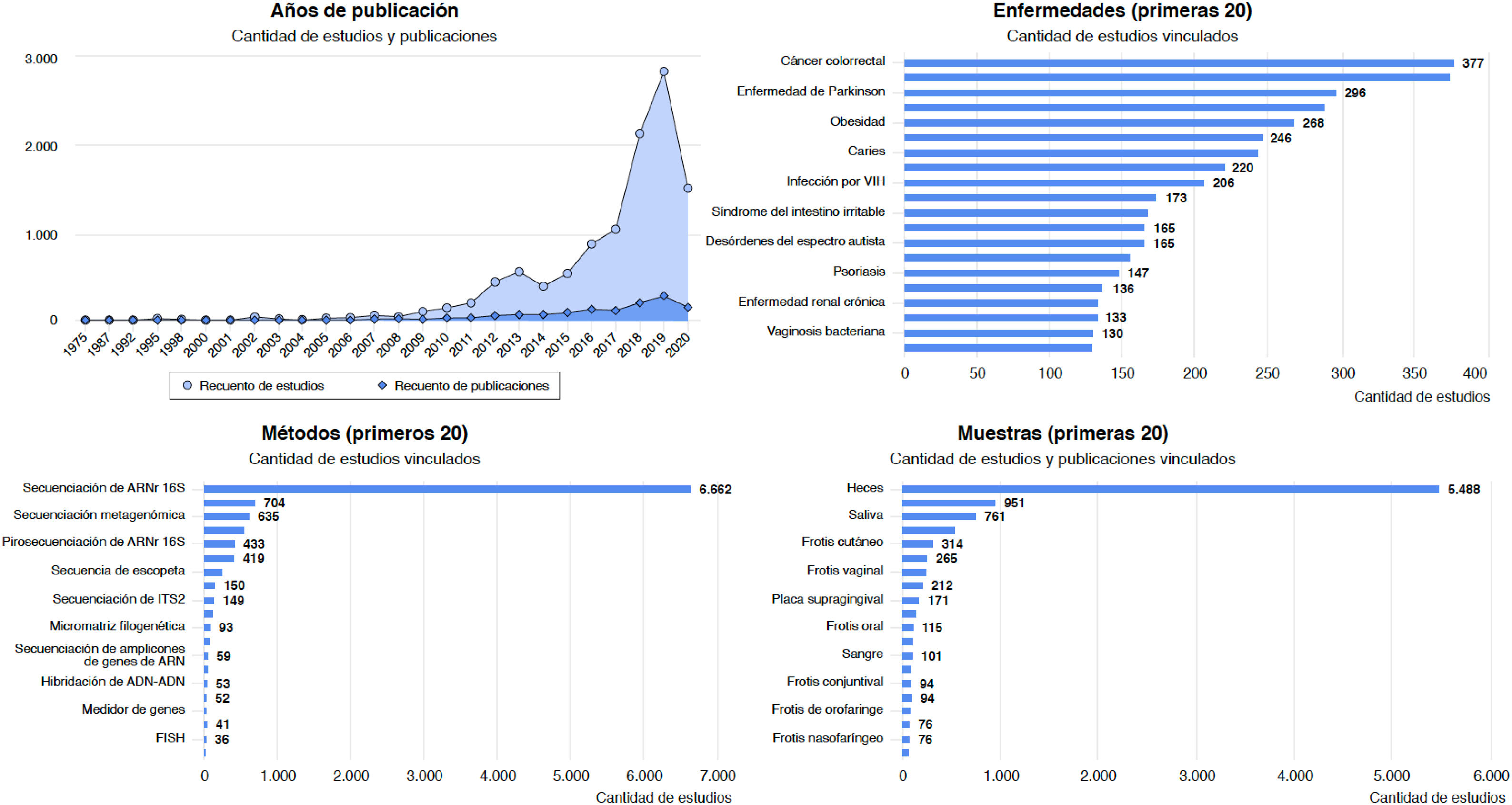
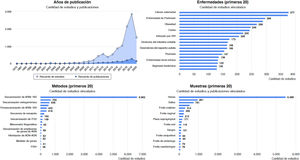
Enfermedades asociadas a disbiosis intestinalLa disbiosis de la microbiota intestinal se ha asociado a una lista amplia de enfermedades inflamatorias, autoinmunes, metabólicas y neoplásicas, y con algunos trastornos de la conducta. La base de datos Disbiome® (https://disbiome.ugent.be)60, recoge estudios sobre la relación microbiota-enfermedad para más de 300 enfermedades diferentes (fig. 4). En la mayoría de ellas, la evidencia científica resulta insuficiente para distinguir si la disbiosis precede a la enfermedad o si la propia enfermedad y su tratamiento conducen a disbiosis42. No obstante, los modelos experimentales de transmisión de microbiota fecal (TMF) sugieren que hay cierta relación de causalidad entre la comunidad microbiana alterada y algunas enfermedades26. Esta sección revisa enfermedades con evidencia de disbiosis intestinal.
Gráficos estadísticos de la web Disbiome® sobre publicaciones y estudios que asocian cambios en la composición de la microbiota con enfermedades humanas (https://disbiome.ugent.be; referencia Janssens et al.60).
A pesar de las mejoras en la terapia intensiva neonatal, el número de niños que padecen enterocolitis necrosante (EN) está aumentando debido a la mayor supervivencia de recién nacidos con muy bajo peso al nacer. La mayoría de las veces la enfermedad se presenta sin previo aviso y sigue siendo devastadora, con altas tasas de mortalidad y complicaciones. En los supervivientes, el síndrome de intestino corto posquirúrgico conlleva importante morbilidad: dependencia de nutrición parenteral, infecciones recurrentes, crecimiento deficiente, insuficiencia hepática, hospitalizaciones prolongadas y trastornos a largo plazo del desarrollo neurológico.
La prematuridad es el principal factor de riesgo. La deficiente implantación de la microbiota intestinal desempeña un papel clave en su patogénesis61. La estructura de la comunidad microbiana en heces de recién nacidos de muy bajo peso al nacer difiere significativamente entre aquellos que eventualmente desarrollarán EN y los que no, especialmente entre los nacidos con menos de 27 semanas de gestación62. Las diferencias son evidentes un mes después del nacimiento y preceden a la aparición de la enfermedad. El aumento de gamma-proteobacterias (enterobacterias) causantes de inflamación y la disminución de anaerobios productores de AGCC parecen ser la firma microbiana que precede a la EN.
Las causas aún no se conocen, y se investigan las cepas de gamma-proteobacterias de los bebés que desarrollan enfermedad. La abundancia de Bifidobacterium y Lactobacillus parece ser clave para la protección del intestino del recién nacido. La EN puede ser consecuencia de la respuesta inflamatoria secundaria al exceso de enterobacterias. La modulación de la microbiota intestinal del bebé prematuro a través de la alimentación con leche materna y suplementos dietéticos disminuye el riesgo de EN. Son necesarios más estudios para identificar la composición microbiana ideal y la combinación más efectiva de suplementos63.
Sepsis neonatalLa microbiota intestinal neonatal sufre cambios dinámicos en respuesta a muchas variables nutricionales y ambientales. La infección neonatal es causa común de mortalidad infantil en todo el mundo, particularmente en bebés muy prematuros. La sepsis se define como una disfunción orgánica potencialmente mortal causada por una respuesta desregulada del hospedador a la infección microbiana. Los prematuros a menudo experimentan disbiosis neonatal, generalmente caracterizada por el crecimiento excesivo de una sola especie de las familias anaerobias facultativas (Enterococcaceae, Staphylococcaceae o Enterobacteriaceae). La enfermedad aparece como consecuencia de diseminación sistémica de microorganismos intestinales.
El uso prolongado de antibióticos de amplio espectro en recién nacidos prematuros se ha asociado con un mayor riesgo de sepsis. Un estudio experimental64 revisó mecanismos para prevenir la expansión de patobiontes, comensales que pueden diseminarse sistémicamente, como la Klebsiella pneumoniae. En el modelo murino, la exposición materna a distintos antibióticos erradicando o enriqueciendo la población de Lactobacillus murinus exacerba o previene la sepsis, respectivamente, y la administración profiláctica de algunos lactobacilos, pero no todos, evita la sepsis. También fue eficaz la administración de E. coli, por competencia nutricional con Klebsiella. El nivel de oxígeno intestinal parece ser determinante en la dinámica de colonización, favoreciendo disbiosis y sepsis. Las vías que restringen el oxígeno luminal en adultos no están operativas en los recién nacidos.
Desnutrición proteicaLa desnutrición afecta a más de mil millones de personas en el mundo y es una causa importante de mortalidad. En muchos casos, la desnutrición se asocia con diarrea e inflamación intestinal (colitis), lo que contribuye a aumentar la morbilidad y la mortalidad. En los últimos años se ha evidenciado que la microbiota intestinal puede jugar un papel modulador en este proceso. De hecho, la desnutrición y la deficiencia de triptófano parecen tener una influencia causal sobre el desarrollo de diarrea y colitis. El triptófano en la dieta se absorbe principalmente a través de la vía de transporte B0AT1/ACE2 en la superficie luminal de las células epiteliales del intestino delgado. Esto da como resultado la activación de mTOR (un factor que regula la expresión de péptidos antimicrobianos) ya sea directamente a través de la detección de nutrientes o a través de la vía triptófano-nicotinamida, lo que afecta notablemente la composición de la microbiota65. En condiciones de lesión intestinal, un microbioma alterado contribuye a la gravedad de la colitis.
Enfermedades atópicasEl asma y la atopia, asociadas clásicamente con hiperactivación de inmunidad adaptativa T helper 2 (Th2), son enfermedades crónicas frecuentes. El asma afecta a más de 235 millones de personas en todo el mundo66. La evidencia reciente relaciona la atopia y el asma con la composición y función del microbioma. Hay menos diversidad de microbiota intestinal en los bebés de 6 meses que luego desarrollan sensibilización alimentaria al año67 y sibilancias a los 5 años68. La abundancia de clostridios y otros géneros del filo Firmicutes durante la primera infancia se asocia con mayor probabilidad de que remita la alergia a la proteína de la leche antes de los 8 años67. El desarrollo de alergias, particularmente alergias respiratorias, se asocia con mayor abundancia fecal de Ruminococcus gnavus, que tiende a ser baja en sujetos no alérgicos. Se observa aumento de R. gnavus antes del comienzo de alergias respiratorias que coexisten con eccema atópico69. Los AGCC, y particularmente el butirato, pueden promover tolerancia. El microbioma de bebés que desarrollan sensibilización alérgica en la infancia carece de genes que codifican enzimas clave para el metabolismo de hidratos de carbono y la producción de butirato70.
Enfermedad metabólica prevalente y deterioro cognitivoLos sujetos con obesidad y/o diabetes mellitus tipo 2 (DM2) desarrollan deterioro cognitivo71,72. Un metaanálisis destacó que la obesidad produce un aumento significativo en el riesgo de déficit cognitivo en adultos73. Las tasas de deterioro cognitivo en pacientes con DM2 se incrementan en entre 1,5 y 2 veces en comparación con los pacientes sin DM2. Tanto el aumento de la adiposidad como la disfunción metabólica (tolerancia alterada a la glucosa y resistencia a la insulina) asociadas a obesidad podrían afectar la cognición de modo independiente74.
Las personas con obesidad, con DM2 o aquellos con déficit cognitivos establecidos comparten mecanismos patogénicos similares: inflamación sistémica de bajo grado, resistencia a la insulina, aumento de las reservas corporales de hierro, estrés oxidativo, disfunción mitocondrial, cambios vasculares (aumento de la presión arterial) y apnea del sueño, que pueden afectar la cognición75. Hay evidencia de que la inflamación crónica de bajo grado daña directamente las neuronas (disminución de la neurogénesis) independientemente de sus efectos sobre el metabolismo76, lo que resulta en un peor rendimiento en las pruebas de memoria y función ejecutiva, reducción de la materia gris y el volumen de la materia blanca, todo directamente relacionado con la adiposidad corporal77. De hecho, algunos metaanálisis encontraron que los adultos con DM2 tienen cambios negativos claros en la función motora, la función ejecutiva, la velocidad de procesamiento, la memoria verbal y la memoria visual78. La memoria, la función ejecutiva y las estructuras del lóbulo temporal medial también parecen particularmente afectadas en pacientes con obesidad74. La acumulación de hierro en el envejecimiento normal del cerebro es un hallazgo común asociado con el deterioro cognitivo79,80, un proceso que se amplifica en la obesidad, especialmente en el lóbulo temporal medial y el hipocampo80,81.
La composición alterada de la microbiota intestinal podría desempeñar un papel importante como desencadenante de inflamación metabólica, resistencia a la insulina, DM2 y cognición alterada82,83. En modelos de ratón axénico (germ-free), la ausencia de microbios intestinales confiere protección contra el desarrollo de obesidad y los déficits cognitivos en aprendizaje y memoria, lo que respalda el papel de la microbiota sobre funciones cerebrales superiores83–85. Un estudio ha evidenciado que las alteraciones de memoria reciente de sujetos con obesidad se relacionan con el metabolismo de aminoácidos aromáticos por parte de la microbiota intestinal86.
Diabetes mellitusLa dieta es un factor principal que perfila la microbiota intestinal, reconociéndose de forma creciente cómo distintos metabolitos microbianos derivados de la dieta se asocian a insulino-secreción, insulino-sensibilidad e incidencia de diabetes tipo 287. A modo de ejemplo, el butirato es producido por bacterias específicas fermentadoras de fibra dietética. La pérdida relativa de estas bacterias se ha objetivado de forma consistente tanto en prediabetes como en diabetes tipo 2 en diferentes cohortes y diferentes etnias88. De hecho, la respuesta glucémica a una comida está determinada tanto por la fisiología del hospedador como por la composición de la microbiota intestinal89.
Enfermedad inflamatoria intestinalLa colitis ulcerosa y la enfermedad de Crohn se caracterizan por respuestas inmuno-inflamatorias exageradas contra microrganismos no patógenos de la microbiota intestinal, generándose lesiones ulcerosas que evolucionan a cronicidad. Numerosos estudios han encontrado defectos marcados en la composición de la microbiota fecal y la asociada a la mucosa90,91. Los pacientes presentan pérdida de riqueza y diversidad microbiana en comparación con los controles sanos, con reducción de productores de butirato (Faecalibacterium, Roseburia, Coprococcus, Lachnospira, etc.) y de Akkermansia muciniphila, que es colonizadora habitual del moco intestinal, y con sobrecrecimiento de proteobacterias, fusobacterias y estreptococos. La pérdida de diversidad se manifiesta especialmente durante y después de los brotes de actividad91. La rotura del equilibrio simbiótico debida al desajuste en el control inmuno-inflamatorio de la población microbiana intestinal conduce a la selección de especies resistentes al oxígeno con potencial inflamatorio.
Los pacientes con colitis ulcerosa o enfermedad de Crohn no recuperan un ecosistema microbiano equilibrado durante los periodos de remisión, y se ha demostrado variabilidad en la composición microbiana por inestabilidad del ecosistema. Cuanto mayor es la inestabilidad microbiana, mayor es el riesgo de nuevo brote92.
Trastornos funcionales digestivosEl síndrome de intestino irritable es el trastorno funcional más frecuente, y se caracteriza por la presencia de dolor abdominal recurrente asociado a alteraciones del ritmo deposicional, ya sea en forma de estreñimiento o de diarrea. Los pacientes presentan cambios cuantitativos en especies bacterianas intestinales en comparación con la población sana. Los productores de butirato, como F. prausnitzii, y la diversidad microbiana están reducidos en pacientes con predominio de diarrea, mientras que los metanógenos están aumentados en pacientes con estreñimiento93.
En sujetos con trastornos funcionales por exceso de gas, los síntomas inducidos por la comida, como hinchazón, distensión y dolor, se relacionaron con inestabilidad microbiana. La dieta rica en vegetales fermentables induce síntomas en los pacientes y la composición de la microbiota intestinal muestra cambios bruscos en los principales filos y géneros en paralelo a la aparición de síntomas. Los sujetos sanos no manifiestan síntomas y su microbiota intestinal se mantiene estable94. Estos datos sugieren que la competencia funcional de la microbiota intestinal confiere estabilidad y previene la aparición de síntomas abdominales posprandiales.
Inmunosenescencia y fragilidadEl término «inmunosenescencia» se aplica a los cambios en el sistema inmunitario relacionados con edad avanzada. Básicamente consisten en exacerbación progresiva del tono inflamatorio y reducción de la capacidad para generar respuestas adaptativas frente a nuevos antígenos. Se ha observado que el aumento de marcadores inflamatorios séricos (TNF-α, IL-6, IL-8, PCR) y el deterioro de índices de fragilidad-comorbilidad se correlacionan con disminución progresiva de la riqueza y diversidad de la microbiota intestinal durante el proceso de envejecimiento15. La disminución de la diversidad microbiana intestinal se caracteriza por reducción de especies productoras de butirato y aumento relativo de proteobacterias con potencial inflamatorio. La ingesta insuficiente de frutas y verduras podría explicar los cambios15, ya que un estudio de intervención con dieta mediterránea consiguió mejorar la microbiota intestinal, revertir los cambios inflamatorios y reducir los índices de fragilidad95.
Enfermedad injerto contra receptorEl trasplante de progenitores hematopoyéticos es un tratamiento de elección en diversas enfernedades, sobre todo en hemopatías malignas y no malignas. Su eficacia viene limitada por complicaciones graves, potencialmente mortales, como la incidencia de infecciones intratables durante la depresión inmunitaria y la enfermedad injerto contra receptor, también llamada del injerto contra el huésped. El papel de la microbiota intestinal en el contexto de «reinicio» del sistema inmunitario que supone el trasplante de progenitores hematopoyéticos, y su posible impacto sobre la presentación de complicaciones está siendo objeto de estudio.
La baja diversidad de microbiota fecal se ha asociado con aumento significativo de mortalidad (52%) en comparación con alta diversidad (8%), y la abundancia de enterobacteriaceas (Escherichia, Proteus, Klebsiella, etc.) se correlaciona con mayor incidencia de bacteriemia y menor supervivencia global96. La baja diversidad bacteriana en heces también es predictiva de evolución fatal de la enfermedad injerto contra receptor96. Los antibióticos reducen considerablemente la diversidad de la microbiota intestinal, y los receptores de trasplante suelen estar sometidos a tratamientos antibióticos múltiples. Se ha observado que el uso de antibióticos frente a anaerobios o la colonización por bacterias multi-resistentes, que sugiere exposición frecuente o prolongada a antibióticos, se asocia a mayor incidencia de enfermedad injerto contra receptor96.
Estas observaciones abren la posibilidad de intervenir sobre la microbiota intestinal del receptor de trasplante con el objetivo de evitar o mitigar las complicaciones y mejorar su supervivencia. Una serie no controlada en pacientes portadores de bacterias multi-resistentes ha demostrado que la TMF, antes o después del trasplante de células progenitoras hematopoyéticas, es una estrategia eficaz y segura para descolonización de bacterias multiresistentes97. Obviamente, se necesitan más estudios para confirmar la eficacia de la TMF en la prevención de complicaciones en los receptores de trasplante, pero se trata sin duda de una estrategia terapéutica prometedora.
Modulación e intervención funcionalModular la microbiota intestinal para mejorar la salud humana es hoy objetivo de investigación intensiva y extensiva que ensaya estrategias tales como intervención dietética con distintos nutrientes, incluyendo prebióticos, probióticos, simbióticos y otras estrategias afines (posbióticos, paraprobióticos), o la TMF. Muy probablemente, el conocimiento de la composición individual de la microbiota intestinal facilitará protocolos futuros de nutrición personalizada para optimizar la salud. En la actualidad, los objetivos principales consisten en incrementar la diversidad microbiana y reforzar la capacidad funcional de generar AGCC, especialmente butirato.
DietaLos nutrientes no solo son esenciales para la salud humana sino también para la salud de la microbiota intestinal. Las funciones metabólicas de la microbiota intestinal están ligadas a la digestión de polisacáridos complejos, producción de AGCC, metabolismo de los ácidos biliares, producción de vitaminas, etc., con los consiguientes efectos tróficos sobre la barrera intestinal y el sistema inmunitario. Así, la alimentación resulta ser un elemento fundamental en la simbiosis entre microbiota y hospedador condicionando y modulando el establecimiento de la microbiota intestinal en el niño, y su estructura y funcionalidad en el adulto. Además de la alimentación (componentes alimentarios, nutrientes, patrones alimentarios etc.), otros factores relevantes son los fármacos, condiciones de higiene, ritmo circadiano, ayuno intermitente, cambios estacionales, industrialización, etc.98.
Los enterotipos parecen estar influenciados por el patrón alimentario habitual99. El enterotipo Bacteroides es el más frecuente en países industrializados y se asocia con hábitos dietéticos propios de la vida urbana. El enterotipo Prevotella es más frecuente en áreas de cultura agraria, con dietas ricas en fibra y bajas en proteína y grasa animal48,100. Otros estudios101,102 han detectado modificaciones de la microbiota según el periodo estacional, observándose cambios en relación al consumo de verduras y frutas frescas en verano, frente a alimentos congelados o enlatados durante el invierno. Las diferencias dietéticas entre distintas poblaciones podrían explicar la variabilidad taxonómica del ecosistema microbiano intestinal.
Las intervenciones dietéticas a corto plazo pueden inducir cambios rápidos en la composición de la microbiota asociados a variaciones drásticas en la cantidad de fibra dietética. La magnitud de los efectos es relativamente modesta en comparación con la variabilidad interindividual en la taxonomía microbiana y los cambios no son consistentes entre los distintos individuos, es decir que cada uno cambia, pero de modo distinto103. Se ha observado que el incremento de proteína y grasa animal junto con la ausencia de fibra dietética aumenta la abundancia de microorganismos tolerantes a las sales biliares (Alistipes, Bilophila) y disminuye los niveles de Firmicutes que metabolizan los polisacáridos complejos de los vegetales (Roseburia, Eubacterium y Ruminococcus). Por el contrario, el consumo abundante de fibra dietética, frutas, verduras y otros vegetales se asocia con incrementos importantes y significativos en las especies fermentativas. En estudios controlados, se ha visto que el consumo de almidón resistente o de otros polisacáridos no digeribles incrementa la abundancia de especies fermentativas como Ruminococcus bromii y Eubacterium rectale104.
En modelos experimentales, un consumo elevado de grasas puede traducirse en desequilibrio del ecosistema intestinal que contribuye al desarrollo de procesos inflamatorios. El mecanismo parece mediado por incremento de absorción de lipopolisacáridos, endotoxemia subclínica y activación de TLR4. Este mismo mecanismo parece contribuir al desarrollo de enfermedades cardiovasculares y metabólicas105. Además, la microbiota puede contribuir a la regulación del metabolismo de los lípidos y la glucosa a través de la interacción de los ácidos biliares en el íleon terminal y la modulación del receptor de ácido biliar acoplado a la proteína G1 (TGR5). Estas evidencias abren una línea de investigación sobre la participación de la microbiota en la eficacia y seguridad individual de algunos de los tratamientos ensayados con ácidos biliares en la obesidad106.
Las proteínas también modulan la composición de la microbiota y la producción de metabolitos. El catabolismo microbiano de los aminoácidos genera indoles, fenoles, amoniaco y aminas, que pueden combinarse con óxido nítrico para formar compuestos nitrosos genotóxicos relacionados con carcinogénesis colorectal107. Por otro lado, el ácido indolpropiónico y el indol-3-acetato resultantes de metabolismo microbiano del triptófano mantienen la homeostasis intestinal, protegen de la colitis experimental y/o reducen la inflamación hepatocitaria106. La contribución microbiana a la generación de TMAO (un factor de riesgo cardiovascular23,24) a partir de carnitina y fosfatidilcolina ya se ha comentado anteriormente.
El impacto de los aditivos alimentarios en la microbiota y la homeostasis intestinal es un área poco estudiada, aunque se sabe que algunos emulsionantes dietéticos, como el polisorbato-80 o la carboximetilcelulosa, condicionan alteraciones metabólicas en ratones obesos. Igualmente, los edulcorantes no calóricos pueden inducir intolerancia hidrocarbonada a través de sus interacciones con la microbiota, tanto en animales de experimentación como en humanos106.
Las dietas vegetarianas o veganas son ricas en hidratos de carbono complejos, de modo que sería esperable su impacto beneficioso en la microbiota intestinal. Algunos estudios transversales y de intervención han evidenciado que se producen cambios a nivel de diferentes taxones, pero no tanto a nivel de riqueza y diversidad. Estos cambios mínimos pueden ser suficientes para justificar los beneficios en producción de AGCC que está aumentada en la población vegetariana. Es también probable que los beneficios de las dietas vegetarianas deriven de la presencia de productos fito-químicos, como las isoflavonas que se mencionaron anteriormente y otros106.
La dieta mediterránea ha demostrado vastos beneficios en la salud poblacional, reduciendo el riesgo de mortalidad y de muchas enfermedades crónicas108,109. Los estudios sugieren que en la intervención alimentaria se debe priorizar la inclusión de cantidad y variedad de alimentos vegetales más que la exclusión de alimentos de origen animal, apoyando el concepto de que la diversidad de la dieta favorece la estabilidad de la microbiota.
PrebióticosSi bien a mediados del siglo XX se reconoció la existencia de un factor bifidogénico presente en la leche materna como responsable del incremento de bifidobacterias en niños, el término prebiótico aparece publicado por primera vez en 1995110. Gibson y Roberfroid definieron el concepto como «ingrediente alimentario no digerible que beneficia al hospedador mediante la estimulación selectiva del crecimiento y/o actividad de un limitado número de bacterias en el colon, mejorando la salud del hospedador». Atendiendo a esta definición, solamente cumplen criterios algunos hidratos de carbono como los galacto-oligosacáridos (GOS), lactulosa, inulina y fructo-oligosacáridos (FOS). Otros compuestos que tienen posibilidades de cumplir estos criterios son isomalto-oligosacáridos (IMO), xilo-oligosacáridos (XOS), transgalacto-oligosacáridos (TOS) y oligosacáridos de la soja (SBOS). Están presentes en leche, hortalizas, frutas, verduras, cereales, legumbres y frutos secos99.
En 2017, la ISAPP revisó el concepto y propuso que un prebiótico «unsustrato que es selectivamente utilizado por microorganismos del hospedador y confiere beneficios para la salud»111. El nuevo concepto sería aplicable a diferentes sustancias, incluyendo hidratos de carbono, polifenoles, ácidos grasos poliinsaturados, etc.
El consenso mantiene el requisito del carácter selectivo de estos compuestos sobre la microbiota, y que los beneficios en salud se demuestren mediante ensayos clínicos bien diseñados. Los avances científicos y clínicos, asociados al desarrollo de técnicas moleculares, están evidenciando que la utilización selectiva de prebióticos no es exclusiva de lactobacilos y bifidobacterias, extendiéndose a géneros tales como Eubacterium y Roseburia. Aunque la mayoría de los prebióticos se administra por vía oral, el panel admite que también pueden administrarse en otras zonas del cuerpo colonizadas por microorganismos como la piel o el tracto vaginal.
Mención aparte merecen los oligosacáridos de la leche materna (HMO, por sus siglas en inglés), una mezcla de extraordinaria complejidad con más de 1.000 estructuras químicas descritas que actúan más allá de meros sustratos para la microbiota intestinal e influyen en numerosas funciones beneficiosas para la salud local y sistémica del lactante5.
Su potencial uso terapéutico en obesidad, resistencia a la insulina, esteatosis hepática, ansiedad o depresión es objeto de investigación. La evidencia generada en distintas enfermedades avala la posibilidad de que los prebióticos tengan un papel promotor de salud en población sana, que puede detectarse mediante amplios estudios observacionales111. Prebióticos emergentes en fase de estudio son el almidón resistente y los prebióticos no hidratos de carbono.
ProbióticosLos alimentos fermentados por microorganismos como pan, cerveza, vino, kéfir, yogur, kumis o queso, están en la dieta humana desde el neolítico, y no solo con fines nutricionales sino también terapéuticos. Una comisión de expertos convocados en 2001 de forma conjunta por la FAO y la OMS definió a los probióticos como «microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del hospedador»112. Esta definición ha sido ampliamente aceptada por la comunidad científica mundial y ha sido recogida en los consensos de la Sociedad Española de Microbiota, Probióticos y Prebióticos (SEMIPyP)113 y de ISAPP114. En ocasiones, se emplea el término «probióticos de nueva generación» para hacer referencia a aquellas especies beneficiosas que forman parte de la microbiota intestinal humana (Faecalibacterium prausnitzii o Roseburia intestinalis). Además, se han propuesto otros términos para denominar probióticos con indicaciones en áreas específicas, como «psicobióticos» u «oncobióticos». La definición de probióticos excluye los microorganismos muertos y los componentes o sustancias producidas por los microorganismos, aunque demuestren efectos biológicos saludables. Se les denomina «paraprobióticos» o «postbióticos», respectivamente.
En los consensos de la SEMIPyP e ISAPP se enfatiza que los probióticos deben estar perfectamente caracterizados a nivel de cepa, y su viabilidad debe mantenerse durante toda la vida útil de los productos en los que se suministraran. Se deben implementar estrictos sistemas de calidad que garanticen su taxonomía y la presencia de cantidades suficientes de microorganismos viables.
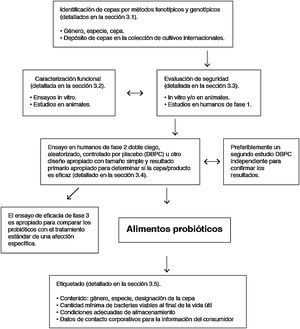
Los microorganismos comercializados como probióticos incluyen levaduras (Saccharomyces, Kluyveromyces) y bacterias de diferentes géneros (Lactobacillus, Streptococcus, Enterococcus, Pediococcus, Bifidobacterium, Propionibacterium, Bacillus, Escherichia). La perfecta caracterización taxonómica del microorganismo es imprescindible para evaluar su seguridad. Además, el concepto de probiótico se aplica solamente a las cepas que han sido evaluadas según las directrices de la FAO/OMS (fig. 5)112. Todo probiótico debe identificarse por su género, especie, subespecie (si corresponde) y una designación alfanumérica propia de la cepa. El beneficio para la salud debe demostrarse mediante ensayos clínicos aleatorizados y controlados. Además, el beneficio demostrado para una condición de salud concreta (p. ej., diarrea aguda) no es extrapolable a otras indicaciones (p. ej., alergia).
Directrices de la FAO/OMS para la evaluación de un microorganismo como probiótico (referencia Roberfroid et al.110).
Numerosos ensayos clínicos han evaluado la eficacia y seguridad de distintos probióticos para diferentes indicaciones que incluyen prevención o tratamiento de diarrea aguda, diarrea asociada a antibióticos, síntomas funcionales digestivos leves o moderados, maldigestión de lactosa, cólico del lactante, etc. La Organización Mundial de Gastroenterología (WGO) publica un documento de libre acceso con información sobre cepas, posología y nivel de evidencia para diversas aplicaciones en el ámbito gastrointestinal115. El potencial uso terapéutico de los probióticos en otras enfermedades (por ejemplo, obesidad, resistencia a la insulina, esteatosis hepática, ansiedad o depresión) es objeto de estudio y se debe acoger con prudencia. Los probióticos podrían tener un papel promotor de salud en población sana114,116.
SimbióticosUn simbiótico es un producto que combina al menos un probiótico y un prebiótico. Un producto solo puede ser denominado simbiótico si está perfectamente caracterizado y ha demostrado inducir un efecto beneficioso superior al de la suma de los generados separadamente, por sus integrantes117. Un ejemplo bastante popular de este tipo de productos es la combinación de microorganismos del género Bifidobacterium o Lactobacillus con fructo-oligosacáridos116.
Transmisión de microbiota fecalLa transmisión de microbiota fecal (TMF) es un método definido para cambiar la microbiota intestinal de un paciente con el fin de normalizar su composición y obtener un beneficio terapéutico. Consiste en la infusión de una suspensión de heces procedentes de un individuo sano en el tubo digestivo del paciente receptor. Se trata de una técnica ya utilizada en China en el siglo IV que a lo largo de la historia ha tenido escaso predicamento hasta que en 2013 demostró su extraordinaria eficacia para el tratamiento de la diarrea refractaria y recurrente por sobrecrecimiento de Clostridioides difficile, con tasas de resolución superiores al 90%118.
La selección del donante debe ser rigurosa para evitar efectos adversos, como la transferencia inadvertida de bacterias multirresistentes. La experiencia actual considera que el procedimiento está libre de efectos secundarios importantes cuando se realiza de acuerdo a protocolos consensuados, como el protocolo europeo119 y el de la Societat Catalana de Digestologia y la Societat Catalana de Malalties Infeccioses i Microbiologia Clínica, que está más actualizado120. En lo últimos años se está investigando su aplicabilidad en otras enfermedades como las enfermedades inflamatorias intestinales, el síndrome metabólico o el trasplante de progenitores hematopoyéticos121. Fuera de la mencionada indicación para resolver la diarrea recurrente por Clostridioides difficile, está técnica solo se utiliza en protocolos de investigación aprobados por un comité ético. Es imprescindible optimizar procedimientos (especialmente en el contexto actual de la pandemia por coronavirus), definir mejor las carencias y seleccionar los microorganismos activos que permitan aplicar enfoques personalizados para tratar enfermedades específicas.
FinanciaciónLa preparación del artículo ha sido financiada por el Instituto Danone (Barcelona).
Conflicto de interesesJA, FG y MSP forman parte del consejo científico del Instituto Danone.