La enfermedad inflamatoria intestinal (EII) se relaciona con un amplio espectro de manifestaciones extra-intestinales. Entre ellas, las afecciones dermatológicas —como el eritema nudoso (EN), las aftas orales o el pioderma gangrenoso (PG)— son las segundas en frecuencia.
El PG es una dermatosis neutrofílica que ocurre en aproximadamente un 1% de los pacientes con EII, siendo más frecuente en mujeres que en varones1. Recientes estudios apuntan a una mayor incidencia del PG en pacientes con colitis ulcerosa (CU) que con enfermedad de Crohn (EC), y en prácticamente la totalidad de los casos publicados existe o ha existido afectación cólica1,2. El PG puede ocurrir antes, después o de manera simultánea al diagnóstico de la EII, y parece no estar relacionado con su curso y gravedad2. Se caracteriza por la aparición de una o varias pústulas en la piel que rápidamente evolucionan a una úlcera muy dolorosa, a veces de gran tamaño, de fondo exudativo, con un borde de crecimiento violáceo perilesional sobreelevado. El estudio anatomopatológico no es específico, pero permite excluir otras causas potenciales de ulceración, como las infecciones o la isquemia crónica. Su tratamiento incluye medidas locales, como el desbridamiento del tejido necrótico y los antibióticos tópicos y, en la mayoría de los casos, es necesario el tratamiento sistémico con corticoides (prednisona 1-1,5mg/kg/día o equivalente). En los casos refractarios —hasta un 50% en algunas series— se emplean inmunosupresores como los inhibidores de la calcineurina o los anti-TNF alfa3,4.
Presentamos el caso de un varón de 48 años que en 2007 comenzó con un brote grave de CU, extensa, refractario a corticoides e infliximab, que requirió cirugía (proctocolectomía con reservorio íleo-anal). Su evolución posterior fue favorable, con aislados episodios de reservoritis, leves y de fácil control. En 2013 presentó una uveítis anterior, y en este último año había sido derivado a reumatología por presentar artritis periféricas. Ambas afecciones aparecieron con el paciente sin sintomatología intestinal.
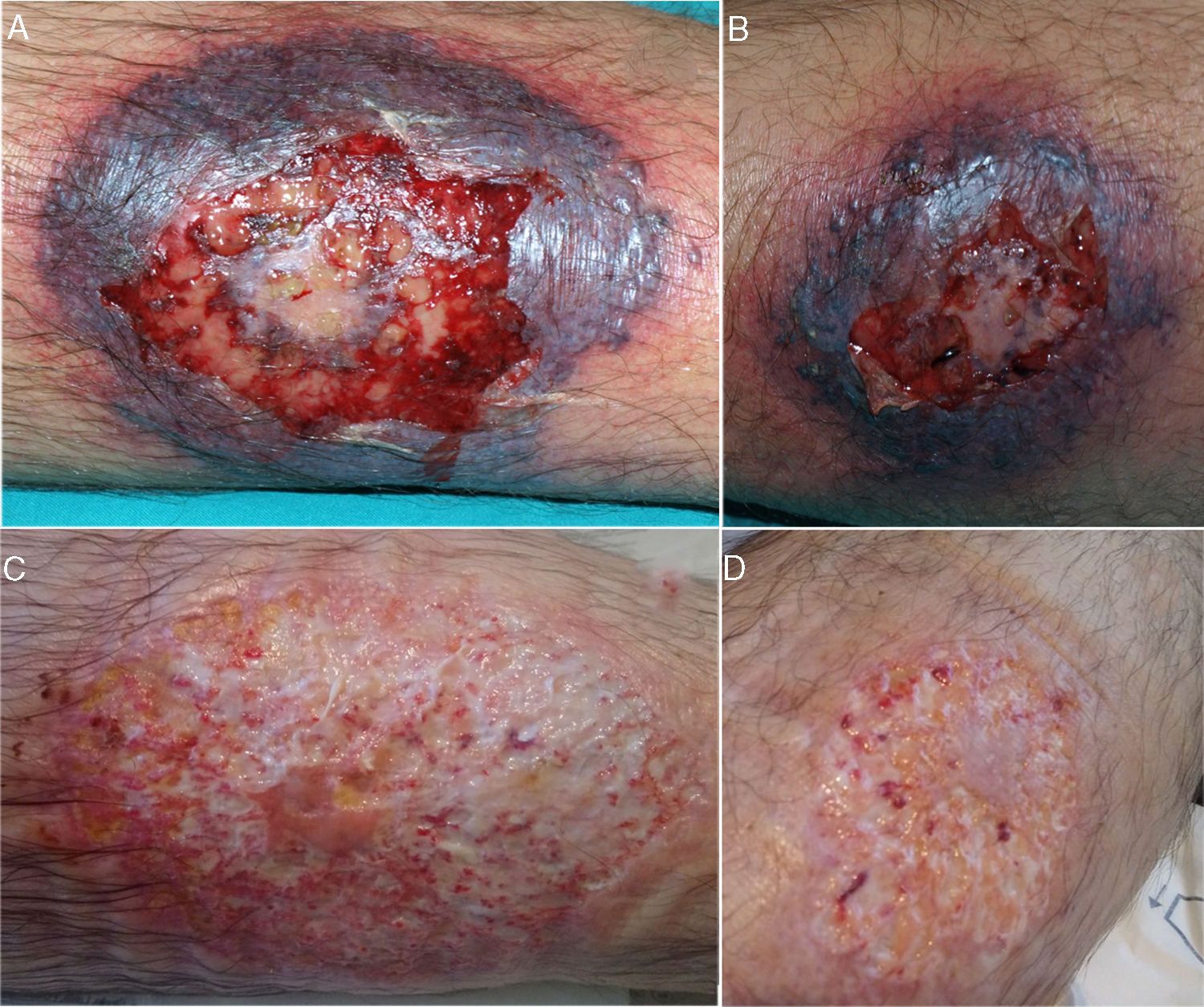
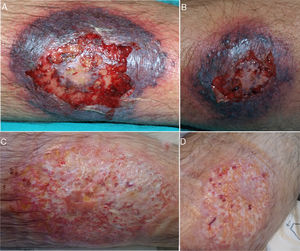
El episodio actual comenzó en enero de 2018 con la aparición de lesiones pustulosas milimétricas en ambos miembros inferiores, de una semana de evolución. Inicialmente las lesiones mejoraron con prednisona oral, pero reaparecieron tras su retirada, esta vez con una evolución más rápida y grave, motivo por el cual ingresó en nuestro hospital. A la exploración se apreciaban sendas úlceras muy dolorosas, en región pretibial derecha y cara externa de pierna izquierda, de 8 y 4cm de diámetro mayor, respectivamente, bordes eritematosos violáceos y un rodete de crecimiento perilesional necrótico (fig. 1A y B). Evaluado por dermatología, el estudio microbiológico fue negativo y la biopsia de una de las lesiones mostró una hipodermis con infiltrado inflamatorio agudo y abscesificación local, con tejido de granulación septal, todo ello compatible con el diagnóstico de PG. Se inició tratamiento con metil-prednisolona intravenosa a dosis de 1mg/kg/día y antibioterapia empírica, además de las curas locales. La evolución posterior fue lenta pero favorable (fig. 1C).
Se han publicado varios casos de PG posquirúrgico en pacientes con EII, pero el que presentamos sería el segundo caso descrito de PG de aparición más de 10 años después de una proctocolectomía restauradora por CU5. Se ha observado una asociación importante entre la presencia de estoma permanente y el PG, encontrándose este antecedente hasta en un 28% de los casos. En este escenario las lesiones suelen aparecer en el postoperatorio precoz, probablemente por un fenómeno de patergia en respuesta a la cirugía. De hecho, algunos autores definen este hallazgo como una variedad específica de PG: el PG periestomal4. Sin embargo, en nuestro paciente el PG tuvo lugar 10 años después de la cirugía, tras una técnica quirúrgica sin estoma, en una localización no relacionada con la misma. Suele admitirse que la evolución del PG es independiente de la EII, pudiendo ocurrir tras largos periodos de remisión de la enfermedad, pero su descripción en pacientes a los que se ha practicado este tipo de intervención, y tantos años después, es excepcional.
La afectación inflamatoria del colon, ya sea en forma de CU o de EC, parece ser un condicionante clave para que se produzca la enfermedad. También se ha encontrado una asociación importante entre el PG y el antecedente de enfermedad extraintestinal ocular tipo uveítis, como ocurrió en nuestro paciente2.
Esto, sumado al hecho de que el paciente padeciera una manifestación auto-inmune como la uveítis, años después de la cirugía, sugieren que la CU y el PG podría compartir una predisposición auto-inflamatoria e inmunológica común. Se desconocen los mecanismos fisiopatológicos de la aparición del PG. Las teorías más aceptadas incluirían diversas alteraciones de la cascada fisiológica de la inflamación que culminarían en una disregulación de la quimiotaxis de los neutrófilos, alteraciones que también se han podido observar en la EII1,2. Algunos autores sugieren una inmunogenicidad cruzada entre antígenos propios del colon y de la piel, teoría que explicaría la relación entre el PG y la EII con afectación cólica1.
La relevancia de este caso radica en el riesgo que pueden tener los pacientes con CU de presentar manifestaciones extra-intestinales autoinmunes importantes como el PG incluso años después de someterse a una intervención curativa de su enfermedad intestinal.