La pancreatitis aguda es una de las principales causas de consulta por dolor abdominal en las unidades de urgencias médicas y requiere hospitalización. Aunque la mayoría de ellas son leves y se recuperan rápidamente, hay un bajo porcentaje que tienen una evolución grave y su mortalidad es del 5-10%. En este artículo se realiza una revisión histórica de las vicisitudes que ha sufrido esta enfermedad desde su primera descripción en 1579 y que va ligada a nombres tan prestigiosos como Nicholaes Tulp, Reginald Fitz, Nicholas Senn y otros muchos que, con sus conocimientos y esfuerzo, han mejorado la supervivencia de los pacientes con esta patología.
Acute pancreatitis is one of most common causes of consultation due to abdominal pain in medical emergency units and it requires hospital admission. Although the majority of cases are mild and patients tend to recover quickly, a small percentage of cases is severe, with mortality in the region of 5-10%. This historical review considers how our understanding of this disease has changed since it was first described in 1579 thanks to the contributions of renowned experts such as Nicolaes Tulp, Reginald Fitz, Nicholas Senn and many others who, through their expertise and dedication, have improved the survival of patients with this disease.
Alejandro el Grande falleció el año 323 a.C., pocos días antes de cumplir los 33años. Había regresado a Babilonia después de sus últimas conquistas en Oriente, cerca del río Indo. Para festejarlo, él y sus generales celebraron un banquete donde se comió y bebió alcohol copiosamente. Al día siguiente Alejandro se quejó de dolor abdominal y fue empeorando progresivamente, y falleció 12días más tarde.
La teoría más aceptada durante años para explicar este desenlace ha sido el envenenamiento. Sin embargo, según el historiador Robin Lane Fox las pócimas más usadas en aquella época eran la estricnina y el eléboro, y ambas tienen unos efectos fulminantes, por lo que considera muy improbable que Alejandro pudiera sobrevivir 12días si hubiera sido emponzoñado1. También se ha apuntado la posibilidad de que se hubiera contagiado de malaria, coincidiendo con una epidemia que afectó a la ciudad de Babilonia en aquella época. Pero en 1986 Simmy Bank (Moorreesberg, Sudáfrica, 1931) propuso la hipótesis de que este podría ser el primer caso de pancreatitis fulminante inducida por el alcohol, aunque esto nunca podrá ser demostrado2.
A pesar de que desde la antigüedad se habían descrito diferentes anomalías en la glándula pancreática que eran referidas con la palabra griega skírros o la latina scirros (tumor, duro), no se había llegado a detallar ninguna enfermedad específica ligada a este órgano. Fue en 1788 cuando Thomas Cawley publicó sus hallazgos autópsicos en un paciente diabético de 34años cuyo páncreas contenía abundantes cálculos3. Sus observaciones le llevaron a plantear la probable vinculación entre la diabetes y el aspecto del páncreas, aunque no pudo establecer lo que era la causa o la consecuencia.
Estas dos descripciones pueden mostrar las dos formas extremas de manifestarse una pancreatitis: la primera, aguda, rápidamente mortal, y la segunda, crónica, con una evolución prolongada.
A lo largo de la historia, en estos últimos 125años se han descrito diversas formas de presentación de esta enfermedad inflamatoria del páncreas, formulándose diferentes clasificaciones. La primera ampliamente aceptada fue la del Simposio de Marsella de 19634, después de la cual se han propuesto diversas categorizaciones. En este artículo se presentan los distintos personajes que han descrito y aportado sus conocimientos para describir y mejorar la comprensión de esta patología que afecta a una parte importante de la población.
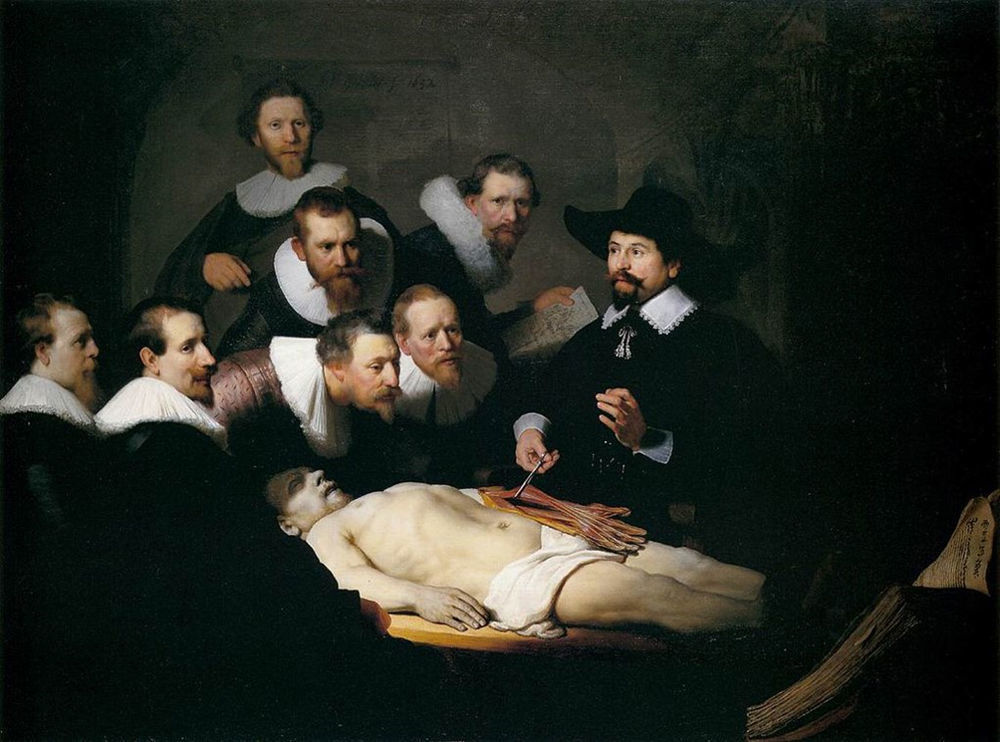
Primeras descripciones y posteriores hallazgosLa primera descripción que se dispone de la clínica y del aspecto del páncreas relacionable con una pancreatitis aguda fue publicada en Basilea en 1579 por Iacobo Auberto Vindone (1500?-1587), médico hugonote que había realizado una autopsia en un paciente alcohólico que mostraba un páncreas necrosado (fig. 1). Casi tres cuartos de siglo más tarde, en 1652, Nicholaes Pietrez Tulp (Ámsterdam, 1593-La Haya, Países Bajos, 1674), reputado médico y anatómico holandés, publicó en su cuarto libro de Observationes medicae la descripción de la clínica y los hallazgos anatómicos de un absceso pancreático que había observado en un hombre joven fallecido después de sufrir dolor de espalda, fiebre continua, insomnio y agitación5. Años antes, en 1632, Nicholaes Tulp había sido inmortalizado por Rembrandt (1606?-1669) en el cuadro titulado Lección de anatomía del Dr. Nicholaes Tulp cuando aquel era profesor de Anatomía del Gremio de Cirujanos de Ámsterdam, cargo que ocupó desde 1628 hasta 1653. En él se ve a Tulp rodeado de una serie de personajes a quienes describe la anatomía del brazo sobre el cadáver del ajusticiado Adriaen Adriaenszoom, delincuente habitual de Ámsterdam, apodado Aris’t Kind (Aris’t el niño)6 (fig. 2).
Una década más tarde de la descripción de Tulp, Guy Patin (1601-1672), que había sido Decano de la Facultad de Medicina de París, publicó una observación similar. En 1679 Théophile Bonet (Ginebra, Suiza, 1620-1689) describió el caso de un páncreas «corrupto y purulento» en su libro Sepulchretum sive Anatomica Practica ex Cadaveribus Morbo denatis (El cementerio o la anatomía práctica en cadáveres muertos de enfermedad), en el que recopiló casi 3.000 autopsias incluyendo sus historiales clínicos. Se considera este el primer libro completo de Anatomía Patológica. Dos años después J.G. Greiselius de Silesia publicó una nueva descripción de necrosis pancreática en su libro De repentina suave morte ex pancreate sphacelato7. Años más tarde, Giambattista Morgagni (Forlí, Italia, 1682-1771) editó en 1761 De sedibus et causis morborum per anatomen indagatis, que contenía más de 700 historias clínicas con sus respectivas autopsias. Entre ellas describía el caso de un paciente con dolor intenso en el abdomen superior, vómitos y colapso en cuya autopsia observó un páncreas aumentado de tamaño lleno de nódulos desiguales y de consistencia cartilaginosa8. Esta obra se tradujo a varios idiomas y sirvió de base para los estudios de Anatomía Patológica.
En 1788, el ya mencionado Thomas Cawley describió múltiples cálculos en el parénquima pancreático de un paciente diabético, lo que podría ser la primera descripción de una pancreatitis crónica de larga evolución que había desarrollado diabetes3. Pero debe recordarse que algunos autores, como Bonet (1679) y Morgagni (1761), ya habían descrito con anterioridad la existencia de cálculos pancreáticos en el momento de la autopsia. En 1793 Mathew Baillie (1761-1823), médico y patólogo escocés, editó el libro The morbid anatomy of some of the most important parts of human body en el que describía un páncreas lobulado y duro con concreciones en los conductos y áreas de fibrosis, todo lo cual podía corresponder también a una pancreatitis crónica9. Debe considerarse, a partir de este momento, que se habían descrito dos aspectos anatómicos distintos de afectación pancreática interpretados como pancreatitis aguda y pancreatitis crónica, lo que sería motivo de plantear, al cabo de unos 170años, una clasificación para definir estos diferentes tipos de pancreatitis4. Esta primera clasificación sufriría posteriormente diversas modificaciones.
En 1803 Antoine Portal (Gaillac, 1742-París, Francia, 1832), que fue presidente perpetuo de la Académie Nationale de Médecine de Francia, médico de LuisXVIII y de CarlosX, y el primero en referir la hemorragia digestiva por varices esofágicas, describió una pancreatitis gangrenosa que relacionó con litiasis biliar10. Una descripción similar la realizó Auguste-Nicolas Gendin (1796-1890) en 1826. Estos autores observaron, también, una analogía entre la inflamación del páncreas y de las glándulas salivales, hecho que fue también observado por otros autores como Théodoric Lerminier (1770-1836) y Salomón Neumann (1819-1908). Sin embargo, no fue hasta 1899 cuando H.F. Harris de Boston relacionó de forma convincente las paperas con la pancreatitis11.
En estos años fueron múltiples las teorías sobre posibles etiologías de la enfermedad, entre las que se pueden destacar el efecto del mercurio, utilizado en el tratamiento de la sífilis, la enfermedad hepática crónica, la migración de un gusano del duodeno al conducto pancreático, la úlcera péptica penetrante a páncreas, la compresión de la vía biliar que provocaba pancreatitis asociada a ictericia, entre otras muchas. Pero debe destacarse el hallazgo realizado por G. Fleischman en 1815 y que describió en su libro Leichenöffnergen (Autopsias)12. Es el caso de un varón joven alcohólico que había fallecido después de repetidos episodios de dolor abdominal, náuseas y vómitos. En la autopsia observó un páncreas muy endurecido que interpretó como el resultado de haber sufrido diversas pancreatitis y que hipotetizó se trataba de una evolución a la cronificación de la enfermedad. En base a esta descripción, Heinrich Claessen en 1842 y Nikolaus Friedreich (1825-1882) en 1878 especularon sobre el papel del alcohol en el desarrollo de la inflamación pancreática13,14. Fueron los primeros que llamaron la atención sobre lo que después se consideraría una de las principales etiologías de la pancreatitis. Este último autor acuñó el término «páncreas de los borrachos», que más tarde popularizaría Reginald Fitz en 1889.
Karl von Rokitansky (Hradec Králové, Bohemia, 1804-Viena, Austria, 1878), catedrático de Patología y primer Rector Electo de la Universidad de Viena, fue el primero en reconocer la pancreatitis aguda hemorrágica como entidad en 184215. Años más tarde, Theodor Albrecht Edwin Klebs (Königberg, Prusia, 1834-Berna, Suiza, 1913), patólogo y bacteriólogo, propuso en 1870 la relación entre la pancreatitis hemorrágica y la peripancreatitis purulenta con parcial secuestración de la glándula16. Dieciséis años después, Nicholas Senn (Sevelen, Suecia, 1844-1908), trabajando como cirujano en el Rush Medical College de Chicago, coincidió con la opinión de los dos personajes anteriores en que la infección pancreática y el absceso eran consecuencia de la pancreatitis aguda. Defendió su hipótesis en una reunión de la American Surgery Association apoyándose en los trabajos experimentales de su artículo The surgery of the pancreas17. También concluyó que la parte lesionada del páncreas sufría un proceso de reabsorción y era reemplazada por tejido conectivo mientras que el resto de la glándula podía mantener su función normal. También observó que si el conducto pancreático se veía afectado por el proceso inflamatorio se producía una obstrucción ductal al cicatrizar el tejido con el consiguiente deterioro de la porción distal de la glándula18. Senn realizó también múltiples estudios experimentales y clínicos relacionados con la cirugía pancreática, lo que le valió que fuera reconocido como el «padre de la pancreatología experimental».
En 1896, Hans Chiari (Viena, Austria, 1851-Estrasburgo, Francia, 1916), exalumno de Rokitansky, propuso la teoría de la autodigestión provocada por la tripsina como posible mecanismo patogenético de la necrosis pancreática al ser aquella activada por la bilis o la enterocinasa, tal como habían sugerido Claude Bernard y Nicholas Shepowalnikov (exalumno de Pavlov) siete años antes19. Parece ser que esta fue la primera teoría razonable que se lanzó para explicar la patogenia de la pancreatitis. Basándose en esta misma teoría, Gerhardt Katsch (Berlín, Alemania, 1887-1961) expuso en 1939 el concepto del «descarrilamiento enzimático» a través del cual enzimas pancreáticas activadas circulan por el torrente sanguíneo provocando lesiones en el pulmón, riñones y capilares (fig. 3). Otros autores, entre esta fecha y 1970, dieron explicaciones similares para comprender la hipocalcemia, la necrosis grasa, el aumento de la permeabilidad capilar, el aumento del surfactante que provoca el daño pulmonar, etc.
Gerhardt Katsch (Berlín, Alemania, 1887-1961). Médico internista alemán que en 1925 propuso la determinación de los valores de amilasa y lipasa en suero para el diagnóstico de la pancreatitis y en 1939 formuló la teoría del «descarrilamiento enzimático» para explicar la patogenia de esta enfermedad.
En 1901 Eugene L. Opie (Stauton, Virginia [EE.UU.], 1873-1971), patólogo del Johns Hopkins Hospital de Baltimore, propuso su «teoría del canal común» basándose en sus hallazgos autópsicos en pacientes con pancreatitis aguda hemorrágica. Observó en una ocasión un pequeño cálculo que dilataba la vía biliar pero no el conducto pancreático, lo que le hizo sugerir que el reflujo de bilis al interior del Wirsung era lo que provocaba la pancreatitis. Esta teoría la demostró experimentalmente al inyectar bilis en el interior del páncreas de animales y provocarles pancreatitis20. Esto le llevó a postular que la obstrucción del conducto pancreático causada por litiasis podría provocar la enfermedad. Sin embargo, es conocido que solo una minoría de pacientes con pancreatitis aguda presentan obstrucción de la vía biliar por cálculos. Ello es debido por un lado a que existen otras causas que provocan la enfermedad (el alcohol, entre otras) y que muchas veces los cálculos solo persisten un corto periodo de tiempo obstruyendo la vía biliar y pancreática, tal como señalaron Juan Acosta y Carlos Ledesma (Rosario, Argentina) en 1974 al observar cálculos en las heces y no en la vía biliar del 94% de los pacientes que habían sufrido pancreatitis aguda, lo que indicaba el paso de los cálculos al intestino después del periodo inicial de la enfermedad21.
Unos años antes, en 1889, Reginald Herber Fitz (Chelsea, Massachusetts [EE.UU.], 1843-1913), profesor emérito de Anatomía Patológica de la Universidad de Harvard y antiguo alumno de Rokitansky y Virchov, publicó en la revista Boston Medical and Surgical Journal22 —fundada en 1828 y que 100 años después se convertiría en New England Journal of Medicine— un artículo en el que documentaba los signos y síntomas de la pancreatitis aguda y establecía las distintas etapas del proceso describiendo la fase gangrenosa, hemorrágica y supurativa. Propuso diferentes etiologías, como la litiasis, el alcohol, la úlcera péptica perforada y el traumatismo abdominal. Y también describió el absceso, la trombosis esplénica y el seudoquiste como complicaciones asociadas a la pancreatitis aguda.
En 1908 Julius Wohlgemuth (Berlín, Alemania, 1874-1948), fisiólogo alemán, descubrió un método para medir la concentración de amilasa en suero, lo que permitió el diagnóstico de la pancreatitis aguda antes de la laparotomía o la autopsia, únicas formas posibles de comprobación diagnóstica por aquel entonces, significando un gran avance en la asistencia clínica de los pacientes. En 1911, Peter Rosenfeld Rona (Budapest, Hungría, 1871-1945), fisiólogo de origen judío, y Leonor Michaelis (Berlín, Alemania, 1875-1949), bioquímico y médico —en 1922 emigró a Japón (Universidad de Nagoya) y en 1926 a Estados Unidos, donde trabajó en la Johns Hopkins University de Baltimore y posteriormente en el Rockefeller Institute de Nueva York— determinaron la actividad de lipasa en sangre. Con los datos aportados por Wohlgemuth, Rona y Michaelis, Gerhardt Katsch propuso la determinación de los valores de amilasa y lipasa para el diagnóstico bioquímico de las enfermedades pancreáticas en 1925, y en 1929 Robert Elman, cirujano de Saint Louis, estableció la relación entre el aumento de los valores séricos de las enzimas pancreáticas y la existencia de inflamación de esta glándula, lo que demostraba definitivamente la utilidad diagnóstica de estas determinaciones23.
En 1916 y en 1920, respectivamente, el ginecólogo Thomas Stephen Cullen (Brigewater, Ontario [Canadá], 1868-1953) y el cirujano George Grey Turner (North Shields, Reino Unido, 1877-1951) describieron, respectivamente, la mancha periumbilical y la equimosis de los flancos abdominales que aparecen en la pancreatitis hemorrágica24.
El primer diagnóstico radiológico de enfermedad pancreática se realizó en 1927 al observarse, en una radiografía simple de abdomen, calcificaciones en el área pancreática. Ello fue posible gracias al descubrimiento realizado por Wilhelm Conrad Röntgen (Lennep, Prusia [ahora Alemania], 1845-Múnich, Alemania, 1923) en 1895 y que le valió el Premio Nobel de Física de 190125. Sin embargo, el diagnóstico morfológico pre mortem y/o prequirúrgico de enfermedad pancreática no pudo realizarse de forma sistemática y convincente hasta la introducción de las diferentes técnicas de imagen (ecografía [1971], tomografía computarizada [1974], resonancia magnética [≈1975]) y endoscópicas (colangiopancreatografía retrógrada endoscópica [1968] y ecoendoscopia [1980])26.
Clasificación de las pancreatitisDesde la descripción clínica y anatómica de Reginald Fitz en 1889 existieron varios intentos de clasificación de las pancreatitis basados en las observaciones realizadas mediante laparotomía o autopsia, pero ninguna de ellas tuvo suficiente éxito como para perdurar, aunque fuera durante un periodo limitado.
En 1946, Mandred W. Comfort (Hillsboro, Texas [EE.UU.], 1894-1957), médico de la Mayo Clinic de Rochester (Minnesota), estableció un nuevo concepto de carácter clínico y anatomopatológico al introducir el término «pancreatitis crónica recidivante»27. Dos años más tarde, los cirujanos Henry Doubilet y John H. Mulholland, del Bellevue Hospital de Nueva York, introdujeron la idea de «pancreatitis aguda recurrente», describiendo su etiología y tratamiento quirúrgico en base a la exposición de 21 casos clínicos28. Años más tarde, en 1958, Joseph L. Owens y John M. Howard, cirujanos de Atlanta, hicieron una clara distinción entre la pancreatitis litiásica y la alcohólica y describieron las calcificaciones en la pancreatitis crónica alcohólica29. Pero no fue hasta 1963, en la reunión que tuvo lugar en Marsella bajo la presidencia de Henri Sarles (1922-2017), eminente gastroenterólogo del Hôpital Sainte Marguerite de esta ciudad, donde se consensuó la primera clasificación basada principalmente en criterios clínicos y morfológicos. De este modo se consideró que la pancreatitis podía ser aguda, aguda recidivante, crónica y crónica recurrente4. A pesar de la simplicidad de esta clasificación clínica y de ser ampliamente aceptada, los términos pancreatitis aguda recidivante y pancreatitis crónica recurrente constituyeron un motivo de confusión ya que, aún hoy, es difícil diferenciar entre un episodio de recurrencia de una pancreatitis aguda y un brote de exacerbación sobre una base de pancreatitis crónica.
Veinte años más tarde, gracias a la introducción de las técnicas de imagen (ultrasonografía y tomografía computarizada) y endoscópica (colangiopancreatografía retrógrada endoscópica), se llevó a cabo una nueva clasificación en base a los conocimientos morfológicos y la historia natural de la enfermedad. Una primera reunión tuvo lugar en la ciudad de Cambridge en 1983 bajo los auspicios de la Pancreatic Society of Great Britain and Ireland30. Un año más tarde se realizó un segundo simposio, de nuevo en la ciudad de Marsella. En ambas reuniones se mantuvo la división de pancreatitis aguda y crónica31. La forma aguda se convino que se caracterizaba por la existencia de dolor abdominal y elevación de enzimas en sangre y orina. Se reconoció que puede haber una respuesta sistémica de diferente intensidad y que los ataques pueden tener carácter recurrente. En las dos reuniones se estuvo de acuerdo en que las complicaciones son la necrosis, la hemorragia y el seudoquiste, pero en la reunión de Cambridge se añadió el flemón y el absceso. En Marsella se profundizó en las definiciones y se fijaron criterios morfológicos esenciales para el diagnóstico de la pancreatitis aguda. Así, se describieron una forma grave con necrosis grasa peripancreática e intrapancreática y necrosis y hemorragia parenquimatosas, y otra forma menos grave con solo necrosis grasa peripancreática y edema intersticial. Al mismo tiempo, establecieron que estas lesiones pueden ser localizadas o difusas, y que cuando la clínica desaparece las alteraciones morfológicas y funcionales se normalizan. La pancreatitis crónica se caracteriza por cambios histológicos irreversibles que pueden ser progresivos y conducen a una pérdida de las funciones exocrina y endocrina y, muy a menudo, están asociados a dolor abdominal. Se definió una forma especial, la pancreatitis crónica obstructiva, que se caracteriza por la posibilidad de mejoría de la función exocrina una vez conseguida la descompresión del conducto de Wirsung obstruido.
En 1992 se reunieron en Atlanta un grupo de expertos con el objetivo de diseñar una nueva clasificación sobre pancreatitis32. En ella se unificaron diferentes criterios referentes a la pancreatitis aguda y se consideró que existe una forma grave (necrohemorrágica) asociada a fallo multiorgánico y/o complicaciones locales como necrosis, seudoquiste o absceso, y una forma leve (edematosa o intersticial) con mínima alteración del órgano y una recuperación sin incidentes. Se definieron también conceptos como el de exudados, necrosis, seudoquiste y absceso. Sin embargo, esta clasificación no estratificaba correctamente los diferentes grados de gravedad y no era suficientemente clara en la definición morfológica de las complicaciones locales.
Por ello, teniendo en cuenta que los nuevos conocimientos fisiopatológicos sobre la pancreatitis aguda indican que su gravedad viene marcada por la repercusión sistémica que ocasiona (fallo orgánico), especialmente si es persistente, y también por las complicaciones locales que se pueden desarrollar (colecciones líquidas o necrosis), especialmente si se infectan, se propusieron 2 nuevas clasificaciones: la Clasificación basada en determinantes (PANCREA)33, el año 2012, y los Criterios de Atlanta revisados, en 201334. La Clasificación basada en determinantes divide la gravedad de los pacientes en 4 niveles: leve (no necrosis ni fallo orgánico), moderada (necrosis estéril y/o fallo orgánico transitorio), grave (necrosis infectada o fallo orgánico persistente) y crítica (necrosis infectada y fallo orgánico persistente) y los Criterios de Atlanta revisados en 3 niveles: leve (sin complicaciones locales, ni sistémicas, ni fallo orgánico), moderadamente grave (complicaciones locales o sistémicas y/o fallo orgánico) y grave (fallo orgánico persistente [>48h]). Esta última introdujo además un nuevo tipo de complicación, que denominaron «necrosis encapsulada». Se trata de tejido pancreático o peripancreático necrosado envuelto por una pared inflamatoria (se realza con la tomografía computarizada dinámica) y requiere de un mínimo de 4 semanas para la formación de esta pared.
Los criterios de ambas han demostrado ser mejores que la vieja clasificación de Atlanta de 1992, pero todavía está por ver si entre ellas son excluyentes o complementarias, como han apuntado algunos autores35. Parece ser que la revisión de Atlanta de 2013 refleja mejor la realidad en la práctica clínica diaria frente al paciente.
La búsqueda de factores pronósticos de gravedadUno de los hechos que siempre ha preocupado a los facultativos que atienden a los pacientes con brotes agudos de pancreatitis es disponer de herramientas para predecir cómo puede evolucionar la enfermedad, de forma leve y con rápida recuperación del paciente, o si sufrirá graves complicaciones y pondrá en riesgo la vida del enfermo. Así, en 1974 John H. Ranson (Bangalore, India, 1938-1995) publicó un conjunto de criterios, conocidos por su epónimo, que se han usado para predecir la gravedad de una pancreatitis aguda alcohólica, aunque posteriormente fueron ligeramente modificados para evaluar la pancreatitis de origen biliar. Este sistema de evaluación se basó en la medición de 11 factores: 5 valorados en el momento de la admisión y 6 a las 48h. La presencia de tres o más de estos factores predicen un mayor riesgo de muerte o gravedad de la enfermedad con una sensibilidad del 60-80%36.
Cuatro años más tarde, el equipo de cirujanos de la Glasgow Royal Infirmary, dirigidos por Clement W. Imrie, eminente cirujano escocés gran experto en patología pancreática37, publicaba otra serie de factores que permiten hacer una predicción pronóstica al inicio de un episodio de pancreatitis aguda, tanto si ha sido provocada por el alcohol como por litiasis. Si el paciente presenta tres o más criterios indica que existe riesgo elevado de que el paciente presente graves complicaciones en el curso de la enfermedad. Se les conoce como Criterios de Glasgow, y fueron revisados por el mismo equipo de Imrie en 198438.
En 1983, Le Gall et al. desarrollaron en Francia el Simplified Acute Physiology Score (SAPS), que en 1993 modificarían y denominaría SAPSII39. Posteriormente, en 1989 se empezó a utilizar el Acute Physiology and Chronic Health Evolution (APACHEII). Se trata de sistemas generales de cuantificación de gravedad en enfermedades agudas para la valoración de pacientes que requieren estancia en unidades de cuidados intensivos. Ambos sistemas consisten en valorar 12 variables fisiológicas, edad y estado de salud previo40.
En 1985, Emil Jacques Balthazar (Rumanía, 1933), que emigró a Estados Unidos, donde es profesor emérito de Radiología de la New York University School of Medicine y está especializado en radiología de la patología abdominal, publicó los criterios que llevan su nombre. Se trata de un baremo que se utiliza para valorar el pronóstico de la pancreatitis aguda según los datos obtenidos mediante tomografía computarizada41. Cinco años más tarde divulgó un nuevo artículo en el que, gracias a la tomografía dinámica, añadía el porcentaje de la extensión de la necrosis pancreática y que se denominó CT Severity Index (CTSI)42.
Pauli Poulakkainen et al., de la Universidad de Helsinki describieron en 1987 la utilidad de la cuantificación de los niveles séricos de proteína C-reactiva (PCR) para la valoración de la gravedad de la pancreatitis aguda43. Esta proteína había sido descrita en 1930 por William S. Tillet y Thomas Francis, del Rockefeller Institute for Medical Research, en relación con las lesiones pulmonares provocadas por el neumococo44.
En 1993, Ivor C. Funnell et al., de Ciudad del Cabo (Sudáfrica), apuntaron el riesgo que suponía la obesidad en los pacientes con pancreatitis aguda proponiendo que se incluyera el índice de masa corporal (IMC>30kg/m2) como criterio de gravedad45. Sus resultados han sido posteriormente comprobados en diversos estudios como factor de riesgo de aparición de complicaciones locales, sistémicas y, también, para la mortalidad46.
Koenraad J. Mortele, del Brigham and Women's Hospital de Boston, publicó un artículo en 2004 en el que proponía un nuevo índice radiológico para mejorar el CTSI al modificar los criterios radiológicos y relacionarlos con la clasificación de Atlanta47. También este mismo año Marianna Arvanitakis, del Erasmus University Hospital de Bruselas, publicó lo que se ha denominado el Magnetic Resonance Severity Index (MRSI) al observar que los datos proporcionados por la resonancia magnética son comparables a los obtenidos mediante TC para la identificación de la gravedad de la pancreatitis aguda pero presentan menos contraindicaciones y, además, permiten identificar si existe disrupción del conducto pancreático, lo cual puede ocurrir en las fases iniciales de la enfermedad48.
En 2008, Bechien U. Wu, de la Harvard Medical School de Boston, con el fin de simplificar la valoración de los diferentes criterios de gravedad aparecidos hasta aquel entonces publicó el llamado Bedside Index of Severity Acute Pancreatitis (BISAP) en el que se valora, dentro de las primeras 24h del ingreso, el nitrógeno ureico >25mg/dl, el deterioro del estado mental, la presencia del síndrome de respuesta inflamatoria sistémica (SIRS), la edad >60años o derrame pleural, lo cual aumenta el riesgo de mortalidad. Este sistema tiene una capacidad de predicción de mortalidad similar al APACHEII pero con un cálculo mucho más sencillo49.
Un año más tarde, Paul G. Lankish, del Municipal Clinic de Lüneburg (Alemania), dando la vuelta a lo divulgado hasta entonces, publicó un estudio en el que definía y evaluaba un sencillo algoritmo clínico para la rápida identificación de los pacientes que en un primer ataque de pancreatitis no precisarán de cuidados intensivos. Valoraba la defensa abdominal y/o la sensibilidad a la descompresión y la normalidad de los valores de hematocrito y de creatinina sérica. El estudio fue realizado en más de 800 pacientes con una precisión diagnóstica del 98%. A este sistema se le ha denominado Harmless Acute Pancreatitis Score (HAPS)50.
No obstante, actualmente la mayoría de autores aceptan que la edad (>35años), el IMC (>30kg/m2), el fallo orgánico y el SIRS, la PCR (>150mg/dl), el nitrógeno ureico (>25mg/dl), el hematocrito (>44%) y la valoración del TCSI o RMSI (dentro de las primeras 72-96h) son los factores que indican los pacientes que precisarán de cuidados intensivos dado el riesgo de que presenten una mala evolución de la pancreatitis.
La persecución de un tratamiento eficazHistóricamente el debate entre el beneficio del tratamiento médico o quirúrgico en la pancreatitis aguda se remonta a finales del sigloxix, en los tiempos de Reginald Fitz y Nicholas Senn, y ha continuado desde entonces. Este segundo autor consideró en 1886 que una intervención quirúrgica en la fase temprana de la enfermedad era ineficaz además de arriesgada17. Sin embargo, unos años más tarde Fitz consideró que la cirugía era un tratamiento satisfactorio en una fase inicial51. La mayoría de estos pacientes, en esta época y a principios del sigloxx, eran diagnosticados en la autopsia o durante la cirugía abdominal, a la cual solo algunos de ellos sobrevivían. En 1887, August Socin (Vevey, Suiza, 1837-1899), profesor de cirugía en Basilea, drenó un quiste pancreático que provocaba obstrucción intestinal a una mujer de 45años que falleció a las 24horas. El quiste resultó ser un hematoma en la cabeza pancreática muy probablemente desarrollado a partir de una pancreatitis aguda, por lo que se considera uno de los primeros tratamientos quirúrgicos en esta enfermedad52.
A inicios del pasado siglo se consideró que la intervención quirúrgica era la mejor terapéutica. Así, Arthur William Mayo-Robson (Filey, Yorkshire [Gran Bretaña], 1853-1933), Johann von Mickulicz Radecki (Czerniowce, Bukowina [hoy Ucraina], 1850-1905), y especialmente Berkeley Moynihan (Malta, 1865-1936) empezaron a realizar laparotomías con drenaje del saco menor y colocación de gasas para conseguir un buen vaciado y evitar el cierre en falso de la cavidad originada (fig. 4)53. Hasta los años treinta la cirugía fue el tratamiento de elección a pesar de que su tasa de mortalidad superaba el 50%. Al lograrse la cuantificación de los valores séricos de amilasa se pudo realizar el diagnóstico sin necesidad de laparotomía, con lo que se extendió el uso del tratamiento conservador, especialmente en las formas no graves de la enfermedad, por lo que la cirugía se realizaba en raras ocasiones. Esto se vio reforzado por la publicación de John R. Paxton y J. Howard Payne (Los Angeles, California) de 1948 en la que, después de revisar 307 casos de pancreatitis, enfatizaron la escasa supervivencia después de una cirugía precoz, por lo que la intervención se consideró innecesaria y perjudicial54. A partir de los años sesenta, dados los pobres resultados del tratamiento médico, los cirujanos reconsideraron sus procedimientos y volvieron a indicar la cirugía en los estadios iniciales de la enfermedad. Sin embargo, persistieron las elevadas tasas de mortalidad, por lo que se siguieron ensayando tratamientos farmacológicos, y una serie de estudios prospectivos realizados en la década de los ochenta mostraron que el tratamiento conservador en los pacientes con necrosis estéril podía ser mejor que la cirugía, y que si se retrasaba la intervención se obtenían mejores resultados, lo que cambió de nuevo la estrategia terapéutica. En los casos de necrosis infectada se propuso retrasar la intervención y realizar desbridamientos, secuestrectomías, lavados (continuos o intermitentes)55 y lo que se denominó open-packing56. El abordaje podía ser abdominal o translumbar55,57. Otros autores propusieron la actuación precoz en todos los pacientes con necrosis, estuviera o no infectada.
En 1979, Stephen G. Gerzof, del Hospital de Veteranos de Boston, realizó un importante avance al demostrar la utilidad del drenado de abscesos abdominales por ultrasonografía o por tomografía computarizada, y en 1987 al implantar el uso de la punción aspirativa guiada mediante estas técnicas con el consiguiente cultivo de los tejidos y colecciones peripancreáticas, lo que permitía un diagnóstico temprano de la infección58,59.
Al inicio de este siglo, Pamoukian y Gagner, del Mount Sinai Medical Center de Nueva York, publicaron las ventajas de la necrosectomía mediante abordaje laparoscópico60, y pocos años más tarde Seifert et al., del Goethe University Hospital de Frankfurt, divulgaron un estudio multicéntrico con una casuística de 93 necrosectomías practicadas mediante punción por vía endoscópica, aunque el 4% de los pacientes acababan requiriendo cirugía abierta61.
Era evidente que uno de los problemas importantes que presentan estos enfermos es la infección del tejido pancreático y peripancreático necrosado, que es una de las principales causas que abocan al fallo multisistémico. Por este motivo, R. Howes planteó en 1975 la conveniencia del tratamiento profiláctico con antibióticos62, tema que se ha debatido hasta nuestros días y que ha sido motivo de múltiples ensayos. Finalmente, se ha considerado que esta profilaxis antibiótica no muestra ventajas en la evolución de la enfermedad63. En 1984, en base a los hallazgos de E. Kivilaakso et al.64, que identificaron la translocación bacteriana abdominal como responsable de la infección de la necrosis pancreática, el equipo de Stoutenbeek demostró la utilidad de la cefotaxima para la descontaminación del tracto digestivo en estos pacientes, consiguiendo reducir la infección al 16%65.
En 1986 Hans G. Beger (Meissen, Alemania, 1936) realizó, en el Hospital Universitario de Ulm, un análisis bacteriológico prospectivo en 114 pacientes con pancreatitis aguda grave en los que obtenía mediante cirugía tejido necrótico y analizaba los gérmenes que lo colonizaban. Demostró que si esto ocurría en una fase temprana estos pacientes presentaban una morbimortalidad mayor que los que presentaban una necrosis estéril66.
En cuanto al tratamiento conservador, se contempló desde el inicio el empleo de la rehidratación y la analgesia, así como la aspiración nasogástrica, que posteriormente se utilizó de forma muy limitada en situaciones muy concretas67. También se ensayaron diversos fármacos para reducir el tiempo de duración de la enfermedad y minimizar el daño tisular. Unos fármacos actuaban como inhibidores de la secreción pancreática como cimetidina68,69, atropina70, glucagón71, calcitonina72, somatostatina y su análogo octreotide73, y otros tenían un efecto inhibidor sobre las enzimas proteolíticas pancreáticas, aprotinina37, gabexato mesilato74,75 e inhibidores de la fosfolipasa76. Sin embargo, ninguno de ellos alcanzó los resultados deseados.
Otro aspecto fundamental en el tratamiento de la pancreatitis aguda grave es la necesidad de mantener el estado nutricional de los pacientes, ya que requieren largos periodos de ayuno, sufren un proceso inflamatorio importante y el riesgo de graves infecciones. Inicialmente, en los años sesenta se ensayó la nutrición enteral mediante yeyunostomía77, pero esta técnica representaba un riesgo muy elevado de complicaciones locales, por lo que seguidamente se planteó la utilización de la nutrición parenteral total. No obstante, se evidenció que este sistema provoca atrofia de la mucosa intestinal y favorece la translocación bacteriana y de toxinas, además del riesgo de infección de la vía78-80. Por este motivo, en la década de los noventa se planteó la administración de la nutrición por vía enteral mediante sonda nasoyeyunal que permite mantener una buena función de la barrera intestinal disminuyendo así las infecciones sistémicas, el fallo multiorgánico, la necesidad de cirugía y la mortalidad81,82. Más tarde se demostró que la nutrición mediante sonda nasogástrica presentaba las mismas ventajas que la utilización de la sonda nasoyeyunal. Sin embargo, en determinados casos en que el paciente no tolere la vía enteral o esta esté contraindicada por existir obstrucción intestinal, íleo paralítico o hipertensión intraabdominal, se sigue empleando la vía parenteral.
Un factor muy importante y definitivo en el tratamiento de los pacientes con pancreatitis aguda grave fue la creación de las unidades de cuidados intensivos. La primera unidad de este tipo fue organizada en el hospital Johns Hopkins de Boston por el neurocirujano Walter Edward Dandy (Missouri, EE.UU., 1886-1946) en 192683. Sin embargo, fue Peter Safar (Viena, Austria, 1924-2003), que emigró a Estados Unidos después de permanecer en un campo de concentración nazi y que se graduó como médico anestesiólogo en la Universidad de Pensilvania, quien rápidamente se interesó por la resucitación cardiopulmonar y en 1962 estableció en el hospital John Hopkins de Baltimore la primera UCI tal como las conocemos hoy en día84. En estas unidades los pacientes son sometidos a vigilancia continuada y a monitorización hemodinámica, renal y respiratoria, consiguiéndose de esta manera la actuación precoz sobre las distintas complicaciones, tanto sistémicas como locales.
Actualmente se considera que el tratamiento de la pancreatitis aguda grave debe ser llevado a cabo por equipos multidisciplinares formados por intensivistas, gastroenterólogos, radiólogos, endoscopistas y cirujanos.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.