Las enfermedades cardiovasculares (ECV) son la primera causa de muerte en el mundo, por ello es fundamental conocer su relación y prevalencia en distintas enfermedades que pueden presentar factores de riesgo específicos para las mismas. El objetivo del presente documento es analizar la prevalencia específica de las ECV en los pacientes con enfermedad inflamatoria intestinal (EII), describiendo la existencia de los factores de riesgo cardiovasculares clásicos y no clásicos en estos pacientes. Asimismo, detallaremos la fisiopatología de la aterosclerosis en este grupo de pacientes, y las distintas formas de medir el riesgo cardiovascular, incluyendo el empleo de calculadoras de riesgo en la práctica clínica y las diferentes formas de objetivar la aterosclerosis subclínica y la disfunción endotelial. Igualmente, se explicará la potencial influencia sobre el riesgo cardiovascular de la medicación utilizada para el manejo de los pacientes con EII y, de forma inversa, la posible influencia de los fármacos más comúnmente empleados para el manejo de las ECV sobre el curso de la EII. Finalmente, en el documento se establecen comentarios y recomendaciones basadas en la evidencia disponible, y en la opinión de expertos. En la elaboración de estas recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa (GETECCU) ha participado un grupo interdisciplinar que incluía a gastroenterólogos expertos en el manejo de la EII y a un cardiólogo consultor para este tipo de pacientes.
Cardiovascular diseases (CVD) are the leading cause of death worldwide. Therefore, it is essential to understand their relationship and prevalence in different diseases that may present specific risk factors for them. The objective of this document is to analyze the specific prevalence of CVD in patients with inflammatory bowel disease (IBD), describing the presence of classical and non-classical cardiovascular risk factors in these patients. Additionally, we will detail the pathophysiology of atherosclerosis in this patient group and the different methods used to assess cardiovascular risk, including the use of risk calculators in clinical practice and different ways to assess subclinical atherosclerosis and endothelial dysfunction. Furthermore, we will describe the potential influence of medication used for managing patients with IBD on cardiovascular risk, as well as the potential influence of commonly used drugs for managing CVD on the course of IBD. The document provides comments and evidence-based recommendations based on available evidence and expert opinion. An interdisciplinary group of gastroenterologists specialized in IBD management, along with a consulting cardiologist for this type of patients, participated in the development of these recommendations by the Spanish Group of Work on Crohn's Disease and Ulcerative Colitis (GETECCU).
Las enfermedades cardiovasculares (ECV) engloban, de acuerdo con la Organización Mundial de la Salud, una serie de trastornos del corazón y los vasos sanguíneos que incluyen el síndrome coronario, las enfermedades cerebrovasculares, la arteriopatía periférica, la trombosis venosa profunda, el embolismo pulmonar, las enfermedades reumáticas cardiacas y las cardiopatías congénitas1. Son la primera causa de muerte a nivel mundial, con 17,9 millones de fallecimientos por estas enfermedades en 2019. Tres cuartas partes de las muertes se producen en países de rentas medias y bajas, y en Europa son las responsables de más de la mitad de las muertes anuales. En 2019 se ha estimado una prevalencia de 6.431,6 casos/105 habitantes y una incidencia de 684,3 casos/105 habitantes2. Las ECV con mayor impacto son la cardiopatía isquémica (CI) y la enfermedad cerebrovascular, que condicionaron el 85% de las muertes en 2019, y representan el 60,2% de los casos incidentes de ECV3–5 (tabla 1).
Prevalencia, incidencia y mortalidad en la población general en 2019
| Prevalencia | Incidencia | Mortalidad | |
|---|---|---|---|
| Enfermedad cardiovascular | 6.431,6 | 684,3 | 239,8 |
| Cardiopatía isquémica | 2.421 | 262,4 | 118 |
| Enfermedad cerebrovascular | 1.240,3 | 150,8 | 84,2 |
| Arteriopatía periférica/isquemia arterial periférica | 1.401,8 | 127,1 | 1 |
Fuente: datos expresados en casos/100.000 habitantes2.
En los pacientes con enfermedad inflamatoria intestinal (EII) está bien establecido que existe un aumento del riesgo de enfermedad tromboembólica venosa (ETEV).
Ya en un estudio clásico publicado en 1964 por el grupo de Oxford, se describía que el embolismo pulmonar era una de las complicaciones más relacionadas con la mortalidad en los pacientes con colitis ulcerosa (CU)6. De hecho, en las guías internacionales sobre el manejo de la ETEV y el tromboembolismo pulmonar se describe a la EII como un factor de riesgo moderado (odds ratio [OR]: 2-9) de la ETEV7.
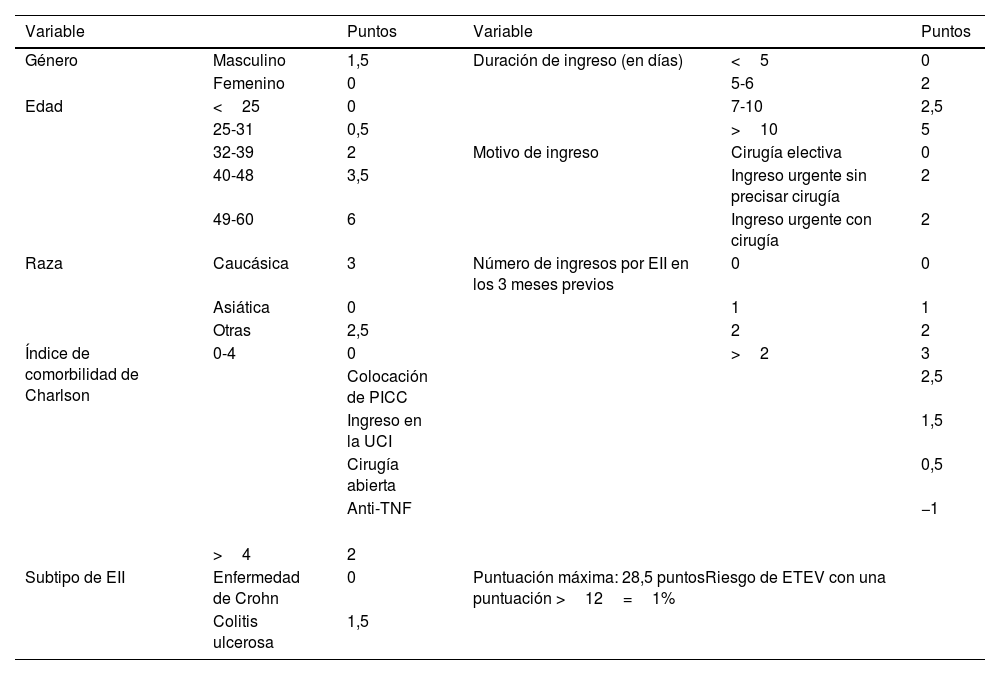
Tres metaanálisis han descrito un riesgo relativo (RR) de ETEV entre 1,96 y 2,20 respecto a los controles sin EII8–10, y un metaanálisis sobre el riesgo en las mujeres con EII embarazadas ha descrito un RR durante el embarazo y en el posparto de 2,13 y 2,61, respectivamente11. El riesgo de ETEV es elevado tanto en fases de remisión (hazard ratio [HR]: 2,1) como durante los brotes de actividad de la EII (HR: 8,4)12. Un reciente trabajo13 analiza la incidencia de ETEV en los 90 días tras el alta en los pacientes con EII; los principales factores de riesgo para desarrollar una ETEV fueron los ingresos más prolongados en el tiempo, la edad avanzada, el sexo masculino y el haber sido ingresados de forma urgente. Por este motivo, para evitar la aparición de estos eventos, se recomienda tratamiento profiláctico antitrombótico adecuado en los pacientes ingresados y, en determinados casos, en los pacientes ambulatorios13–17. Para identificar aquellos pacientes de EII con mayor riesgo de ETEV tras el alta, se ha propuesto un sistema de estadificación de riesgo (tabla 2,13) que puede ser útil para su empleo en la clínica. En una serie alemana recientemente publicada18, que incluye 333.975 ingresos de los pacientes con enfermedad de Crohn (EC), la presencia de ETEV es un factor independiente de aumento de mortalidad en los pacientes ingresados con EC (OR: 9,31; intervalo de confianza del 95% [IC 95%]: 7,54-11,50). Y la ETEV no solo se asocia a una peor evolución clínica, sino que conlleva un sobrecoste económico muy relevante en el tratamiento de los pacientes con EII19.
Sistema de estadificación de riesgo de la ETEV 90 días tras el alta en los pacientes con EII
| Variable | Puntos | Variable | Puntos | ||
|---|---|---|---|---|---|
| Género | Masculino | 1,5 | Duración de ingreso (en días) | <5 | 0 |
| Femenino | 0 | 5-6 | 2 | ||
| Edad | <25 | 0 | 7-10 | 2,5 | |
| 25-31 | 0,5 | >10 | 5 | ||
| 32-39 | 2 | Motivo de ingreso | Cirugía electiva | 0 | |
| 40-48 | 3,5 | Ingreso urgente sin precisar cirugía | 2 | ||
| 49-60 | 6 | Ingreso urgente con cirugía | 2 | ||
| Raza | Caucásica | 3 | Número de ingresos por EII en los 3 meses previos | 0 | 0 |
| Asiática | 0 | 1 | 1 | ||
| Otras | 2,5 | 2 | 2 | ||
| Índice de comorbilidad de Charlson | 0-4 | 0 | >2 | 3 | |
| Colocación de PICC | 2,5 | ||||
| Ingreso en la UCI | 1,5 | ||||
| Cirugía abierta | 0,5 | ||||
| Anti-TNF | −1 | ||||
| >4 | 2 | ||||
| Subtipo de EII | Enfermedad de Crohn | 0 | Puntuación máxima: 28,5 puntosRiesgo de ETEV con una puntuación >12=1% | ||
| Colitis ulcerosa | 1,5 | ||||
EII: enfermedad inflamatoria intestinal; ETEV: enfermedad tromboembólica venosa; PICC: catéter central de inserción periférica; UCI: unidad de cuidados intensivos; TNF: factor de necrosis tumoral.
Fuente: modificado de Harvey et al.13.
Los datos sobre el riesgo de enfermedad cardiovascular ateroesclerótica (ECVAS) son discordantes. Hay estudios que no aprecian un riesgo mayor al de la población general20–24, y otros que describen un riesgo menor25,26. Sin embargo, 5 metaanálisis9,27–30 y varios estudios recientes31,32 orientan a un aumento del riesgo de CI y de ictus, que oscila entre el 15 y el 25% respecto de la población general, tras ajustar por factores de riesgo cardiovascular (FRCV) (tabla suplementaria 1). Por este motivo, diversos grupos de expertos abogan por evaluar el riesgo cardiovascular arteriosclerótico en los pacientes con EII33.
El riesgo de ECVAS aumenta tanto en los pacientes con EC como con CU, aunque algunos estudios han apreciado que el riesgo es mayor en los pacientes con EC34–36. El aumento de riesgo es mayor en las mujeres que en los varones, y en los pacientes de menor edad en comparación con los pacientes mayores29,32,34–36. Un estudio que analizaba las características de los pacientes con ECVAS prematura o extremadamente prematura (pacientes menores de 55 años o menores de 40 años, respectivamente) encontró que el porcentaje de pacientes con EII en estos grupos de edad con ECVAS era superior al de los pacientes control37 (tabla suplementaria 2).
Los resultados de incidencia de eventos arteriales agudos, entre los que destacan la CI, la enfermedad cerebrovascular, la enfermedad arterial periférica o la muerte por eventos agudos arteriales, recientemente publicados del análisis de datos del biobanco del Reino Unido, que incluye a más de 450.000 participantes, en los que se aparearon los datos de 5.094 pacientes con EII con los de 20.376 controles, encontró un mayor riesgo de este tipo de eventos en los pacientes con EII, sobre todo en los pacientes varones menores de 55 años y en lsd mujeres de menos de 65 años. Cabe destacar que tanto los niveles elevados de proteína C reactiva (PCR) de alta sensibilidad como la gravedad de la EII fueron los factores predictores independientes de los eventos arteriales agudos en estos pacientes38.
No está claro si este aumento de riesgo de ECV se asocia también a un aumento de la mortalidad por ECV. Diferentes metaanálisis no han apreciado un aumento de la mortalidad por ECV9,30,39, habiéndose incluso observado que la supervivencia en los pacientes con EII que sufren un infarto agudo de miocardio (IAM) puede ser un 25% mayor que en los pacientes sin EII40. Sin embargo, una serie alemana reciente18 ha descrito que la presencia de ETEV es un factor independiente de aumento de mortalidad en los pacientes ingresados con EC (OR: 9,31; IC 95%: 7,54-11,50), y datos sobre la cohorte noruega IBSEN41, tras 30 años de seguimiento, demuestran que la mortalidad por ECV en los pacientes con EII es superior a la de la población general, tanto en CU (HR: 1,51 [1,10-2,08]) como en EC (HR: 2,04 [1,11-3,77]).
Resumen y recomendación
- -
Los pacientes con EII tienen un riesgo aumentado de ETEV y de EVASC. Este aumento de riesgo, en comparación con la población general, es mayor en los pacientes jóvenes y en las mujeres.
- -
Se recomienda tratamiento profiláctico antitrombótico en los pacientes con EII ingresados por cualquier motivo. Debe valorarse mantener este tratamiento al alta hospitalaria en los pacientes con alto riesgo de trombosis (tabla 2).
- -
El aumento de riesgo de ECV podría asociarse también a un mayor riesgo de muerte por este motivo, pero los datos no son concluyentes.
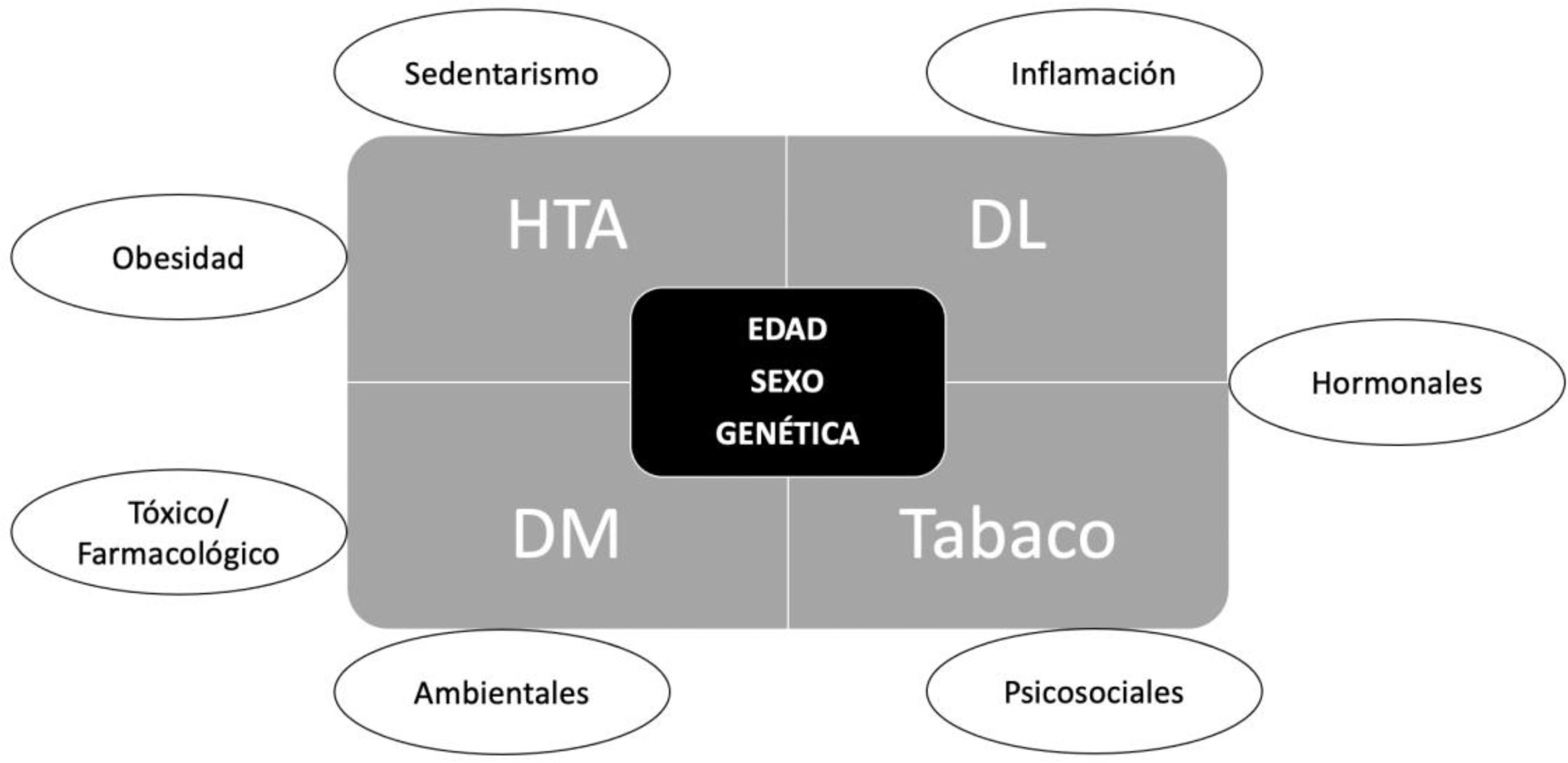
Los FRCV clásicos son factores clínicos descritos en el Framingham Heart Study que confieren un aumento de riesgo de desarrollar una ECVAS. Estos factores son: la edad, el género, el nivel de colesterol total, el nivel de colesterol-LDL, la presión arterial (PA) sistólica, el tratamiento antihipertensivo, la diabetes mellitus (DM) y el consumo de tabaco42. Junto a estos factores, pueden considerarse otros que se han ido identificando posteriormente, como la historia familiar de enfermedad cardiovascular, la etnia, la obesidad, el sedentarismo y la dieta. Además del riesgo que estos factores confieren individualmente, se ha observado un efecto multiplicador de los mismos cuando se presentan varios de ellos de forma simultánea43.
La prevalencia de estos FRCV en nuestro medio es elevada44,45. En los países ricos de Europa el 23,4% de los varones y el 15,6% de las mujeres son fumadores. La prevalencia de actividad física insuficiente es del 32%. El 20,6% de la población presenta hipertensión arterial (HTA), el 18,8% de los varones y el 18,1% de las mujeres dislipemia, el 5,8% presenta DM y el 22,3% es obesa.
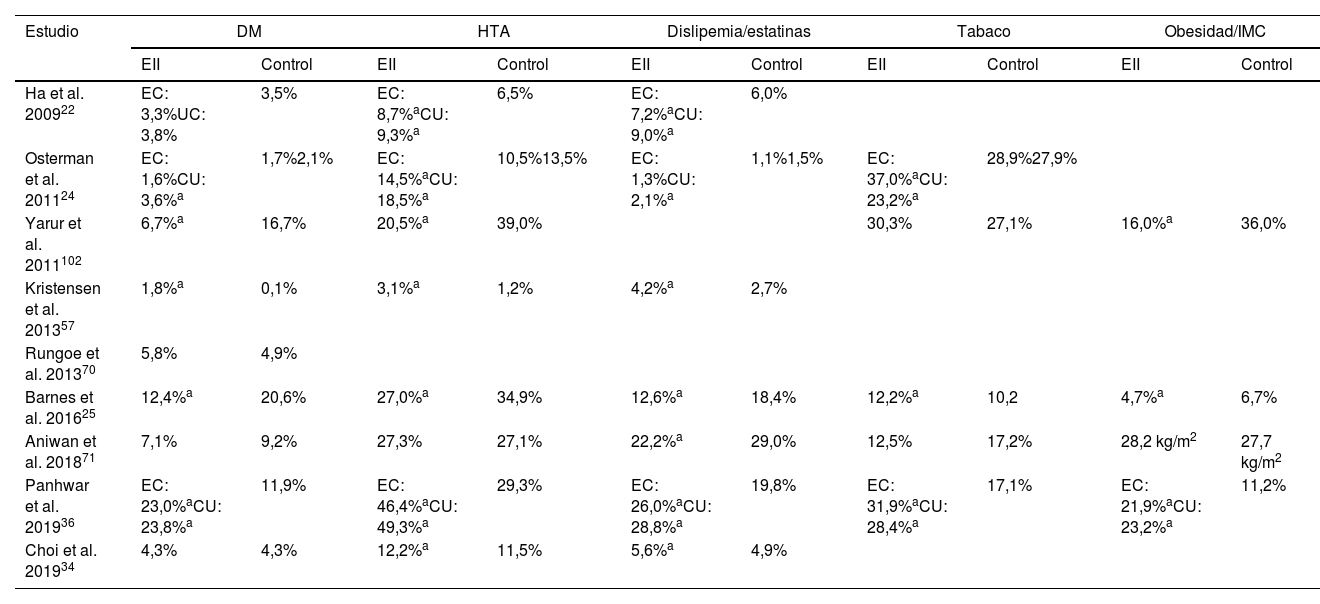
En los estudios que han valorado el riesgo cardiovascular en EII, la frecuencia de FRCV en los pacientes con EII respecto a los grupos control es variable, con estudios que aprecian una menor frecuencia, estudios que muestran una frecuencia similar y otros que muestran mayor frecuencia de alguno de los FRCV clásicos29,46 (tabla 3). De forma similar, los estudios que han analizado directamente la prevalencia de los FRCV en los pacientes con EII muestran resultados contradictorios. Un estudio poblacional danés encontró que los pacientes con EII presentaban valores inferiores de PA, de colesterol total y colesterol LDL, con cifras de glucemia y parámetros corporales similares a la población general47. Por el contrario, un estudio norteamericano realizado a partir de una encuesta de salud poblacional apreció que los pacientes con EII tienen mayor prevalencia de HTA, DM, hipercolesterolemia y actividad física insuficiente, y una prevalencia similar de tabaquismo y obesidad respecto de la población general; estas diferencias desaparecen en los pacientes mayores de 65 años de edad48. Finalmente, un reciente estudio transversal realizado en centros de referencia franceses y belgas ha descrito que dos tercios de los pacientes con CU presentan al menos un FRCV49.
Prevalencia de los factores de riesgo cardiovasculares en los estudios que analizan el riesgo de la enfermedad cardiovascular arteriosclerótica en los pacientes con EII
| Estudio | DM | HTA | Dislipemia/estatinas | Tabaco | Obesidad/IMC | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| EII | Control | EII | Control | EII | Control | EII | Control | EII | Control | |
| Ha et al. 200922 | EC: 3,3%UC: 3,8% | 3,5% | EC: 8,7%aCU: 9,3%a | 6,5% | EC: 7,2%aCU: 9,0%a | 6,0% | ||||
| Osterman et al. 201124 | EC: 1,6%CU: 3,6%a | 1,7%2,1% | EC: 14,5%aCU: 18,5%a | 10,5%13,5% | EC: 1,3%CU: 2,1%a | 1,1%1,5% | EC: 37,0%aCU: 23,2%a | 28,9%27,9% | ||
| Yarur et al. 2011102 | 6,7%a | 16,7% | 20,5%a | 39,0% | 30,3% | 27,1% | 16,0%a | 36,0% | ||
| Kristensen et al. 201357 | 1,8%a | 0,1% | 3,1%a | 1,2% | 4,2%a | 2,7% | ||||
| Rungoe et al. 201370 | 5,8% | 4,9% | ||||||||
| Barnes et al. 201625 | 12,4%a | 20,6% | 27,0%a | 34,9% | 12,6%a | 18,4% | 12,2%a | 10,2 | 4,7%a | 6,7% |
| Aniwan et al. 201871 | 7,1% | 9,2% | 27,3% | 27,1% | 22,2%a | 29,0% | 12,5% | 17,2% | 28,2 kg/m2 | 27,7 kg/m2 |
| Panhwar et al. 201936 | EC: 23,0%aCU: 23,8%a | 11,9% | EC: 46,4%aCU: 49,3%a | 29,3% | EC: 26,0%aCU: 28,8%a | 19,8% | EC: 31,9%aCU: 28,4%a | 17,1% | EC: 21,9%aCU: 23,2%a | 11,2% |
| Choi et al. 201934 | 4,3% | 4,3% | 12,2%a | 11,5% | 5,6%a | 4,9% | ||||
CU: colitis ulcerosa; DM: diabetes mellitus; EC: enfermedad de Crohn; EII: enfermedad inflamatoria intestinal; HTA: hipertensión arterial; IMC: índice de masa corporal.
Pese a estos datos contradictorios, alguno de los FRCV tradicionales se ha asociado en mayor o menor medida a la EII. Un metaanálisis que incluye 2 estudios caso/control y 3 estudios poblacionales ha descrito que el riesgo de DM es mayor en los pacientes con EII respecto de la población general (OR/RR: 1,26; IC 95%: 1,20-1,32)28. La prevalencia de obesidad y sobrepeso en los pacientes con EII es del 15-40% y del 20-40%, respectivamente50, y es probable que estos porcentajes aumenten con el tiempo, ya que se ha observado un aumento progresivo del peso y del índice de masa corporal (IMC) de los pacientes con EC participantes en ensayos clínicos desde 1991 a 200851; además, las mujeres con obesidad (IMC>30) tienen un mayor riesgo de desarrollar EC que las mujeres con un IMC normal52. El tabaco es un factor ambiental ampliamente estudiado en el desarrollo de las EII; en el estudio europeo EPI-IBD se encontró que, en el momento del diagnóstico, el 36-38% de los pacientes con EC y el 9-11% de los pacientes con CU eran fumadores53. En otras cohortes prospectivas, la prevalencia de fumadores activos era del 26-39,9% en EC y del 10-15,3% en CU, similar o inferior a las de las respectivas poblaciones generales54,55.
Aunque los FRCV clásicos no son más frecuentes en los pacientes con EII que en la población general, influyen en el riesgo cardiovascular individual. En un estudio en el que se siguieron durante 2 años a 300 pacientes con EII sin FRCV clásicos, únicamente un paciente desarrolló un evento cardiovascular isquémico56. Por otro lado, los pacientes con EII y ECVAS presentan más frecuentemente FRCV clásicos que los pacientes con EII sin ECVAS32. Por último, los pacientes con EII y FRCV tienen un riesgo aumentado de eventos cardiovasculares35,36,57,58.
Resumen y recomendación
- -
La prevalencia de los FRCV clásicos en los pacientes con EII es variable en los estudios publicados, pero no parece estar aumentada respecto de la población general.
- -
Los FRCV clásicos influyen en el riesgo CV individual de los pacientes con EII.
- -
Recomendamos valorar individualmente en cada paciente los FRCV clásicos para detectar precozmente un mayor riesgo de ECV, al igual que se hace en la población general.
Dado que el aumento del riesgo de la ECVAS en los pacientes con EII no parece relacionarse con una mayor frecuencia de FRCV tradicionales, se postula que los modificadores de riesgo cardiovascular (antiguos FRCV no tradicionales) pueden tener una influencia relevante, al igual que ocurre en otras enfermedades inflamatorias59.
Aterosclerosis subclínica en los pacientes con enfermedad inflamatoria intestinalSe ha descrito que la presencia de aterosclerosis subclínica aumenta el riesgo de ECVAS, y en individuos con riesgo cardiovascular intermedio el estudio por métodos no invasivos de la aterosclerosis subclínica puede ayudar a mejorar la estimación del riesgo cardiovascular60. Los pacientes con EII sin FRCV o sin ECVAS establecida presentan marcadores de aterosclerosis subclínica como son el espesor de la íntima-media carotídea, la rigidez arterial, o datos de disfunción endotelial61–64.
Papel de la actividad inflamatoria en el riesgo cardiovascularLa aterosclerosis puede considerarse como una enfermedad inflamatoria en la que los mecanismos inmunes interaccionan con factores metabólicos para iniciar, propagar y activar las lesiones arteriales65. En la EII, aparte de la actividad inflamatoria, se ha descrito la activación de biomarcadores asociados a la ECVAS, como el dímero D, el factor von Willebrand, la hiperhomocisteinemia, la LDL oxidada, el fibrinógeno, las metalopeptidasas de la matriz, el NF-κB y el interferón-γ66,67.
En los pacientes con EII se ha descrito una relación entre los eventos cardiovasculares y la actividad inflamatoria. Debido a que la mayor parte de los estudios se ha realizado sobre cohortes poblacionales o bases de datos administrativas, la asociación se basa en datos indirectos, como el tiempo desde el diagnóstico de la EII, el inicio del tratamiento corticoideo o la proximidad a ingresos por la EII. El porcentaje de pacientes con actividad moderada o grave es elevado durante el primer año tras el diagnóstico de EII68,69. En un estudio poblacional danés se describió que el aumento de riesgo de CI en los pacientes con EII era especialmente elevado en los 3 primeros meses y en el primer año desde el diagnóstico de la EII70. En diversos estudios se ha descrito que los pacientes con necesidad de tratamiento corticoideo presentan un aumento de riesgo de ECVAS respecto de los pacientes que no los necesitan durante el seguimiento70,71, al igual que ocurre en los pacientes que necesitan ingreso o cirugía por la EII35,70–72. Varios estudios que definen la actividad de la EII en base a un criterio que incluye ingresos hospitalarios, prescripción de corticoides o anti-TNF57,73, o una clasificación específica de la enfermedad58, han encontrado un aumento del riesgo de eventos cardiovasculares en los pacientes con actividad respecto de los que están en remisión. Además, los pacientes sin brotes de actividad presentan un riesgo similar a los individuos sin EII. Por otro lado, la presencia de estos marcadores de actividad se ha asociado a un aumento de la mortalidad por IAM y a un aumento del riesgo de reinfarto74. El único estudio que ha valorado el riesgo cardiovascular en base a parámetros objetivos es un estudio caso/control francés, que encontró que los pacientes con EII que desarrollaban un evento arterial presentaban más frecuentemente niveles medios de PCR superiores a 5mg/l en el año y los 3 años previos58.
Factores psicosocialesLa ansiedad y la depresión son consideradas condiciones clínicas asociadas a un aumento del riesgo cardiovascular y a su vez, el desarrollo de ECV en estos pacientes puede agravar el curso de la enfermedad mental, con un aumento del riesgo de suicidio75. La ansiedad y la depresión, también han sido estudiadas en los pacientes con EII, presentando también mayor frecuencia en estos pacientes, por lo que el estrés psíquico podría influir negativamente en su salud cardiovascular76.
Resumen
- -
El aumento de ECV en los pacientes con EII no se explica únicamente por los FRCV clásicos.
- -
Los pacientes con EII muestran datos de arteriosclerosis subclínica en ausencia de FRCV o ECV establecida.
- -
La actividad inflamatoria se asocia a mayor riesgo de ECV y a un peor pronóstico de ECVAS establecida.
- -
La mayor frecuencia de ansiedad y depresión en los pacientes con EII puede influir en el mayor riesgo de ECV de estos pacientes.
La aterosclerosis es una enfermedad inflamatoria que produce el deterioro de la pared arterial mediante el acúmulo y oxidación de lípidos en la capa íntima de la pared arterial77. Es conocido el papel patogénico de los FRCV (HTA, hipercolesterolemia, tabaquismo y DM) y también está ampliamente demostrado el aumento de la prevalencia de la enfermedad aterosclerótica en los pacientes con inflamación crónica (virus de inmunodeficiencia humana, artritis reumatoide (AR) o psoriasis) en los que el estado inflamatorio sistémico, sirve de estímulo para la progresión de la lesión aterosclerótica78–80.
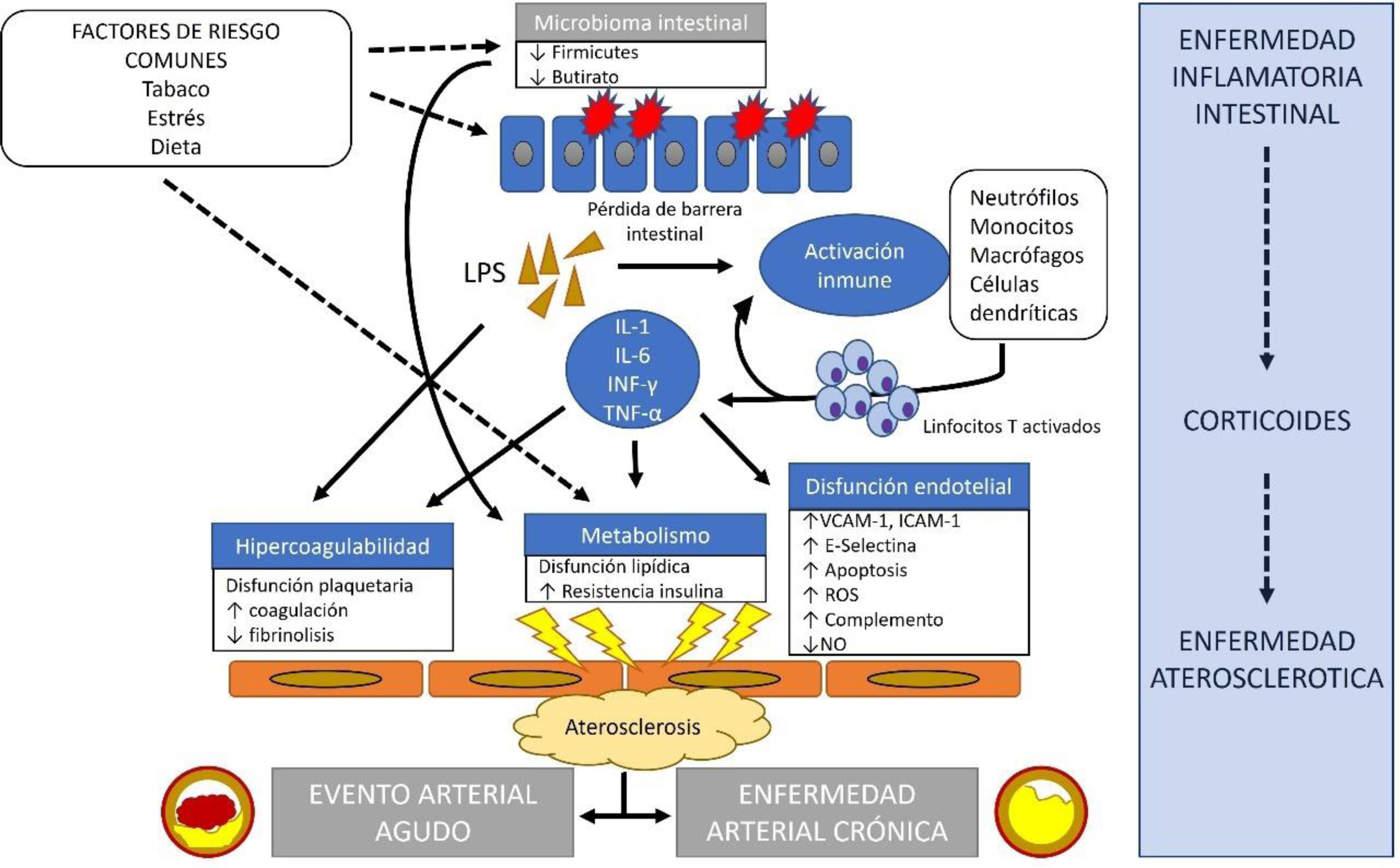
A modo de resumen sencillo, la aterosclerosis no es una mera acumulación lipídica en la pared arterial; es un proceso inflamatorio complejo sobre una pared arterial predispuesta genéticamente77. Afecta a arterias de mediano y gran calibre y se desarrolla durante toda la vida, apareciendo las primeras lesiones macroscópicas (las estrías de colesterol) ya en la edad infantil y juvenil, con un componente inflamatorio, más que lipídico77. A nivel microscópico o celular, la disfunción endotelial es la primera alteración patológica descrita y posibilita el paso de leucocitos, la fácil adhesión de plaquetas y el depósito de moléculas de colesterol de baja densidad (mayoritariamente LDL), que son oxidadas por los linfocitos T activados y fagocitadas por macrófagos que se transforman en células espumosas. La consecuente liberación de citoquinas vasogénicas, de factores de proliferación de músculo liso que intentan aislar la placa de colesterol, y una reducción de la producción de óxido nítrico endotelial que disminuye la distensibilidad arterial, favorecen la rigidez arterial progresiva. Inicialmente el remodelado arterial evita una disminución del calibre de la luz, pero la fibrosis y calcificación terminan produciendo una pérdida progresiva del calibre que llega a producir clínicamente los síndromes coronarios crónicos. La rotura aguda de las placas de colesterol motivada por mecanismos inflamatorios agudos o mecánicos expone el interior de la placa de ateroma, formando un trombo y dando lugar a los síndromes coronarios agudos por trombosis del vaso.
En la EII, además del estado inflamatorio sistémico, la alteración del microbioma y el uso habitual de corticoides, que generan resistencia a la insulina, HTA y dislipemia, favorecen la progresión de la valvulopatía81. La alteración del microbioma y, en especial, la disminución de bacterias del filo Firmicutes, parece tener consecuencias proinflamatorias82 ya que reduce la producción de butirato lo cual favorece la obesidad, la resistencia a la insulina y la dislipemia83. Generalmente, los niveles de LDL en los pacientes con EII son más bajos que en los pacientes control, pero también los de HDL, presentando además un aumento de los niveles de triglicéridos84. Se cree que esta alteración en las proporciones lipídicas puede tener importancia en la relación epidemiológica entre ambas enfermedades. Por último, se crea un estado de hipercoagulabilidad85, y85 ya hemos comentado que existe disfunción endotelial que empeora por la pérdida de la función de barrera intestinal con liberación de citoquinas inflamatorias a la sangre (interleuquina (IL)-6, IL-1, interferón-γ y TNF-α) y aumento de lipopolisacáridos86.
La relación fisiopatológica entre la EII y la aterosclerosis se resume en la figura 1.
El riesgo cardiovascular está determinado por la presencia de factores de riesgo que pueden ser modificables y no modificables. Dentro de los primeros están los factores de riesgo mayores (HTA, dislipemia, DM y tabaquismo) y los secundarios (fig. 2).
La evaluación de estos factores de riesgo debe hacerse rutinariamente para valorar el riesgo de eventos cardiovasculares y establecer las medidas pertinentes de prevención primaria o secundaria en los pacientes con determinadas enfermedades o factores de riesgo basales (mayores de 40 años, DM, hipercolesterolemia, etc.)87.
Las calculadoras de riesgo cardiovascular son una herramienta para poder dar un valor objetivo al riesgo cardiovascular de un paciente y ayudar al clínico a tomar una decisión terapéutica, que debe estar guiada por principios de riesgo/beneficio y eficiencia. Las calculadoras de riesgo no pretenden sustituir la capacidad integradora del clínico a la hora de tomar estas decisiones. Además, existen múltiples calculadoras que pueden ser más o menos apropiadas para la evaluación del riesgo en diferentes pacientes88. Dicho esto, las principales guías internacionales de riesgo cardiovascular reconocen el papel aterogénico de las enfermedades inflamatorias crónicas89–92, si bien no se mencionan recomendaciones específicas para los pacientes con EII. Todas ellas coinciden en el efecto modificador de las enfermedades inflamatorias crónicas por su papel fisiopatológico y, en muchas de ellas, por la toxicidad de los fármacos requeridos para su tratamiento, que puede tener un efecto deletéreo cardiovascular propio. Además, en las guías estadounidenses para el control del riesgo cardiovascular, se especifica que la ausencia de otras evidencias de enfermedad aterosclerótica, como la presencia del calcio coronario, no deben reclasificar a la baja el riesgo cardiovascular del paciente con enfermedades inflamatorias, reconociendo la posibilidad de ateromatosis no calcificada y el riesgo procoagulante añadido en estas enfermedades89.
Además, la edad, la presencia de FRCV mayores, como la DM, o el origen étnico del paciente, pueden hacer que utilicemos preferentemente una calculadora u otra. Para facilitar a los clínicos este proceso, algunas herramientas digitales como U-prevent (https://u-prevent.com/) contienen diferentes calculadoras y ayudan al clínico a elegir la más apropiada.
De forma general, la recomendación de las guías europeas para el manejo del riesgo cardiovascular es que, en cualquier paciente por encima de 40 años sin ECV ni comorbilidades (DM, enfermedad renal crónica, hipercolesterolemia familiar o LDL>190mg/dl), se realice una estimación del riesgo cardiovascular mediante la calculadora SCORE275 utilizando las tablas ajustadas al riesgo de la población de origen (España, con población europea de bajo riesgo, pertenece al grupo con incidencia de mortalidad cardiovascular inferior a 150 por cada 100.000 habitantes), y establecer las medidas de prevención correspondientes75. Además, en nuestro medio se ha utilizado la calculadora de riesgo QRISK393, mostrando una buena correlación con el SCORE para calcular el riesgo cardiovascular en los pacientes con EII, siendo incluso más específica para estos pacientes, en los que la escala SCORE infraestima el riesgo a 10 años, posiblemente por no tener en cuenta factores específicos con alta prevalencia en esta población (como el uso de corticoides o la enfermedad mental).
Es conocido que las calculadoras universales de riesgo cardiovascular (como SCORE) pueden infraestimar el riesgo de ECV en los pacientes con EII46, pero no conocemos cómo ajustar estas calculadoras para este grupo de pacientes. En los pacientes muy jóvenes (<40 años), no hay evidencia para iniciar medidas de prevención de riesgo cardiovascular, aunque padezcan una EII como factor de riesgo aislado.
Recomendación
- -
Teniendo en cuenta la experiencia de uso, la validación en población europea de bajo riesgo (incluyendo población española) y su fácil acceso, creemos recomendable utilizar la escala SCORE2 para los pacientes con EII a partir de los 40 años como herramienta para valorar el riesgo cardiovascular y su control evolutivo.
Es importante demostrar la existencia de enfermedad aterosclerótica en estadios subclínicos para poder establecer estrategias más o menos intensivas de prevención de eventos cardiovasculares. En las últimas décadas, las técnicas de imagen y la utilización de biomarcadores más específicos asociados a eventos cardiovasculares permiten modular el riesgo clásico que se establece según las calculadoras de riesgo habituales (ver apartado: ¿Cómo podemos medir el riesgo cardiovascular en los pacientes con EII? Calculadoras de riesgo). Sin embargo, en términos de prevención primaria principalmente, hay que tener en cuenta que muchas de estas técnicas son costosas y tienen riesgo para el paciente, como son las pruebas con radiación. Por tanto, la mayoría de las guías de prevención de riesgo cardiovascular no indican su realización de forma habitual.
Una de las pruebas más sencillas para el diagnóstico de la enfermedad arterial periférica subclínica es el índice tobillo/brazo. Se obtiene realizando el cociente entre la PA media tomada en las extremidades superiores y la tomada en las extremidades inferiores. Valores por debajo de 0,9 evidencian una caída desproporcionada de la PA en las extremidades inferiores, y son diagnósticos de enfermedad arterial periférica. En los pacientes asintomáticos, este resultado debe interpretarse como un modificador de riesgo y podría agravar el cálculo estimado por las calculadoras de riesgo. Esta prueba es sencilla y poco costosa, pudiéndose realizar con un manómetro, por lo que debe realizarse en cualquier paciente con clínica de claudicación o, de forma rutinaria, en la evaluación del riesgo cardiovascular para el despistaje de enfermedad arterial periférica.
Las pruebas de imagen (tabla suplementaria 3) complementan la evaluación del riesgo cardiovascular, si bien, su utilización rutinaria no está recomendada por la ausencia de coste/eficiencia en cribado poblacional y la falta de estandarización metodológica75,94. El diagnóstico incidental de estenosis, aneurismas, úlceras o disecciones arteriales a cualquier nivel mediante pruebas de imagen (aunque no se hubieran realizado con dicha finalidad) conlleva el diagnóstico de enfermedad arterial aterosclerótica, por lo que deberían iniciarse medidas de prevención secundaria. El cálculo del calcio coronario, el grosor de la íntima medido mediante ecografía en carótidas, la velocidad sistólica pico en carótidas y la presencia de placas ateroscleróticas a nivel carotídeo o femoral, son modificadores de riesgo. De todos ellos, el cálculo del calcio coronario es el más sólidamente asociado al riesgo cardiovascular y permite la mejor capacidad de reclasificación del riesgo, comparable a la presencia de placas de ateroma carotídeo y femoral y muy superior a la medición de la íntima carotídea95. Se ha descrito que en los pacientes con EII el empleo de la ecografía para valorar la existencia de placas carotídeas permite reclasificar a un 21% de los pacientes como de alto riesgo cardiovascular96.
En la tabla suplementaria 3, se resumen las principales características, ventajas e inconvenientes de las pruebas de imagen más habitualmente empleadas en la evaluación del riesgo cardiovascular.
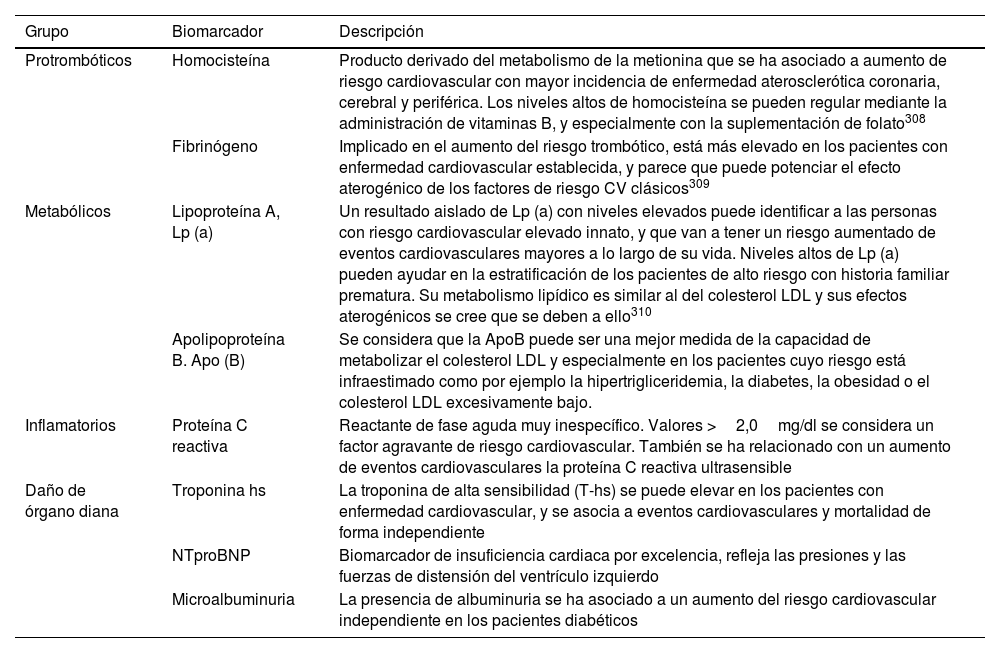
En cuanto a la determinación de biomarcadores, en general no está recomendado su uso de forma rutinaria en la evaluación del riesgo cardiovascular. Se han descrito múltiples moléculas presentes en la sangre cuya alteración se asocia a mayor incidencia de eventos cardiovasculares; los principales se describen en la tabla 4.
Biomarcadores asociados a mayor riesgo cardiovascular
| Grupo | Biomarcador | Descripción |
|---|---|---|
| Protrombóticos | Homocisteína | Producto derivado del metabolismo de la metionina que se ha asociado a aumento de riesgo cardiovascular con mayor incidencia de enfermedad aterosclerótica coronaria, cerebral y periférica. Los niveles altos de homocisteína se pueden regular mediante la administración de vitaminas B, y especialmente con la suplementación de folato308 |
| Fibrinógeno | Implicado en el aumento del riesgo trombótico, está más elevado en los pacientes con enfermedad cardiovascular establecida, y parece que puede potenciar el efecto aterogénico de los factores de riesgo CV clásicos309 | |
| Metabólicos | Lipoproteína A, Lp (a) | Un resultado aislado de Lp (a) con niveles elevados puede identificar a las personas con riesgo cardiovascular elevado innato, y que van a tener un riesgo aumentado de eventos cardiovasculares mayores a lo largo de su vida. Niveles altos de Lp (a) pueden ayudar en la estratificación de los pacientes de alto riesgo con historia familiar prematura. Su metabolismo lipídico es similar al del colesterol LDL y sus efectos aterogénicos se cree que se deben a ello310 |
| Apolipoproteína B. Apo (B) | Se considera que la ApoB puede ser una mejor medida de la capacidad de metabolizar el colesterol LDL y especialmente en los pacientes cuyo riesgo está infraestimado como por ejemplo la hipertrigliceridemia, la diabetes, la obesidad o el colesterol LDL excesivamente bajo. | |
| Inflamatorios | Proteína C reactiva | Reactante de fase aguda muy inespecífico. Valores >2,0mg/dl se considera un factor agravante de riesgo cardiovascular. También se ha relacionado con un aumento de eventos cardiovasculares la proteína C reactiva ultrasensible |
| Daño de órgano diana | Troponina hs | La troponina de alta sensibilidad (T-hs) se puede elevar en los pacientes con enfermedad cardiovascular, y se asocia a eventos cardiovasculares y mortalidad de forma independiente |
| NTproBNP | Biomarcador de insuficiencia cardiaca por excelencia, refleja las presiones y las fuerzas de distensión del ventrículo izquierdo | |
| Microalbuminuria | La presencia de albuminuria se ha asociado a un aumento del riesgo cardiovascular independiente en los pacientes diabéticos |
Respecto a la disfunción endotelial, hemos comentado que se trata de la primera alteración de la enfermedad aterosclerótica y hay pruebas de la relación de estas alteraciones con la aparición de eventos cardiovasculares en estudios retrospectivos de los pacientes con diferentes enfermedades inflamatorias97. Hasta hace pocos años su estudio requería exploraciones invasivas o mediante medicina nuclear para conocer el flujo coronario basal y tras vasodilatación, como indicador del estado de la microcirculación y de la función endotelial. Los avances tecnológicos están permitiendo la medición no invasiva mediante TC. En cualquier caso, la evaluación de la función endotelial no se indica en la valoración del riesgo cardiovascular. Actualmente, la especificidad, el coste y los riesgos asociados a estas pruebas hace que estén restringidas a un uso clínico con intención diagnóstica y terapéutica de problemas de isquemia miocárdica98. En un reciente metaanálisis se ha descrito que los pacientes con EII presentan una mayor disfunción endotelial y rigidez arterial, lo cual abre la puerta a investigaciones futuras que justifiquen su valor diagnóstico para prevenir eventos cardiovasculares y complementar la estratificación del riesgo cardiovascular en los pacientes con EII con estas técnicas64.
Recomendación
- -
La utilización rutinaria de pruebas de imagen, biomarcadores o pruebas funcionales coronarias en la evaluación del riesgo cardiovascular en los pacientes con EII no está recomendada.
- -
Algunos hallazgos incidentales de enfermedad aterosclerótica subclínica pueden utilizarse para reclasificar el riesgo cardiovascular global del paciente, en especial, el calcio coronario.
En apartados anteriores hemos visto que el riesgo cardiovascular está aumentado en la EII, al igual que ocurre en otros procesos inflamatorios de base inmune como la psoriasis, la AR o el lupus eritematoso sistémico99. Parece bien establecido que un proceso inflamatorio crónico acelera la arteriosclerosis y aumenta el número de eventos cardiovasculares, tanto venosos como arteriales100, siendo este aumento de riesgo mucho más llamativo en los pacientes de menos de 50 años37,99. Globalmente, el riesgo cardiovascular va a depender del paciente, de la actividad de la enfermedad y del tratamiento instaurado101.
Desde el punto de vista del paciente no está suficientemente aclarado si los FRCV son más prevalentes en los pacientes con EII, puesto que los datos son discordantes. Se ha encontrado una prevalencia menor102, similar24,103 o mayor48, especialmente en los pacientes menores de 65 años con respecto a la población general. Sin embargo, a pesar de que la frecuencia de factores de riesgo fuera mayor, seguiría sin explicarse el aumento en casi 2 veces del riesgo de eventos cardiovasculares.
Dado que un proceso inflamatorio crónico aumenta la probabilidad de padecer un evento cardiovascular, de forma lógica se ha intentado evaluar en varios ensayos clínicos si los fármacos con potencial para controlar un proceso inflamatorio reducen el riesgo de nuevos episodios cardiovasculares. El primer estudio con resultados positivos fue el CANTOS104 que compara el efecto de canakinumab, un inhibidor de la IL-1β, frente a placebo en los pacientes con IAM y PCR de alta sensibilidad elevada (>2mg/l). Sin embargo, un ensayo posterior con metotrexato (MTX) no encontró una reducción de nuevos eventos cardiovasculares105. Por lo tanto, no todos los fármacos con acción anti-inflamatoria reducen el riesgo cardiovascular. En este sentido parece fundamental el efecto sobre la IL-1β e IL-6. Así, los estudios favorables con dosis bajas de colchicina (COLCOT y LoDoCo2)106,107 han llevado a la aprobación por parte de la FDA de la colchicina a dosis de 0,5mg/día para reducir eventos cardiovasculares en pacientes con enfermedad cardiovascular establecida.
Por otro lado, el escenario tratado en estos ensayos clínicos es claramente diferente del que presentan los pacientes con EII, puesto que incluyen pacientes con eventos cardiovasculares donde la carga inflamatoria es claramente menor que la observada en los pacientes con EII. Debido a lo anterior, los datos no son extrapolables, aunque esos estudios ponen de manifiesto que el control de la actividad inflamatoria puede reducir el riesgo cardiovascular.
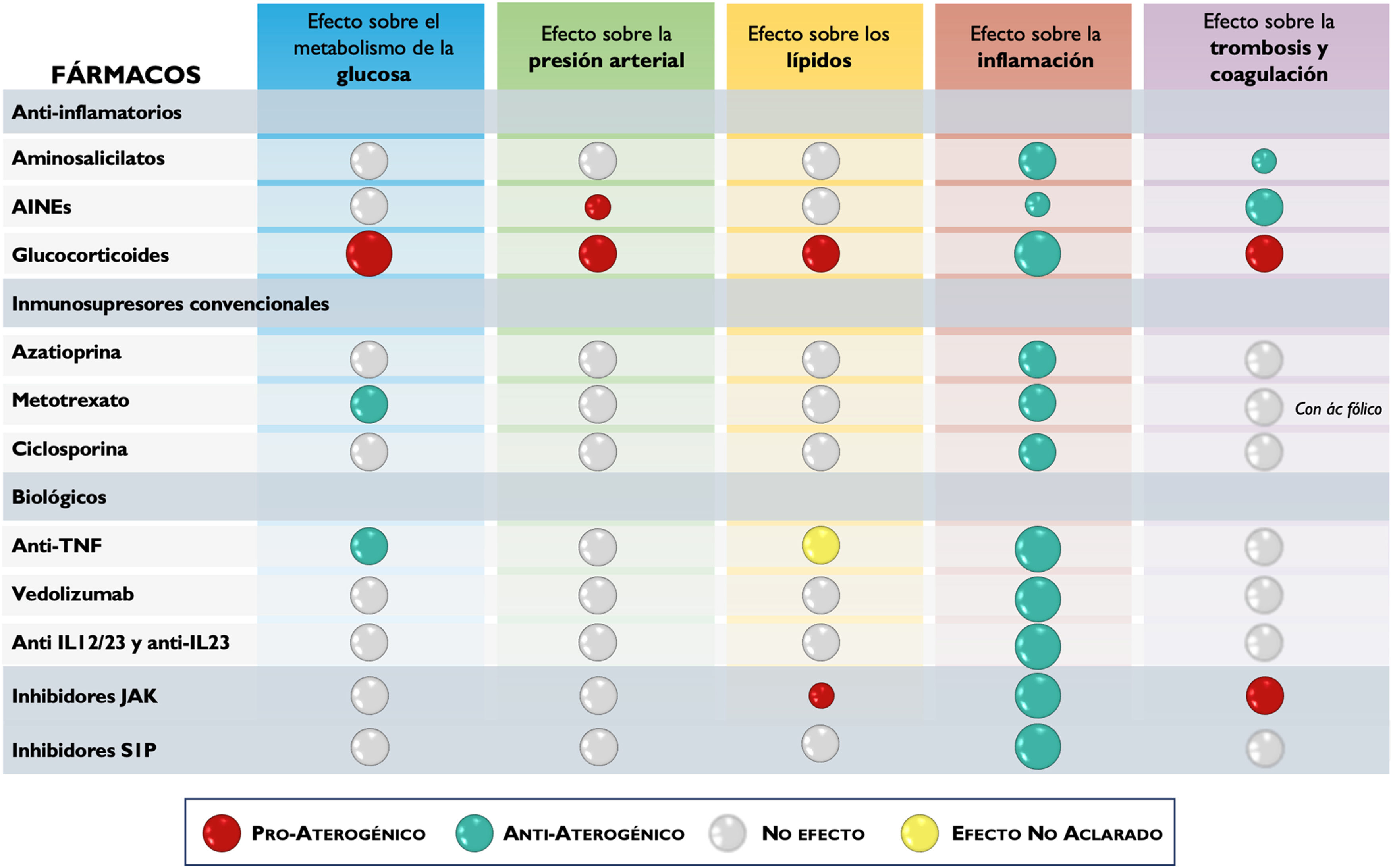
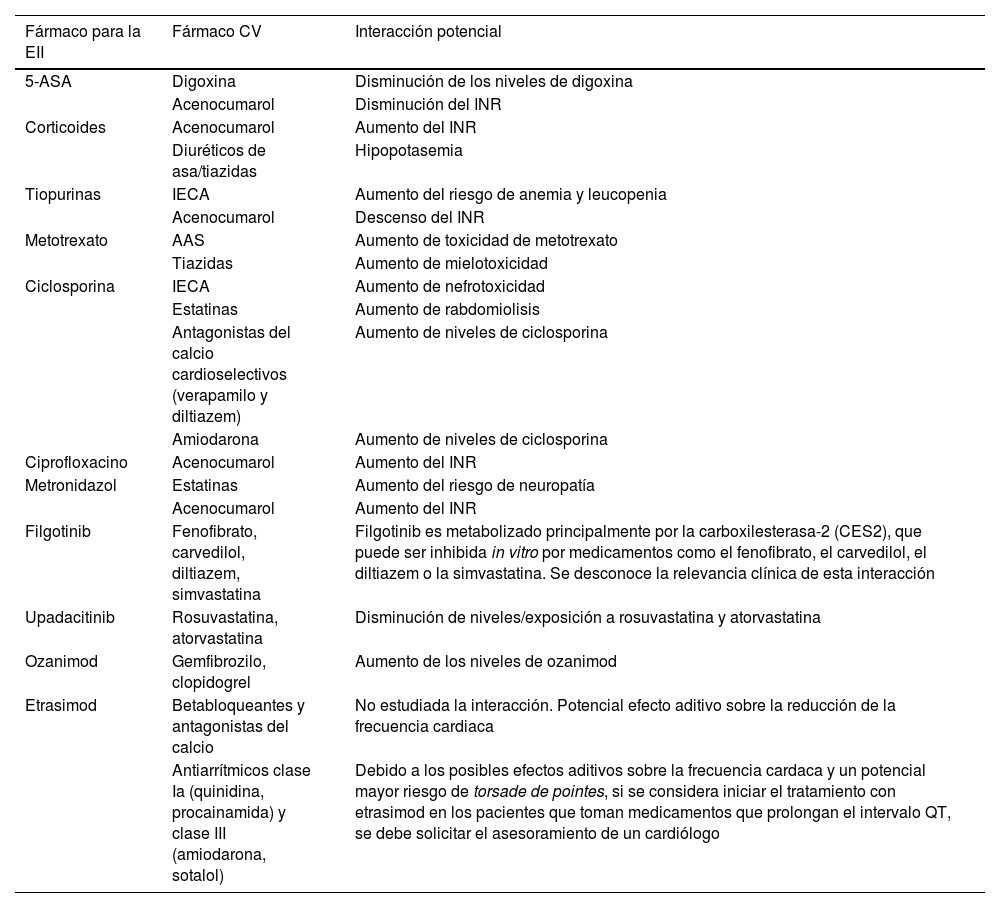
El efecto neto global de un fármaco empleado para el tratamiento de la EII sobre el riesgo cardiovascular dependerá, además de su efecto sobre la carga inflamatoria, de los posibles efectos que pueda tener sobre los FRCV clásicos, como la HTA, la DM o la dislipemia o de sus posibles acciones sobre la coagulación o la trombosis101 (tabla 5). Repasaremos en este punto los datos disponibles de los distintos tratamientos empleados para el manejo de la EII con respecto del riesgo cardiovascular. Es importante destacar que a la hora de generar pruebas sobre este efecto existen una serie de limitaciones que conviene subrayar. En primer lugar, los estudios deben incluir un gran número de pacientes, ya que los eventos cardiovasculares son poco frecuentes en la población con EII, lo que obliga en muchas ocasiones a recurrir a registros que permiten el acceso a la información de un gran número de pacientes aunque, con frecuencia, dicha información no sea lo suficientemente completa. Por otro lado, en este tipo de estudios es especialmente importante ajustar el riesgo basal de las poblaciones que se comparan (con un determinado fármaco o sin él) y esto no siempre se hace en las publicaciones existentes, sobre todo en lo referente a la actividad de la propia EII, generalmente por falta de información en las bases de datos.
Desde un punto de vista teórico, es difícil predecir el efecto de estos fármacos sobre el riesgo cardiovascular. Si bien tienen una acción antiagregante potencialmente beneficiosa (al menos la sulfasalazina [SFS]), podrían tener un efecto neutro sobre la función endotelial108 o bien podrían aumentar la rigidez arterial109. Además, la SFS podría aumentar los niveles de colesterol total y LDL, al menos asociada a prednisona, hidroxicloroquina (HCQ) y MTX110. A pesar de estos posibles efectos desfavorables sobre el riesgo cardiovascular, se ha observado en un estudio casos/control, que la SFS podría reducir el riesgo cardiovascular en los pacientes con AR y sin exposición previa a HCQ, MTX o SFS111.
En los pacientes con EII existen 2 estudios casos/control basados en registros nacionales. En el estudio danés70, que incluyó a 28.833 pacientes con 1.175 episodios de CI, el grupo tratado con aminosalicilatos tuvo una incidencia menor respecto de los no tratados. El estudio del Reino Unido112 tampoco encuentra un aumento del riesgo CV.
CorticoidesEs bien conocido que los corticoides aumentan el riesgo cardiovascular al aumentar la probabilidad de presentar algún factor de riesgo conocido, y eso a pesar de que controlen adecuadamente la actividad inflamatoria de la enfermedad basal del paciente.
En primer lugar, aumentan el riesgo de producir HTA en porcentajes que varían del 17 al 73% de los pacientes tratados con distintas enfermedades113,114, y este efecto se observa con dosis superiores a 7,5mg/día sin que haya una clara relación dosis/efecto a partir de esa dosis113. También es conocido el riesgo de hiperglucemia y DM con estos fármacos, que se puede observar hasta en un 32,3 y un 18,6%, respectivamente115 (tabla 6).
Factores predisponentes para la aparición de hiperglucemia o diabetes con el tratamiento esteroideo
| - Sexo masculino- Edad avanzada- Historia familiar de diabetes- Fumador activo- HTA- Obesidad- Intolerancia a la glucosa, DM tipo I o II preexistente- Diabetes gestacional previa- Historia de hiperglucemia previa por corticoides- Valores previos más elevados de Hb A1c y glucemia posprandial |
DM: diabetes mellitus; HbA1c: hemoglobina glicada; HTA: hipertensión arterial.
Otros efectos que contribuyen a aumentar el riesgo cardiovascular de estos fármacos son el aumento de peso, la retención de sodio con la aparición subsiguiente de edemas o la hiperlipidemia116,117. La lipodistrofia que provocan va más allá de un cambio estético, ya que se asocia a HTA, hiperglucemia e hiperlipidemia118,119, de modo que cuando estos cambios ocurren, debemos investigar y tratar estos factores de riesgo.
Los corticoides también inducen un estado de hipercoagulabilidad (aumento de niveles de fibrinógeno y descenso del tPA)120, por lo que es de esperar un aumento del riesgo de TEV. De hecho, es bien conocido este riesgo tanto de forma global121,122 como en las distintas enfermedades en las que se emplean estos fármacos123–129. En la EII existe un metaanálisis publicado que incluye 8 estudios observacionales con cerca de 60.000 pacientes con EII y 3.260 episodios tromboembólicos que encuentra un riesgo aumentado (OR: 2,2) con la exposición a corticoides frente a los pacientes no expuestos a estos fármacos130. Estudios en situaciones concretas, como los pacientes ingresados131 o posquirúrgicos132 muestran unos resultados similares. La crítica más importante a estos estudios es la falta de ajuste por gravedad de la enfermedad, pudiendo ser la exposición a corticoides un marcador de gravedad y, por tanto, de mayor riesgo de TEV133. Sin embargo, cuando se comparan con los anti-TNF, que también podrían asociarse a una mayor gravedad, estos últimos reducen hasta en 5 veces el riesgo de TEV (OR: 0,267; 0,16-0,67; p<0,005)130,134,135. Existe además una clara relación entre la dosis y el mayor riesgo de TEV, de forma que con dosis de prednisona superiores a 30mg/día se incrementa en 10 veces136, mientras que con dosis bajas (<5mg/día) el riesgo es claramente inferior, aunque persiste aumentado. El riesgo es mayor al inicio del tratamiento, y se reduce posteriormente, aunque permanece discretamente aumentado incluso tiempo después de su suspensión114,136.
La edad es un factor importante a tener en cuenta, ya que no solo la probabilidad de responder a este tratamiento es menor en los pacientes de mayor edad, sino que además el riesgo de TEV es claramente mayor (7,2 vs. 0,5%) como se observa en un estudio retrospectivo multicéntrico que incluye a los pacientes con CU137.
Con respecto a las trombosis arteriales se ha observado un aumento del riesgo con el empleo de estos fármacos en las enfermedades inmunomediadas (IMID)138; sin embargo, no en todos los estudios se observa este hecho139 y, de nuevo, en la mayoría de los casos no se ajusta por gravedad de la enfermedad. En esta dirección, en un estudio prospectivo en AR el mayor riesgo de eventos cardiovasculares con la exposición a corticoides desaparece tras ajustar por la actividad de la enfermedad140. Los grandes estudios retrospectivos basados en registros141,142 que incluyen a pacientes con EII, muestran que el riesgo de ECV aumenta con la exposición a corticoides, de forma que el riesgo es el doble con la dosis de 5mg/día de prednisona con respecto a los pacientes no expuestos, y se multiplica por 6 si la dosis es mayor de 25mg/día. De nuevo, no hay una dosis que no confiera riesgo con estos fármacos.
Con respecto a los estudios que solo incluyen a los pacientes con EII destacaremos 2; el primero71 encuentra, tras ajustar por los FRCV, una tasa aumentada de IAM e insuficiencia cardiaca en los pacientes con tratamiento esteroideo con respecto a los controles. El segundo estudio143 es una cohorte retrospectiva donde observan un aumento de mortalidad en los pacientes con EC y exposición prolongada a corticoides (>3.000mg de prednisona o >600mg de budesónida) frente a anti-TNF, así como unas tasas de ECV mayores en los pacientes con EC, no así en los pacientes con CU.
En cualquier caso, y a falta de estudios en EII con un diseño óptimo, los consensos publicados sobre enfermedad cardiovascular e IMID59 aconsejan evitar el tratamiento prolongado con estos fármacos, intentando retirarlos en cuanto sea posible y reevaluando de forma constante las razones para que el paciente los siga recibiendo.
Recomendaciones
- -
Los corticoides aumentan el riesgo de trombosis venosa, incluso a dosis bajas, por lo que se recomienda vigilar la aparición de esta complicación durante el tratamiento e incluso en los 2-3 meses después de su retirada.
- -
Los corticoides promueven tanto la aparición de factores de riesgo CV como de enfermedad CV por lo que se recomienda sopesar su empleo en los pacientes con ECV. Si son imprescindibles, se aconseja retirarlos en cuanto sea posible y evitar un empleo prolongado.
Existen datos experimentales en modelos murinos de arteriosclerosis para pensar que estos fármacos puedan tener un papel protector144. Sin embargo, no existen muchos estudios clínicos que demuestren su posible papel protector sobre la ECV. En el estudio del Registro Nacional de Pacientes danés, que compara un gran volumen de pacientes con EII frente a controles, la tasa de CI tiende a ser inferior con tiopurinas, aunque no alcanza la significación estadística70. Sin embargo, un análisis más reciente del mismo registro danés, que incluía el periodo desde 2005 hasta 2018, sí encontró que las tiopurinas tenían un efecto protector sobre los eventos arteriales en general, y sobre la aparición de CI o enfermedad cerebrovascular en particular145. Por el contrario, en un estudio nacional francés, que incluye a 177.827 pacientes con EII en los que compara el riesgo de eventos arteriales en los pacientes expuestos y no expuestos, la azatioprina no tenía un efecto protector146. Sin embargo, en un estudio reciente basado en la misma base de datos francesa147, las tiopurinas se asocian con una reducción del riesgo de recurrencia de eventos arteriales en los pacientes con EII (HR: 0,76; IC 95%: 0,66-0,88), por lo que en los pacientes de mayor riesgo sí podrían tener un efecto protector.
MetotrexatoLas pruebas sobre el efecto de este fármaco sobre el riesgo cardiovascular en los pacientes con EII son limitadas y los datos provienen en su práctica totalidad de otras IMID, fundamentalmente la AR y la psoriasis. En primer lugar, este fármaco tiene potenciales efectos beneficiosos sobre los FRCV clásicos, ya que puede reducir la PA148. Por otro lado, tiene un efecto beneficioso sobre el perfil lipídico, con un aumento de la función del colesterol HDL, reducción de la formación de células espumosas y disminución de lipoproteínas aterogénicas149,150. También podría reducir el riesgo de DM tipo II hasta en un 19%151, y en los pacientes con DM tipo II establecida, podría reducir la hemoglobina glicada (HbA1c)150.
Por otro lado, es bien conocido que el MTX interfiere con el metabolismo del ácido fólico, determinando la aparición de hiperhomocisteinemia que aumenta tanto el riesgo de ECVAS como de ETEV. Sin embargo, lo habitual en la práctica clínica es utilizar este fármaco asociado al ácido fólico, de forma que su empleo conjunto disminuye las concentraciones de homocisteína149, con lo que se evitaría este efecto perjudicial sobre el riesgo cardiovascular.
Donde más se ha estudiado el efecto neto del MTX sobre el riesgo cardiovascular en la práctica clínica es en la AR, existiendo en dicha enfermedad varios metaanálisis publicados. En el último de ellos152, que incluye 10 estudios con un total de 195.416 pacientes, se concluye que el MTX reduce el riesgo de ECV en un 20% (RR: 0,798; IC 95%: 0,726-0,876; p=0,001; I2=27,9%). Este efecto se ha corroborado en un estudio prospectivo reciente153 donde se ajusta por la actividad de la enfermedad, siendo las dosis altas (>15mg/semana) más beneficiosas. También ha demostrado reducir la mortalidad por ECV en AR de forma significativa154. La asociación del MTX con fármacos biológicos no está claro que aumente el efecto protector, dado que hay estudios con resultados discordantes153,155.
CiclosporinaEl uso de ciclosporina puede inducir desde las fases iniciales la aparición de HTA156, hecho que debemos tener en cuenta cuando se paute este tratamiento en los pacientes con CU grave, ya que casi todos los pacientes estarán tratados de forma concomitante con corticoides, que también pueden producir este mismo efecto, como hemos comentado anteriormente. No existe información específica sobre el riesgo cardiovascular asociado al empleo de la ciclosporina a largo plazo en los pacientes con EII. Sí se sabe que el uso prolongado de la misma en diferentes grupos de enfermedades se relaciona con la aparición de hipertrofia y fibrosis cardiaca, hiperlipidemia y un incremento del riesgo de aterosclerosis157.
Recomendación
- -
En los pacientes con riesgos CV en los que se valore iniciar ciclosporina se recomienda valorar antes otras opciones de tratamiento ya que el uso de ciclosporina se asocia con un aumento de riesgo de HTA desde las fases iniciales de su uso, y el tratamiento a largo plazo se relaciona con hiperlipidemia y un aumento de riesgo de aterosclerosis.
La información de los efectos del tacrolimus sobre los factores de riesgo cardiovascular proviene en su mayoría de los estudios realizados en los pacientes trasplantados, no disponiendo tampoco de datos específicos en el subgrupo de pacientes con EII158. Extrapolando de los estudios en el escenario del paciente trasplantado, se conoce que el tacrolimus puede producir efectos similares a la ciclosporina (ambos son inhibidores de la calcineurina) favoreciendo la aparición de HTA, aunque en menor medida que la ciclosporina159, y produciendo hiperlipidemia, aspectos a tener en cuenta cuando se paute este tratamiento.
Recomendación
- -
En los pacientes con riesgos CV en los que se valore iniciar tacrolimus se recomienda tener en cuenta otras opciones de tratamiento ya que el tacrolimus se asocia con un aumento de riesgo de HTA desde las fases iniciales de su empleo (aunque algo menor que la ciclosporina), y su uso a largo plazo también se relaciona con hiperlipidemia y un aumento de riesgo de aterosclerosis.
El efecto de los anti-TNF sobre el riesgo cardiovascular depende fundamentalmente de su capacidad para controlar la actividad inflamatoria, puesto que su influencia sobre los FRCV tradicionales es escasa, o incluso negativa, como ahora describiremos.
Con respecto al metabolismo hidrocarbonado, los fármacos anti-TNF disminuyen, en líneas generales la resistencia a la insulina160–162, la HbA1c160 y mejoran la función de las células beta. Por un lado, el TNF-α aumenta la resistencia a la insulina, así como la actividad inflamatoria de la propia enfermedad162; por tanto, es lógico pensar que el empleo de fármacos con efecto anti-TNF tenga un efecto beneficioso. Además, hay casos publicados tanto de DM tipo 1 como tipo 2 con un mejor control de la DM tras el empleo de estos fármacos163, aparte de haberse descrito el efecto beneficioso del golimumab en la DM tipo 1 de reciente comienzo164.
Se han relacionado estos fármacos con un aumento del peso corporal165–169, aunque es difícil saber si se debe a un control de la actividad inflamatoria y una mejoría del estado nutricional, o bien a un efecto propio directo. El estudio más relevante a este respecto es el de Winter et al.170 que incluye 851 pacientes de 4 bases de datos danesas de pacientes que inician un tratamiento anti-TNF. Menos del 10% de los pacientes consiguen una ganancia ponderal mayor del 10% con respecto al basal, que ocurre fundamentalmente en aquellos pacientes con bajo peso al inicio del estudio. Además, es probable que esto mismo suceda sea cual sea el fármaco biológico empleado si se consigue el control de la actividad inflamatoria de la enfermedad de base171.
Por último, se ha relacionado a los anti-TNF con cambios en el perfil lipídico. Existe también un metaanálisis reciente en la EII que describe el efecto de varios grupos de fármacos usados para el manejo de esta enfermedad sobre el metabolismo lipídico116. En dicho trabajo encuentran que los corticoides y el tofacitinib producen una elevación significativa de los niveles de colesterol, no así los anti-TNF. Otros estudios han encontrado elevaciones inferiores al 10% del colesterol total, HDL y triglicéridos171, por lo que la influencia real que podría tener sobre el riesgo cardiovascular parece limitada.
Los anti-TNF podrían también mejorar los marcadores de arteriosclerosis y de riesgo de futuros eventos cardiovasculares; ejemplos de esto son la disfunción endotelial172 o la rigidez arterial173, aunque los resultados sobre su influencia en el grosor de la íntima carotídea son contradictorios174–178.
Con respecto a los eventos tromboembólicos venosos, los anti-TNF restablecen las alteraciones de la coagulación predisponentes en mayor medida que otros fármacos como el vedolizumab o los tiopurínicos179. En esta misma dirección apunta un metaanálisis de 8 estudios observacionales que encuentra que los anti-TNF reducen el riesgo de TEV casi 5 veces (OR: 0,267; IC 95%: 0,106-0,674; p=0,005)130. Aunque quizás, el estudio más relevante, tanto por el número de pacientes incluidos (5.173 pacientes con EII que inician anti-TNF frente a 16.498 controles) como por el ajuste inicial de las variables incluidas, sea el de Desai et al.180, a pesar de su diseño retrospectivo. La variable de interés es la hospitalización por TEV, excluyendo por tanto los episodios manejados de forma ambulatoria. Los anti-TNF no resultan ser un factor protector, aunque la tendencia es clara (HR: 0,78; IC 95%: 0,6-1,02). Sin embargo, en los pacientes con EC (HR: 0,62; IC 95%: 0,44-0,86) o en los menores de 45 años (HR: 0,55; IC 95%: 0,34-0,87), los anti-TNF sí reducen el riesgo de TEV. En este sentido, en un metanálisis reciente en el que se comparan con los corticoides se demuestra un riesgo 3 veces menor de TEV (PMID: 37952112).
En la EII hay menos datos que en otras IMID sobre la reducción del riesgo de eventos arteriales (CI, arteriopatía periférica o ictus isquémico) asociada al empleo de los anti-TNF. El primer estudio destacable es el de Lewis et al.143, que compara en 2 bases de datos americanas la mortalidad y la ECV en los pacientes con exposición prolongada a corticoides con respecto del empleo de anti-TNF. Se observó una reducción de la mortalidad (OR: 0,78; 0,65-0,93) y de los ECV (OR: 0,68; 0,55-0,85) solo en los pacientes con EC, probablemente porque el número de pacientes con CU era claramente inferior. El estudio más destacado es el realizado por Kirchgesner et al.146, que analiza la base de datos de la sanidad francesa que incluye a 177.827 pacientes con EII comparando los pacientes expuestos con no expuestos. Encuentran una reducción del riesgo de eventos arteriales con anti-TNF del 21% (HR: 0,79; IC 95%: 0,4-0,72). Un estudio posterior147 basado en la misma base de datos, aunque en un periodo de tiempo diferente, analiza el riesgo de recurrencia de eventos arteriales en los pacientes que ya han tenido un episodio previo. En este caso, tanto los anti-TNF (HR: 0,75; IC 95%: 0,63-0,9) como las tiopurinas (HR: 0,76; IC 95%: 0,66-0,88) se asocian a un menor riesgo de recurrencia. Hay varios metaanálisis de otras enfermedades IMID con resultados similares; de todos ellos cabe destacar el de Fumery et al.181 porque incluye, aparte de los pacientes con espondiloartropatías, psoriasis, artritis psoriásica y AR, a los pacientes con EII. La reducción del riesgo de eventos arteriales asociada a los biológicos es del 30% de forma global (OR: 0,7; 0,59-0,82); este porcentaje se mantiene solo si se consideran los estudios ajustados por la gravedad de la enfermedad. Es importante destacar 2 aspectos de los estudios en enfermedades reumáticas; en primer lugar, que el beneficio se observa en los pacientes que responden a los anti-TNF182,183 y en segundo lugar, que a mayor duración de la exposición mayor es la reducción del riesgo184. Sin embargo, un metaanálisis en red reciente con 40 estudios (7 de ellos en pacientes con EII), la mayoría ensayos clínicos, encuentra una asociación entre ECV y los fármacos anti-TNF (OR: 2,49; 1,14-5,62) similar a los inhibidores de JAK y los anti-IL12/23185. Se trata de una asociación, no analizándose en el estudio los resultados por riesgo CV o actividad de la EII.
Por último, es muy importante recordar que el uso de anti-TNF se ha relacionado con la exacerbación de insuficiencia cardiaca, por lo que están desaconsejados en los pacientes con insuficiencia cardiaca y clase funcional NYHA III-IV186.
Recomendaciones
- -
Existen resultados contradictorios sobre el riesgo CV de los fármacos anti-TNF, no obstante, si son necesarios para el tratamiento de la EII, recomendamos su utilización independientemente del riesgo CV basal o la presencia de ECV previas.
- -
Los fármacos anti-TNF se han relacionado con un empeoramiento de la insuficiencia cardiaca por lo que está contraindicado su empleo en los pacientes con clase funcional NYHA III-IV.
Hay pocos datos sobre los posibles efectos del vedolizumab en el riesgo cardiovascular. En el análisis de la base de datos Truven MarketScan (publicado solamente en forma de resumen)187, que incluye a 597 pacientes con EC tratados con vedolizumab y 16.055 con anti-TNF, se encuentra un aumento significativo de los eventos cardiovasculares (IRR: 2,06; 1,37-3,09) con el vedolizumab187. Asimismo, encuentran un riesgo aumentado de embolismo pulmonar (IRR: 3,01; 1,11-8,18) y de trombosis venosa profunda (IRR: 2,67; 1,32-5,41) en los pacientes tratados con vedolizumab. No obstante, hay que destacar que no se realiza un ajuste de las poblaciones estudiadas, en las que existen marcadas diferencias, como el mayor empleo de corticoides en el grupo de vedolizumab (78,8 vs. 48,9%) siendo conocido el aumento del riesgo de trombosis venosa que se asocia al empleo de los corticoides. En la base de datos de la Administración de Alimentos y Medicamentos de los EE. UU. (Food and Drug Administration [FDA]) de notificaciones de efectos adversos, no se encuentra ninguna alerta de una posible asociación con trombosis venosas en los pacientes que reciben tratamiento con vedolizumab. Sin embargo, sí se encuentra una alerta de posible asociación con ictus con respecto a la encontrada con anti-TNF, aunque es solo una señal de dicha potencial asociación (que sirve de base para hacer estudios observacionales a largo plazo), ya que se basa en notificaciones voluntarias188. En las revisiones de seguridad del fármaco no se ha encontrado un aumento de eventos cardiovasculares189,190. Por todo lo anterior, no hay datos sólidos que apoyen que este fármaco se asocie con un aumento del riesgo cardiovascular.
UstekinumabDesde un punto de vista teórico, el bloqueo de la IL-12 en animales de experimentación conlleva una disminución de la aterogénesis y una mayor estabilización de la placa de ateroma191. El eje IL-23/IL-17 tiene efectos contrapuestos; por un lado bloquea diferentes mediadores implicados en el proceso de aterogénesis (IL-6, GM-CSF y varias quimioquinas) y por otro activa la producción de colágeno tipo I por las células musculares, contribuyendo a la estabilización de la placa192. Sabemos que la IL-23 y la IL-22 tienen un papel relevante para evitar la expansión de la microbiota proaterogénica; de hecho, ciertos modelos murinos deficientes en IL-23 muestran una arteriosclerosis acelerada que se puede bloquear con la supresión de la microbiota193. Los estudios con medición de la íntima carotídea o de la rigidez arterial no aclaran tampoco estos efectos contrapuestos debido a que los resultados no son uniformes194,195. Sin embargo, existen datos que apoyan su potencial antiaterogénico, como un pequeño ensayo clínico con 43 pacientes en el que se observa una reducción de la inflamación vascular de la aorta con PET/TC196 en los pacientes tratados con ustekinumab frente a los que reciben placebo. También se ha publicado un estudio con coronariografía no invasiva por TC antes y después del tratamiento con varios biológicos en los pacientes con psoriasis, en donde se observa una reducción de las placas de ateroma similar a la obtenida con los anti-TNF y significativamente inferior a la que se observa con anti-IL-17197.
Los datos clínicos de la influencia de estos fármacos en el riesgo cardiovascular derivan fundamentalmente de pacientes dermatológicos, que es donde más evidencia acumulada existe. El primer metaanálisis publicado, que incluía los datos del briakinumab (anticuerpo monoclonal frente a IL-12 e IL-23), fármaco finalmente no aprobado, no encontraba más riesgo de ECV en los pacientes tratados con fármacos anti-IL-12/23 que con anti-TNF198 o con placebo. Sin embargo, un metaanálisis posterior199 sí encuentra un mayor riesgo de ECV con estos fármacos (OR: 4,23; IC 95%: 1,07-16,7) con respecto al placebo. No obstante, este estudio ha recibido muchas críticas200 por cuestiones metodológicas, tales como el método de análisis empleado (Peto odds ratio), el escaso número de ECV (solo 10 casos), el seguimiento corto y la ausencia de ajuste por pérdidas. Todo lo anterior limita de forma importante el valor que se puede dar a dicho metaanálisis. Posteriormente, otro metaanálisis publicado más recientemente, no observa un aumento de esta complicación con fármacos anti-TNF, anti-IL-17 o con ustekinumab. No debemos olvidar que los ensayos clínicos están diseñados fundamentalmente para evaluar la eficacia, de forma que los efectos adversos poco frecuentes pueden no ser detectados; por no hablar de que los ECV se asocian a ciertas características (como la edad o la comorbilidad) que constituyen en muchas ocasiones un criterio de exclusión para los ensayos clínicos. Por este motivo, los registros (sobre todo los prospectivos) tienen más posibilidades de encontrar una asociación. En este sentido, el registro prospectivo PSOLAR, que es el que incluye a mayor número de pacientes (12.093 pacientes; 40.388 pacientes/año), no encuentra una asociación entre las ECV y el uso de ustekinumab201,202, al igual que los registros norteamericano203, alemán204, danés205 o británico-irlandés206.
Por otro lado, hay que destacar otro estudio reciente207, que también ha suscitado controversia, en el que se intenta evaluar si el tratamiento con ustekinumab tendría el efecto comentado anteriormente de desestabilizar la placa de ateroma, de forma que pudiera inducir ECV precozmente en los pacientes de alto riesgo. El estudio incluye a 9.290 pacientes expuestos al fármaco (1.110 con EC) de la base de datos del sistema nacional de salud francés, de los cuales 179 sufren un ECV grave que precisa ingreso (ictus o síndrome coronario agudo). Los autores analizan si existe una asociación entre la introducción del ustekinumab y el ECV y encuentran un aumento de riesgo solo en los pacientes de alto riesgo cardiovascular (OR: 4,17; IC 95%: 1,19-14,59) y no entre los que tienen bajo riesgo. La principal limitación del estudio, aparte de lo arbitrario de los límites temporales, es la falta de ajuste para elementos de confusión; de ellos, los más importantes son la toma de medicación concomitante (como, por ejemplo, los corticoides) o la presencia de actividad de la enfermedad (más probables ambos en el momento de iniciar el tratamiento con el fármaco), que aumentan per se el riesgo cardiovascular y podrían ser los desencadenantes del ECV, que podría no estar directamente relacionada con el fármaco191. Por último, comentar el metaanálisis en red reciente que incluye 40 estudios controlados (36 aleatorizados) con diferentes fármacos en enfermedades IMID, donde los inhibidores IL-12/23 se asocian a un riesgo aumentado de ECV de forma similar a los anti-TNF o inhibidores de JAK185. No obstante, y de acuerdo con la conclusión del estudio, la elección del fármaco en la EII debe ir dirigido más por las características de la enfermedad que por el riesgo cardiovascular, dado que un control adecuado de la enfermedad de base es el principal factor determinante de una ECV precoz o acelerada208.
Recomendación
- -
Los inhibidores de la IL-12/23 se han asociado con un aumento de riesgo CV en un metaanálisis en red de ensayos clínicos, pero no en series o registros de práctica real. No obstante, recomendamos su empleo cuando sean necesarios por las características de la EII independientemente del riesgo CV basal.
La influencia de tofacitinib en los FRCV se centra en la elevación que produce de los niveles de lípidos séricos116,117,209, fundamentalmente con la dosis de 10mg/12h, y que afecta tanto al colesterol total como al HDL y LDL, con lo que la relación LDL/HDL no se modifica. Las elevaciones son discretas (p, ej., 16mg/dl de media de elevación de la cifra de colesterol-LDL durante la fase de mantenimiento del tratamiento), y responden bien al tratamiento con estatinas210.
A nivel experimental, tanto en modelos murinos211 como en células endoteliales humanas212, tiene un efecto antiaterogénico, al inhibir varios de los mediadores implicados en este proceso, por lo que no se conoce bien el mecanismo por el que aumenta el riesgo cardiovascular en los pacientes de riesgo.
Comenzando con el riesgo de TEV, es obligado comentar el estudio ORAL Surveillance, que motivó las alertas de la FDA y la Agencia Europea del Medicamento (European Medicines Agency [EMA]). Este estudio se inicia en el año 2014 e incluye pacientes mayores de 50 años con AR moderada/grave, fracaso a MTX y, al menos, un factor de riesgo cardiovascular. Los pacientes se aleatorizan a 3 grupos: tofacitinib 5mg/12h, tofacitinib 10mg/12h o un anti-TNF, incluyéndose más de 1.400 pacientes en cada brazo del ensayo. En febrero de 2019 se realizó un análisis intermedio en el que encuentran diferencias en mortalidad (HR: 3,28; IC 95%: 1,55-6,95) y en embolias pulmonares (HR: 5,96; IC 95%: 1,75-20,33) entre el grupo de pacientes tratados con la dosis de tofacitinib 10mg/12h y los tratados con anti-TNF; estas diferencias solo se observaron en los pacientes con factores de riesgo de TEV47. No obstante, aunque el RR pueda parecer alto, las tasas de incidencia son bajas. Así, para la dosis de 5 y 10mg/12h y anti-TNF, la incidencia de embolismo pulmonar y TVP fueron de 0,27, 0,5 y 0,09 pacientes/año y de 0,3, 0,38 y 0,18 pacientes/año, respectivamente. Los principales factores de riesgo de TVE encontrados en este estudio para todos los grupos de tratamiento fueron: historia de TVE previo (HR: 7; 2,46-20,2), uso de corticoides concomitantes (HR: 3), anticonceptivos orales (HR: 3,56), antidepresivos (HR: 2,94), HTA (HR: 2,57), sexo masculino (HR: 2,18), IMC≥30kg/m2 (HR: 2,97) y edad≥65 años (HR: 2)213.
Sin embargo, estos datos no se corroboran en los metaanálisis214,215 publicados que incluyen los ensayos clínicos en las diferentes IMID. Es verdad que el tiempo de seguimiento es limitado y la población con FRCV está infrarepresentada.
En cuanto a las series y registros de práctica clínica, no se han encontrado diferencias entre los pacientes tratados con tofacitinib y los grupos control —habitualmente tratados con anti-TNF— tanto en los pacientes con enfermedades reumatológicas como en los pacientes con CU216,217. En el programa de ensayos clínicos en los pacientes con CU, solo se encontraron 5 casos de embolismo pulmonar y uno de TVP en la fase abierta de extensión218, lo que supone una incidencia de 0,28 (0,09-0,65) y 0,06 (0,00-0,31), respectivamente. Todos los pacientes salvo uno tenían factores predisponentes.
Con el resto de los inhibidores de JAK ensayados en la EII no se ha encontrado un aumento de TEV con respecto a los controles, al igual que ocurre con tofacitinib, siendo las tasas de incidencia similares entre ellos219. Desconocemos si la mayor selectividad de estos nuevos inhibidores JAK les otorga un menor riesgo de TEV, aunque existen notificaciones para los inhibidores de JAK selectivos en la base de datos de farmacovigilancia de la FDA que aconsejan investigar este aspecto220,221. En este sentido, la EMA ha realizado un análisis exhaustivo de la posible extrapolación de los resultados del ORAL Surveillance a otras indicaciones distintas de la AR, a otras poblaciones de pacientes tratadas con este tipo de fármacos y a otros inhibidores de JAK. El resumen de un documento muy completo de revisión realizado por la EMA222 es que parece que el aumento del riesgo de ETEV y eventos mayores cardiovasculares observados en dicho estudio es un efecto de clase, no existiendo suficientes datos objetivos que permitan limitar solo al tofacitinib los efectos secundarios cardiovasculares observados en el ORAL Surveillance. Por otro lado, los resultados preliminares de un estudio observacional (B023) con otro inhibidor de JAK (baricitinib) sugieren también un aumento del riesgo de eventos mayores cardiovasculares y ETEV en los pacientes con AR tratados con baricitinib en comparación con aquellos tratados con anti-TNF223. Por lo tanto, los datos observados en el ORAL Surveillance (y los preliminares del estudio B023) sobre el riesgo de ETEV se han generalizado por parte de la EMA para todos los fármacos inhibidores de JAK. La utilización de anticoagulación parece eficaz en prevenir los episodios de ETEV en los pacientes tratados con inhibidores de JAK224. No está establecido cuando se deben emplear, aunque probablemente sea razonable utilizar la anticoagulación en caso de asociación de varios factores de riesgo.
Con respecto al riesgo de eventos arteriales, volvemos a revisar el estudio ORAL Surveillance225 que, con un diseño de no inferioridad, establece el límite superior del intervalo de confianza de la HR en menos de 1,8, para considerar una frecuencia de efectos adversos equivalente al anti-TNF. En el caso concreto de las ECV, este límite es superado con lo que se considera que son más frecuentes en los grupos tratados con tofacitinib con respecto a los anti-TNF (OR: 1,33; IC 95%: 0,91-1,94). La incidencia de ECV para los grupos de 5 y 10mg/12h y anti-TNF es de 0,91, 1,05 y 0,79 por cada 100 pacientes/año, respectivamente. Expresado en número de pacientes que es necesario tratar al año para que aparezca una ECV la cifra sería de 567 para la dosis de 5mg/12h y de 319 para la de 10mg/12h225. En subanálisis publicados posteriormente se han intentado identificar los factores que permitan detectar a las subpoblaciones de este estudio con un mayor riesgo de ECV con tofacitinib respecto a los anti-TNF226,227. El factor más determinante es que el paciente haya tenido un episodio previo de ECV. En este subgrupo de pacientes la incidencia de un nuevo episodio de ECV fue del 8,3 y 7,7% para las dosis de 5 y 10mg/12h de tofacitinib respectivamente, frente a una incidencia del 4,2% con anti-TNF (HR: 1,94; IC 95%: 0,95-4,14). Sin embargo, en los pacientes sin episodios de ECV previos, la incidencia de nuevos episodios fue muy similar en los 3 grupos (2,4, 2,8 y 2,3%, respectivamente)226. Es verdad que se trata de un subanálisis y que la potencia estadística podría no ser suficiente para detectar diferencias entre los pacientes sin episodios de ECV previos, pero en todo caso el riesgo sería muy bajo. Otro subanálisis del estudio ORAL Surveillance analiza el peso de los diferentes factores de riesgo y concluye que la edad ≥65 años y el tabaquismo (actual o pasado) son los que confieren, de forma independiente, un mayor riesgo. Así, cuando uno de estos 2 factores está presente, el riesgo de ECV, TVE, neoplasias y mortalidad está aumentado. Sin embargo, en los pacientes sin ninguno de estos 2 factores la incidencia de ECV y TVE es similar a la encontrada con anti-TNF227. Un aspecto que suscita polémica es la poca precisión de la definición de exfumador. En este estudio, la mayoría de los pacientes con historia de tabaquismo había fumado durante más de 10 años (96,2 y 98,4% en los grupos de tofacitinib y anti-TNF, respectivamente) siendo el riesgo de ECV similar al de fumadores activos, a pesar de que más del 60% de ellos había dejado de fumar durante un periodo superior a 10 años. Por último, hay que destacar que el grado de control de la enfermedad podría ser determinante en el riesgo CV, ya que en un nuevo subanálisis del ORAL Surveillance no se encontraban diferencias de ECV en los pacientes con enfermedad totalmente controlada entre grupos, no así en los que el control era parcial208.
De nuevo, los metaanálisis publicados214,228, los estudios observacionales en CU229, la revisión de los pacientes en el programa de CU218,230,231, y los estudios observacionales a partir de registros tanto en enfermedades IMID217,232–235 como en CU236–239, no encuentran una incidencia superior de ECV en los pacientes tratados con tofacitinib con respecto a otros tratamientos. El estudio STAT-RA es interesante porque reproduce los hallazgos del ORAL Surveillance, y de alguna manera puede explicar esta aparente discordancia. Este estudio recoge 12.852 pacientes con AR tratados con tofacitinib de 3 bases de datos americanas, y los compara con los tratados con anti-TNF con un ajuste adecuado de poblaciones (propensity score). No encuentran diferencias en ECV (HR: 1,01; 0,83-1,23) entre ambos grupos, aunque seleccionando a los pacientes con los criterios de inclusión del ORAL Surveillance sí existe una tendencia no significativa en el grupo de pacientes tratados con tofacitinib (HR: 1,33; 0,91-1,94).
En los pacientes con CU el riesgo CV basal es en general bajo, así en el programa OCTAVE un 80% de los pacientes tenía bajo riesgo de ECV. En contraste este porcentaje es claramente más bajo en los ensayos en AR (21% en el ORAL Surveillance y 54% en los ensayos clínicos iniciales)240 o en la artritis psoriásica (63%)241. Esto podría explicar, en parte, el que no se encuentre un aumento de ECV o de TEV en los estudios en EII. En esta patología también se ha intentado identificar a los pacientes de mayor riesgo de ECV bajo tratamiento con JAK. La edad ≥65 años es claramente un factor de riesgo de ECV en un subanálisis de los ensayos en CU con tofacitinib242 cuando comparamos con la población de menor edad, aunque esto probablemente suceda con cualquier otro fármaco, reflejo de una mayor incidencia general en este subgrupo de población. Además, el RR no es muy alto (IR: 1,06; 0,13-3,61) por lo que no tiene un gran poder discriminante. Otra aproximación más interesante es la que realizan Schreiber et al.231 calculado el riesgo CV basal de los pacientes incluidos en los estudios OCTAVE mediante el Atherosclerotic Cardiovascular Disease (ASCVD) y poniéndolo en relación con los eventos encontrados. Los pacientes con un riesgo CV alto (>20% a 10 años) o intermedio (≥7,5% y <20%) tienen más ECV (IR: 1,81; 0,05-10,07; IR: 1,54; 0,42-3,95, respectivamente) que los que no tienen riesgo basal o es límite, donde el número de eventos es mínimo (2/901). Por tanto, el cálculo del riesgo basal podría tener utilidad para identificar a los pacientes con mayor riesgo de ECV, también con estos fármacos. Los datos con los 2 nuevos JAK con indicación en EII, filgotinib y upadacitinib, son similares. A falta de un ensayo similar al ORAL Surveillance, no se ha encontrado una incidencia mayor de ECV entre los pacientes con IMID tratados con estos fármacos respecto de los diferentes comparadores, ya sea placebo, anti-TNF o MTX243–246. En los correspondientes programas en EII tampoco se ha encontrado una incidencia mayor de ECV247–249. A pesar de todos estos datos, el metaanálisis en red reciente que hemos comentado anteriormente y que incluye los ensayos clínicos de varias indicaciones IMID sí encuentra un riesgo CV aumentado (OR: 2,64; 1,26-5,99) aunque sin diferencias con anti-TNF o IL-12/23185.
Sin embargo, la EMA ha restringido (desde el punto de vista cardiovascular) el empleo de los inhibidores de JAK a situaciones en las que no haya alternativas adecuadas en los pacientes de 65 años o más, los pacientes con riesgo aumentado de problemas graves cardiovasculares (como IAM o ictus), los pacientes con historia de enfermedad aterosclerótica y fumadores activos o exfumadores importantes de largo tiempo de evolución. También deben usarse con precaución en aquellos pacientes que tengan otros factores de riesgo, distintos de los arriba descritos, para presentar ETEV223.
Nos parece que puede ser de utilidad en la práctica clínica, la realización de un listado de comprobación basal de FRCV y de posibles limitaciones del uso de estos fármacos en los pacientes con EII, que se puede actualizar periódicamente, y que nos dará, sin duda, mayor seguridad a la hora de emplear este tipo de fármacos.
Adjuntamos un ejemplo de listado de comprobación (fig. 3) que nos ayuda a identificar de forma sencilla, rápida y fiable aquellos pacientes en los que se puede emplear este tipo de fármacos con seguridad.
Recomendaciones
- -
Los inhibidores de JAK aumentan el riesgo CV en los pacientes mayores de 65 años con factores de riesgo CV, particularmente si existen episodios de ECV previos o tabaquismo, tanto actual como pasado si ha sido de larga duración (10 años o más). Por tanto, se recomienda evitar en estos pacientes si hay otras alternativas terapéuticas.
- -
Asimismo, se recomienda no utilizarlos en caso de presencia de factores de riesgo de tromboembolismo venoso a menos que no existan otras alternativas. Con los datos actuales no se pueden establecer diferencias de riesgo entre los diferentes inhibidores de JAK.
Listado de comprobación sobre riesgo cardiovascular y enfermedad tromboembólica venosa en los pacientes con EII de cara a valorar el uso de fármacos inhibidores de JAK (modificado de las recomendaciones de la EMA y de las guías de manejo de la enfermedad tromboembólica)7,223,225.
El primer representante de este grupo de fármacos fue el fingolimod que producía como efecto adverso cardiovascular alteraciones en la conducción cardiaca. La frecuencia de bradicardia sintomática en los ensayos clínicos de esclerosis múltiple era del 0,6% para la dosis más baja y del 2,1% para la dosis alta250. El bloqueo AV de segundo grado aparecía en un 1% de los pacientes. Estas alteraciones, en la mayoría de los casos no conllevaron la retirada del fármaco.
Existen 5 receptores de S1P, con distribución variable en los diferentes tejidos, en concreto en el corazón se expresan S1PR1, S1PR2 Y S1PR3. De esta forma, un inhibidor más selectivo (fingolimod no lo es) podría relacionarse con una menor tasa de efectos adversos en general y cardiovasculares en particular33. El ozanimod es un inhibidor selectivo de los receptores S1PR1 y S1PR5, aprobado por la EMA para el tratamiento de la CU. La frecuencia de trastornos de la conducción parece inferior a la encontrada con fingolimod. Así, en el metaanálisis de los ensayos en esclerosis múltiple, el ozanimod no se relaciona con la aparición de bradicardia, aunque sí con la de HTA251 a pesar de lo cual no se asocia a un riesgo de ECV aumentado. En el ensayo fase III, con 1012 pacientes incluidos, solo 5 presentaron bradicardia durante el periodo de inducción y no se observó ningún caso de bloqueos de 2.° o 3er grado252. En este mismo estudio hubo únicamente 2 casos de crisis hipertensivas que no obligaron a retirar el tratamiento. En el ensayo fase II en la EC la disminución de la frecuencia cardiaca era muy discreta (0,7lpm) y transitoria, volviendo a la frecuencia cardiaca basal a las 6h253. Recientemente se ha publicado el estudio de extensión de la fase III en CU con un seguimiento de 3 años254 donde se recoge un único caso de bradicardia al inicio del tratamiento (0,2/100 pacientes/año), un caso tardío de bloqueo AV completo en principio no relacionado con el fármaco y un 12,2% de pacientes con HTA (3,9/100 pacientes/año).
El etrasimod es un modulador de los receptores S1P1, S1P5 y S1P5 con 2 ensayos fase III en CU con 289 y 238 pacientes. En estos estudios 9 pacientes experimentaron bradicardia (7 asintomáticos) en los 2 primeros días de tratamiento y 3 bloqueo AV (2 de primer grado y uno de segundo) asintomáticos y que no requirieron tratamiento, también en el primer día del estudio255.
Cuando se inicia un tratamiento con estos fármacos, en concreto con ozanimod, se aconseja la monitorización de la PA semanalmente en los pacientes con HTA previa, de forma ideal por el propio paciente, y en cualquier caso a los 3 meses y luego cada 6 meses256. Con respecto a los trastornos de conducción, se aconseja la monitorización durante las primeras 6h tras administrar la dosis a los pacientes con frecuencia cardiaca basal inferior a 55lpm, antecedentes de IAM, ICC o bloqueo AV de segundo grado tipo Mobitz I (el tipo II y el bloqueo de tercer grado suponen una contraindicación para el tratamiento)256. En estos casos se realizará un ECG basal y a las 6h, así como una medición horaria de la PA y del pulso.
Anti-IL-23El papel de la IL-23 en los modelos experimentales de arteriosclerosis no está del todo aclarado, ya que existen datos discordantes. Es cierto que en un modelo murino se ha observado una aceleración de la placa arteriosclerótica en ratones deficientes para la subunidad p19; sin embargo, en la mayoría de los estudios no se ha observado ningún efecto de p19 en el tamaño o contenido de la misma191. Por otro lado, los niveles elevados de IL23 se han relacionado con una mortalidad mayor en los pacientes con arteriosclerosis carotídea257. En la práctica clínica estos fármacos tienen un perfil se seguridad excelente sin que se haya observado un aumento del riesgo de ECV ni en los estudios en EII258,259 ni en psoriasis260–262, donde la experiencia es mayor. En el metaanálisis en red ya comentado anteriormente, los anti-IL-23 no aumentaron el riesgo CV, al contrario de lo que sucedió con los anti-TNF, inhibidores de JAK o ustekinumab185.
¿Cómo puede influir la medicación que empleamos para el manejo de las enfermedades cardiovasculares sobre la enfermedad inflamatoria intestinal?La prevalencia de la EII en los pacientes mayores de 65 años está aumentando, suponiendo en la actualidad el 25-35% del total de pacientes con EII263. Este aumento de la prevalencia se debe, por un lado, al aumento de los nuevos diagnósticos en este tramo de edad (que actualmente suponen el 15-23% de los nuevos diagnósticos263,264) y, por otro, al envejecimiento de los pacientes con una enfermedad crónica con baja mortalidad como es la EII265. Por este motivo, cada vez veremos en nuestras consultas más pacientes mayores con EII, estimándose que en 2030 la prevalencia de EII en mayores de 65 años será superior a la prevalencia en el grupo de 15-65 años266.
Entre las peculiaridades del manejo de la EII en población mayor de 65 años destacan la necesidad de prestar especial atención a las comorbilidades, la fragilidad, el deterioro cognitivo y la polimedicación. En un estudio reciente se constató que los pacientes con EII mayores de 65 años tomaban una media de 9 fármacos, muchos de ellos utilizados para tratar ECV, de los cuales el 40% tenían potenciales interacciones con fármacos utilizados para tratar la EII267,268 (tabla 7).
Potenciales interacciones entre los fármacos utilizados en el manejo de los pacientes con enfermedades cardiovasculares y los fármacos utilizados para el tratamiento de la EII
| Fármaco para la EII | Fármaco CV | Interacción potencial |
|---|---|---|
| 5-ASA | Digoxina | Disminución de los niveles de digoxina |
| Acenocumarol | Disminución del INR | |
| Corticoides | Acenocumarol | Aumento del INR |
| Diuréticos de asa/tiazidas | Hipopotasemia | |
| Tiopurinas | IECA | Aumento del riesgo de anemia y leucopenia |
| Acenocumarol | Descenso del INR | |
| Metotrexato | AAS | Aumento de toxicidad de metotrexato |
| Tiazidas | Aumento de mielotoxicidad | |
| Ciclosporina | IECA | Aumento de nefrotoxicidad |
| Estatinas | Aumento de rabdomiolisis | |
| Antagonistas del calcio cardioselectivos (verapamilo y diltiazem) | Aumento de niveles de ciclosporina | |
| Amiodarona | Aumento de niveles de ciclosporina | |
| Ciprofloxacino | Acenocumarol | Aumento del INR |
| Metronidazol | Estatinas | Aumento del riesgo de neuropatía |
| Acenocumarol | Aumento del INR | |
| Filgotinib | Fenofibrato, carvedilol, diltiazem, simvastatina | Filgotinib es metabolizado principalmente por la carboxilesterasa-2 (CES2), que puede ser inhibida in vitro por medicamentos como el fenofibrato, el carvedilol, el diltiazem o la simvastatina. Se desconoce la relevancia clínica de esta interacción |
| Upadacitinib | Rosuvastatina, atorvastatina | Disminución de niveles/exposición a rosuvastatina y atorvastatina |
| Ozanimod | Gemfibrozilo, clopidogrel | Aumento de los niveles de ozanimod |
| Etrasimod | Betabloqueantes y antagonistas del calcio | No estudiada la interacción. Potencial efecto aditivo sobre la reducción de la frecuencia cardiaca |
| Antiarrítmicos clase Ia (quinidina, procainamida) y clase III (amiodarona, sotalol) | Debido a los posibles efectos aditivos sobre la frecuencia cardaca y un potencial mayor riesgo de torsade de pointes, si se considera iniciar el tratamiento con etrasimod en los pacientes que toman medicamentos que prolongan el intervalo QT, se debe solicitar el asesoramiento de un cardiólogo |
AAS: ácido acetilsalicílico; IECA: inhibidores del enzima convertidor de la angiotensina; INR: International Normalized Ratio; 5-ASA: ácido 5-aminosalicílico.
Fuente: modificado de Parian et al. y de las fichas técnicas de los fármacos268,311–314.
Además, aunque la evidencia es aún limitada, algunos fármacos utilizados habitualmente para el manejo de las ECV podrían interferir en el curso de la enfermedad, bien empeorando el pronóstico (por la posibilidad de desencadenar recaídas) o mejorándolo (por su efecto antiinflamatorio específico). A continuación, vamos a describir los efectos potenciales sobre la EII de algunos de los fármacos más comúnmente utilizados a nivel cardiovascular (tabla 8).
Efecto potencial en la EII de los fármacos más comúnmente utilizados para las enfermedades cardiovasculares
| Fármaco | Efecto sobre la EII (potencial) | Calidad de la evidencia |
|---|---|---|
| Ácido acetilsalicílico | Conflictivo | Moderada |
| Clopidogrel | Ninguno | Muy baja |
| Estatinas | Disminución de la incidenciaDisminución de las recaídasQuimioprofilaxis del CCR | Baja |
| Betabloqueantes | Aumento de las recaídas | Muy baja |
| IECA/ARA-II | Disminución de recaídas | Muy baja |
| Anticoagulantes orales | Mayor riesgo de sangrado gastrointestinalMenor riesgo de eventos tromboembólicos | Alta |
ARA: antagonistas del receptor de la angiotensina; CCR: cáncer colorrectal; EII: enfermedad inflamatoria intestinal; IECA: inhibidores de la enzima convertidora de angiotensina.
El ácido acetilsalicílico (AAS) se utiliza ampliamente para la prevención primaria y secundaria de las ECV. El AAS pertenece al grupo de los antiinflamatorios no esteroideos (AINE), cuyo uso frecuente se ha relacionado con un mayor riesgo de incidencia de EII269 y un mayor riesgo de exacerbaciones en la EC270. Aunque se desconocen los mecanismos subyacentes por los que los AINE podrían aumentar el riesgo de EII, se han propuesto la disminución de la producción de prostaglandinas, la acción tópica directa mediante la interacción con los fosfolípidos de membrana y los efectos sobre la actividad mitocondrial270,271.
Los datos sobre el posible aumento de la incidencia de la EII en los pacientes con uso regular de AAS son conflictivos. Un estudio de cohortes prospectivo con más de 135.000 pacientes sugiere un aumento de la incidencia de EC, pero no de CU272.
Sin embargo, otro estudio de cohortes con más de 75.000 participantes269 y un metaanálisis más reciente270 no han encontrado un mayor riesgo de incidencia o exacerbación de la EII con el uso diario de AAS. Estos datos sobre la seguridad del AAS parecen confirmarse en un pequeño estudio experimental de administración de AAS a pacientes con EII quiescente273 y en otro estudio retrospectivo reciente que incluía 764 pacientes con EII, de los cuales 174 estaban tomando AAS274. En modelos animales se ha demostrado que para producir colitis se precisa una inhibición tanto de la isoenzima COX-1 como de la COX-2275. En sujetos sanos el AAS a dosis bajas inhibe preferentemente la COX-1276, lo que podría explicar el diferente impacto del AAS a dosis bajas y otros AINE en la EII.
Apenas hay estudios que investiguen el efecto de otros fármacos antiplaquetarios como el clopidogrel sobre la EII. Un pequeño estudio restrospectivo no demostró empeoramiento de la EII en los pacientes con CI que recibieron tratamiento combinado con AAS y clopidogrel tras someterse a una coronariografía percutánea terapéutica277. De hecho, se ha postulado su posible efecto beneficioso por su doble efecto antiinflamatorio y antitrombótico, como sugieren algunos modelos animales, pero 2 ensayos clínicos realizados en CU con otro fármaco similar (ridogrel), no demostraron diferencias frente a placebo278,279.
¿Tienen las estatinas algún efecto sobre la enfermedad inflamatoria intestinal?Las estatinas son fármacos ampliamente utilizados en la prevención primaria y secundaria de las ECV. Además de su efecto hipolipemiante, han demostrado un efecto antiinflamatorio medido como disminución de la PCR280. Entre los mecanismos propuestos de este potencial efecto antiinflamatorio están la disminución de la permeabilidad intestinal, la inhibición de citoquinas proinflamatorias y la inhibición de la migración de leucocitos281. De hecho, en un estudio caso/control retrospectivo llevado a cabo en una base de datos administrativa, se observó una reducción en la incidencia de EII (tanto EC como CU) con una OR de 0,71 (IC 95%: 0,66-0,75) a los 2 años282. En un estudio similar realizado sobre un registro poblacional sueco, se observa también una disminución de la incidencia de EC (OR: 0,71; IC 95%: 0,63-0,79) con una tendencia no significativa hacia un efecto dosis/dependiente; sin embargo, no se demostró ninguna relación con la incidencia de CU283. Un metaanálisis de 5 estudios retrospectivos encuentra una disminución de la incidencia de EII considerada en su conjunto (HR: 0,81; IC 95%: 0,63-1,06; I2: 81,3%), sin demostrar una disminución de la incidencia de EC o CU consideradas de forma aislada284.
Respecto a la posible influencia de las estatinas sobre la actividad de la EII, la evidencia es escasa y conflictiva. Un estudio de cohortes retrospectivo utilizando una base de datos administrativa, encontró que las estatinas reducen un 18% el riesgo de recaída de la EII, utilizando como medida las prescripciones de corticoides285, aunque los resultados solo eran significativos con la atorvastatina y en los pacientes con CU. Sin embargo, 2 pequeños ensayos clínicos con menos de 40 pacientes con CU han arrojado resultados contradictorios entre sí.286. Por lo tanto, son necesarios ensayos clínicos para confirmar que el tratamiento adyuvante de la EII con estatinas tiene realmente un efecto antiinflamatorio específico.
Por otro lado, algunos estudios han sugerido un pequeño beneficio potencial del tratamiento con estatinas en la reducción del riesgo de cáncer, especialmente colorrectal (CCR)287. Este posible efecto preventivo de las estatinas sobre el riesgo de CCR también se ha sugerido en algunos estudios en pacientes con EII288–290. Inicialmente, se publicó un estudio caso/control de base poblacional289, que encontró que el tratamiento con estatinas durante 5 años disminuía el riesgo de CCR en los pacientes con EII (OR: 0,07; IC 95%: 0,01-0,78). Posteriormente, un estudio sobre una base prospectiva estadounidense de más de 11.000 pacientes con EII encontró una reducción modesta, aunque estadísticamente significativa, de la incidencia de CCR (2 vs. 3%; OR ajustada: 0,35; IC 95%: 0,24-0,53)288. Estos datos han sido recientemente confirmados en un análisis de una base de datos nacional sueca290, que incluyó más de 10.500 pacientes con EII, y que también ha encontrado una disminución del riesgo de CCR en los pacientes tratados con estatinas (aHR: 0,76; IC 95%: 0,61-0,96), efecto que aumentaba conforme aumentaba la duración del tratamiento con estatinas. Este estudio encontró además una disminución de la mortalidad por CCR (aHR: 0,56; IC 95%: 0,37-0,83) y una disminución de la mortalidad global (aHR: 0,63; IC 95%: 0,57-0,69) en los pacientes con EII tratados con estatinas. Aunque un pequeño estudio unicéntrico realizado en los pacientes con EII sometidos a colonoscopias de cribado no ha encontrado diferencias estadísticamente significativas en el riesgo de CCR291, un metaanálisis incluyendo este estudio incluye las estatinas como uno de los factores protectores de CCR en los pacientes con EII (OR: 0,39; IC 95%: 0,22-0,70), aunque le asigna un nivel de evidencia bajo292.
De esta manera, la evidencia disponible sugiere que las estatinas podrían tener un efecto quimiopreventivo de CCR en los pacientes con EII. El potencial efecto antiinflamatorio de las estatinas sobre la actividad de la EII requiere confirmación en ensayos clínicos bien diseñados.
Recomendaciones
- -
Es seguro administrar estatinas a pacientes con EII y deben utilizarse para la prevención primaria y secundaria de ECV según las mismas indicaciones que en la población general.
- -
El tratamiento a largo plazo con estatinas podría tener un efecto quimiopreventivo y disminuir la incidencia de CCR en los pacientes con EII.
La evidencia sobre el uso de antihipertensivos en los pacientes con EII es escasa, por lo que no está claro si alguna clase de antihipertensivos puede tener un beneficio sobre otra en relación con el riesgo cardiovascular o con la actividad de la propia enfermedad. Existen algunos estudios preclínicos in vitro o en modelos animales que sugieren el potencial efecto antiinflamatorio de algunos de estos fármacos, pero la escasa evidencia clínica existente proviene de estudios retrospectivos de baja calidad.
La activación de los receptores β-adrenérgicos ha demostrado tener un potente efecto antiinflamatorio a nivel intestinal293. En un pequeño estudio caso/control retrospectivo, se demostró que los pacientes tratados con betabloqueantes, tenían un mayor número de recaídas, medidas como cambios en la prescripción294. Dado el importante beneficio pronóstico de los betabloqueantes en los pacientes con ICC, es imprescindible la valoración conjunta con cardiología antes de plantear su retirada295.
Datos preclínicos sugieren que el sistema renina-angiotensina podría tener un papel en los mecanismos de inflamación y fibrosis a nivel intestinal. De hecho, la inhibición del sistema renina-angiotensina mediante inhibidores de la enzima convertidora de angiotensina 2 (IECA) o bloqueadores del receptor de la angiotensina 2 (ARA-II) disminuye la actividad inflamatoria en modelos animales de EII, por lo que se ha sugerido que estos fármacos podrían tener efectos beneficiosos en la EII, especialmente por su efecto antifibrótico296,297. Los resultados de 3 estudios retrospectivos sugieren un potencial efecto beneficioso en los pacientes tratados con IECA y/o ARA-II, analizando tanto índices de actividad y cifras de calprotectina fecal, como tasas de hospitalizaciones y cirugías o prescripción de corticoides y biológicos298–300.
Otro estudio retrospectivo realizado en los pacientes con EC, encuentra efectos opuestos en ambos grupos de fármacos, con un efecto beneficioso de los ARA-II (medido como necesidad de corticoides), y un efecto perjudicial de los IECA (medido como necesidad de cirugía)301.
Puesto que los IECA/ARA-II son los fármacos de primera línea recomendados en las guías de tratamiento de la HTA, parecen fármacos apropiados para el inicio de tratamiento farmacológico en los pacientes con EII302.
Recomendación
- -
No existe evidencia científica de calidad que permita recomendar un tratamiento antihipertensivo específico para los pacientes con EII, por lo que los IECA/ARA-II, que son los fármacos de primera línea recomendados para el tratamiento de la HTA en población general, serían también de elección en los pacientes con EII.
Las heparinas de bajo peso molecular (HBPM) y los anticoagulantes orales se utilizan para la profilaxis y el tratamiento de la ETEV. El riesgo de ETEV está aumentado en los pacientes con EII, especialmente en aquellos hospitalizados por un brote agudo10. Como contrapartida, han demostrado un mayor riesgo de hemorragia en la población general, incluyendo hemorragia gastrointestinal, aunque la evidencia en los pacientes con EII es escasa.
Las guías clínicas recomiendan la profilaxis de ETEV en los pacientes hospitalizados con EII15,16. La utilización de HBPM como profilaxis de ETEV en los pacientes con EII no parece aumentar el riesgo de sangrado, según los datos de un único estudio retrospectivo unicéntrico303.
En un estudio multicéntrico de cohortes retrospectivas de los pacientes con EII, se demostró una mayor incidencia de sangrado mayor no letal (IRR: 3,7; IC 95%: 1,5-9), más evidente en CU, en los pacientes tratados con heparina y anticoagulantes dicumarínicos, efecto contrarrestado por una menor incidencia de ETEV304. Dada la elevada tasa de recurrencia de la ETEV en los pacientes con EII, los autores concluyen que los beneficios de la anticoagulación superan los riesgos en estos pacientes.
Por otro lado, el riesgo de sangrado de los anticoagulantes orales en los pacientes con EII no parece ser mayor que en la población general. Así, en un subanálisis del registro multicéntrico español Registro Informatizado Enfermedad Trombo Embólica (RIETE) recientemente publicado, no se demostró un aumento de riesgo de sangrado mayor ni sangrado gastrointestinal en RIETE pacientes anticoagulados con EII, respecto de RIETE pacientes anticoagulados sin EII. Sí que se observó una tendencia no significativa a mayor riesgo de sangrado en la EII activa respecto de la inactiva305.
Los anticoagulantes orales de acción directa (ACOD) presentan algunas ventajas respecto a los antagonistas de la vitamina K, como son su rápido inicio y final de acción, los efectos anticoagulantes dosis/dependientes predecibles, menos interacciones y un efecto independiente de la ingesta de vitamina K. Algunos ensayos clínicos pivotales han encontrado un mayor riesgo de sangrado gastrointestinal en los pacientes tratados con ACOD respecto de los tratados con dicumarínicos, especialmente con rivaroxabán, un inhibidor selectivo y potente del factor Xa. Sin embargo, un metaanálisis reciente no confirmó este riesgo306.
No existen publicaciones específicas del riesgo de sangrado con los ACOD en los pacientes con EII. Solo existe una serie de 13 pacientes, publicada como carta al director, en la que se observaba una mayor disminución de los niveles de hemoglobina en los pacientes con EII tratados con ACOD respecto a los pacientes con EII antiagregados con AAS y los pacientes con ACOD sin EII307. Se necesitan estudios prospectivos que evalúen y comparen el riesgo de sangrado gastrointestinal en los pacientes con EII que precisan anticoagulación.
Recomendaciones
- -
La utilización de heparinas de bajo peso molecular como profilaxis de la ETEV en los pacientes con EII no ha demostrado aumentar el riesgo de sangrado.
- -
No se ha demostrado un mayor riesgo de sangrado en los pacientes anticoagulados con EII respecto a anticoagulados en la población general, aunque la evidencia respecto a los anticoagulantes de acción directa es insuficiente.
Las ECV constituyen la principal causa de muerte en los países occidentales, suponiendo un reto de primer orden el prevenirlas y detectarlas precozmente para poder adoptar medidas que ayuden a mitigar la morbimortalidad asociada con la misma. Los pacientes con EII tienen unas características especiales (actividad inflamatoria crónica mantenida, exposición a múltiples medicamentos -algunos con aumento claro de los factores de riesgo cardiovascular-, necesidad de ingresos hospitalarios e intervenciones quirúrgicas) que los hacen especialmente susceptibles a la aparición de este grupo de enfermedades. Debemos realizar un cribado exhaustivo de los factores de riesgo cardiovascular clásicos en nuestros pacientes con EII, así como utilizar calculadoras de riesgo cardiovascular que nos ayuden a detectar precozmente a los pacientes con mayor riesgo. De igual forma, deberemos utilizar el arsenal terapéutico disponible para el tratamiento de la EII de forma juiciosa, poniendo siempre en la balanza los beneficios esperables sobre la actividad inflamatoria de la enfermedad frente a los posibles riesgos cardiovasculares asociados con algunos de los tratamientos aprobados en la actualidad.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores han recibido financiación para investigación, formación, asistencia a reuniones científicas y asesorías de las siguientes compañías:
I. Marín-Jiménez: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Takeda, Janssen, Sandoz, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical, Lilly y Vifor Pharma.
D. Carpio: Abbvie, Dr Falk Pharma, Faes, Ferring, Johnson & Johnson, Lilly, MSD, Pfizer, Takeda y Tillots Pharma.
V. Hernández: MSD, AbbVie, Ferring, Dr. Falk Pharma, Tillotts Pharma, Pfizer, Takeda, Janssen, KernPharma Biologics, Adacyte, Sandoz, Biogen, Fresenius-Kabi, FAES Farma, Galapagos y Lilly.
F. Muñoz: Kern Pharma, Abbvie, Pfizer, Takeda, Janssen y Tillotts Pharma.
E. Zatarain-Nicolás: AstraZeneca, Roche, Novartis y Bayer.
Y. Zabana: AbbVie, Adacyte, Almirall, Amgen, FAES Pharma, Ferring, Janssen, Kern Pharma, Lilly, MSD, Otsuka, Pfizer, Sanofi, Shire Pharmaceuticals, Takeda, Galapagos, Boehringer Ingelheim y Tillots.
M. Mañosa: MSD, Abbvie, Kern, Takeda, Janssen, Pfizer, Ferring, Faes Farma, Dr. Falk Pharma, Lilly, Tillotts Pharma y Adacyte.
F. Rodríguez-Moranta: Janssen, MSD, AbbVie, Pfizer, Takeda, Lilly, Ferring, Faes Farma y Falk Pharma y Tillots Pharma.
M. Barreiro-de Acosta: MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen,Takeda, Janssen, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Gebro Pharma, Otsuka Pharmaceutical y Vifor Pharma.
A. Gutiérrez-Casbas: AbbVie, MSD, Kern, Ferring, FAES, Amgen, Roche, Sandoz, Janssen, Pfizer, Dr. Falk Pharma, Tillots y Galapagos.