La hiperinsulinemia se ha relacionado con riesgo cardiovascular, tanto de forma independiente como por facilitar la aparición de otros factores de riesgo cardiovascular. Además, por diferentes vías, se ha asociado con un incremento en el riesgo de cáncer. Ello hace prioritario identificar y tratar de forma precoz al paciente hiperinsulinémico, con el fin de retrasar o evitar el riesgo cardiovascular, así como el desarrollo de diabetes mellitus de tipo 2 (DM2) y algunos tipos de cáncer. Debemos plantear una nueva estrategia en el tratamiento de la hiperglucemia en estos pacientes, con el objetivo principal de reducir peso, para disminuir la insulinorresistencia y con ello, la hiperinsulinemia. Por este motivo, la prescripción de insulinosecretores e insulina debería utilizarse con precaución en estos pacientes.
Hyperinsulinemia has been associated with cardiovascular risk, both independently and by facilitating the development of other cardiovascular risk factors. It has also been associated by different routes with increased cancer risk. Thus, this makes it a priority to identify and treat the hyperinsulinemic patient early in order to delay or prevent cardiovascular risk and the development of type 2 diabetes mellitus (T2DM) and certain types of cancer. A new strategy is needed for the treatment of hyperglycemia in these patients, whose primary objective would be to achieve weight loss, reduce insulin resistance and thereby hyperinsulinemia. That is, prescribing insulin secretors and insulin should be used with caution in these patients.
Los individuos con insulinorresistencia (IR) suelen presentar hiperinsulinemia compensadora tras una ingesta rica en glúcidos, con relación al grado de IR que poseen1. La hipótesis de Neel (1962) hace referencia al gen ahorrador o gen hiperinsulinémico, que facilita la supervivencia en un medio adverso, con escasez alimentaria, gracias a una respuesta exagerada de insulina, principal hormona anabólica. Así, el organismo es capaz de ahorrar energía, incrementando masa grasa y muscular. Sin embargo, como decía Neel, ese mismo gen, ante la abundancia de alimento y una vida sedentaria, se convertiría en su asesino silente, promoviendo, mediante la hiperinsulinemia, la aparición y progresión de diferentes factores de riesgo cardiovascular y con ello, una muerte prematura. Su metabolismo anabólico, otrora virtud, sería causa de muerte cardiovascular en un entorno favorable. Además, el incremento ponderal progresivo incrementaría el grado de IR, con mayor respuesta hiperinsulinémica, cerrando el círculo2. La hiperinsulinemia se ha asociado a riesgo cardiovascular, dado que promueve los denominados factores tradicionales, como son obesidad, hipertensión arterial y dislipidemia, con LDL pequeñas y densas, particularmente aterogénicas, así como otros factores de riesgo menos conocidos: hipercoagulabilidad, disfunción endotelial, inflamación arterial, reducción de la luz arterial mediante el engrosamiento de la íntima y media, entre otros3,4. Es importante resaltar que un paciente con IR podrá desarrollar una diabetes mellitus tipo 2 (DM2) a lo largo de su vida, tanto por el incremento de su IR con relación al aumento de peso progresivo, que no podrá ser controlada adecuadamente a pesar de una respuesta hiperinsulinémica compensadora, como por un deterioro progresivo de la función beta pancreática, apareciendo, por todo ello, hiperglucemia5. Ello es particularmente evidente en el contexto de un estilo de vida no adecuado.
Por otro lado, la hiperinsulinemia induce un incremento en la síntesis hepática de insulin-like grow factor 1 (IGF-1), factor de crecimiento endotelial, responsible, entre otros, de la reducción de la luz arterial, pero también reconocido factor mitogénico de facilitación y crecimiento tumoral. En este sentido, son numerosos los estudios que relacionan hiperinsulinemia y diferentes tipos de cáncer (mama, colon, etc.)6.
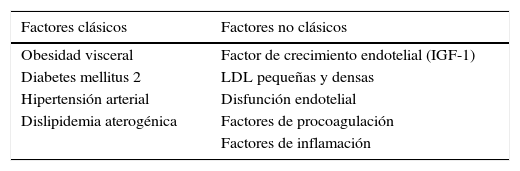
Hiperinsulinemia y riesgo cardiovascularLa hiperinsulinemia se asoció con aumento en la prevalencia de enfermedad coronaria y mortalidad cardiovascular, a partir de 3 grandes estudios prospectivos, poblacionales7–9. Estos hallazgos fueron corroborados posteriormente por otros autores10–13. Sin embargo, no todos los estudios han hallado esta relación de causalidad14–16. La principal diferencia metodológica entre ellos radica en el hecho de que, en estos últimos, se incluyó a pacientes de edad avanzada y el tiempo de seguimiento fue más corto, lo que podría explicar en parte, estos resultados contradictorios17. Todo ello ha suscitado un cierto debate sobre si el riesgo es promovido de forma independiente por la hiperinsulinemia, o si esta favorece la aparición de otros factores de riesgo reconocidos, tanto clásicos, como no clásicos (tabla 1). Desde un punto de vista práctico, en lo que sí hay un acuerdo unánime es en la importancia de reducir peso en estos pacientes, con el fin de disminuir la insulinorresistencia y, con ello, el riesgo cardiovascular. La hiperinsulinemia compensadora, en un estado de insulinorresistencia, puede promover obesidad por diferentes vías. Fundamentalmente, mediante el aumento de los depósitos grasos por la inhibición de la lipolisis y la estimulación de la lipogénesis, así como por un incremento de la masa muscular (miogénesis), favoreciendo, con ello, el incremento ponderal18. Además, la respuesta hiperinsulinémica posprandial ante una ingesta rica en glúcidos puede inducir hipoglucemia reactiva y la necesidad de ingerir mayor cantidad de glúcidos para corregirla, lo que dificulta seguir un plan de dieta correcto. Por ese motivo se aconsejan dietas con baja carga glucémica en el paciente con IR19. La obesidad induce aterogénesis por multipes vías que incluyen dislipidemia e hipertensión, mientras que los depósitos grasos en la pared arterial provocan inflamación, que aceleraría el proceso18. Además, la hiperinsulinemia favorece el incremento en la síntesis endógena, a nivel hepático fundamentalmente, de lipoproteínas plasmáticas, responsables del característico perfil lipídico de estos pacientes. La denominada dislipidemia aterogénica (HDL-colesterol bajo, triglicéridos elevados y LDL-colesterol ligeramente alto). No obstante, se trata de un LDL-colesterol particularmente aterogénico, dado que al ser partículas más pequeñas y densas, son fácilmente oxidables y, por ello, difícilmente reconocibles por el receptor y los macrófagos que deberían depurarlas. Por otro lado, también se ha descrito una reducción en la actividad de la lipoproteinlipasa, que contribuiría a empeorar este perfil lipídico20. Además, la hiperinsulinemia facilita el desarrollo de hipertensión arterial por diferentes vías, favoreciendo la retención de sodio renal, aumentando la actividad del sistema nervioso simpático, así como del eje renina-angiotensina y reduciendo la luz arterial mediante el aumento del grosor de la pared, a nivel de íntima y media (mediado por IGF-1). Por este motivo, estos pacientes suelen presentar hipertensión arterial de difícil control, que a menudo requiere de asociación de fármacos que actúen por diferentes vías para su correcto control21. Además de los factores tradicionales de riesgo cardiovascular que hemos comentado, existirían otros factores no tan habituales, asociados también con hiperinsulinemia. Se ha descrito un estado de hipercoagulabilidad con relación a un aumento en la concentración del factor inhibidor del plasminógeno, así como disfunción endotelial y mecanismos de inflamación arterial, directamente relacionados con la hiperinsulinemia, que conducirían a un notable incremento de los fenómenos aterotrombóticos22,23. Por todo ello, el paciente IR suele desarrollar lesiones macroangiopáticas, años antes de que aparezca la DM2. El estudio de Bressler et al. fue el primero en demostrar que los pacientes con enfermedad coronaria difusa eran marcadamente hiperinsulinémicos, en comparación con los participantes con tolerancia normal a la glucosa que presentaban coronarias sanas24. Posteriormente, Reaven et al. corroboraban estos hallazgos25. Múltiples estudios prospectivos, incluyendo el San Antonio Heart study (SAHS) y el estudio Botnia, han demostrado que la insulinorresistencia en sujetos con tolerancia normal a la glucosa predice futura enfermedad cardiovascular, aun después de ajustar para los diferentes factores de riesgo. De ese modo, se estima que estos pacientes doblarían la incidencia de enfermedad cardiovascular, de igual modo que los pacientes ya diagnosticados de DM226,27. Se han detallado observaciones similares en los estudios de Bruneck, Verona Diabetes y el Insulin Resistance Atherosclerosis (IRAS)28–30. El modo en cómo la insulinorresistencia y la respuesta hiperinsulinémica compensadora conducen a cada uno de los componentes del síndrome metabólico ha sido revisado en detalle31.
La hiperinsulinemia promueve riesgo cardiovascular mediante:
| Factores clásicos | Factores no clásicos |
|---|---|
| Obesidad visceral | Factor de crecimiento endotelial (IGF-1) |
| Diabetes mellitus 2 | LDL pequeñas y densas |
| Hipertensión arterial | Disfunción endotelial |
| Dislipidemia aterogénica | Factores de procoagulación |
| Factores de inflamación |
Los individuos con IR pueden mantener la normoglucemia durante muchos años de su vida, a expensas de una respuesta compensadora hiperinsulinémica por parte de las células beta pancreáticas. Sin embargo, poseen 5 veces más posibilidades de desarrollar DM2 que los individuos normales. En un estado de IR, en un principio, la hiperinsulinemia compensadora podría mantener la normoglucemia durante un tiempo variable, pero si se incrementa la insulinorresistencia por la obesidad progresiva y la vida sedentaria, dicha hiperinsulinemia no sería capaz de compensar y, tras un fracaso relativo de las células beta pancreáticas, aparecería la hiperglucemia y, con ella, el diagnóstico de DM232.
Hiperinsulinemia y cáncerEn los últimos años, numerosos estudios clínicos y epidemiológicos han relacionado hiperinsulinemia y cáncer6,33. El mecanismo de esta asociación no se ha dilucidado por completo, aunque se relaciona mayoritariamente con el sistema IGF-1. El Aerobic Center Longitudinal Study incluyó 33.230 varones, libres de cáncer, que fueron seguidos durante 14 años, demostrando un aumento en el riesgo de muerte por cáncer superior al 56% en pacientes con IR34. También otros estudios han observado una mayor incidencia de diferentes tipos de tumores, así como un peor pronóstico en estos pacientes35,36. El documento de consenso de 2010, presentado por la American Diabetes Association y la American Cancer Society, refiere que la hiperinsulinemia podría estimular la carcinogénesis mediante la estimulación de los receptores celulares IGF-insulina, al modo como lo hacen los estrógenos con el cáncer de mama37. Se ha asociado DM2 con muerte prematura, tanto por riesgo cardiovascular como por cáncer de hígado, páncreas, ovario, colorrectal, pulmón, vejiga y mama, aconsejando la necesidad de considerar un estudio apropiado a la edad y sexo, para el despistaje de neoplasia en individuos con diabetes38. Un metaanálisis reciente destaca que un tratamiento intensivo para obtener la normoglucemia en DM2 no reduciría el riesgo de cáncer, considerando que probablemente no sería la hiperglucemia la principal responsable, sino la hiperinsulinemia de estos pacientes39.
La hiperinsulinemia aumenta la biodisponibilidad de IGF-1, aumentando su síntesis hepática por un lado y reduciendo las proteínas transportadoras (IGFBP-1 y IGFBP-2) por otro. Así, aunque la hiperinsulinemia puede, por sí misma, inducir crecimiento tumoral, la mayoría de los efectos mitogénicos y antiapoptósicos son mediados por IGF-16. Otro mecanismo propuesto consistiría en la reducción de proteína transportadora de hormonas sexuales, mediada principalmente por insulina, que incrementaría los niveles de estrógenos, facilitando el crecimiento del cáncer de mama40. Finalmente, el estado proinflamatorio que se observa en el paciente IR, con una producción excesiva de ácidos grasos libres, interleucina-6, leptina, factor de necrosis tumoral-alfa y factor inhibidor del plasminógeno, permitiría un medio ideal para el desarrollo y el crecimiento tumoral41.
Ello ha suscitado un interés creciente de la oncología por conocer el mecanismo de acción de los diferentes fármacos insulinosensibilizadores. Evans et al., en 2005, relacionaron por primera vez una disminución de la incidencia de cáncer en pacientes con DM2 que recibían tratamiento con metformina42. Posteriormente se observó una notable reducción en el riesgo de cáncer en pacientes que recibían metformina, en comparación con aquellos que recibían sulfonilureas o insulina43. Un reciente metaanálisis observa una reducción del 31% en el riesgo de cáncer en pacientes con DM2 que recibían metformina, en comparación con otros tratamientos y concluye que la hiperinsulinemia incrementa el riesgo de cáncer en individuos sanos y puede justificar, en parte, la asociación obesidad-cáncer44. Se han publicado varios estudios con metformina, que han podido demostrar notables beneficios, tanto en el control del crecimiento tumoral como en la respuesta al tratamiento con quimio- y radioterapia45,46. Se ha sugerido que la metformina inhibiría el crecimiento tumoral mediante la activación de la cinasa activa por monofosfato de adenina (AMPK), o directamente, reduciendo niveles de insulinemia. En este sentido destacan sendos metaanálisis que observan una reducción significativa, tanto de cáncer colorrectal como de cáncer de mama en pacientes con DM2 tratados con metformina47,48. La utilización de otro tipo de fármacos insulinosensibilizadores, las tiazolidinodionas, ha mostrado un efecto neutro en cuanto a la incidencia de cáncer, salvo en un estudio que observó una reducción significativa en el cáncer de pulmón49. Sin embargo, el incremento ponderal asociado a estos fármacos y un reciente estudio de cohortes que los relacionan con cáncer de vejiga, han promovido cierta reticencia en su uso50. Por otro lado, se ha asociado el empleo de insulinosecretores e insulina en el tratamiento de la DM2, con un aumento en la incidencia de cáncer en estos pacientes50–52. No obstante, estos datos no han sido corroborados por otros autores53. Los datos del reciente estudio Origin no resuelven totalmente nuestras dudas. Los investigadores concluyen que el tratamiento con insulina glargina para obtener la normoglucemia en pacientes con DM2 no empeora el riesgo cardiovascular ni la incidencia de cáncer, pero tampoco los reduce con relación al grupo control. Por otro lado, llama la atención que, en el grupo tratado con glargina, el 50% recibían también metformina, lo que dificulta la interpretación de los resultados. Además, las dosis de insulina que se emplearon fueron notablemente bajas (0,3-0,4 u/kg), en comparación con las que requieren habitualmente en clínica real los pacientes con IR. Por supuesto, se observó un aumento de peso significativo en el grupo tratado con insulina54.
Tratamiento de la hiperinsulinemiaAnte todo lo expuesto, parece lógico que debamos identificar y tratar al paciente hiperinsulinémico, incluso antes de que aparezcan los diferentes factores de riesgo cardiovascular y, por supuesto, antes de que aparezca DM2. Numerosos estudios han demostrado un notable beneficio en este sentido55. En el apartado de tratamiento no farmacológico se aboga por un cambio en el estilo de vida, fundamentalmente dieta y ejercicio, así como por abandonar el hábito tabáquico, si lo hubiera. En cuanto al tipo de ejercicio y la frecuentación, es amplia la bibliografía, pero nos remitiremos a una magnifica revisión de este tema que se ha publicado recientemente56. En general se aconseja la práctica de ejercicio, principalmente aeróbico, con regularidad, un mínimo de 120 min semanales. Las recientes recomendaciones nutricionales de la American Diabetes Association (ADA) aconsejan 3 tipos de dietas para el control de la DM2: dieta hipocalórica, baja en grasas, dieta mediterránea y dieta hipoglucídica57. Existen numerosos estudios que demuestran que, de todas ellas, la que obtiene mejores resultados en cuanto a reducción de hiperinsulinemia posprandial sería, sin duda, la de menor contenido en glúcidos58,59. En cuanto al tratamiento farmacológico, se ha pronunciado también la ADA en sus últimas recomendaciones y cito textualmente: «Los estudios aleatorizados controlados han demostrado que los individuos con riesgo elevado para el desarrollo de diabetes pueden recibir intervenciones que reducen significativamente la tasa de inicio de la diabetes. Estas intervenciones incluyen un programa intensivo de modificación del estilo de vida que ha demostrado ser muy eficaz (58% de reducción del riesgo a los 3 años), así como el empleo de agentes farmacológicos: metformina, inhibidores de la alfa-glucosidasa, orlistat y tiazolidinodionas»57.
ConclusionesEs prioritario identificar y tratar de forma precoz al sujeto hiperinsulinémico, antes de que desarrolle las complicaciones macrovasculares que comportan un incremento del riesgo cardiovascular y, por supuesto, antes de que el paciente sea diagnosticado de DM2. Probablemente, obtendríamos un beneficio adicional en la reducción de determinados tipos de cáncer en estos pacientes.
El objetivo principal del tratamiento de la DM2 consiste en normalizar las cifras de glucemia, sin olvidar el control de las comorbilidades que frecuentemente la acompañan. Sin embargo, en el caso de la DM2, en el contexto de un paciente IR, nos encontramos con una disyuntiva razonable. La hiperglucemia se relaciona fundamentalmente con microangiopatía (retinopatía, nefropatía y polineuropatía), mientras que la hiperinsulinemia lo hace con macroangiopatía. Por otro lado, sabemos de la asociación entre hiperinsulinemia y cáncer. En el momento de indicar un tratamiento farmacológico adecuado, deberemos intentar normalizar la glucemia, sin empeorar la hiperinsulinemia de estos pacientes. Por tanto, aquellos fármacos que puedan condicionar incremento ponderal, fundamentalmente sulfonilureas e insulina, deberían precribirse con precaución en estos pacientes. Sin duda, la mejor opción sería la combinación de metformina con buenos hábitos higiénico-dietéticos. El objetivo primordial sería la reducción ponderal. Es por ello por lo que, en los últimos años, se han desarrollado diferentes familias de fármacos que apuestan decididamente por este fin. Los agonistas del receptor de GLP-1 (arGLP-1) son un grupo farmacológico que, además del efecto hipoglucemiante por el efecto incretínico, inducen una pérdida ponderal y una mejora de la presión arterial y la dislipidemia, lo que se traduce en un beneficio global del riesgo cardiovascular de los pacientes con diabetes que podría devenir en una reducción de complicaciones macrovasculares a largo plazo. Otro grupo farmacológico apostaría por la misma finalidad pero por caminos diferentes, utilizando un mecanismo no insulínico, como serían los inhibidores del cotransportador renal de sodio-glucosa (SGLT2), obteniendo resultados parecidos a los anteriores e incrementando la pérdida de glucosa en orina (glucosúricos). Probablemente, deberíamos plantearnos si los pacientes con DM2 y obesidad merecerían guías terapéuticas específicas, que priorizaran en este sentido. Probablemente nos encontramos en un momento de cambio en el enfoque terapéutico de nuestros pacientes, pasando de un criterio meramente glucocentrista a otro más global, adipocentrista.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.