La enfermedad arterial periférica (EAP) es frecuente en el paciente anciano. Dado que muchos pacientes se encuentran asintomáticos, la EAP se encuentra frecuentemente infradiagnosticada y secundariamente, infratratada. Esto es importante, ya que la EAP se asocia con un incremento de la mortalidad. En este contexto, la medición del índice tobillo-brazo es especialmente útil, ya que permite un diagnóstico precoz de la misma. El tratamiento de la EAP debe incluir, además de la antiagregación adecuada, el control de los factores de riesgo, así como el manejo de los síntomas de la EAP. En el presente manuscrito se revisan las evidencias actuales acerca de la EAP en el paciente anciano, desde los datos epidemiológicos, pasando por el diagnóstico, hasta el tratamiento.
Peripheral artery disease (PAD) is common in the elderly. Because many patients are asymptomatic, this process is often underdiagnosed and undertreated, which has serious consequences since PAD is associated with increased mortality. Measurement of the ankle-arm index is especially useful as it allows early diagnosis of PAD. The treatment of PAD should include both appropriate antiplatelet therapy and control of risk factors, as well as management of the symptoms of PAD. The present article reviews current evidence on PAD in the elderly, including epidemiological data, diagnosis and treatment.
La enfermedad arterial periférica (EAP) se puede definir de manera general como el conjunto de cuadros clínicos agudos o crónicos derivados de una enfermedad arterial obstructiva que conduce a una disminución del flujo sanguíneo1. Por su relevancia e importancia dentro de la EAP, la presente revisión se va a centrar en la EAP producida por obstrucción aterosclerótica crónica de los miembros inferiores2. Además de ser una entidad ciertamente invalidante en algunos pacientes, su presencia se asocia con un aumento el riesgo de presentar complicaciones cardiovasculares, como síndrome coronario agudo, ictus o muerte cardiovascular3. Así, se ha observado en un estudio que combinó los datos de 2 registros canadienses, realizado en 9.810 pacientes con enfermedad vascular, diabetes, o tener al menos 65 años de edad y 2 factores de riesgo cardiovascular adicionales, que en comparación con aquellos sujetos sin EAP (n = 8.303), aquellos con EAP (n = 1.507) tenían cerca de 2 veces mayor riesgo de eventos cardiovasculares mayores tras sólo 6 meses de seguimiento (7,3% frente a 4,1%; P < 0,0001). Tras el ajuste de numerosos factores de confusión, la presencia de EAP al inicio del estudio se asoció con un aumento en el riesgo de secuelas vasculares (OR 1,54; IC 95% 1,18-2,01; P < 0,0001)4. En otro estudio realizado en Italia, tras 24 meses de seguimiento, el 15% de los pacientes con EAP murieron, y el 25% desarrolló un evento cardiovascular no fatal. La presencia de EAP se asoció con un aumento de 4 veces en el riesgo de muerte por cualquier causa y cerca de 8 veces en el riesgo de muerte cardiovascular5.
En España, en el registro PAMISCA (Prevalencia de Afectación de Miembros Inferiores en el paciente con Síndrome Coronario Agudo) que incluyó a sujetos ≥40 años de edad (edad media 66 años) que habían ingresado por un síndrome coronario agudo, el 39,8% tenía además EAP, y su presencia se asoció con un riesgo incrementado de complicaciones cardiovasculares6.
Desafortunadamente, estos datos podrían ser incluso peores. Una proporción significativa de sujetos con EAP se encuentran asintomáticos. Así, más del 20% de los sujetos con EAP en la población general, y el 10% de los pacientes >65 años diagnosticados de EAP por los médicos generales mediante el índice tobillo-brazo (ITB) no presentan los síntomas clásicos7–9. Esto es mucho más llamativo en las poblaciones de mayor riesgo, como los diabéticos3. Esto hace que un número importante de pacientes sean diagnosticados de manera tardía de EAP, lo que hace que se retrase el tratamiento, y consecuentemente, su pronóstico sea peor2,9,10.
Existe una relación directa entre el desarrollo de la aterosclerosis y la edad. Por lo tanto, el riesgo de desarrollar EAP aumenta con la edad11. A pesar de esto, ante un paciente anciano no siempre se piensa en esta posibilidad, sobre todo si se tiene en cuenta que aproximadamente sólo la mitad de los pacientes ancianos con EAP se encuentran sintomáticos2,11. De hecho, en un estudio realizado en nuestro país en cerca de 3.800 sujetos mayores de 49 años, si bien el 7,6% tenía un ITB <0,9, de estos pacientes, el 80,7% estaba infradiagnosticado, a pesar de que el 29,3% presentaba clínica de claudicación intermitente, siendo el infradiagnóstico mayor en los sujetos ≥70 años de edad (OR 3,12; IC 95% de 1,12–8,67)10.
Epidemiología y perfil clínico del paciente con arteriopatía periféricaAl igual que en el resto de las manifestaciones de la enfermedad aterosclerótica, la prevalencia de EAP aumenta con la edad. Datos del National Health and Nutrition Examination Survey 1999-2004 en el que se analizaron a 3.947 sujetos ≥60 años de edad a los que se les determinó el ITB, la prevalencia de EAP fue del 12,2% (7,0% en los de 60 a 69 años, 12,5% en los de 70 a 79 años y 23,2% en los de ≥80 años)12. En un estudio realizado en Alemania en 6.880 pacientes atendidos en Atención Primaria con una edad ≥65 años (edad media 72,5 años; 42% varones), la prevalencia de EAP fue del 19,8% en varones y del 16,8% en mujeres8. En otro estudio realizado en Estados Unidos en cerca de 7.000 pacientes ≥70 años de edad o entre 50 y 69 años y antecedentes de hábito tabáquico o diabetes, el 29% de los pacientes tenía EAP13. En un estudio en el que se analizaron a 1.160 varones (edad media 80±8 años) y a 2.464 mujeres (edad media 81±8 años), la prevalencia de EAP fue del 32% en los varones y del 26% en las mujeres (p =0,0001 entre sexos)14. Además, la prevalencia de EAP no sólo aumenta con la edad, sino también con la presencia de otros factores de riesgo o comorbilidades, incluyendo la población anciana, lo que incrementa aún más el riesgo de presentar complicaciones cardiovasculares en esta población.
Numerosos factores se han asociado con el desarrollo de EAP. Así, en el National Health and Nutrition Examination Survey 1999-2004, el hábito tabáquico actual (OR 5,48), la historia previa de hábito tabáquico (OR 1,94), la diabetes mellitus (OR 1,81), la función renal reducida (OR 2,69), la disfunción renal leve (OR 1,71), la proteína C reactiva de alta sensibilidad >3,0mg/L (OR 2,69), la hipertensión arterial tratada pero no controlada (OR 1,95), y la hipertensión arterial no tratada (OR 1,68) se asociaron con la presencia de EAP (tabla 1)12.
| Factores de riesgo | Odds ratio | Intervalo de confianza 95% |
| Población National Health and Nutrition Examination Survey 1999-200412 | ||
| Fumador actual | 5,48 | 3,60-8,35 |
| Función renal disminuida | 2,69 | 1,58-4,56 |
| Proteína C reactiva de alta sensibilidad >3,0 mg/L | 2,69 | 1,24-5,85 |
| Hipertensión arterial tratada pero no controlada | 1,95 | 1,40-2,72 |
| Exfumador | 1,94 | 1,39-2,69 |
| Diabetes mellitas | 1,81 | 1,12-2,91 |
| Función renal levemente dsminuida | 1,71 | 1,22-2,38 |
| Hipertensión arterial no tratada | 1,68 | 1,13-2,50 |
| Estudio ADAN (sujetos >70 años de edad con un diagnóstico establecido de diabetes)3 | ||
| Neuropatía diabética | 2,68 | 1,97-3,63 |
| Sexo varón | 1,85 | 1,48-2,31 |
| Cardiopatía isquémica | 1,75 | 1,37-2,22 |
| Retinopatía diabética | 1,71 | 1,29-2,27 |
| Enfermedad cerebrovascular | 1,66 | 1,30-2,13 |
| Hábito tabáquico | 1,63 | 1,15-2,29 |
| Dislipemia | 1,63 | 1,30-2,03 |
| Nefropatía diabética | 1,48 | 1,16-2,88 |
| Historia familiar de ECV precoz | 1,57 | 1,24-1,99 |
| Estilo de vida sedentario | 1,32 | 1,04-1,66 |
ECV: enfermedad cardiovascular.
El paciente debe ser manejado globalmente para poder estratificar el riesgo cardiovascular de una manera más completa. Así, cuando en la consulta a un paciente se le detecta un determinado factor de riesgo es importante la búsqueda de otros factores de riesgo, así como de daño orgánico, entre los que se debería incluir la detección precoz de la EAP. Así por ejemplo, en el estudio LIPYCARE (LÍPidos Y riesgo CARdiovascular en España) en el que se incluyeron a más de 3.400 pacientes con hipercolesterolemia sin tratamiento hipolipemiante atendidos en las consultas de Atención Primaria, el 9,1% presentaba además EAP15. En el estudio PRESCOT (Prevención cardiovasculaR en España en atención primaria: intervención Sobre el COlesterol en hiperTensión) en el que se incluyeron a cerca de 13.000 pacientes con hipertensión arterial atendidos en las consultas de Atención Primaria, el 4,4% tenía EAP16. En el CONTROLRISK, en el que se incluyeron a cerca de 9.000 atendidos tanto en las consultas de Atención Primaria, como del especialista, la proporción de sujetos con EAP fue del 8% en ambos casos17. En el estudio CINHTIA (Cardiopatía Isquémica crónica e HiperTensIón Arterial en la práctica clínica en España) en el que se incluyeron a más de 2.000 pacientes con hipertensión arterial y cardiopatía isquémica crónica atendidos en las consultas de cardiología, el 16% tenía además EAP18. En el estudio ELDERCIC (Evaluación de los aspectos clínicos Ligados a la Diferencia de Edad en el manejo diaRio de la Cardiopatía Isquémica Crónica) se analizó el perfil clínico y el manejo de los pacientes con cardiopatía isquémica crónica atendidos en las consultas de cardiología en España de acuerdo con la edad. Se incluyeron a más de 1.000 pacientes (50,5% tenía >65 años). Globalmente, el 13,5% de los sujetos analizados tenían además EAP, 14,9% en aquellos >65 años, frente al 11,7% en los de ≤65 años (p=NS entre edades)19.
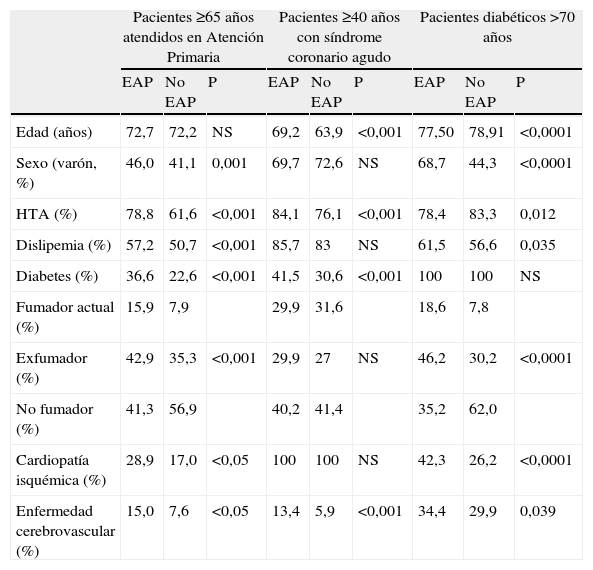
No sólo es importante conocer que el tener un factor de riesgo cardiovascular o enfermedad cardiovascular asociada incrementa el riesgo de presentar EAP, sino también conocer cuál es el perfil clínico de los pacientes con EAP. Varios estudios han analizado este aspecto. En el estudio previamente comentado y realizado en Alemania en 6.880 pacientes atendidos en Atención Primaria con una edad ≥65 años, se comparó el perfil clínico de los pacientes en función de la presencia de EAP. Aquellos pacientes con EAP en comparación con los que no tenían EAP, eran ligeramente más mayores, tenían más diabetes (OR ajustada 1,8), hipertensión arterial (OR 2,2), alteraciones del metabolismo lipídico (OR 1,3), así como más enfermedad aterotrombótica a otros niveles, como enfermedad cerebrovascular (OR 7,6%) o cualquier evento cardiovascular (OR 1,5) (tabla 2)8. En el estudio PAMISCA (pacientes ≥40 años de edad que ingresas por un síndrome coronario agudo), los pacientes con EAP tenían más hipertensión arterial, diabetes mellitus, así como antecedentes de enfermedad cardiaca y cerebrovascular (tabla 2)6. El estudio ADAN (estudio de prevalencia de la enfermedad Arterial periférica en pacientes diabéticos ancianos) se diseñó para conocer la prevalencia de EAP en pacientes ancianos con diabetes. Para ello se incluyeron a 1.642 sujetos >70 años de edad con un diagnóstico establecido de diabetes. Globalmente, la prevalencia de EAP fue del 60,6% (83,2% en pacientes atendidos por cirujanos vasculares y del 31,9% en aquellos atendidos por otras especialidades médicas; p<0,001) (tabla 1). En cuanto a las características clínicas de los pacientes, los que tenían EAP tenían más dislipemia, nefropatía diabética, cardiopatía isquémica y enfermedad cerebrovascular y eran más fumadores. Curiosamente, la hipertensión arterial fue más común en los que no tenían antecedentes de EAP (tabla 2)3.
| Pacientes ≥65 años atendidos en Atención Primaria | Pacientes ≥40 años con síndrome coronario agudo | Pacientes diabéticos >70 años | |||||||
| EAP | No EAP | P | EAP | No EAP | P | EAP | No EAP | P | |
| Edad (años) | 72,7 | 72,2 | NS | 69,2 | 63,9 | <0,001 | 77,50 | 78,91 | <0,0001 |
| Sexo (varón, %) | 46,0 | 41,1 | 0,001 | 69,7 | 72,6 | NS | 68,7 | 44,3 | <0,0001 |
| HTA (%) | 78,8 | 61,6 | <0,001 | 84,1 | 76,1 | <0,001 | 78,4 | 83,3 | 0,012 |
| Dislipemia (%) | 57,2 | 50,7 | <0,001 | 85,7 | 83 | NS | 61,5 | 56,6 | 0,035 |
| Diabetes (%) | 36,6 | 22,6 | <0,001 | 41,5 | 30,6 | <0,001 | 100 | 100 | NS |
| Fumador actual (%) | 15,9 | 7,9 | 29,9 | 31,6 | 18,6 | 7,8 | |||
| Exfumador (%) | 42,9 | 35,3 | <0,001 | 29,9 | 27 | NS | 46,2 | 30,2 | <0,0001 |
| No fumador (%) | 41,3 | 56,9 | 40,2 | 41,4 | 35,2 | 62,0 | |||
| Cardiopatía isquémica (%) | 28,9 | 17,0 | <0,05 | 100 | 100 | NS | 42,3 | 26,2 | <0,0001 |
| Enfermedad cerebrovascular (%) | 15,0 | 7,6 | <0,05 | 13,4 | 5,9 | <0,001 | 34,4 | 29,9 | 0,039 |
HTA: hipertensión arterial; EAP: enfermedad arterial periférica.
A la luz de estos datos se puede concluir que en los pacientes con factores de riesgo o enfermedad cardiovascular asociada es más frecuente la presencia de EAP, y al contrario, que en los sujetos con EAP es más común la presencia de otros factores de riesgo y de enfermedades cardiovasculares asociadas, y más cuanto mayor sea la edad del paciente.
Actitud diagnósticaAunque ante un paciente con clínica de claudicación intermitente la sospecha diagnóstica de EAP es relativamente sencilla, muchos pacientes se encuentran asintomáticos20,21. Así por ejemplo, si bien se ha estimado que aproximadamente 1 de cada 5 personas con edad ≥65 años, que visita al médico de Atención Primaria padece EAP (definida como ITB <0,9), sólo 1 de cada 10 de estos pacientes presentarán síntomas clásicos de claudicación intermitente8,13. Es decir, que si únicamente se tiene en cuenta la sintomatología, muchos de los pacientes con EAP no van a ser diagnosticados. Esto es especialmente importante, ya que como se demostró en un estudio prospectivo en el que se incluyeron a 6.880 pacientes no seleccionados ≥ 65 años atendidos por médicos de Atención Primaria, de los que tras un seguimiento de 5 años, 836 tenían EAP asintomática (ITB <0,9 sin síntomas), y 593 EAP sintomática (revascularización miembros inferiores, amputación por EAP, o claudicación intermitente), el riesgo de mortalidad fue similar en la EAP independientemente de si era sintomática o no, y claramente superior a aquellos pacientes sin EAP22.
En consecuencia, ante un paciente anciano, independientemente de si tiene síntomas de claudicación intermitente o no, siempre es importante pensar en esta posibilidad, sobre todo, si presenta algún factor de riesgo o enfermedad aterosclerótica asociada, principalmente cardiopatía isquémica o enfermedad cerebrovascular.
La exploración física debe incluir la medida de la presión arterial en ambos brazos, palpación de las carótidas así como auscultación de las mismas, auscultación del abdomen y búsqueda de soplos, palpación del abdomen valorando especialmente la pulsación aórtica, la palpación de los pulsos (braquial, radial, cúbito, femoral, poplíteo, pedio, tibial posterior), y la auscultación de ambas arterias femorales en búsqueda de soplos. Asimismo, es fundamental una exploración adecuada de los pies (color, temperatura, integridad de la piel, cambios tróficos, úlceras,…)2,20,21,23. En esta situación es especialmente útil la palpación de los pulsos periféricos. La ausencia de un pulso implica una obstrucción arterial proximal al área palpada. Sin embargo, es importante destacar que en algo más del 12% de la población normal no se palpan el pulso pedio y el tibial posterior24.
La primera prueba no invasiva para el diagnóstico de la EAP es el ITB. Aunque en personas sanas el ITB es >1, la EAP se define cuando el ITB es <0,920. Se estima que con este punto de corte la sensibilidad es del 79% y la especificidad del 96%25. Sin embargo, si se considera un punto de corte de <0,8 o bien la media de 3 valores <0,9, el valor predictivo positivo es ≥95%, mientras que un ITB >1,10 o la media de 3 valores >1,0 tiene un valor predictivo negativo ≥99%20,26. Por otra parte, existe una correlación entre los niveles del ITB y la severidad de la EAP, de tal forma, que un ITB entre 0,6 y 0,9 habitualmente se correlaciona con una claudicación intermitente leve a moderada, un ITB de entre 0,4 y 0,6 con una claudicación severa, y entre 0,25 y 0,4, con dolor en reposo. Globalmente, cuando el ITB es <0,5, el riesgo de amputación es elevado2,20. No obstante, en pacientes con diabetes o insuficiencia renal, en donde existe una importante calcificación de las arterias, lo que aumenta su rigidez, el ITB se encuentra falsamente elevado, lo que podría hacer que en algunos de estos pacientes con EAP el ITB presentase unos valores dentro del rango de la normalidad2.
Pero, ¿qué importancia tiene en la práctica clínica diaria la medición del ITB? El estudio VITAMIN (Valor del Índice Tobillo-Brazo en Medicina Interna) en el que se incluyeron a cerca de 500 sujetos sin enfermedad arterial conocida, de los que un 35% eran diabéticos y sólo un 16% tenían un riesgo bajo según Framingham, el 27,4% tenían un ITB<0,9 (el 37,9% de los diabéticos y el 21,3%, de los no diabéticos). Con estos resultados, los autores concluyeron que en una proporción elevada de pacientes con riesgo cardiovascular intermedio o alto se detecta EAP asintomática, por lo que recomiendan que el ITB debería medirse sistemáticamente en enfermos con riesgo vascular27. En el estudio ADAN, en el que se incluyeron a sujetos >70 años de edad con un diagnóstico establecido de diabetes, si la proporción de sujetos con EAP conocida era del 60,6%, tras la medición del ITB esta proporción ascendió al 70,99%. En el caso de los pacientes atendidos por los cirujanos vasculares, estos porcentajes fueron del 83,2% y de 80,2%, respectivamente, mientras que en los pacientes atendidos por otras especialidades médicas, estos fueron del 31,9% y del 59,6%, respectivamente3. Es decir, que en los pacientes ancianos atendidos por los diferentes especialistas, la medición del ITB es especialmente útil, sobre todo, teniendo en cuenta que el infradiagnóstico de la EAP en los ancianos es relativamente frecuente10. Por otra parte, se ha sugerido que un ITB bajo puede ser un predictor precoz de deterioro cognitivo lo que puede ser un valor añadido en la identificación de sujetos con un riesgo incrementado de daño cognitivo, tan común en edades avanzadas de la vida28,29.
Las recientes guías americanas recomiendan con un nivel de evidencia B, que la medición del ITB en reposo para el diagnóstico de la EAP debería realizarse en aquellos pacientes con 1 o más de las siguientes características: síntomas en miembros inferiores con el esfuerzo, heridas que no curan, edad ≥65 años, o ≥50 años con antecedentes de hábito tabáquico o diabetes21. Dado que las arterias de los dedos del pie suelen escapar a la calcificación, el índice dedo del pie-brazo se debería emplear en aquellos pacientes en los que se sospeche la presencia de EAP, pero en los que el ITB no se puede realizar porque las arterias no sean comprimibles, como ocurre en ocasiones en diabéticos de larga evolución o en ancianos. Las guías americanas establecen como valores de referencia del ITB, los siguientes puntos de corte: arterias no comprimibles: >1,4; normal 1,00- 1,4; border-line: 0,91-0,99; y anormal ≤0,9021. Las guías europeas recomiendan la determinación del ITB como prueba no invasiva de primera línea tanto para el cribaje como para el diagnóstico de la EAP (recomendación IB). Asimismo, señalan que en caso de arterias no comprimibles, o un ITB >0,4, se deben emplear métodos alternativos como el índice dedo del pie-brazo, análisis de las ondas Doppler, o registro de volumen del pulso (recomendación IB)20.
Otros métodos no invasivos como la medida de la presión sistólica a diferentes niveles y los registros de volumen del pulso, la pletismografía, la flujometría Doppler y la ultrasonografía dúplex están indicados como métodos de primera línea para confirmar el diagnóstico de EAP y localizar las lesiones (recomendación IB)20. Asimismo, la ultrasonografía dúplex, y/o angiografía por tomografía axial computarizada y/o la angiografía por resonancia magnética están indicadas para localizar las lesiones de la EAP y considerar las opciones de revascularización (recomendación IA)20. Finalmente, las guías europeas señalan que los datos anatómicos obtenidos por las pruebas de imagen deben siempre valorarse junto con las pruebas hemodinámicas antes de tomar una decisión terapéutica (recomendación IC)20. Por último, la prueba de esfuerzo en tapiz rodante puede ser útil para confirmar el diagnóstico en aquellos pacientes con EAP con síntomas sugestivos, para valorar la severidad de la afectación funcional por la EAP, así como en aquellos que tienen un ITB normal en reposo, pero reducido tras el esfuerzo2,20,21,23.
Actitud terapéuticaEl tratamiento del paciente con EAP no debe limitarse únicamente a reducir la sintomatología o plantear la necesidad de revascularización, sino que se debe realizar una aproximación global mediante el tratamiento de todos los factores de riesgo y enfermedades asociadas2,7,20,21,30,31. Dado que los pacientes con EAP tienen un riesgo elevado de eventos cardiovasculares, el control de los diferentes factores de riesgo cardiovascular es fundamental en esta población.
Aunque el estudio HOPE (Heart Outcomes Prevention Evaluation) demostró que el inhibidor de la enzima convertidora de angiotensina ramipril redujo en un 25% la incidencia de eventos cardiovasculares mayores en el subgrupo de pacientes que tenían EAP en el momento de la inclusión del estudio32, en un reciente meta-análisis se indica que la evidencia actualmente disponible acerca de la eficacia de los inhibidores de la enzima convertidora de angiotensina sobre la distancia recorrida en el tapiz rodante en pacientes con claudicación intermitente es contradictoria33. En cuanto a los antagonistas de los receptores de angiotensina II, el estudio ONTARGET (Ongoing Telmisartan Alone and in Combination with Ramipril Global Endpoint Trial) demostró que telmisartán y ramipril fueron equivalentes en este contexto34. Por otra parte, es importante destacar que los beta bloqueantes no producen un efecto negativo sobre la claudicación, por lo que no están contraindicados en la EAP35. Es más, el empleo de beta bloqueantes en sujetos con EAP y un infarto de miocardio previo ha demostrado reducir de manera significativa los eventos coronarios, además de ser beneficiosos en el perioperatorio de aquellos pacientes que van a ser sometidos a cirugía vascular20,36,37.
En cualquier caso, independientemente del fármaco antihipertensivo a emplear, lo más importante es conseguir los objetivos de control de presión arterial. Las guías europeas señalan que en todos los pacientes con EAP el objetivo debería ser <140/90mmHg, y <130/80mmHg en los sujetos con diabetes o insuficiencia renal crónica, si bien este último objetivo ha sido cuestionado por la Sociedad Europea de Hipertensión Arterial20,38. En el caso concreto de los ancianos, las últimas recomendaciones de la Sociedad Europea de Hipertensión Arterial publicadas en el año 2009, señalan que en esta población ninguna de las clases terapéuticas de antihipertensivos difieren en su capacidad para reducir la presión arterial. Asimismo, también recomiendan que en la población anciana el tratamiento farmacológico puede comenzarse cuando la presión arterial sistólica sea mayor 140mmHg con un objetivo <140mmHg, con precaución para evitar los efectos adversos debido a una reducción excesiva o demasiado rápida39. Lo que sí está claro, es, como demostró el estudio HYVET (Hypertension in the Very Elderly Trial) que el tratamiento antihipertensivo es beneficioso en sujetos ≥80 años39.
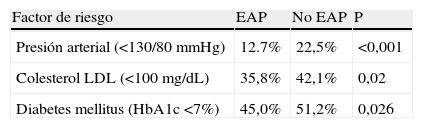
Lograr los objetivos de colesterol LDL ha demostrado ser beneficioso en los pacientes con EAP. Las recientes guías para el manejo del paciente con dislipemia recomiendan un objetivo de colesterol LDL <70mg/dL (1,8 mmol/L) y/o una reducción de al menos el 50% si no es posible este objetivo en pacientes con un riesgo muy elevado, incluyendo a aquellos pacientes con EAP40. En la mayoría de los pacientes con EAP será necesario el empleo de estatinas para conseguir estos objetivos. No sólo es que el tratamiento con estatinas mejora el pronóstico cardiovascular en estos pacientes, sino que se ha sugerido que podría tener efectos positivos adicionales sobre la distancia recorrida en los pacientes con claudicación intermitente20,41. En cuanto a la diabetes mellitus, las guías europeas establecen que en pacientes con diabetes y EAP, los niveles de HbA1c deberían ser ≤6,5%20. Sin embargo, en los pacientes ancianos hay que ser especialmente cuidadoso en el tratamiento para evitar las hipoglucemias. Finalmente, en todos los pacientes con EAP debería evitarse el hábito tabáquico20. En ausencia de contraindicaciones o indicaciones específicas, uno o más los siguientes tratamientos farmacológicos pueden ser empleados: vareniclina, bupropion, y terapia sustitutiva de la nicotina21. Sin embargo, cuando se analiza el grado de control de los factores de riesgo, aquellos pacientes con EAP tienen un peor control de los mismos en comparación con los pacientes sin EAP (tabla 3)3.
Grado de control de los factores de riesgo en el estudio en pacientes ancianos con diabetes, según la presencia de enfermedad arterial periférica. Datos del estudio ADAN (adaptado de Escobar et al.3)
| Factor de riesgo | EAP | No EAP | P |
| Presión arterial (<130/80 mmHg) | 12.7% | 22,5% | <0,001 |
| Colesterol LDL (<100 mg/dL) | 35,8% | 42,1% | 0,02 |
| Diabetes mellitus (HbA1c <7%) | 45,0% | 51,2% | 0,026 |
En cuanto al manejo de la claudicación intermitente, las guías europeas recomiendan inicialmente un tratamiento conservador durante 3-6 meses, que incluya el control adecuado de los factores de riesgo, el entrenamiento físico, así como el tratamiento farmacológico. Si los resultados son favorables, se realizará seguimiento clínico y revaluación de la situación de manera periódica. En cambio, si la evolución no es favorable, se localizarán las lesiones mediante las pruebas de imagen, y posterior revascularización, bien mediante tratamiento endovascular o bien mediante by-pass20.
El tratamiento antiagregante es fundamental en el paciente con EAP. De hecho, está indicado (recomendación clase I) para reducir el riesgo de infarto de miocardio, ictus y muerte vascular en los sujetos con EAP aterosclerótica sintomática de los miembros inferiores. Para ello se recomienda el empleo de aspirina a una dosis diaria de 75 a 325mg, o bien clopidogrel 75mg/día como alternativa. Con un nivel de recomendación IIa se aconseja el tratamiento antiplaquetario para reducir el riesgo de infarto de miocardio, ictus, o muerte vascular en sujetos asintomáticos, con un ITB ≤0,9. Sin embargo, no está bien establecido los posibles beneficios de la antiagregación en pacientes asintomáticos con un ITB entre 0,91 y 0,99 (recomendación IIb)21,42–44.
Varios estudios han analizado los efectos de diferentes fármacos en los pacientes con claudicación intermitente. Los más relevantes se describen a continuación. La pentoxifilina es un inhibidor de la fosfodiestarasa que disminuye la viscosidad sanguínea al aumentar la flexibilidad de los hematíes, y de esta forma mejorar el flujo sanguíneo en la microcirculación y oxigenación de los tejidos. Su uso en pacientes con claudicación intermitente se ha asociado con una mejora significativa en la distancia al caminar. Está contraindicada en pacientes con hemorragia grave o hemorragia retiniana extensa, y en el infarto de miocardio reciente. Dado que los ancianos son más susceptibles al efecto hipotensor y a la insuficiencia renal, se recomienda en esta población utilizar dosis menores20,41. El naftidrofurilo reduce la agregación plaquetaria y eritrocitaria. Se ha observado que tiene un efecto positivo tanto sobre la distancia al caminar como sobre la calidad de vida en los pacientes con claudicación intermitente. En ancianos hay que tener cierta precaución ya que son más sensibles al efecto hipotensor20,45. El cilostazol es un inhibidor de la fosfodiesterasa-3 que ha demostrado mejorar la distancia máxima que pueden caminar los pacientes con claudicación intermitente, así como mejorar la calidad de vida en esta población. Su uso está contraindicado en pacientes con insuficiencia renal grave, insuficiencia hepática moderada o grave, insuficiencia cardiaca congestiva, embarazo, predisposición conocida a hemorragias, así como en pacientes con antecedentes de taquicardia ventricular, fibrilación ventricular o ectopia ventricular multifocal, así como pacientes con prolongación del intervalo QTc. Sin embargo, no hat recomendaciones específicas en la población anciana20,41,46–48. Por otra parte, no sólo es importante el tratamiento farmacológico, sino que se ha demostrado que el entrenamiento físico mejora tanto los síntomas como la capacidad de ejercicio en pacientes con claudicación intermitente20,49.
ConclusionesLa EAP conlleva un aumento en el riesgo de presentar complicaciones cardiovasculares. Esto no es de extrañar, ya que los sujetos con EAP tienen un peor perfil de riesgo, con más factores de riesgo cardiovascular y más enfermedades asociadas, especialmente la cardiopatía isquémica y la enfermedad cerebrovascular. Esto es particularmente importante en la población anciana, ya que, de una parte, tienen más EAP, y de otra, tienen más enfermedades asociadas. Por lo tanto, el diagnóstico precoz de la misma es fundamental. Dado que en muchos casos la EAP cursa de manera asintomática, es importante pensar en esta posibilidad, sobre todo en aquellos sujetos con algún factor de riesgo o enfermedad cardiovascular asociada. Desafortunadamente, la EAP se encuentra actualmente infradiagnosticada, especialmente en ancianos, y en consecuencia, infratratada. En este contexto, la medición del ITB es imprescindible para el diagnóstico precoz de la EAP. El tratamiento de la EAP debe incluir el control de los diferentes factores de riesgo cardiovascular, incluyendo el cese del hábito tabáquico, así como el manejo de los síntomas de la EAP, ya sea bien mediante el tratamiento farmacológico, bien mediante la revascularización (endovascular o by-pass) en su caso. En este contexto, la antiagregación es parte fundamental del tratamiento en el paciente con EAP.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.