La opción de un injerto vascular es una medida correctiva para pacientes con enfermedad arterial periférica o aneurismas y para acceso arteriovenoso en pacientes con hemodiálisis crónica. A partir de la colocación de una prótesis de injerto vascular se puede desarrollar infección asociada en el 1-6% de los pacientes, con una alta incidencia de mortalidad del 13 al 58%. El diagnóstico de una infección asociada a injerto vascular se realiza a partir de hallazgos clínicos, microbiológicos e imagenológicos, para así definir, además de su presencia, su compromiso y extensión. El manejo ideal requiere de tratamiento quirúrgico y antibioticoterapia; sin embargo, el tratamiento quirúrgico no siempre es posible. Reportamos este caso de manejo médico exitoso de una infección de injerto vascular de aorta en la cual el 18F-fluorodeoxyglucose positron emission tomography/computed tomography (18F-FDG-PET/CT) presentó utilidad como método diagnóstico y de seguimiento.
The option of a vascular graft is a corrective intervention for patients with peripheral artery disease, aneurisms, and to achieve arterio-venous access in patients on chronic hemodialysis. Infections from a prosthetic vascular graft occurs in 1 to 6% of patients, and this development is related to the incidence of mortality of 13 to 58%. The diagnosis of a vascular graft infection is made via the combination of clinical, microbiologic and imaging findings that allow a definition of not only the presence of infection but also its severity and spread. The ideal approach requires both surgical and antimicrobial therapy; however, the former is not always possible. We report a case of successful medical management of an aortic vascular graft infection and the usefulness of a 18F-fluorodeoxyglucose positron emission tomography/computed tomography (18F-FDG-PET/CT) scan as a tool for diagnosis and follow-up.
La opción de un injerto vascular es una medida correctiva efectiva para pacientes con enfermedad arterial periférica o aneurismas y para acceso arteriovenoso en pacientes con hemodiálisis crónica. La incidencia de infecciones de injerto vascular oscila entre el uno y el 6%1,2. El riesgo de infección en prótesis aórticas torácicas o abdominal completa se reporta entre el 0,3 y el 1% y es la de menor riesgo de infección, mientras la prótesis con anastomosis inguinal es la de mayor riesgo3,4. La infección de injerto vascular es una complicación poco frecuente, pero con alta morbimortalidad; los reportes muestran tasas de mortalidad entre el 13 y el 58%, con un riesgo de amputación de miembro inferior de hasta el 70% en relación con injertos aortoilíacos, ileofemorales y aortofemorales. Las manifestaciones clínicas son variadas y para el diagnóstico se requiere la presencia de hallazgos clínicos, microbiológicos e imagenológicos. Se considera infección temprana si se presenta en los primeros 3 meses y tardía si es posterior a los 3 meses. El manejo ideal cuando se documenta este tipo de infección es combinado: antibioticoterapia prolongada y manejo quirúrgico. El manejo médico conservador sin retiro del injerto se ha asociado a incremento de mortalidad5. Sin embargo, la decisión de manejo quirúrgico en este grupo de pacientes puede estar limitada por las comorbilidades de base, la integridad y localización del injerto, y el microorganismo implicado6.
Caso clínicoPaciente de sexo masculino de 60 años de edad que consulta al servicio de urgencias el 21 de enero de 2011 por cuadro clínico de 24 h de evolución consistente en fiebre entre 38,6 y 39,0°C, la cual no cede con el consumo de acetaminofén. Se asocia a astenia, adinamia y dolor cervicodorsal, sin otros síntomas asociados, sin deterioro de su clase funcional y sin dolor abdominal.
Antecedentes personales: hipertensión arterial en manejo con hidroclorotiazida 25mg/día, EPOC oxígeno requirente durante 12 h los últimos 4 meses, tubo valvulado aórtico hace 15 años por aneurisma de la aorta ascendente, anticoagulado con warfarina 3,75mg/día, además con atorvastatina 10mg/día, colecistectomizado, fumador de 20 cigarrillos/día hasta hace 15 años. No refiere antecedentes alérgicos, ni familiares. Al examen físico de ingreso: en buenas condiciones generales, hidratado, consciente, febril. Tensión arterial 140/87mmHg; frecuencia cardiaca: 120 latidos por minuto; frecuencia respiratoria: 22 por minuto; temperatura: 38,6°C; peso: 66kg; SaO2 88%. Cuello móvil sin rigidez, sin adenopatías, sin ingurgitación yugular; ruidos cardiacos rítmicos regulares sin soplos, con clic valvular audible, murmullo vesicular presente en ambos campos pulmonares, disminuido en base izquierda; abdomen blando, no doloroso a la palpación; extremidades sin edema, bien perfundidas, sin déficit neurológico. Resto del examen físico, sin alteraciones.
Paraclínicos de ingreso con leucocitos 14.500 células/mm3, neutrófilos 82%; linfocitos 9%; hemoglobina 17,8g/dL; hematocrito 52,9%; plaquetas 160.000 células/mm3; PCR 93,56mg/l. La radiografía de tórax evidencia opacidad basal izquierda. El uroanálisis y el gram de orina no son sugestivos de infección de vías urinarias. Se inicia empíricamente ampicilina sulbactam 3 g intravenosos cada 6 h más claritromicina 500mg cada 12 h por sospecha de neumonía adquirida en la comunidad. Hemocultivos 3 de 3 positivos en las primeras 24 h de incubación para Staphylococcus aureus sensible a meticilina. Se decide iniciar oxacilina con bolo inicial de 2 g y 12 g día en infusión continua más rifampicina oral 600mg/día.
Ecocardiograma TT y TE solicitado por antecedente de tubo valvulado sin vegetaciones, con prótesis mecánica normofuncionante. Ecografía y TAC de tórax con escaso derrame pleural bilateral de predominio izquierdo, no septado, con discreta atelectasia basal izquierda y cambios de enfisema. Se comenta con el grupo de neumología las radiografías previas y la TAC de tórax de octubre de 2010, con iguales hallazgos a los de ingreso, por lo cual se descarta neumonía. Hemograma con leucocitosis en disminución 11.500 células/mm3; neutrófilos 77%; linfocitos 13%; hemoglobina 14,7g/dL; hematocrito 42,3%; plaquetas 177.000 células/mm3; PCR en aumento progresivo 237,36mg/l. Ecografía abdominal dentro de normalidad. TAC de tórax sin evidencia de colecciones a nivel del tubo valvulado. Gammagrafía ósea reciente sin lesiones de osteomielitis. Hemocultivos de control del día 26 y 28 de enero, negativos. Hemograma de control sin leucocitosis ni neutrofilia. La evolución clínica es adecuada; sin embargo, llama la atención la persistencia de pico febril diario y la PCR elevada. Se continúa manejo instaurado con oxacilina y rifampicina con persistencia de picos febriles en el día 7 de tratamiento, aunque sin deterioro clínico. Se descarta endocarditis bacteriana. Se sospecha compromiso infeccioso en remplazo de aorta ascendente (tubo valvulado aórtico), por lo cual se decide realizar 18F-fluorodeoxyglucose positron emission tomography/computed tomography (18F-FDG-PET/CT). Continúa en manejo antibiótico con oxacilina intravenosa hasta obtener reporte de 18F-FDG-PET/CT y establecer plan de manejo.
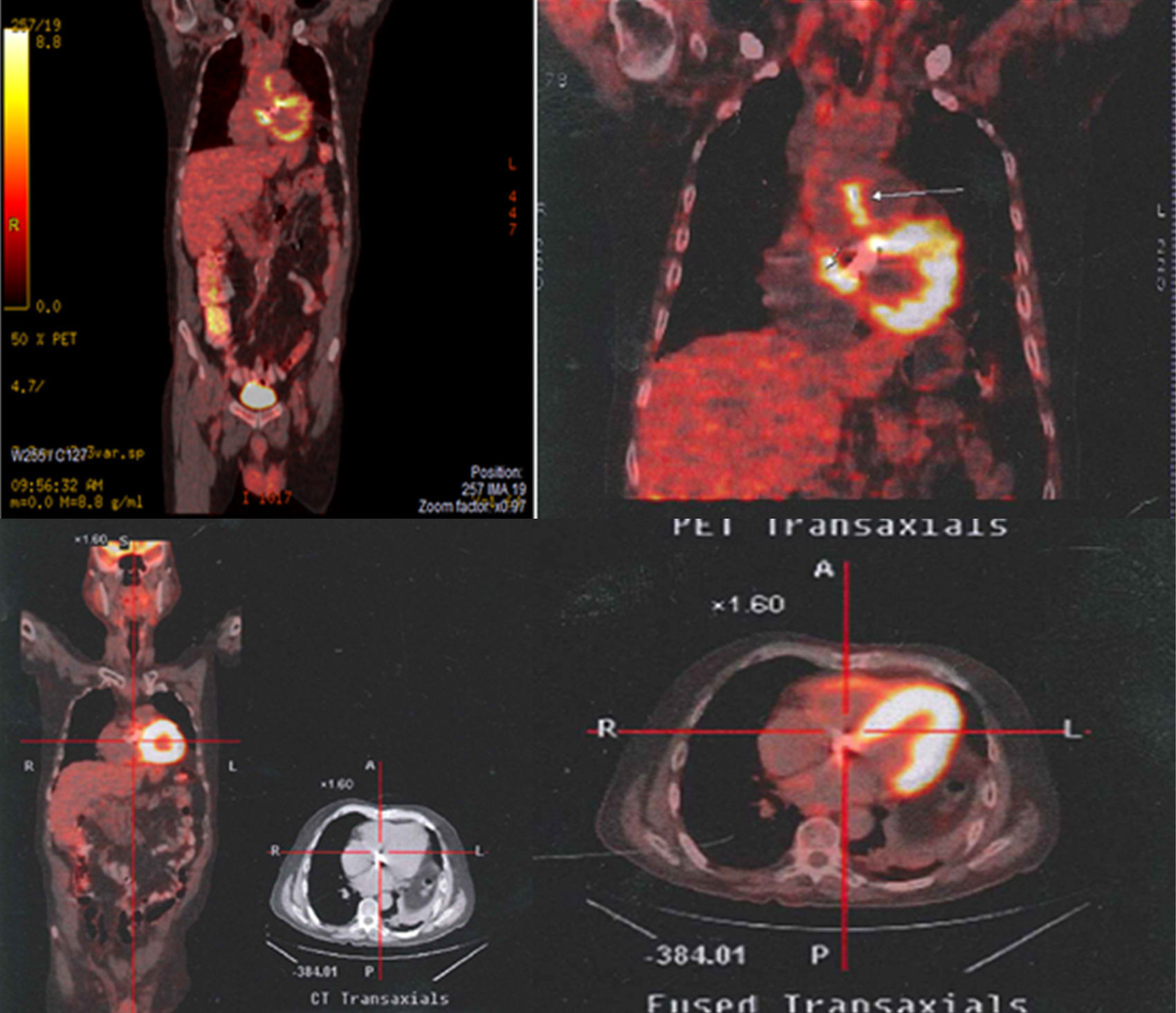
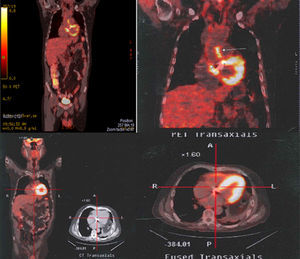
Se realiza 18F-FDG-PET/CT (fig. 1), el cual reporta cambios hipermetabólicos sugestivos de aortitis, proceso inflamatorio/infeccioso de las paredes de la raíz de la aorta inmediatamente por encima del plano valvular, por lo cual se hace el diagnóstico de infección de injerto aórtico como foco primario desencadenante de la bacteriemia por Staphylococcus aureus. A los 15 días de ingreso al hospital se hace cambio de oxacilina a cefazolina, un gramo cada 8 h, por presencia de flebitis química recurrente secundaria a la infusión de oxacilina. Se cumplen 28 días de manejo antibiótico intravenoso y posteriormente se hace manejo oral con cefalexina 500mg cada 8 h y rifampicina 600mg día por 4 meses. Antes de la suspensión del tratamiento antibiótico se realiza un 18F-FDG-PET/CT de control (fig. 1) en donde se observa resolución de las anormalidades hipermetabólicas, hallazgo que es interpretado como resolución del proceso infeccioso. En el seguimiento clínico el paciente se encuentra sin recaída infecciosa y con sobrevida hasta el último control en junio de 2015.
Arriba. Aumento focal anormal al momento del diagnóstico (09/02/2011) de la captación en los contornos de la raíz de la aorta ascendente inmediatamente encima del reemplazo valvular sugestivo de aortitis. Proceso inflamatorio/infeccioso de las paredes de la raíz de la aorta inmediatamente por encima del plano valvular. Abajo. Estudio normal sin cambios hipermetabólicos anormales. Tras 4 meses de antibioticoterapia (14/06/2011).
Este reporte describe el caso de un paciente de 60 años de edad con comorbilidades (hipertensión arterial y EPOC oxígeno requirente), con infección tardía de injerto vascular de aorta torácica, quien presenta como única manifestación clínica bacteriemia por Staphylococcus aureus sensible a meticilina, con PCR elevada, sin hallazgos imagenológicos en ecocardiograma ni en TAC. Requirió para su diagnóstico el uso de 18F-FDG-PET/CT. Adicionalmente, ante las comorbilidades del paciente, la integridad del injerto, la ausencia de sepsis severa o choque séptico, la resolución de la bacteriemia y la posibilidad de seguimiento estricto se decide dar manejo médico con antibioticoterapia que incluyó rifampicina, seguimiento con marcadores de fase aguda y 18F-FDG-PET/CT, logrando resolución del proceso infeccioso con manejo conservador del injerto.
Los factores de riesgo para infección de injerto vascular descritos en la literatura son múltiples. Dentro de ellos se encuentra la cirugía de urgencia, el tiempo quirúrgico prolongado, la hiperglucemia posquirúrgica, la reintervención quirúrgica, la incisión inguinal, la diabetes mellitus, la enfermedad renal crónica, la obesidad, la infección activa en un sitio distante durante la intervención y complicaciones de la herida quirúrgica como seroma, hematoma, necrosis cutánea o infección del sitio operatorio superficial. Sin embargo, en nuestro paciente no fue posible establecer claramente un factor de riesgo diferente a la presencia de un injerto vascular. Los microorganismos frecuentemente aislados son cocos grampositivos como Staphylococcus aureus, Staphylococcus epidermidis y Streptococcus spp. hasta en el 60% de los casos, seguidos de infección por gramnegativos, infecciones mixtas y Candida spp.1,2,6,7.
El diagnóstico de infección de injerto vascular se realiza con la presencia de 2 o más de los siguientes criterios: cultivos microbiológicos positivos, signos clínicos de infección, biomarcadores inflamatorios elevados o signos radiológicos de infección del injerto más la exclusión de otros posibles focos infecciosos. Dentro de los cultivos aceptados como criterio diagnóstico encontramos los hemocultivos, el cultivo de material del injerto extirpado, cultivo de colecciones periprotésicas o de tejidos profundos de la herida. Se dejan de lado y sin validez diagnóstica aquellos tomados de la secreción superficial de la herida, teniendo en cuenta el alto riesgo de contaminación de la muestra7. Se reporta una gran variedad de manifestaciones clínicas, algunas muy evidentes con signos inflamatorios locales, presencia de abscesos, exposición del injerto, fistulización y disrupción de la anastomosis. No obstante, en algunos casos, la presencia de bacteriemia puede ser la única manifestación. La presencia de compromiso sistémico es variable. En nuestro paciente la presencia de bacteriemia por Staphylococcus aureus y la persistencia de picos febriles y PCR elevada en presencia del antecedente del injerto vascular configuraba un cuadro de alta sospecha clínica. Sin embargo, el apoyo imagenológico con ecocardiograma y TAC no permitió confirmar este diagnóstico. El uso del 18F-FDG-PET/CT fue de utilidad en el diagnóstico8.
La cohorte VASGRA del hospital universitario de Zúrich8 contó con 34 pacientes con sospecha de infección de injerto vascular a los cuales se les realizó 18F-FDG-PET/CT y el resultado se correlacionó con el reporte de cultivos microbiológicos tomados de tejido profundo periprotésico o del material del injerto extirpado (estándar diagnóstico). El 18F-FDG-PET/CT reconoció 27 casos con infección de injerto vascular como verdaderos positivos, un paciente fue catalogado como falso positivo, 6 pacientes fueron de buena manera reconocidos como verdaderos negativos, mientras que ningún caso fue clasificado como un falso negativo. Se determinó una sensibilidad del 100%, una especificidad del 86%, un valor predictivo positivo del 96% y negativo del 100%8.
El tratamiento recomendado actualmente, aunque no está basado en estudios clínicos aleatorizados, combina el manejo quirúrgico agresivo con desbridamento y escisión del injerto asociado con antibioticoterapia1,2,6. El manejo conservador con antibióticos se asocia a altas tasas de mortalidad y recaídas. Saleem et al. reportaron el seguimiento de 5 años en 44 pacientes en manejo médico conservador, Staphylococcus aureus y Staphylococcus coagulasa negativos fueron los microorganismos predominantes; la mortalidad fue del 46% y en el análisis multivariado la única variable con valor predictivo significativo para mortalidad fue el manejo conservador con antibióticos (HR: 3,62; IC 95%: 1,17-11,24; p<0,02)5. Sin embargo, en pacientes que no son candidatos a manejo quirúrgico por múltiples comorbilidades y alto riesgo de mortalidad quirúrgica, algunas series pequeñas de casos muestran como opción el manejo antibiótico supresivo de por vida9,10. En infecciones por Staphylococcus aureus la incorporación de rifampicina al esquema de tratamiento ha sido demostrada como un factor protector (OR: 0,32; IC 95%: 0,10-0,96; p=0,04)11.
La experiencia de uso de 18F-FDG-PET/CT para seguimiento es menos clara. Una publicación reciente de un centro realizó un estudio prospectivo en 25 pacientes con seguimiento de una media de 170 días: el 18F-FDG-PET/CT permitió suspender o cambiar el manejo antibiótico en el 8 y el 16% de los pacientes, respectivamente12. En nuestro caso, la realización de 18F-FDG-PET/CT fue de utilidad para definir la suspensión del tratamiento antibiótico en un paciente que se consideraba que requeriría tratamiento supresivo de por vida. El seguimiento del paciente hasta el momento (4 años después de tratado) ha demostrado una supervivencia libre de complicaciones asociadas a la infección del injerto vascular.
Las infecciones de injertos vasculares se asocian a altas tasas de morbimortalidad. El uso de 18F-FDG-PET/CT es promisorio como apoyo diagnóstico y en el seguimiento de pacientes con manejo conservador.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores manifiestan que no tienen ningún conflicto de intereses.