El compromiso neurológico de la enfermedad de Chagas que afecta el sistema nervioso suele ser una manifestación crónica de esta entidad con predominio de afectación del sistema nervioso autonómico. El presente artículo hace el reporte de un caso de síndrome de Guillain-Barré en un paciente con enfermedad de Chagas aguda y revisión de la literatura.
The neurological impairment of Chagas disease that affects the nervous system is usually a chronic manifestation of this condition and predominantly affects the autonomic nervous system. This article presents a case of Guillain-Barré syndrome in a patient with acute Chagas disease as well as a literature review.
La enfermedad de Chagas (ECha) es una entidad infecciosa transmitida por el Trypanosoma cruzi (T. cruzi) que afecta a 10 millones de personas en Latinoamérica1 según la Organización Mundial de la Salud (OMS). El compromiso del sistema nervioso puede presentarse en cualquiera de las fases, con afectación del sistema nervioso central en la forma de meningitis, encefalitis, enfermedad cerebrovascular y con alteración del sistema nervioso periférico en el 10% de los casos, con neuropatías sensitivo-motoras con sintomatología mixta de predominio sensitivo2. La presentación como síndrome de Guillain-Barré en la fase aguda es inusual.
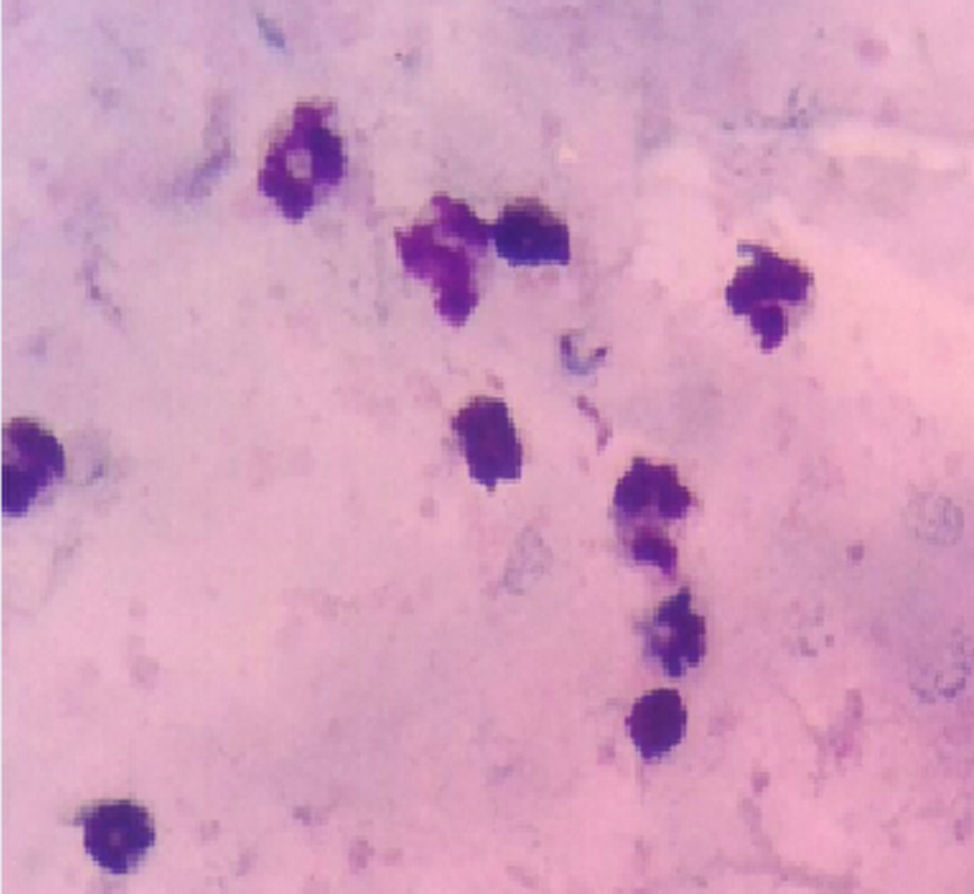
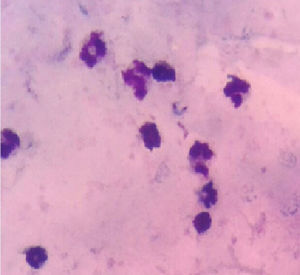
Descripción del casoMujer de 26 años con cuadro clínico de 17 días de evolución consistente en astenia, adinamia y dorsalgia que en los últimos 5 días se asoció a cefalea, escalofríos y debilidad en miembros inferiores, por lo cual decidió acudir a una farmacia donde le administraron un antibiótico vía oral, dipirona intramuscular y acetaminofén. A los días siguientes, el cuadro de debilidad se incrementó con compromiso de las 4 extremidades sin alteraciones de esfínteres ni síntomas sensitivos. Acudió a un hospital, donde, tras estudios, documentan tripomastigotes del T. cruzi en prueba de gota gruesa, por lo que deciden iniciar tratamiento con benzinidazol (fig. 1) esquema que se continuó al ser trasladada al hospital urbano. La paciente menciona un posible contacto durante uno de sus días de trabajo con el vector. Respecto a los antecedentes: hipertensión arterial en padres y madre con diabetes mellitus. Al examen físico, signos vitales con taquicardia y lo demás en parámetros normales; sin alteración en la esfera mental, pares craneales normales, cuadriparesia fláccida 3/5 con hiporreflexia +/++++ generalizada y respuesta plantar flexora. Se hospitalizó para estudios con función tiroidea, electrolitos, CPK normales, VIH negativo y EMG–NC compatible con polirradiculoneuropatía motora axonal aguda. Se inició ciclo con plasmaféresis con 5 días de esquema y al cabo del décimo día se realizó punción lumbar diagnóstica que evidenció disociación citoalbúmina (proteínas en 520mg/dl, células cero y resto de parámetros normales). Tras 15 días de hospitalización, se dio egreso al presentar mejoría de fuerza hasta 4/5 en miembros superiores y 3/5 en inferiores, con negativización de frotis de control. Completó esquema con benzonidazol por 60 días sin aparición de efectos adversos.
DiscusiónLa ECha fue descrita por el brasilero Carlos Chagas con la colaboración de Oswaldo Cruz en 19091: ambos determinaron que el T. cruzi es el agente causal de la ECha, dependiente de su vector el triatominio Rhodnius prolixus2. Su transmisión se da por medio de la introducción de las heces después de que el vector haya obtenido sangre de su víctima por medio de las laceraciones cutáneas o conjuntivales (principales), vía hematógena, vía vertical (2 al 10% de las gestantes con la enfermedad), vía oral o por accidentes de laboratorio1,2. En esta última vía las manifestaciones son totalmente diferentes, sin síntomas previos a los 5 días, con posterior miocarditis con alta mortalidad, mayor en el paciente joven1,2. Esta entidad afecta a 10 millones de personas en Latinoamérica1 según la OMS.
La enfermedad en fase aguda ocurre entre 10 y 60 días después de la infección; el 66% de los casos son asintomáticos1, ya que dependerá de la cepa del parásito y de las características del sistema inmune. Las características más comunes son los picos febriles, el signo de Romaña, conjuntivitis y, en otros casos más raros, las linfoadenopatías1.
Las manifestaciones neurológicas de la ECha se han clasificado en centrales, que podrían aparecer de forma aguda en el 10% e incluyen encefalitis, meningitis aséptica y enfermedad cerebrovascular1,2; la presentación a nivel periférico se ha visto casi en la totalidad de los casos en el estadio crónico de la enfermedad, y ha sido descrito que hasta un 35% de los casos ocurre en fase aguda, como en el caso presentado. Sin embargo, no hay reportes de casos descritos de síndrome de Guillain-Barré en esta fase. La neuropatía periférica no es una manifestación prominente de la ECha. Fue reconocida primero en modelos animales, antes de su identificación en humanos3,4. En modelos animales se han encontrado infiltrados linfocitarios de macrófagos y parásitos intracelulares a nivel de los nervios periféricos. Se ha visto destrucción neuronal de las astas anteriores en la médula espinal lumbar y torácica, aunque es más evidente en los plexos mioentéricos, con afectación de neuronas de gran y mediano calibre que al parecer también presentan un actividad reducida de la acetilcolinesterasa2.
El síndrome de Guillain-Barré se ha relacionado con antecedentes infecciosos recientes, principalmente con Campylobacter jejuni por diarrea, infecciones respiratorias, infección por el virus de la inmunodeficiencia humana, antecedente vacunal reciente por polio o tétanos y otras asociaciones infecciosas con citomegalovirus, virus de Epstein-Barr, Haemophilus influenzae, virus de la varicela-zóster y Mycoplasma pneumoniae. Por su parte, la eficacia de la plasmaféresis, como en el caso descrito, se ha demostrado frente a los primeros 7 días de presentación con 5 días de esquema5,6.
La neuropatía periférica es un hallazgo común a nivel subclínico en humanos, especialmente en el examen electrofisiológico, tanto en la fase aguda como en la crónica7,8. En el 10% de los casos se han vistos neuropatías sensitivo-motoras con sintomatología mixta, aunque en la mayoría de los casos solo se refiere sintomatología sensitiva y en estudios electrofisiológicos se determinaron procesos de desmielinización y pérdida axonal sin visualización de bloqueos de la conducción2,3. Histopatológicamente se ha visto denervación parcial, además de infiltrados granulomatosos perivasculares y lesiones desmielinizantes multifocales2.
Otros casos de compromiso periférico se presentan como sinapticopatías con lesiones de la unión neuromuscular2 o miopatías en las que la parasitemia produce lisis muscular del músculo liso del sistema digestivo principalmente y lesiones agudas con infiltrados mononucleares con predominio de CD8+, causando necrosis de fibras musculares y la atrofia de las restantes a nivel endomisial y perivascular2. Finalmente en la forma disautonómica, principalmente a nivel del sistema parasimpático (30% de los casos), se ha visto parasitismo neuronal con periganglionitis y anormalidades degenerativas de las células de Schwann con necrosis de las células autonómicas del corazón, del esófago y del colon2.
En un estudio realizado se encontró que individuos que padecían la ECha presentaron reactividad positiva frente a los anticuerpos antigangliósidos, siendo estos glucolípidos estructura de la mielina, dada la reactividad frente a antígenos del parásito, lo que podría ser la explicación del desarrollo de una neuropatía periférica9. Se ha determinado la presencia de antígenos del huésped como la proteína ribosomal de 23kD, la miosina, la proteína B13 y el péptido-Cha como causante de reacciones cruzadas en infecciones por el T. cruzi10, determinando una fisiopatología autoinmune común y una posible asociación entre esta parasitemia en fase aguda y el síndrome de Guillain-Barré.
Las manifestaciones neurológicas de la ECha son de expresión en el sistema nervioso central y en el periférico. La correlación entre EcCha y síndrome de Guillain-Barré como una manifestación neurológica en la fase aguda es poco frecuente en la literatura pero debe tenerse presente como una expresión clínica para futuros casos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.