El riñón está implicado en la homeostasis de la glucosa a través de 3 mecanismos principales: la gluconeo-énesis renal, el consumo de glucosa para satisfacer las necesidades energéticas renales y la reabsorción de glucosa en el túbulo proximal. La reabsorción de glucosa es una de las funciones fisiológicas renales de más relevancia, gracias a la cual se recupera la totalidad de la glucosa filtrada, la orina queda libre de glucosa y se evita la pérdida de calorías. Aproximadamente el 90% de la glucosa es reabsorbido en el segmento S1 del túbulo proximal, donde se localizan los transportadores SGLT2 y GLUT2, mientras que el 10% restante es reabsorbido en el segmento S3, donde predominan SGLT1 y GLUT1. En pacientes con hiperglucemia, el riñón continúa reabsorbiendo glucosa, por lo que contribuye a perpetuar la hiperglucemia. La mayor parte de la reabsorción renal de glucosa está mediada por transportadores SGLT2. Varios estudios experimentales y clínicos sugieren que el bloqueo farmacológico de estos transportadores podría aportar beneficios en el manejo de la hiperglucemia en pacientes con diabetes tipo 2.
The kidney is involved in glucose homeostasis through three main mechanisms: renal gluconeogenesis, renal glucose consumption and glucose reabsorption in the proximal tubule. Glucose reabsorption is one of the most relevant physiological functions of the kidney, through which filtered glucose is fully recovered, urine is free of glucose, and calorie loss is prevented. Approximately 90% of the glucose is reabsorbed in the S1 segment of the proximal tubule, where GLUT2 and SGLT2 transporters are located, while the remaining 10% is reabsorbed in the S3 segment by SGLT1 and GLUT1 transporters. In patients with hyperglycaemia, the kidney continues reabsorbing glucose, and hyperglycaemia is maintained. Most renal glucose reabsorption is mediated by the SGLT2 transporter. Several experimental and clinical studies suggest that pharmacological blockade of this transporter might be beneficial in the management of hyperglycemia in patients with type 2 diabetes.
La nefrona es la unidad funcional del riñón. Cada riñón contiene aproximadamente entre 1-1,3 millones de nefronas. La nefrona se divide en 2 estructuras fundamentales: el glomérulo y el túbulo. El glomérulo está formado por un conglomerado de capilares con 3 capas celulares, el endotelio capilar, la membrana basal y la capa de células epiteliales. Esta estructura actúa como microfiltro, tanto para agua como para otras sustancias. En el túbulo pueden distinguirse varias porciones: túbulo proximal, asa de Henle y túbulo distal. En el túbulo, el fluido filtrado en el glomérulo se transforma en orina tras la reabsorción de agua y diversos solutos. La reabsorción tubular de glucosa es una de las funciones fisiológicas renales de más relevancia, gracias a la cual se recupera la totalidad de la glucosa filtrada, por lo que la orina queda libre de glucosa y se evita la pérdida de calorías1. El desarrollo de nuevos fármacos dirigidos a modular dicha reabsorción tubular de glucosa supone un cambio de concepto en el manejo de la diabetes, centrado hasta fechas recientes en la insulina.
Homeostasis de la glucosaLa concentración plasmática de glucosa se mantiene en condiciones normales alrededor de los 90 mg/dl gracias a un exquisito equilibrio entre la absorción intestinal de glucosa, la glucogenólisis hepática, la reabsorción y la excreción renal de glucosa, y la gluconeogénesis que se produce tanto en el hígado como en el riñón1,2. El mantenimiento de la glucemia es de gran importancia para evitar las consecuencias patológicas de la hiper y la hipoglucemia. Es bien sabido que la hiperglucemia mantenida se traduce en la aparición de afectación retiniana, renal y neurológica, además de incrementar el riesgo de enfermedades cardiovasculares2. Por otra parte, la hipoglucemia se acompaña de sintomatología que afecta al sistema nervioso central y contribuye al incremento de la morbilidad de distintas causas2,3. El riñón está implicado en la homeostasis de la glucosa a través de 3 mecanismos principales: la liberación de glucosa en el torrente sanguíneo mediante la gluconeogénesis, el consumo de glucosa para satisfacer las necesidades energéticas renales y la reabsorción de glucosa en el túbulo proximal (tabla 1)4.
Metabolismo y transporte de la glucosa en sujetos no diabéticos.
| Glucosa corporal total | ~ 450 g/día |
| Consumo de glucosa | ~ 250 g/día |
| Cerebro | ~ 125 g/día |
| Resto del organismo | ~ 125 g/día |
| Glucosa de la dieta | ~ 180 g/día |
| Producción de glucosa (gluconeogénesis y glucogenólisis) | ~ 70 g/día |
| Filtración y reabsorción renal de glucosa | ~ 180 g/día |
| Concentración plasmática de glucosa | ~ 90 mg/dl |
| Glucosa sanguínea total | ~ 4-5 g |
Modificada de referencia 4.
La liberación de glucosa al torrente circulatorio en el organismo se produce a través de 2 mecanismos fundamentales: la glucogenólisis, fundamentalmente en el hígado, y la gluconeogénesis, producida tanto en hígado como en riñón.
Mediante la gluconeogénesis se sintetiza glucosa-6-fosfato a partir de precursores como el lactato, el glicerol y diversos aminoácidos. Posteriormente, tras la acción hidrolítica de la glucosa-6-fosfatasa se obtiene glucosa libre5.
La utilización de la glucosa por el riñón se produce fundamentalmente en la médula renal, mientras que la liberación de glucosa se produce en la corteza. Esta separación se debe a las diferencias en la distribución de las enzimas implicadas a lo largo de la nefrona5. En la médula renal hay una importante actividad fosforilativa y glucolítica, pero las células medulares carecen de glucosa-6-fosfatasa, por lo que no pueden liberar glucosa libre a la circulación. Por el contrario, las células de la corteza renal sí disponen de dicha enzima5. La gluconeogénesis renal consiste en la síntesis de novo de glucosa a partir de precursores no carbohidratos como lactato, glutamina, alanina y glicerol. Aunque es difícil de determinar, se ha estimado que la contribución renal a la liberación de glucosa corporal es aproximadamente del 20%. Teniendo en cuenta que la gluco-neogénesis supone aproximadamente el 50% de toda la glucosa liberada, puede estimarse que la gluconeogénesis renal es responsable del 40% del total5.
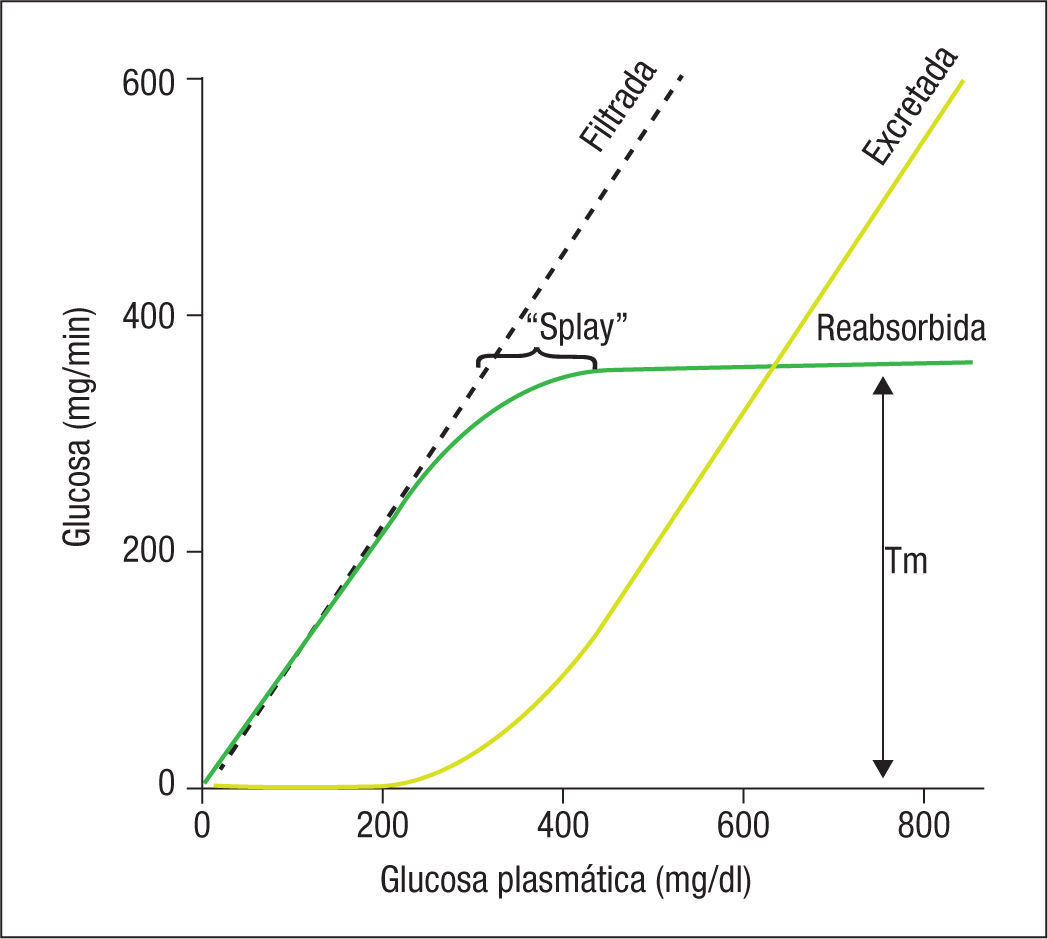
La cantidad de glucosa filtrada por el glomérulo se define como el producto de la concentración plasmática de glucosa y la tasa de filtrado glomerular (TFG)1. A modo de ejemplo, para una TFG de 125 ml/min y una glucemia de 100 mg/dl, la carga de glucosa filtrada es de 125 mg/min (lo que supone 180 g de glucosa al día)6. A medida que la concentración plasmática de glucosa aumenta, la carga de glucosa filtrada se incrementa de forma lineal (fig. 1)1,7.
Transportadores renales de glucosaLa presencia de transportadores de membrana es imprescindible para desplazar la glucosa dentro y a través de la célula renal. Dicho transporte se realiza mediante la participación de 2 tipos de transportadores: los facilitadores del transporte de glucosa (GLUT) y los co-transportadores de glucosa acoplados a los canales de sodio (SGLT)8. Estos transportadores controlan el transporte y la reabsorción de glucosa en varios tejidos, incluyendo el túbulo proximal renal, el intestino delgado, la barrera hematoencefálica y otros tejidos periféricos8.
Los GLUT participan en el transporte pasivo de glucosa a través de las membranas celulares, por lo que facilita el equilibrio de concentración a ambos lados de la membrana8. Por el contrario, los SGLT median el transporte de glucosa frente a un gradiente de concentración gracias al cotransporte de sodio9. La energía necesaria para este proceso es aportada por el gradiente transmembrana de sodio, que se mantiene por la actividad de la bomba sodio-potasio ATPasa8.
La tabla 2 recoge un listado descriptivo de los principales transportadores GLUT y SGLT expresados en el tejido renal10. Además, la mayoría de ellos se expresa en otros tejidos. La mayoría de las células expresan más de un transportador de glucosa. Los requerimientos energéticos de cada tejido se reflejan en el tipo de transportadores de glucosa expresados9.
Distribución y propiedades de los principales transportadores GLUT (transportador de glucosa) y SGLT (cotransportador sodio-glucosa) identificados en el tejido renal.
| Transportador | Distribución | Función en el riñón |
|---|---|---|
| SGLT1 | Intestino, túbulo proximal renal (segmento S3) | Reabsorción de la glucosa no reabsorbida por SGLT2 |
| SGLT2 | Túbulo proximal renal (segmentos S1 y S2) | Reabsorción de la mayor parte de la glucosa |
| SGLT4 | Intestino, riñón, hígado, cerebro, pulmón, tráquea, útero, páncreas | ? |
| SGLT6 | Cerebro, riñón, intestino | ? |
| GLUT1 | Muy extendido, sobre todo en eritrocitos y endotelio vascular | Liberación a la circulación de la glucosa reabsorbida por SGLT1 |
| GLUT2 | Hígado, páncreas, intestino, túbulo proximal renal | Liberación a la circulación de la glucosa reabsorbida por SGLT2 |
Modificada de referencia 10.
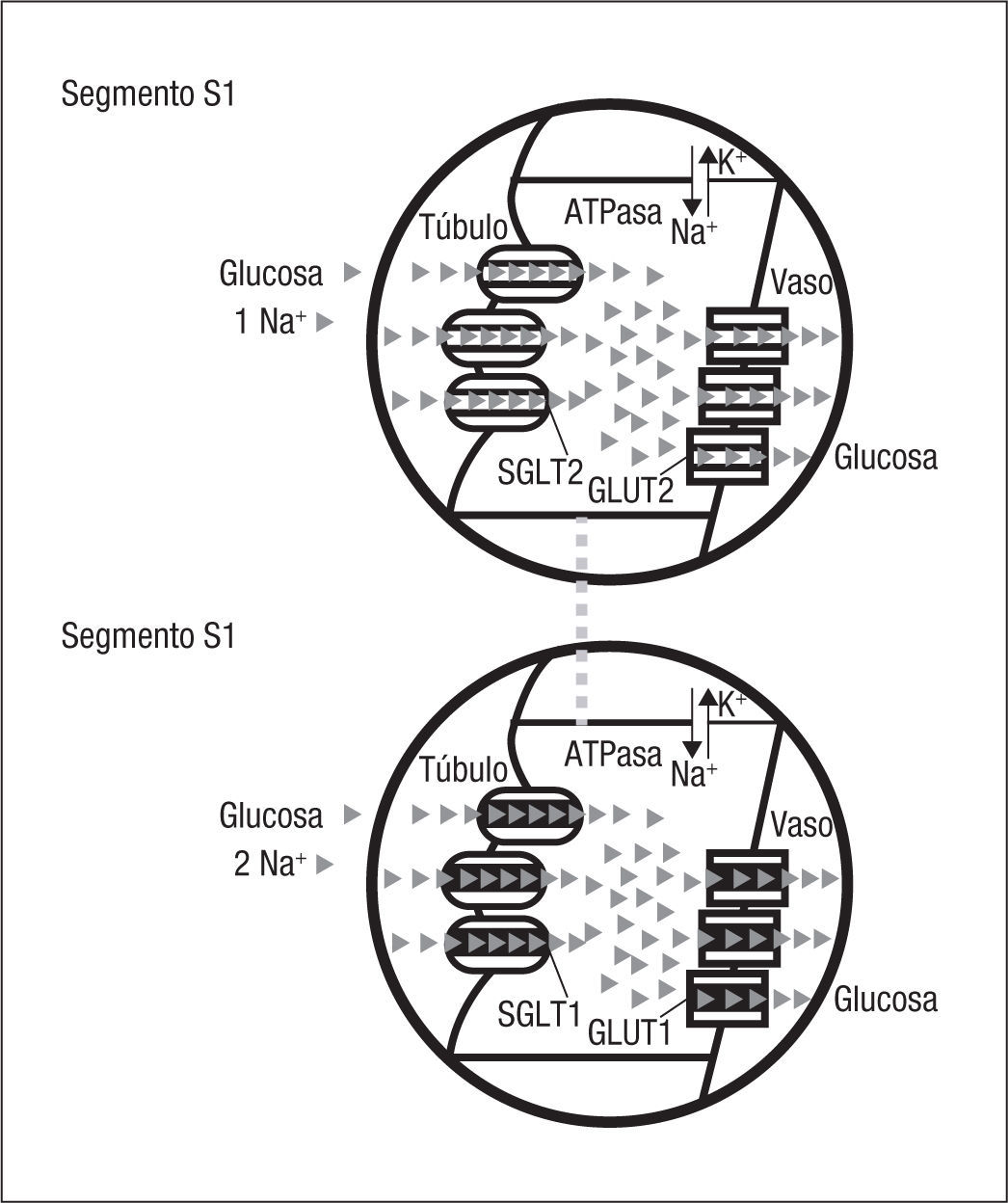
De los 4 transportadores SGLT expresados en el riñón (SGLT1, SGLT2, SGLT4 y SGLT6), SGLT2 es el más importante8,11. SGLT2 se expresa de forma predominante en la superficie luminal de las células de la primera parte del túbulo proximal (segmentos S1 y S2)12. Se trata de un transportador de baja afinidad y alta capacidad, con una ratio sodio:glucosa de 1:1 (fig. 2)9,13. Varios estudios experimentales sugieren que SGLT2 es el responsable de la reabsorción del 90% de la glucosa filtrada por el glomérulo14. El 10% restante es reabsorbido por SGLT1, que presenta elevada afinidad y baja capacidad, con una ratio sodio:glucosa de 2:1, y se expresa en la superficie luminal del segmento S3 del túbulo proximal9,13.
GLUT2 es el principal transportador pasivo de glucosa expresado en el riñón. Está presente en la membrana basolateral de las células epiteliales de los segmentos S1 y S2 del túbulo proximal, y tiene menor afinidad por la glucosa en comparación con los demás transportadores de tipo GLUT9,14. La función de GLUT2 es liberar al torrente circulatorio la glucosa reabsorbida en el túbulo proximal por los transportadores SGLT9. En el segmento S3, dicha función es realizada por el transportador GLUT114,15.
El papel predominante del transportador SGLT2 en la reabsorción renal de glucosa ha determinado que su bloqueo selectivo sea una de las potenciales estrategias beneficiosas en pacientes con diabetes16,17.
Reabsorción renal de glucosa en la diabetes tipo 2En condiciones fisiológicas con una TFG normal, toda la glucosa filtrada es reabsorbida cuando la glucemia es < 180 mg/dl. Dicha concentración se conoce como el umbral renal de la glucosa6,18. Sin embargo, cuando la glucemia excede dicha concentración, el riñón empieza a excretar glucosa en la orina. Además, cuando la reabsorción de glucosa alcanza su máxima capacidad (Tm glucosa [transporte máximo de glucosa]) en el túbulo proximal, aparece la glucosuria7,18. En los sujetos sanos no diabéticos, el Tm glucosa se sitúa alrededor de los 375 mg/min18,19. Cuando se supera el umbral renal de glucosa se produce una diferencia entre la reabsorción real de glucosa y la teórica, con el consiguiente “aplanamiento” de la curva de glucosa reabsorbida19. Además, este fenómeno se produce de forma heterogénea, ya que el Tm no es igual en todas las nefronas, y depende de la longitud de estas y del número de transportadores de glucosa. La glucosuria también puede aparecer en presencia de concentraciones plasmáticas de glucosa más bajas en situaciones de hiperfiltración, como ocurre por ejemplo durante el embarazo1.
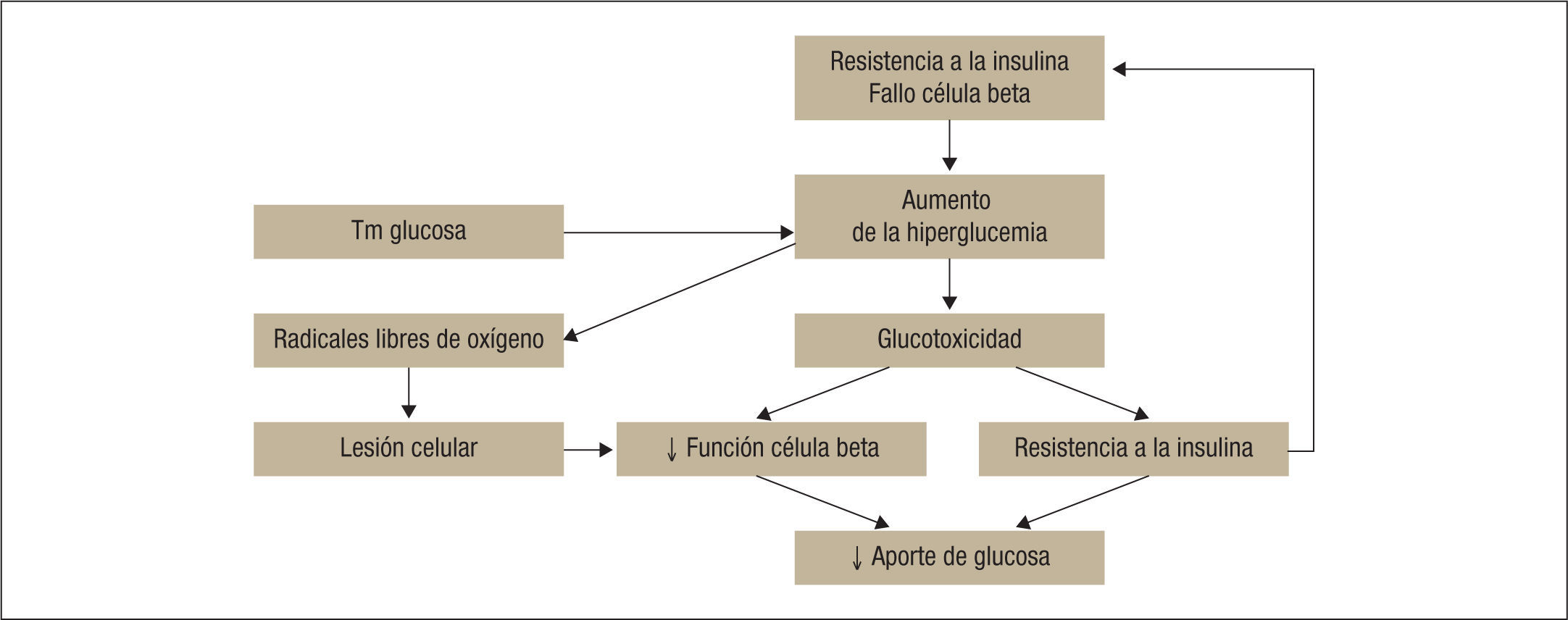
En una situación de hiperglucemia sostenida, la reabsorción renal de glucosa contribuye al mantenimiento de dicha hiperglucemia19. A medida que la glucemia aumenta, la reabsorción de glucosa también se incrementa. Varios trabajos han mostrado que, en pacientes con diabetes, el Tm glucosa es más elevado que en sujetos no diabéticos20,21. La hiperglucemia prolongada puede contribuir en la glucotoxicidad, mecanismo por el que la hiperglucemia favorece una pérdida de la función betapancreática (fig. 3)22,23.
Los efectos del aumento de la reabsorción renal de glucosa en situaciones de hiperglucemia han sido motivo de varios estudios animales y con modelos celulares humanos. Las ratas diabéticas con hiperglucemia presentan un incremento de la expresión génica de SGLT2 y GLUT2, lo que conlleva un aumento de la reabsorción renal de glucosa19,24–27. Además se ha descrito un incremento de la expresión de ARN mensajero de SGLT2 y GLUT2 y un aumento de la actividad transportadora en cultivos de células de túbulo proximal de personas con diabetes tipo 2 en comparación con las de sujetos sanos28. Dicha sobreexpresión está regulada por la propia hiperglucemia, ya que tras la corrección de esta se ha descrito una reducción de la expresión génica de SGLT219,24–27.
ConclusionesEl riñón participa de forma clave en diversos procesos fisiológicos como el mantenimiento de una adecuada hidratación, el equilibrio hidroelectrolítico y ácido-base y el balance de glucosa, entre otros. En el glomérulo se produce un filtrado masivo de agua y solutos que después son reabsorbidos de forma selectiva por el túbulo proximal. Cada día los riñones filtran unos 180 g de glucosa, que son reabsorbidos en su totalidad en el túbulo. Aproximadamente el 90% de la glucosa es reabsorbido en el segmento S1, donde se localizan los transportadores SGLT2 y GLUT2, mientras que el 10% restante es reabsorbido en el segmento S3, donde predominan SGLT1 y GLUT1. Además, GLUT1 y GLUT2 participan en el transporte pasivo de glucosa a través de la membrana basolateral de las células tubulares. En personas con hiperglucemia, el riñón continúa reabsorbiendo glucosa, por lo que contribuye a perpetuar la hiperglucemia. La mayor parte de la reabsorción renal de glucosa está mediada por transportadores SGLT2. Varios estudios experimentales y clínicos sugieren que el bloqueo farmacológico de estos transportadores podría aportar beneficios en el manejo de la hiperglucemia en pacientes con diabetes tipo 2, que estarían mediados por un mecanismo de acción diferente del resto de tratamientos antidiabéticos17.
Conflicto de interesesEl autor declara haber recibido honorarios como ponente o asesor de AstraZeneca, Boehringer, Esteve y Janssen.