La inmunodepresión en el trasplante de órganos tiene como objetivo fundamental la prevención de los episodios de rechazo agudo, con el mínimo de efectos secundarios sobre el injerto y el paciente, tanto a corto como a medio y largo plazo. Otros objetivos son evitar o reducir la incidencia de disfunción crónica del injerto y la tasa de recurrencia de la enfermedad que motiva el trasplante. Por ello, dado que los inmunodepresores actuales son muy eficaces en la prevención del rechazo, es muy importante ajustar la dosificación al mínimo eficaz para conseguir los objetivos, especialmente en la etapa de mantenimiento.
Aunque la introducción de la ciclosporina A (CsA) a principios de la década de los años ochenta posibilitó el desarrollo de los trasplantes, al reducir tanto la incidencia como la gravedad de los episodios de rechazo y mejorar espectacularmente la supervivencia del paciente y del injerto, su primera formulación (Sandimmun®) presentaba una absorción irregular e impredecible, lo que limitaba su utilidad clínica. La aparición de la nueva formulación en microemulsión (Sandimmun Neoral®) mejoró estos problemas farmacocinéticos, ya que proporcionaba un perfil de absorción más predecible y fiable, con menos variabilidad en los pacientes y una mayor área bajo la curva que la formulación convencional; esta ventaja supuso una mejor tolerancia y superioridad clínica en comparación con la formulación previa1-5.
Justificación farmacocinética, farmacodinámica y clínica del análisis de las concentraciones de ciclosporina en sangre
En su formulación actual la CsA sigue mostrando una notable variabilidad en su biodisponibilidad entre pacientes y en un mismo paciente que justifica, dado su estrecho margen terapéutico, el análisis de su perfil farmacocinético para el ajuste de la dosis y la optimización de su uso clínico6. La máxima absorción de la CsA se produce normalmente dentro de las 2 h siguientes a la administración oral, lo que conduce a un rápido pico de concentración en sangre y un descenso paulatino, si bien existe una gran variabilidad de un paciente a otro, dependiendo del grado de absorción gastrointestinal individual. En el postoperatorio del trasplante esta absorción puede estar alterada por la existencia de edema intestinal o íleo, o según el grado de flujo biliar. Durante la etapa de mantenimiento una exposición inadecuada al fármaco, bien por defecto con incremento del riesgo de rechazo, bien por exceso lo que favorece la nefrotoxicidad, podría contribuir al desarrollo de la disfunción crónica del injerto, lo cual limita la supervivencia de éste y contribuye a la morbilidad y mortalidad del paciente trasplantado.
La forma más precisa de valorar el grado de absorción y exposición al fármaco consistiría en determinar las concentraciones en las 4 o en las 12 h siguientes a la administración y establecer una curva de concentraciones del fármaco en sangre (área bajo la curva [ABC]: ABC0-4 o ABC0-12). La imposibilidad de realizar esto en la práctica habitual llevó a la búsqueda del punto de la curva que mejor se relacionara con el ABC. Las concentraciones predosis (C0), que habían servido de referencia para los ajustes de dosis durante 2 décadas, no guardan relación con la exposición al fármaco medida por el ABC0-12, o su expresión simplificada ABC0-4, ni predicen el riesgo de rechazo agudo6,7.
Estudios recientes6-9 han mostrado que el punto de la curva que mejor predice la exposición al fármaco, así como la máxima inhibición de la interleucina 2, es la concentración a las 2 h de la administración (C2). Además, éste es el punto que mejor se relaciona con la concentración máxima del fármaco y el ABC, y es capaz de predecir la toxicidad del fármaco. La estrecha relación6 entre el ABC0-4 y la C2 hacen de esta última el parámetro farmacocinético ideal para el ajuste de la dosificación de CsA en la práctica clínica8,9. No obstante, algunos autores no ven ventaja en utilizar la determinación de la C210,11.
Otra ventaja de la determinación de la C2 es que permite identificar a un grupo de pacientes que presentan escasa absorción o absorción retrasada mediante la medición de otro punto de concentración9. En los pacientes en los que la C0 sea muy similar a la C2 debe descartarse una alteración de la absorción y considerarse la posibilidad de una curva de absorción desplazada o disminuida. En estos casos puede determinarse la concentración a las 6 h de administrarse la dosis (C6 ): si es similar a la C2, puede considerarse que el paciente presenta una absorción escasa y se recomendará aumentar la dosis en función de la C2; si la C6 es mayor que la C2, se considerará que presenta una absorción lenta y se recomendará ajustar la dosis en función de la C6.
Análisis de la ciclosporina A en sangre mediante la C2 en el trasplante renal
Postrasplante renal de novo
Determinación de la C2 y riesgo de rechazo agudo. La incidencia de rechazo agudo se relaciona con el ABC0-4 alcanzada en los primeros 3-5 días postrasplante (un 45% en 22 pacientes con ABC0-4 < 4.400 ng/h/ml frente al 3% en 33 pacientes con ABC0-4 > 4.400 ng/h/ml; p = 0,002)7. Otros autores han confirmado la relación entre el ABC0-4, el ABC0-12, la C2 y el riesgo de rechazo agudo en el postrasplante inmediato12,13. El riesgo es menor en pacientes que alcanzan una C2 mayor de 1.500 ng/ml al tercer día del trasplante.
El estudio MO2ART14 fue el primer ensayo multicéntrico internacional que se propuso evaluar la eficacia y seguridad de la determinación de la C2. Incluyó a 296 pacientes, que recibieron tratamiento triple con esteroides, CsA en microemulsión (Neoral) y micofenolato mofetil (MMF) o azatioprina (11%). Las dosis iniciales de CsA fueron de 10 mg/kg y se ajustaron mediante la determinación de C2 a partir del día 2 con la finalidad de alcanzar los valores diana al quinto día de evolución. En los pacientes que presentaron función retrasada del injerto (el 33,8%) se logró reducir la C2 diana al 50%, lo que permitió la inducción con anticuerpos.
Durante los primeros 3 meses todos los pacientes se sometieron a C2 de referencia comunes, acordes con experiencias clínicas previas. A partir del cuarto mes se les aleatorizó según 2 intervalos de C2 hasta completar el año de seguimiento. Se dispone de los resultados durante el primer trimestre14.
Al quinto día del trasplante el 60,8% de los pacientes con función renal conservada y el 19,5% de los que presentaron función retrasada del injerto tuvieron C2 superiores a 1.600 ng/ml14. La incidencia de rechazo agudo confirmado por biopsia fue del 11,4% (un 10,4% en aquellos con función renal inmediata y un 13,3% en aquellos con función retrasada del injerto). La supervivencia del injerto fue del 91,2%, y la del paciente, del 96,6%. La creatinina sérica media fue de 132 mmol/l a los 3 meses de evolución, sin diferencias entre los pacientes con función renal inicial conservada (130 mmol/l) o retrasada (140 mmol/l). Los autores concluyeron que la determinación de la C2 en pacientes trasplantados de novo con riesgo estándar se siguió de una baja incidencia de rechazo, sin incremento de los efectos secundarios, lo que validaba en términos de seguridad y eficacia el valor del control de la C2 en el primer trimestre.
Control de la C2 e inmunodepresión coadyuvante. La mayor experiencia en el control de la C2 se ha obtenido con protocolos de doble tratamiento con CsA y esteroides o de triple tratamiento, añadiendo azatioprina o MMF. Se consideraron óptimas las C2 superiores a 1.500 ng/ml entre los 3 y 5 días posteriores al trasplante13. La adición de basiliximab no modificó la C2 predictiva de un riesgo de rechazo agudo13.
Aunque en algunas de las series analizadas un porcentaje variable de pacientes recibió globulinas antilinfocíticas de manera profiláctica, aún no se ha establecido cómo influyen en las C2 predictivas de rechazo. Únicamente en el ensayo MO2ART se observó que en los pacientes que recibieron inducción las dosis iniciales y las cifras diana de C2 pudieron reducirse a la mitad sin que los pacientes presentaran un riesgo incrementado de rechazo agudo14.
Recientemente se ha publicado la experiencia de 2 ensayos con el inhibidor de mTOR everolimus, asociado a CsA y esteroides15. Ambos contemplaban la administración de 2 dosis de everolimus, 1,5 o 3 mg/día; las dosis iniciales de CsA en el primer ensayo fueron de 8 mg/kg/día, mientras que en el segundo se redujeron a la mitad, 4 mg/kg/día, y se asoció basiliximab a la dosis estándar de 20 mg los días 0 y 4 postrasplante. Los ajustes de dosis de la CsA se efectuaron según la C2: en el primero los valores fueron de 1.000-1.400 ng/ml en el primer mes, 700-900 ng/ml en el segundo, 550-650 ng/ml en el tercero y 350-450 ng/ml en los meses 4 a 12; en el segundo estudio, con basiliximab, los valores diana de C2 fueron 500-700 ng/ml los primeros 2 meses y 350-450 ng/ml los meses 3 a 12. La incidencia de rechazo agudo fue del 13 al 25% según los grupos, significativamente mayor en los pacientes cuyos valores de everolimus fueron inferiores a 3 ng/ml. La dosis media de CsA al mes del trasplante en el primer estudio fue de 4,7 mg/kg/día y la C2 se situó en torno a 1.150 ng/ml, sin diferencias entre ambas dosificaciones de everolimus. En el segundo estudio las dosis fueron de 3 mg/kg/día y la C2 de 700 ng/ml. La mediana del filtrado glomerular a los 6 meses varió entre 62 y 67 ml/min en los diversos grupos15.
Control de la C2 y función retrasada del injerto. En presencia de necrosis tubular aguda establecida, existe la inclinación a intentar minimizar la nefrotoxicidad, por lo que se tiende a reducir las dosis de CsA o a demorar su introducción. En estas circunstancias, hay un riesgo incrementado de rechazo agudo, que puede paliarse con la inducción con anticuerpos14.
Dada la utilización creciente de injertos procedentes de donantes de edades avanzadas, a corazón parado, con isquemias frías prolongadas u otras circunstancias que incrementen el riesgo de presentar función retrasada del injerto, queda por establecer si en estos grupos de pacientes serían seguras las C2 de referencia para la población estándar. Muy probablemente, los datos derivados del estudio MO2ART indican que la inducción con globulinas antilinfocíticas o anticuerpos frente al receptor de la interleucina 2, asociada a dosis bajas de CsA, con el objetivo de alcanzar unas C2 reducidas, sería más segura sin detrimento de la eficacia en la prevención del rechazo del injerto. En un reciente estudio aleatorizado y multicéntrico español en receptores de riñones con un riesgo alto de función retrasada, la administración de dosis muy bajas de CsA controladas mediante la determinación de la C2 desde el primer día de trasplante, combinada con inducción con basiliximab, MMF y esteroides, se asoció con mínimas tasas de rechazo y una menor incidencia de función retrasada en comparación con la introducción diferida de CsA16.
Control de la C2 en receptores pediátricos. La C2 se relaciona de manera más estrecha con el ABC0-4 y el ABC0-12 que la C0 en receptores pediátricos de trasplante renal de novo17. Una C2 superior a 1.500 ng/ml en el quinto día postrasplante previno el rechazo agudo, que apareció en el 50% de los pacientes que no alcanzaron dicha concentración. La exposición a la CsA, medida por C2 o ABC0-4, no se relacionó con un incremento de la creatinina sérica u otros efectos adversos. Kovarik et al18 confirmaron que la relación entre ABC0-4 y C2 al séptimo día del trasplante era similar a la observada en la población trasplantada adulta, de modo que propusieron unos valores de referencia similares.
Control de la C2 y trasplante de riñón y páncreas. Ricart et al19 han comunicado su experiencia con el control de la C2 en una serie de 10 pacientes con trasplante de riñón y páncreas de novo a quienes se aplicó un protocolo de tratamiento triple con MMF e inducción con basiliximab. En los meses 1, 3 y 6 la C2 fue de 1.380; 1.085, y 1.192 ng/ml, y la creatinina sérica de 1,4; 1,6, y 1,5 mg/dl, respectivamente. Dos pacientes presentaron episodios de rechazo agudo corticosensible, permaneciendo los injertos funcionantes a los 6 meses.
Postrasplante renal de mantenimiento
La C2 apropiada de CsA en la población con trasplante renal que recibe tratamiento de mantenimiento (a partir del primer año del trasplante) es motivo de debate. Parece confirmarse que la determinación de la C2 también es útil en esta etapa, pero hacen falta más datos para confirmar los posibles efectos beneficiosos en la prevención del rechazo crónico y en la minimización de la nefrotoxicidad y los efectos secundarios.
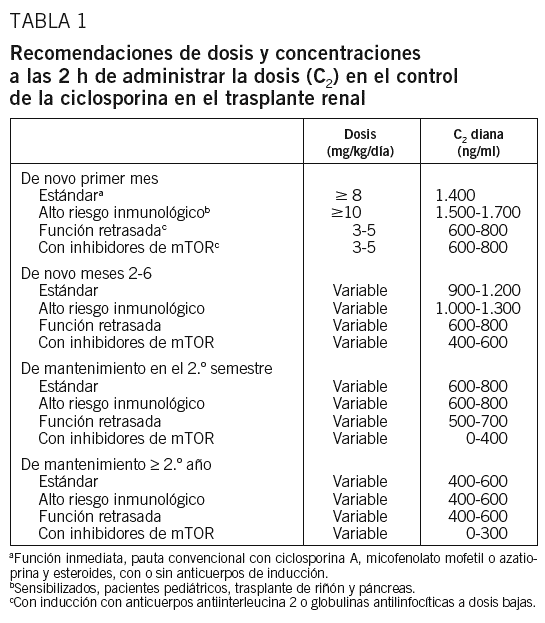
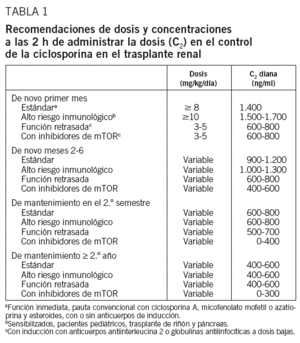
La mayoría de los estudios parecen confirmar que se requieren unas C2 menores que las tradicionalmente recomendadas, aunque los intervalos todavía son muy amplios20-29. Esta tendencia a aconsejar valores en sangre inferiores a los inicialmente propuestos se sustenta también en estudios farmacodinámicos en que una C2 de 384 ng/ml se asoció a una buena inhibición de la calcineurina, interleucina 2 y síntesis de interferón25. Podría aconsejarse, por tanto, mantener unas C2 de CsA en torno a 500 ng/ml, teniendo en cuenta que tal recomendación no está sustentada por evidencias concluyentes. Probablemente los pacientes en tratamiento triple necesiten concentraciones menores, y los pacientes en monoterapia con CsA, concentraciones superiores (tabla 1).
Resumen
La dosis inicial de CsA dependerá de la C2 objetivo, de la medicación coadyuvante y del perfil del paciente. En los pacientes de riesgo estándar que comienzan con función renal conservada y a los que se aplica un protocolo convencional con CsA, esteroides y MMF o azatioprina, con o sin inducción con anticuerpos frente al receptor de la interleucina 2, la dosis inicial de CsA no debería ser inferior a 8 mg/kg/día, con el objetivo de alcanzar valores superiores a 1.400 ng/ml antes del quinto día postrasplante y mantenerlos durante el primer mes.
Los pacientes pediátricos, otros considerados de mayor riesgo inmunológico e incluso los receptores de riñón y páncreas podrían requerir C2 de hasta 1.700 ng/ml antes del quinto día postrasplante. Para alcanzar los objetivos propuestos puede ser necesario realizar frecuentes determinaciones de la C2, cada 48 h, durante las primeras 2 semanas, dada la amplia variabilidad en la absorción y biodisponibilidad del fármaco tanto entre los distintos pacientes como en un mismo paciente. En aquellos con una C2 baja a pesar de incrementos de las dosis, debería determinarse la C6 para establecer si presentan escasa absorción o absorción lenta.
Los valores antes mencionados pueden disminuir a 1.200 ± 100 ng/ml en el segundo mes; 1.000 ± 100 ng/ml en el tercero; 900 ± 100 ng/ml en los meses 4 a 6, y 700 ± 100 ng/ml el segundo semestre.
Los pacientes con función retrasada del injerto o con alto riesgo de desarrollarla podrían beneficiarse de la administración de dosis reducidas de CsA, entre 3 y 5 mg/kg/día, en los protocolos de tratamiento triple antes mencionados, junto con inducción con anticuerpos frente al receptor de la interleucina 2 o globulinas antilinfocíticas a dosis bajas.
Con la introducción de nuevos inmunodepresores como el everolimus, las C2 de referencia podrían disminuir significativamente, con la consiguiente reducción del riesgo de nefrotoxicidad, pero sin pérdida de la eficacia inmunodepresora.
En la etapa de mantenimiento, en ausencia de evidencias, sería aconsejable mantener las C2 en torno a 500 ng/ml. Probablemente dichas concentraciones podrían reducirse en pacientes con tratamiento triple e incrementarse en los pacientes en monoterapia.
Control de la ciclosporina A mediante la C2 en el trasplante hepático
Postrasplante hepático de novo
Estudios comparativos entre la C0 frente a la C2 de ciclosporina A. El estudio internacional INT-0630 fue el primer estudio prospectivo que se concibió para comparar la determinación de la C0 frente a la C2 en el trasplante hepático. Incluyó a un total de 307 pacientes de 29 centros repartidos en 9 países. Se recomendó iniciar el tratamiento con 15 mg/kg/día en 2 dosis, y las cifras propuestas fueron de 250-400 ng/ml para el grupo de C0 y de 850-1.400 ng/ml para el grupo de C2. La dosis media inicial durante el primer mes fue más elevada en el grupo de C2 (12,9 frente a 10,3 mg/kg/día; p < 0,001). La incidencia de rechazo agudo probado por biopsia fue inferior en el grupo de C2 (un 21,6 frente a un 30,4%; p = 0,054), y también la de rechazo moderado o grave (un 47 frente al 70%; p = 0,004). La tasa de rechazo en los pacientes del grupo de C2 que alcanzaron la concentración propuesta el día 3 fue del 12,5%, frente al 26,3% cuando la alcanzaron el día 7 (p < 0,03). Entre los pacientes con infección por el virus de la hepatitis C la incidencia de rechazo fue significativamente menor en el grupo de C2 frente al de C0 (el 21 frente al 33%). Este hallazgo es particularmente importante en este grupo de pacientes, ya que el tratamiento del rechazo con bolos de esteroides se ha asociado en algunos estudios a la gravedad de la recurrencia de la infección por el virus de la hepatitis C. La conclusión del estudio fue que la C2 es superior a la C0 en el control de la CsA, ya que tanto la tasa global de rechazo como la gravedad de éste son menores, y la tolerancia, similar.
Dos estudios prospectivos de centro único evaluaron el beneficio clínico del control de la C2 de CsA en receptores de trasplante hepático de novo31,32. En el primero, la dosis inicial fue de 15 mg/kg/día y las concentraciones diana perseguidas fueron de 800-1.200 ng/ml, que se alcanzaron en todos pacientes al quinto día29. La tasa de rechazo fue del 7%, siempre corticosensible. El segundo comparó un grupo en que se controló la C0 (n = 70) frente a otro con C2 (n = 38)30. La dosis inicial fue de 20 mg/kg/día, y las concentraciones diana, las estándares, que todos alcanzaron. La tasa de rechazo fue del 26 y el 18% para los grupos de C0 y de C2, respectivamente. La necesidad de reciclaje esteroideo fue mayor con C0 (del 76 frente al 50%), y la disfunción renal, menor (del 37 frente al 51%).
Estudios comparativos de la C2 de ciclosporina A frente a tacrolimus. El LIS2T33 es el primer estudio multicéntrico, prospectivo y abierto que ha comparado la seguridad y la eficacia del control de la C2 de CsA Neoral® (n = 250) frente a tacrolimus (n = 245) en el trasplante hepático de novo en adultos. La dosis inicial recomendada de CsA fue de 10-15 mg/kg/día, y las concentraciones deseadas, de 800 a 1.200 ng/ml en los primeros 3 meses y de 700-900 ng/ml hasta el sexto mes. La dosis recomendada de tacrolimus fue de 0,1-0,15 mg/kg/día, y las concentraciones de 5-15 ng/ml en los primeros 3 meses y de 5-12 ng/ml hasta el sexto mes. Todos los pacientes recibieron esteroides con o sin azatioprina según la práctica del centro. La tasa de rechazo fue similar (un 26% para la C2 de Neoral® frente al 24% con tacrolimus), al igual que la incidencia de muerte o pérdida del injerto, si bien en el subgrupo de pacientes con infección por el virus de la hepatitis C fue superior en el grupo de tacrolimus (un 15 frente al 6%; p < 0,05). Ambos grupos mostraron un porcentaje similar de efectos adversos graves, con mayor incidencia de diabetes de novo y diarrea en el grupo de tacrolimus (tabla 2).
Resumen
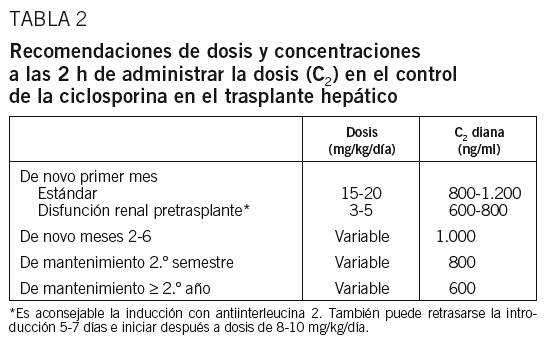
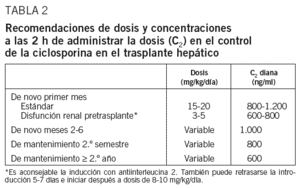
La dosis inicial de CsA será de 15 a 20 mg/kg/día, con el fin de conseguir concentraciones de 800-1.200 ng/ml al quinto día. En los pacientes en que no se alcancen las concentraciones deseadas, habrá que revisar la pauta de administración y de toma de muestras para que sean adecuadas, y si el paciente es portador de Kehr, éste deberá estar pinzado. Debe considerarse excepcional que un paciente, al séptimo día del trasplante, precise mantener las dosis máximas de CsA para alcanzar las concentraciones objetivo. En estos casos, debemos considerar que pueda presentar absorción lenta o absorción tardía.
En pacientes con disfunción renal conocida antes del trasplante se puede realizar tratamiento inmunodepresor de inducción con basiliximab, asociando dosis bajas de CsA (3-5 mg/kg/día con concentraciones de 600-800 ng/ml), o bien la supresión completa de la CsA con introducción tardía de las mismas dosis inferiores a las habituales (8-10 mg/kg/día) a partir del quinto al séptimo día, en que cabe esperar que haya tenido lugar la recuperación de la función renal. Se puede considerar asociar otros inmunodepresores como el MMF.
Postrasplante hepático de mantenimiento
La inmunodepresión óptima es la que consigue prevenir el rechazo y evitar la toxicidad. Esto adquiere aún mayor importancia en los tratamientos de mantenimiento del trasplante hepático, en el que a largo plazo el rechazo tanto agudo como crónico es un problema de escasa frecuencia y, en la mayor parte de los casos, controlable. No se puede decir lo mismo de la incidencia de efectos adversos a largo plazo; especialmente hay que destacar la nefrotoxicidad y los factores de riesgo cardiovascular. El control estricto de los fármacos inmunodepresores puede ser fundamental para mejorar este aspecto.
En un primer estudio en 35 pacientes estables tras un año del trasplante hepático, el control de la C2 con cifras objetivo de 300-600 ng/ml permitió disminuir la dosis de CsA en el 18% de los pacientes, con beneficios clínicos en forma de ausencia de rechazo y mantenimiento de la función renal. Estos beneficios no se observaron en el grupo con concentraciones objetivo de 700-1.000 ng/ml34.
Los estudios posteriores del grupo de Toronto han permitido confirmar estos beneficios de ausencia de rechazo en el injerto y nulo deterioro de la función renal con concentraciones superiores (1.000 ng/ml en el primer semestre, 800 ng/ml en el segundo y 600 ng/ml a partir del primer año) y descenso de dosis, de la presión arterial y de la necesidad de antihipertensivos, así como mejoría de la función renal35. Sin embargo, otros 2 estudios europeos con un reducido número de pacientes no han mostrado resultados similares36,37.
Los estudios realizados hasta la actualidad han permitido ajustar las dosis tras la conversión a control de la C2 en pacientes en que se observa sobredosificación. Sin embargo, en ninguno de ellos se han modificado las dosis en caso de que la determinación de C2 evidenciase cifras inferiores a las propuestas como objetivo (tabla 2).
Resumen
En los receptores de trasplante hepático en fase de mantenimiento se recomienda mantener unas C2 de 1.000 ng/ml el primer semestre, de 800 ng/ml en el segundo y de 600 ng/ml a partir del primer año, aunque existe la posibilidad de mantener concentraciones inferiores según el tratamiento inmunodepresor asociado, la enfermedad de base y la toxicidad en relación con la CsA.
En caso de pacientes en que se cambia la pauta de control de la C0 por la de C2, se ajustará la dosis en función de los parámetros de la C2 objetivo, en especial cuando el ajuste a C2 permita disminuir la dosis. En el caso de que las C2 sean bajas, si el paciente se mantiene estable desde el punto de vista de la función hepática, no es recomendable aumentar la dosis.
Control de la C2 de ciclosporina A en el trasplante cardíaco
Postrasplante cardíaco de novo
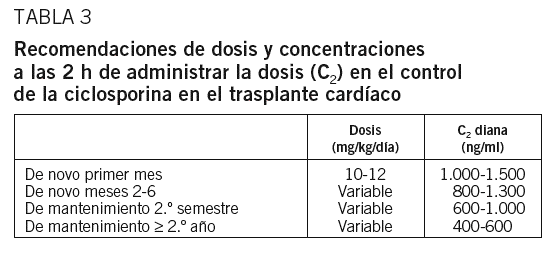
Aunque son escasos los estudios, la determinación de la C2 parece ser la que mejor relación guarda con el ABC también en receptores de trasplante cardíaco38. Concentraciones entre 1.000 y 1.500 ng/ml durante el primer año se asocian a una tasa menor de rechazo que concentraciones inferiores39. Basándonos en los estudios en trasplante renal (con tasas de rechazo parecidas a las del cardíaco), parece aconsejable alcanzar las concentraciones «terapéuticas» entre el tercer y el quinto días. En el Motown40, un estudio abierto, los receptores de trasplante cardíaco reciben 20 mg de basiliximab los días 0 y 4 postrasplante, y la CsA se controla mediante la C2, con diana de 1.700 ng/ml el primer mes y descenso progresivo hasta 800 ng/ml a partir del primer año.
En pacientes con insuficiencia cardíaca congestiva previa al trasplante cardíaco, al haber distintos grados de edema intestinal, la absorción de la medicación oral puede ser deficiente los primeros días, para ir mejorando a medida que la situación hemodinámica mejora. Esto debe tenerse en cuenta para evitar la sobredosificación de CsA, que puede tener como consecuencia el deterioro de la función renal, ya de por sí comprometida en los primeros días tras el trasplante cardíaco.
Postrasplante cardíaco de mantenimiento
En este caso disponemos aún de menos evidencia científica41-43. Cantarovich et al41 estudiaron a 114 pacientes con trasplante cardíaco de más de un año de evolución y controlaron el tratamiento con Neoral® para alcanzar unas C2 entre 300 y 600 ng/ml o C0 entre 100 y 200 ng/ml. Cuando se controló de acuerdo con los valores de C2, los autores no encontraron diferencias en el número de rechazos ni cambios en la fracción de eyección, aunque se requirieron dosis inferiores de CsA.
Un estudio prospectivo comparó la dosificación de CsA guiada por C0 frente a C2 en 125 pacientes que habían recibido un trasplante de corazón al menos un año antes40. La C0 requerida se situó entre 80 y 120 ng/ml, y la C2 entre 300 y 600 ng/ml, y no se detectaron diferencias. En un reciente estudio retrospectivo se ha observado que la C2 es superior a la C0 como predictor de nefrotoxicidad y rechazo agudo, y presenta menor variabilidad43 (tabla 3).
Resumen
Continuando con la tendencia de aconsejar concentraciones más elevadas que en el trasplante hepático y en el intervalo alto de los fijados para el trasplante renal, se podría recomendar para el trasplante cardíaco: concentraciones de 1.000-1.500 ng/ml en el primer mes; de 900-1.300 ng/ml los meses 2-3; de 800-1.200 ng/ml los meses 4 a 6; de 600-1.000 ng/ml los meses 6-12, y de 400-600 ng/ml a partir del primer año.
Control de la ciclosporina A mediante la C2 en el trasplante pulmonar
El pulmón es un injerto especialmente predispuesto a la infección, ya que está en contacto directo con el exterior y tiene alteraciones en el funcionamiento del sistema de aclaramiento mucociliar y de los linfocitos y macrófagos alveolplante pulmonar.
La aplicación de los conocimientos sobre la mejora del control de la CsA mediante la C2, que se han desarrollado fundamentalmente en los trasplantes renal, hepático y cardíaco, es de gran interés para el trasplante pulmonar. Sin embargo, en éste los conocimientos sobre el control de la C2 son limitados y no es apropiado extrapolar los conocimientos adquiridos en otros trasplantes sin asumir riesgos no aceptables.
Postrasplante pulmonar de novo
El único estudio que ha evaluado la utilidad de controlar la CsA mediante la C2 en el postrasplante pulmonar inmediato se realizó con 50 pacientes (20 de ellos con fibrosis quística) y tuvo un seguimiento medio de 503 días. Se utilizaron C2 predefinidas a partir de la experiencia en otros órganos: superiores a 800 ng/ml en 48 h; superiores a 1.200 ng/ml de 7 a 30 días; superiores a 1.000 ng/ml de 30 a 60 días; superiores a 800 ng/ml en el tercer mes; superiores a 700 ng/ml del cuarto al sexto meses, y superiores a 600 ng/ml a partir del sexto. Los resultados fueron buenos44.
Existe el inconveniente añadido de que los pacientes que reciben un trasplante pulmonar presentan un íleo paralítico postoperatorio que puede ser bastante persistente y que con frecuencia impide la administración oral de CsA de forma precoz. Algunos grupos utilizan la administración por sonda nasogástrica.
Postrasplante pulmonar de mantenimiento
Los escasos estudios sobre la utilidad de la C2 en el postrasplante pulmonar se han realizado en el postoperatorio tardío de receptores de trasplante pulmonar en fase estables. Algunos estudios han analizado la variabilidad intraindividual e interindividual del ABC en el trasplante pulmonar y, en general, se han encontrado datos similares a los trasplantes de otros órganos sólidos44-46, tanto en los pacientes con supuesta absorción normal como en aquellos con fibrosis quística45. El cambio del control de la C0 a la C2 con descenso de dosis se ha mostrado útil en un mejor control de la disfunción renal en estos pacientes47.
No hay C2 bien definidas en esta fase del trasplante pulmonar, aunque los datos preliminares podrían apuntar a unas cifras entre las aceptadas en los trasplantes renal y cardíaco. Sin embargo, son necesarios más estudios para aclarar este punto (tabla 4).
Resumen
La dosis inicial debe seguir siendo la habitual en cada centro de trasplante pulmonar. No se conocen con certeza las C2 más adecuadas, y se necesitan estudios que puedan valorar, a largo plazo, el impacto del control de la CsA mediante la C2 en este tipo de trasplante. En el único estudio prospectivo llevado a cabo hasta ahora se aconsejaron concentraciones diana de 800 ng/ml los primeros 2 días; de 1.200 ng/ml de 7 a 30 días; de 1.000 ng/ml de 30 a 60 días; de 800 ng/ml en el tercer mes; de 700 ng/ml del cuarto al sexto meses, y de 600 ng/ml a partir del sexto. Por los datos que tenemos en otros trasplantes, parece claro que las cifras de C2 deberán alcanzarse lo antes posible en el trasplante pulmonar. Se deberán evaluar estrategias de dosificación oral temprana de los pacientes mediante la administración de la medicación por vía oral con sonda nasogástrica en el postoperatorio inmediato.
No parece que los pacientes con fibrosis quística deban tratarse con estrategias diferentes del resto.
Otros aspectos del control de la ciclosporina A mediante la C2 en los trasplantes de órgano sólido
Aspectos metodológicos y logísticos
La implantación del seguimiento de la CsA mediante la determinación de la C2 requiere la aceptación y la concienciación de todo el equipo médico responsable de los pacientes en cada centro. El momento de la extracción debe ser a las 2 h ± 15 min de la toma matutina de la dosis de CsA. Es preciso disponer del personal de enfermería necesario para asegurar la extracción dentro del margen de tiempo de muestreo. Debe informarse al laboratorio de la hora de administración de la dosis de CsA y de la obtención de la muestra, y hay que desarrollar circuitos que garanticen la llegada de la muestra al laboratorio en un margen de tiempo apropiado para la entrega de resultados diarios.
A las 2 h de la administración de la dosis la concentración de metabolitos en sangre es menor que en situación predosis, y por ello la diferente especificidad de los anticuerpos monoclonales empleados tiene menor trascendencia en el resultado obtenido. La optimización en la transferibilidad de resultados hace más aceptable la determinación de la C2 de CsA mediante inmunoanálisis, cuyos anticuerpos presentan mayor reacción cruzada con los metabolitos. Por otro lado, en la mayoría de los inmunoanálisis la linealidad del método es inferior a las dianas terapéuticas establecidas para la C2, lo que requiere una dilución de la muestra a analizar.
La C2 debe interpretarse en función de las dianas de concentración terapéutica establecidas en los diversos tipos de trasplante de órganos sólidos, y presenta una serie de limitaciones que deben tenerse en cuenta para una correcta interpretación de los resultados. Ya se ha comentado que en el postrasplante inmediato hay una mayor incidencia de pacientes con perfil de absorción retrasada, que pueden presentar concentraciones máximas del fármaco entre las 4 y 6 h posteriores a la administración de la dosis, y en los que la C2 no es un buen reflejo de la biodisponibilidad. En el último consenso sobre el control de la C2 se aconseja la determinación de la C2 y C6 para distinguir entre pacientes con mala absorción y aquellos con absorción lenta9. También se puede contemplar la realización de un ABC en los primeros 4 días postrasplante para detectar el perfil de absorción del paciente.
Implantación en fases
Es recomendable establecer un diseño de implantación del seguimiento de las concentraciones de CsA mediante C2 en fases progresivas: sala de hospitalización, unidad de cuidados intensivos y consultas externas.
Es recomendable comenzar la implantación en la sala de hospitalización donde ingresen los pacientes trasplantados. La ubicación de todos los pacientes en la misma sala facilita el control del seguimiento de las concentraciones del fármaco. La enfermera responsable de los pacientes trasplantados es la responsable de la administración de la dosis indicada a una hora determinada, y la misma enfermera es la responsable de obtener la muestra para controlar las concentraciones de CsA 2 h después. Todo ello se reflejará en los documentos de control de calidad correspondientes. El inconveniente de este método es que se requieren 2 punciones para obtener muestras: la habitual, donde se incluye el control bioquímico y hematológico habitual, dentro del método habitual hospitalario, y otra a las 2 h de recibir la CsA.
Con objeto de incluir de forma controlada las determinaciones de la C2 en el conjunto de los pacientes que acuden de forma ambulatoria al departamento de análisis clínicos para realizarse los análisis correspondientes y garantizar que dichas determinaciones se efectúan en el margen de tiempo adecuado para la determinación de la C2, debe instaurarse una serie de mecanismos de control que permitan realizar dichas determinaciones de forma sistemática: código nuevo y exclusivo en la hoja de solicitud de análisis, tramo horario en el caso de programación electrónica, que no permita programación fuera del horario previsto, y, por supuesto, una adecuada información al paciente, que debe concienciarse de la importancia de tomar la medicación a la hora prevista, especialmente el día en que acude a realizar el análisis.
La información debe ser oral y con recordatorio escrito, que se adjunta en cada solicitud de analítica. En caso de alguna variación en los horarios, el propio paciente debe informar en el laboratorio, que lo anota en el momento de suministrar el resultado, y a su médico habitual en el momento de la visita.
Para controlar que todas estas fases se han seguido de forma adecuada, es recomendable instaurar una serie de mecanismos de control de calidad, tanto en el ámbito de la sala de hospitalización como en el control de consultas externas. Para ello se recomienda utilizar hojas de control por parte de la enfermería en la sala de hospitalización y por parte del paciente en el domicilio.
Resumen del desarrollo del control de la C2 de Sandimmun Neoral® en la práctica clínica
Entre los factores clave en la resistencia a la implantación del seguimiento de la C2 de Sandimmun Neoral® en muchos centros figuran los problemas logísticos derivados de la necesidad de obtener las muestras de sangre dentro de las 2 h siguientes (± 15 min) a la administración oral del fármaco. Aunque cada centro debe realizar los esfuerzos necesarios para vencer, de la manera que considere más adecuada, según sus características y peculiaridades propias, las dificultades que plantea una nueva sistemática de trabajo, hay una serie de recomendaciones generales que pueden ser útiles:
Revisión crítica de la evidencia científica de los métodos de seguimiento de las concentraciones de Sandimmun Neoral®. La medición de las concentraciones mediante la C2 es la técnica óptima en el postrasplante inmediato.
Compartir esta información y la importancia del cambio respecto a la técnica clásica con todos los profesionales implicados en el cuidado de estos pacientes (médicos especialistas, cirujanos, intensivistas, personal de laboratorio, de enfermería de planta y técnico, etc.).
Concienciar a los propios pacientes, desde el principio, de la importancia de los tiempos de la toma de la medicación y de la extracción de sangre para verificar las concentraciones del inmunodepresor.
Formación y entrenamiento del personal de enfermería en esta nueva técnica. Etiquetado correcto y explícito de las muestras de sangre mediante C2.
Comenzar con un sistema doble de determinación de la C0 y C2 como entrenamiento inicial, comparar resultados y adquirir confianza con el nuevo sistema.
Los ajustes de la dosis son fáciles de realizar según una sencilla fórmula: dosis nueva = dosis previas (C2 deseado/C2 actual). La decisión debe basarse también en la situación clínica y biológica del paciente.
Agradecimiento
Queremos expresar nuestra gratitud a Miguel González Molina (Hospital Carlos Haya, Málaga), Manuel Arias (Hospital Universitario Marqués de Valdecilla, Santander), Francisco Valdés (Hospital Juan Canalejo, La Coruña), Julio Pascual (Hospital Ramón y Cajal, Madrid), Gerardo Clemente (Hospital Gregorio Marañón, Madrid), José Mir (Hospital La Fe, Valencia), Alejandra Otero (Hospital Juan Canalejo, La Coruña), María G. Crespo (Hospital Juan Canalejo, La Coruña), Nicolás Manito (Hospital de Bellvitge, Barcelona), José M. Borro (Hospital Juan Canalejo, La Coruña), Rafael Lama (Hospital Reina Sofía, Sevilla), M. Ángeles De Cos (Hospital Universitario Marqués de Valdecilla, Santander) y Dolores Aumente (Hospital Reina Sofía, Sevilla).
Grupo Español de Consenso Ciclosporina C2
Comité de redacción
Luis Pallardó (Hospital Dr. Peset, Valencia), Aurelio Rodríguez (Hospital Universitario de Canarias, Santa Cruz de Tenerife), Francisco Ortega (Hospital Central de Asturias, Oviedo), José Vicente Torregrosa (Hospital Clínic, Barcelona), Julio Santoyo (Hospital Carlos Haya, Málaga), Miguel Ángel Suárez (Hospital Carlos Haya, Málaga), Joan Figueras (Hospital de Bellvitge, Barcelona), Laura Lladó (Hospital de Bellvitge, Barcelona), José Luis Rodríguez Lambert (Hospital Central de Asturias, Oviedo), Antonio Román (Hospital Vall d'Hebron, Barcelona), Merce Brunet (Hospital Clínic, Barcelona) y Leonor Pou (Hospital Clínic, Barcelona).