La ecografía torácica es una técnica novedosa para estratificar el riesgo de los pacientes COVID-19. Sin embargo, no existen datos que comparen dicha técnica con la radiografía de tórax, una técnica ampliamente utilizada en esta enfermedad.
Pacientes y métodosAnálisis retrospectivo en pacientes estables COVID-19. Se compararon la escala de daño pulmonar radiológica de Schalekamp y ecográfica de LUZ-Score. El objetivo primario fue la muerte intrahospitalaria o la necesidad de ingreso en la UCI para tratamiento con ventilación mecánica.
ResultadosSe reclutaron 138 pacientes. La mediana de la escala de Schalekamp fue de 2 (2) y la del LUZ-Score de 21 (10). No se objetivó una correlación significativa entre ambas escalas. Los pacientes con un LUZ-Score ≥21 puntos al ingreso presentaron peor función pulmonar y mayores concentraciones de LDH, PCR e interleucina-6. La escala radiológica de Schalekamp no logró identificar a una población de mayor riesgo. Únicamente la adición de la ecografía pulmonar a un modelo de valoración clínica mejoró de manera significativa el área bajo la curva para el objetivo primario (ABC 0,805 [IC95%: 0,662-0,948]; p≤0,001).
ConclusionesNo se objetivó una correlación entre la afectación radiológica y la ecográfica. Únicamente la ecografía pulmonar identificó un subgrupo de pacientes con una mayor afectación clínico-analítica. La ecografía pulmonar mejoró el modelo de predicción clínico, mientras que la radiografía de tórax no añadió información relevante.
Point of care lung ultrasound (POCUS) has been recently used to assess prognosis in COVID-19 patients. However, there are no data comparing POCUS and chest-X ray, a technique widely used.
Patients and methodsRetrospective analysis in stable COVID-19 patients. Schalekamp radiological lung scale and LUZ-Score ultrasound scale were compared. Primary end-point was in-hospital death and/or need for Intensive Care Unit admission.
ResultsA total of 138 patients were included. Median Schalekamp scale was 2 (2) and median LUZ-Score scale was 21 (10). No significant correlation was observed between both techniques. Patients with a LUZ-Score ≥21points at admission had worse lung function and higher concentrations of LDH, CRP and Interleuquine-6. Schalekamp scale failed to identify patients at a higher risk at admission for the primary end-point. Addition of POCUS to a previous clinical model, improved risk prediction (AUC 0.805 [95%CI: 0.662-0.948]; P=<.001).
ConclusionsChest X-ray and POCUS showed no correlation at admission in this analysis. Only POCUS identified a group of patients with greater clinical and analytical involvement. POCUS improved, previous clinical model, while chest X-ray did not add relevant predictive information for the primary endpoint.
La infección por el virus del distrés respiratorio severo del adulto tipo2 (SARS-CoV-2), conocida como COVID-19, ha generado una alta morbimortalidad a nivel mundial1,2. Dicha enfermedad tiene una marcada afectación respiratoria, capaz de producir cuadros de distrés respiratorio del adulto (SDRA) independientemente de la edad, especialmente en pacientes vulnerables2-4. Dado que se trata de una enfermedad infecciosa capaz de producir cuadros graves en pacientes jóvenes y sin antecedentes médicos2,5, disponer de herramientas objetivas para identificar precozmente a los pacientes de mayor riesgo resulta vital para mejorar el pronóstico de la enfermedad.
La radiografía (Rx) simple de tórax es una técnica sencilla, segura y de amplio uso en la valoración inicial de la COVID-196. La afectación bilateral radiológica se ha identificado en pacientes críticos como un factor independiente de riesgo7. Sin embargo, a pesar de su utilidad, es una técnica operador-dependiente y cuya máxima rentabilidad se ha observado al emplear complejos modelos informáticos que analizan imágenes radiológicas8, un recurso que no siempre está disponible en los centros hospitalarios.
Por el contrario, la ecografía pulmonar ha supuesto un hito importante en el manejo de esta enfermedad9. Es una técnica fácil de aplicar, reproducible, inocua y con unos resultados similares a los obtenidos mediante tomografía computarizada (TC)10. La gradación de las lesiones producidas por COVID-19 mediante escalas de puntuación ecográficas se ha correlacionado con el pronóstico a corto plazo11-13, y cada vez son más frecuentes los trabajos de investigación relacionados con esta técnica en la COVID-1914-16.
La hipótesis de este trabajo es que la capacidad predictiva de la ecografía pulmonar es superior a la de la Rx. Los objetivos de este estudio son: 1)Analizar las características basales de una cohorte de pacientes hospitalizados, según las lesiones pulmonares generadas por el SARS-CoV-2 e identificadas por Rx o por ecografía pulmonar. 2)Analizar la correlación entre los hallazgos de la Rx y los de la ecografía pulmonar. 3)Analizar la capacidad predictiva al ingreso de la Rx versus la ecografía pulmonar para identificar a los pacientes con peor evolución durante su hospitalización.
Pacientes y métodosDiseño del estudioEstudio retrospectivo llevado a cabo en los servicios de Enfermedades Infecciosas y Medicina Interna de un hospital universitario entre julio y octubre de 2020. Los criterios de inclusión del estudio han sido previamente publicados11. En resumen, se trata de pacientes con una edad ≥18años ingresados con el diagnóstico de infección sintomática por SARS-CoV-2 confirmada mediante proteínaC reactiva (PCR) o serología (IgM y/o IgG) y que aceptaron las condiciones del estudio. Los criterios de exclusión más importantes fueron el ingreso previo en la unidad de cuidados intensivos (UCI), la negativa del paciente o la presencia de enfermedades crónicas avanzadas como la EPOC, el deterioro cognitivo avanzado o la dependencia funcional importante11.
Durante las primeras 72horas de ingreso por COVID-19 se registraron las variables biológicas y clínicas del paciente. Se realizó un cálculo aproximado de la PAFI, definida como el cociente entre la saturación de O2 y la FiO2 administrada (PAFI estimada) y se cuantificó el grado de disnea del paciente mediante la escala subjetiva de Borg (entre 0 y 10)11.
Radiografía de tóraxLas imágenes se obtuvieron a partir de Rx de tórax en proyección posteroanterior y/o anteroposterior, cuando se realizó mediante equipos portátiles, durante las primeras 24horas de ingreso y fueron analizadas de manera independiente por un radiólogo experto, ciego al resto de parámetros clínicos, analíticos o eventos clínicos acontecidos durante el seguimiento. La cuantificación de las lesiones pulmonares radiológicas se realizó según la escala validada de Schalekamp et al.17. Dicha escala se basa en el análisis de cuatro cuadrantes pulmonares (dos en cada pulmón), cada uno valorado de 0 a 2 según el grado de afectación pulmonar producido por la COVID-19, con una puntuación final entre 0 y 8 puntos17,18. El tiempo máximo aceptado entre la realización de ambas técnicas (Rx de tórax y ecografía torácica) fue de 24horas, a partir de la primera atención prestada en el servicio de urgencias, a fin de evitar diferencias en la identificación de las lesiones según la prueba empleada.
Ecografía pulmonarEl protocolo empleado fue el LUZ-Score11. Se trata de una escala cuantitativa que analiza el grado de afectación ecográfica en base a los hallazgos en cada uno de los doce cuadrantes torácicos analizados, con una puntuación final entre 0 y 48 puntos. Dicha técnica se centra fundamentalmente en el análisis de los diferentes patrones pulmonares, prestando especial atención a la presencia de líneas «b» pulmonares y/o consolidaciones subpleurales13.
ObjetivosEl objetivo primario del estudio se definió como el evento combinado de muerte intrahospitalaria y/o necesidad de ingreso en la UCI para iniciar ventilación mecánica. Se consideraron también varios objetivos secundarios: 1)la necesidad de incremento del flujo (FiO2) de oxígeno durante las primeras 72horas; 2)la necesidad de cambiar o incrementar el tratamiento médico previamente pautado durante las primeras 72horas de ingreso, y 3)la necesidad de incrementar el flujo de oxígeno y/o el tratamiento médico durante las primeras 72horas de ingreso.
Análisis estadísticoLas variables categóricas se expresaron como porcentajes. Las variables continuas se expresaron como la media ±desviación estándar o mediana (rango intercuartílico [RI]) según cumplieran la normalidad. El análisis comparativo de las variables cuantitativas se llevó a cabo mediante la t de Student o la U de Mann-Whitney, en el caso de que no fueran variables continuas. Las variables categóricas se analizaron mediante el test de chi cuadrado (χ2). La correlación entre ambas escalas se llevó a cabo mediante el test de Spearman.
Para la creación de los distintos modelos de predicción del objetivo primario se realizó un primer análisis univariante que incluía aquellas variables significativas o con una p<0,100 en el contraste de hipótesis. El modelo multivariante se diseñó teniendo en cuenta aquellas variables significativas en el análisis univariante, incluyendo también aquellos parámetros que han demostrado en trabajos previos su mal pronóstico en pacientes COVID-19 y cuyo valor de p en el análisis univariante era inferior 0,100 (edad, lactato deshidrogenasa [LDH], índice de masa corporal [IMC] y antecedente previo de diabetes). Una vez diseñado el modelo clínico, se calculó su potencia mediante el análisis de las áreas bajo la curva (ABC) y las curvas ROC correspondientes. A partir de este modelo clínico, se diseñaron modelos alternativos, incluyendo los parámetros de este estudio (ecografía pulmonar y/o radiografía de tórax), en el caso de que fuesen significativos en el análisis univariante. Por último, se analizaron las curvas de supervivencia mediante las curvas de Kaplan-Meier y el test de Log-Rank.
Los intervalos de confianza fueron del 95%, estableciendo la significación estadística con un valor de p inferior a 0,05. El análisis estadístico se llevó a cabo mediante el paquete estadístico SPSS en su versión 24,0 para Windows.
ResultadosCaracterísticas basales de la muestra (tablas 1 y 2)Radiografía de tórax versus ecografía pulmonarLa mediana de la escala de Schalekamp17 (Rx) fue de 2 puntos (RI: 2) y la mediana de la escala LUZ11 (ecografía pulmonar) fue de 21 puntos (RI: 10), no existiendo un grado de correlación significativo entre ambas técnicas (Rho de Spearman=0,146; p=0,086).
Características basales de la muestra según la afectación pulmonar cuantificada mediante la escala radiológica de Schalekamp (mediana) al ingreso
| Variable | Total | Schalekamp (0 a 2 puntos) | Schalekamp (3 o más puntos) | p |
|---|---|---|---|---|
| Tamaño muestral, n (%) | 138 (100,0) | |||
| Edad, años | 57,7±13,0 | 56,7±12,5 | 59,8±14,1 | 0,197 |
| Género varón, n (%) | 84 (60,9) | 56 (58,9) | 28 (65,1) | 0,492 |
| Duración de los síntomas, días | 6,5±3,2 | 6,4±3,4 | 6,6±2,9 | 0,702 |
| Comorbilidades, n (%) | ||||
| Hipertensión | 52 (37,7) | 29 (30,5) | 23 (53,5) | 0,010 |
| Insuficiencia cardíaca | 4 (2,9) | 3 (3,2) | 1 (2,4) | 0,803 |
| Dislipemia | 42 (30,4) | 27 (28,4) | 15 (34,9) | 0,445 |
| Enfermedad coronaria | 5 (3,6) | 2 (2,1) | 3 (7,0) | 0,156 |
| Diabetes | 23 (16,7) | 12 (12,6) | 11 (25,6) | 0,059 |
| Tabaquismo | 48 (35,0) | 33 (35,1) | 15 (34,9) | 0,980 |
| EPOC/Asma | 15 (10,9) | 12 (12,6) | 3 (7,0) | 0,323 |
| Flutter/Fibrilación auricular | 5 (3,7) | 3 (3,2) | 2 (4,9) | 0,642 |
| ERC | 7 (5,1) | 4 (4,2) | 3 (7,0) | 0,493 |
| Variables clínicas | ||||
| IMC (kg/m2) | 28,9 (6,3) | 28,7 (6,0) | 29,8 (7,2) | 0,564 |
| PAS(mmHg) | 127±16 | 127±16 | 126±16 | 0,742 |
| PAD (mmHg) | 77±10 | 77±11 | 76±9 | 0,659 |
| FC (latidos/min) | 80±12 | 80±18 | 82±12 | 0,272 |
| PAFI estimada (mmHg) | 367 (89) | 379 (88) | 355 (101) | 0,805 |
| Escala de disnea de Borg (puntos) | 2 (4) | 2 (4) | 3 (5) | 0,271 |
| Laboratorio | ||||
| Urea (mg/dl) | 34 (19) | 34 (18) | 34 (20) | 0,874 |
| Creatinina (mg/dl) | 0,91 (0,30) | 0,91 (0,28) | 0,92 (0,38) | 0,905 |
| Aspartato transaminasa (U/l) | 38 (27) | 38 (29) | 38 (26) | 0,646 |
| Alanina transaminasa (U/l) | 32 (27) | 34 (31) | 31 (19) | 0,334 |
| Creatina fosfocinasa (U/l) | 97 (93) | 99 (94) | 91 (85) | 0,919 |
| Lactato deshidrogenasa (U/l) | 306 (141) | 307 (117) | 300 (175) | 0,593 |
| Proteína C reactiva (mg/l) | 64 (82) | 59 (74) | 77 (85) | 0,110 |
| Ferritina (ng/ml) | 770 (963) | 789 (1043) | 724 (814) | 0,790 |
| Hemoglobina (g/dl) | 14,9±1,5 | 14,3±1,5 | 14,2±1,4 | 0,900 |
| Leucocitos totales (× 1000) | 5,4 (3,1) | 5,7 (3,1) | 5,2 (3,6) | 0,495 |
| Linfocitos totales (× 1000) | 0,9 (0,7) | 0,9 (0,6) | 0,7 (0,7) | 0,215 |
| D-dímero (ng/ml) | 688 (625) | 737 (538) | 597 (898) | 0,523 |
| Fibrinógeno (mg/dl) | 775±171 | 772±169 | 781±175 | 0,355 |
| Interleucina-6 (pg/ml) | 42 (29) | 43 (27) | 33 (33) | 0,331 |
| Ecografía pulmonar (LUZ-Score) | 21 (10) | 21 (14) | 22 (7) | 0,226 |
EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica (filtrado glomerular estimado <60ml/min/1,73m2 calculado mediante fórmula CKD-EPI creatinina); FC: frecuencia cardíaca; IMC: índice de masa corporal; LUZ-Score: Lung Ultrasound Zaragoza-Score; PAD: presión arterial diastólica; PAS: presión arterial sistólica;
Las variables se muestran como media ±desviación estándar o mediana (rango intercuartílico).
Características basales de la muestra según la afectación pulmonar cuantificada mediante la escala ecográfica LUZ-Score (mediana) al ingreso
| Variable | Total | LUZ-Score (< 21 puntos) | LUZ-Score (≥ 21 puntos) | p |
|---|---|---|---|---|
| Tamaño muestral, n (%) | 138 (100,0) | 63 (45,7) | 75 (54,3) | |
| Edad (años) | 57,7±13,0 | 55,4±13,6 | 59,6±12,3 | 0,058 |
| Género, varón, n (%) | 84 (60,9) | 41 (65,1) | 43 (57,3) | 0,353 |
| Duración de los síntomas (días) | 6,5±3,2 | 5,6±3,6 | 7,2±2,8 | 0,559 |
| Comorbilidades, n (%) | ||||
| Hipertensión | 52 (37,7) | 27 (42,9) | 25 (33,3) | 0,250 |
| Insuficiencia cardíaca | 4 (2,9) | 3 (4,8) | 1 (1,3) | 0,328 |
| Dislipemia | 42 (30,4) | 20 (31,7) | 22 (29,2) | 0,759 |
| Enfermedad coronaria | 5 (3,6) | 3 (4,8) | 2 (2,7) | 0,512 |
| Diabetes | 23 (16,7) | 8 (12,7) | 15 (20,0) | 0,252 |
| Tabaquismo | 48 (35,0) | 18 (29,0) | 30 (40,0) | 0,180 |
| EPOC/Asma | 15 (10,9) | 8 (12,7) | 7 (9,3) | 0,527 |
| Flutter/Fibrilación auricular | 5 (3,7) | 4 (6,6) | 1 (1,4) | 0,177 |
| ERC | 7 (5,1) | 4 (6,3) | 3 (4,0) | 0,531 |
| Variables clínicas | ||||
| IMC (kg/m2) | 28,9 (6,3) | 29,5 (6,2) | 28,5 (6,1) | 0,215 |
| PAS (mmHg) | 127±16 | 128±17 | 126±16 | 0,424 |
| PAD (mmHg) | 77±10 | 76±12 | 77±9 | 0,555 |
| FC (latidos/min) | 80±12 | 78±13 | 83±12 | 0,025 |
| PAFI estimada (mmHg) | 367 (89) | 429 (74) | 349 (117) | <0,001 |
| Escala de disnea de Borg (puntos) | 2 (4) | 1,5 (4) | 3,0 (4) | 0,043 |
| Laboratorio | ||||
| Urea (mg/dl) | 34 (19) | 36 (23) | 31 (16) | 0,056 |
| Creatinina (mg/dl) | 0,91 (0,30) | 0,97 (0,25) | 0,85 (0,29) | 0,025 |
| Aspartato transaminasa (U/l) | 38 (27) | 35 (26) | 41 (27) | 0,137 |
| Alanina transaminasa (U/l) | 32 (27) | 34 (27) | 30 (30) | 0,975 |
| Creatina fosfocinasa (U/l) | 97 (93) | 97 (96) | 92 (92) | 0,839 |
| Lactato deshidrogenasa (U/l) | 306 (141) | 282 (97) | 310 (177) | 0,005 |
| Proteína C reactiva (mg/l) | 64 (82) | 43 (76) | 83 (71) | 0,006 |
| Ferritina (ng/ml) | 770 (963) | 696 (1036) | 858 (951) | 0,512 |
| Hemoglobina (g/dl) | 14,9±1,5 | 14,4±1,3 | 14,4±1,7 | |
| Leucocitos totales (× 1000) | 5,4 (3,1) | 5,4 (3,5) | 5,3 (3,1) | 0,726 |
| Linfocitos totales (× 1000) | 0,9 (0,7) | 0,9 (0,6) | 0,8 (0,6) | 0,175 |
| D-dímero (ng/ml) | 688 (625) | 684 (674) | 714 (694) | 0,304 |
| Fibrinógeno (mg/dl) | 775±171 | 748±155 | 805±179 | 0,041 |
| Interleucina-6 (pg/ml) | 42 (29) | 30 (33) | 48 (48) | <0,001 |
| Puntación radiológica Schalekamp (puntos) | 2,0 (2,0) | 2,0 (2,0) | 2,0 (2,0) | 1,000 |
EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica (filtrado glomerular estimado <60ml/min/1,73m2 calculado mediante fórmula CKD-EPI creatinina); FC: frecuencia cardíaca; IMC: índice de masa corporal; LUZ-Score: Lung Ultrasound Zaragoza-Score; PAD: presión arterial diastólica; PAS: presión arterial sistólica;
Las variables se muestran como media ±desviación estándar o mediana (rango intercuartílico).
Las características basales de la muestra según la puntuación radiológica (mediana) pueden valorarse en la tabla 1. A excepción de la prevalencia de hipertensión arterial (53,5% vs. 30,5%; p=0,010), no se encontraron diferencias en las características basales de la muestra de aquellos pacientes con mayor puntuación de Schalekamp17 (3 o más puntos) (tabla 1).
Las características basales de la muestra según la puntuación ecográfica se muestran en la tabla 2. Los pacientes con mayor LUZ-Score11 (≥21puntos) presentaron una mayor frecuencia cardíaca al ingreso, una menor PAFI estimada, así como una mayor sensación subjetiva de disnea (escala de Borg). En el apartado analítico destacaba una elevación significativa de marcadores inflamatorios, como la PCR y la interleucina-6 (IL-6). También fueron mayores las concentraciones de creatinina y LDH, en aquellos pacientes con mayor afectación pulmonar determinada por ecografía (≥21 puntos) (tabla 2).
Análisis de los objetivos y modelos de predicción clínicaEn total, 15 pacientes (10,9%) alcanzaron el objetivo primario de muerte intrahospitalaria y/o necesidad de ingreso en la UCI para ventilación mecánica. Un total de 45 pacientes (34,1%) necesitaron incrementar el flujo de oxígeno durante las primeras 72horas, 53 pacientes (39,6%) vieron incrementado su tratamiento médico durante las primeras 72horas y 64 pacientes (49,2%) precisaron ya sea de un incremento del flujo de oxígeno, ya sea de un incremento del tratamiento médico (tabla suplementaria 1).
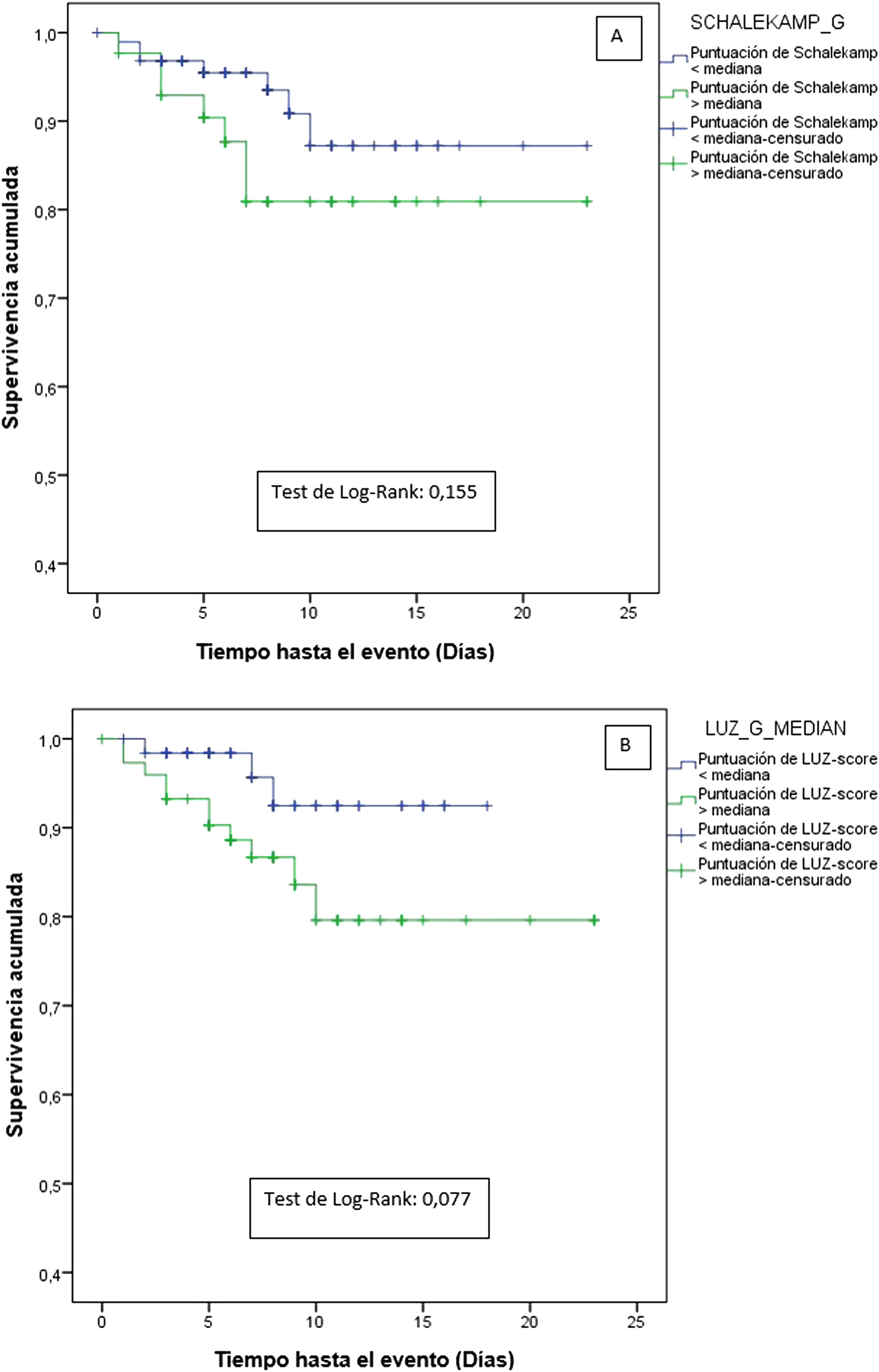
Cuando se compararon las escalas de Schalekamp y LUZ-Score, únicamente se encontraron diferencias estadísticamente significativas para los objetivos primarios y secundarios al emplear la ecografía pulmonar (tabla suplementaria 1). El análisis de las curvas de supervivencia no mostró diferencias estadísticamente significativas ni para la radiografía de tórax (test de Log-Rank=0,155) ni para la ecografía pulmonar (test de Log-Rank=0,077) (fig. 1A y B).
Curvas de supervivencia para el objetivo primario (muerte intrahospitalaria y/o ingreso en unidad de cuidados intensivos para ventilación mecánica) según la afectación pulmonar determinada mediante: A)radiografía de tórax (mayor o menor a la mediana de la escala Schalekamp [2 puntos], y B)ecografía pulmonar (mayor o menor a la mediana de la escala LUZ-Score [21 puntos].
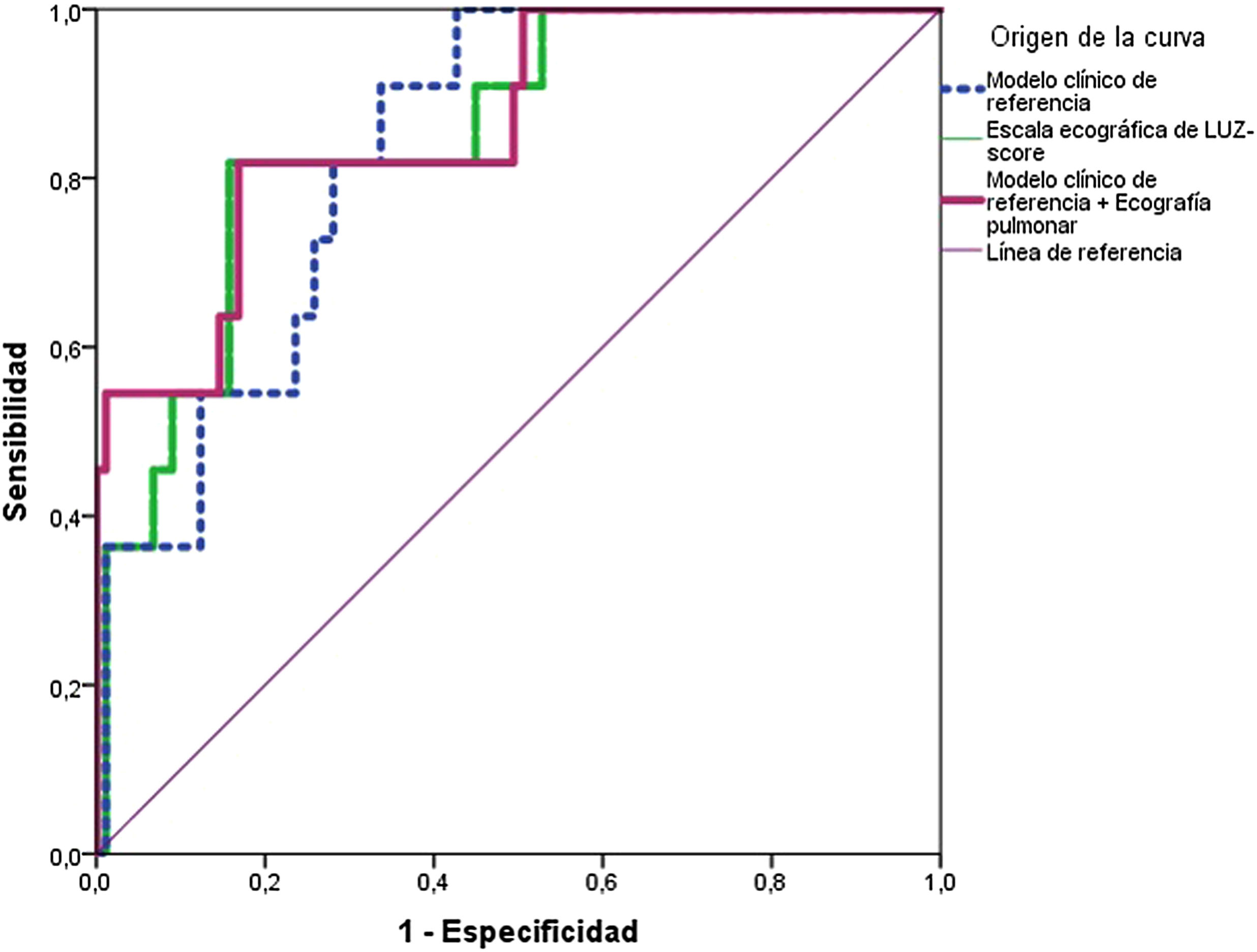
Únicamente el modelo clínico (ABC: 0,790 [0,652-0,928]; p=<0,001) y la ecografía pulmonar (ABC 0,747 [0,595-0,899]; p=0,002), mostraron resultados estadísticamente significativos (fig. 2 y tabla 3). Al combinar el modelo clínico basal con la ecografía pulmonar al ingreso, se objetivó un incremento de la capacidad predictiva (ABC 0,805 [IC95%: 0,662-0,948]; p≤0,001). Por el contrario, la Rx (Schalekamp et al.17) no mostró resultados estadísticamente significativos (ABC: 0,561 [IC95%: 0,369-0,754]; p=0,440) (fig. 2 y tabla 3).
Curvas ROC de predicción al ingreso por neumonía COVID-19 para el objetivo primario (muerte intrahospitalaria y/o ingreso en unidad de cuidados intensivos para ventilación mecánica) según los diferentes modelos analizados (modelo clínico, escala ecográfica de LUZ-Score y combinación de ambas).
Áreas bajo la curva de los diferentes modelos analizados para el objetivo primario de muerte intrahospitalaria y/o ingreso en unidad de cuidados intensivos
| Variable | ABC (IC 95%) | p |
|---|---|---|
| Escala ecográfica de LUZ-Score | 0,747 (0,595-0,899) | 0,002 |
| Escala radiológica de Schalekamp | 0,561 (0,369-0,754) | 0,440 |
| Modelo clínico* | 0,790 (0,652-0,928) | <0,001 |
| Modelo clínico* +Ecografía pulmonar (LUZ-Score) | 0,805 (0,662-0,948) | <0,001 |
Variables incluidas en el modelo analítico: edad (años), antecedente previo de dislipemia, antecedente previo de diabetes, índice de masa corporal (kg/m2), creatinina al ingreso (mg/dl), LDH al ingreso (U/l) y PAFI estimada al ingreso (mmHg).
Para más información, consultar tabla suplementaria 3).
En el presente trabajo realizamos un análisis comparativo entre la Rx (Schalekamp et al.17) y la ecografía pulmonar (LUZ-Score11) para identificar a pacientes COVID-19 que presentan una peor evolución durante su estancia hospitalaria. Nuestros resultados demuestran que la valoración cuantitativa del daño pulmonar mediante ecografía pulmonar es superior a la de la Rx, sin que exista una buena correlación entre ambas técnicas. De hecho, únicamente la adición de la ecografía pulmonar a un modelo de predicción clínica mejoró la capacidad predictiva del mismo, demostrando su potencial utilidad para identificar a los pacientes con peor pronóstico al ingreso. Estos resultados son inéditos, no habiendo encontrado estudios similares que comparen ambas técnicas mediante escalas cuantitativas en la literatura médica.
Seleccionar e identificar precozmente a los pacientes con COVID-19 cuyas características clínicas los convierten en pacientes de alto riesgo es un objetivo fundamental para poder mejorar el pronóstico durante el ingreso. Desde que comenzase la pandemia, son múltiples las herramientas pronósticas que han sido elaboradas, algunas basadas en datos puramente clínicos19, o bien en modelos de predicción que incluyen parámetros analíticos20 o de pruebas de imagen11,16,17,21.
Schalekamp et al.17 investigaron si la cuantificación del daño pulmonar, a través de una escala radiológica cuantitativa, era capaz de identificar a pacientes COVID-19 con peor evolución. Sus resultados demostraron que dicha escala era un predictor independiente de mal pronóstico intrahospitalario17. Ahora bien, en dicho estudio se incluyeron aproximadamente un 47% de pacientes críticos y no se incluyeron datos como la saturación de oxígeno o el IMC, factores que podrían haber sobreestimado la utilidad de dicha escala como predictor de riesgo17.
Frente a la Rx, la ecografía pulmonar ha supuesto una revolución en los pacientes COVID-1911,16,21,22. Su precisión se ha equiparado a la de la TC pulmonar en una pequeña serie de casos15,22,23, y sus características intrínsecas (reproducibilidad, ausencia de irradiación, etc.) la convierten en una técnica atractiva9.
En nuestro análisis, la estratificación de la población a través de una escala ecográfica cuantitativa (LUZ-Score ≥21 puntos) permitió identificar un subgrupo de pacientes con una peor función pulmonar (PAFI-estimada y LDH) y mayores concentraciones de reactantes de fase aguda (PCR, fibrinógeno e IL-6), y ello sugiere que la escala de LUZ-Score permite identificar a los pacientes con mayor afectación. Por contra, la escala de Schalekamp17 no objetivó diferencias entre la población, no existiendo tampoco una correlación significativa con la escala ecográfica, lo cual podría deberse a varias causas. Nuestra muestra presentaba un IMC medio de 28,9kg/m2, por lo que el alto grado de sobrepeso podría haber dificultado la interpretación radiológica, máxime si tenemos en cuenta que dado que se trata de una enfermedad altamente transmisible, la mayoría de radiografías se realizaron con equipos portátiles en proyección anteroposterior, disminuyendo la rentabilidad diagnóstica de la prueba18,24,25. Además, resulta imprescindible señalar la disociación clínico-radiológica que muchos pacientes COVID-19 presentan al ingreso debido a la peculiar cronología fisiopatológica de esta enfermedad, una situación que podría hacer que la radiografía de tórax infraestimara el daño pulmonar registrado1,2,26-28. Nuestros resultados así lo sugieren, y de hecho, en el análisis de regresión logística univariante la escala de Schalekamp17 no resultó significativa. La ecografía pulmonar, sin embargo, mostró una buena área bajo la curva por sí misma, siendo ligeramente inferior a la del modelo clínico diseñado a partir de nuestra población, y la combinación de ambos parámetros (ecografía y modelo clínico) permitió generar un modelo de predicción clínica con un área bajo la curva de 0,805 (IC95%: 0,662-0,948), aunque no se objetivaran diferencias significativas en las curvas de supervivencia, probablemente debido al bajo número de eventos (10,9%).
En cuanto a las limitaciones de nuestro estudio, hemos de tener en cuenta que se trata de un análisis retrospectivo llevado a cabo sobre una cohorte de pacientes de un único centro hospitalario, por lo que nuestros resultados no han sido validados y no son extrapolables a otra población. Además, hubiese sido de utilidad disponer de imágenes de TC torácica (gold standard) con las que poder comparar las imágenes radiológicas y ecográficas; sin embargo, no todos los pacientes con COVID-19 incluidos en este análisis disponían de dicha técnica, dado que su solicitud quedó supeditada al facultativo responsable del paciente en base a criterios clínicos. Por último, el tamaño muestral empleado podría haber disminuido la potencia final del estudio, características propias de este tipo de análisis.
En conclusión, no objetivamos una correlación entre la escala de Schalekamp y el LUZ-Score para cuantificar la afectación pulmonar al ingreso de los pacientes con COVID-19. Los pacientes con mayor afectación ecográfica (puntuación del LUZ-Score más elevada) presentaron una peor función pulmonar objetivada a través de parámetros clínicos y/o analíticos, una situación que no se observó en los pacientes con mayor afectación radiológica (Schalekamp). La adición de una primera valoración ecográfica pulmonar al ingreso mejoró la capacidad predictiva de un modelo clínico, por lo que sugerimos su uso para identificar a los pacientes COVID-19 de mayor riesgo al ingreso.
Consideraciones éticasEl estudio cumplió con las directrices generales de la Declaración de Helsinki y fue aprobado por el comité de ética correspondiente el día 13 de mayo de 2020 (CEICA, Ref. C.P.-C.I. PI20/248).
FinanciaciónEl estudio fue financiado a través de una campaña de crowfunding promovida por el Instituto de Investigación Sanitario Aragón (IIS Aragón) durante los años 2019-2020 (https://www.iisaragon.es/utilidad-de-la-ecografia-clinica-y-el-uso-de-biomarcadores-sericos-en-la-estratificacion-del-riesgo-de-pacientes-con-infeccion-por-sars-cov2-covid-19/)
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses durante la realización de este artículo.






![Curvas de supervivencia para el objetivo primario (muerte intrahospitalaria y/o ingreso en unidad de cuidados intensivos para ventilación mecánica) según la afectación pulmonar determinada mediante: A)radiografía de tórax (mayor o menor a la mediana de la escala Schalekamp [2 puntos], y B)ecografía pulmonar (mayor o menor a la mediana de la escala LUZ-Score [21 puntos]. Curvas de supervivencia para el objetivo primario (muerte intrahospitalaria y/o ingreso en unidad de cuidados intensivos para ventilación mecánica) según la afectación pulmonar determinada mediante: A)radiografía de tórax (mayor o menor a la mediana de la escala Schalekamp [2 puntos], y B)ecografía pulmonar (mayor o menor a la mediana de la escala LUZ-Score [21 puntos].](https://static.elsevier.es/multimedia/00257753/0000015900000011/v1_202211240521/S0025775322000914/v1_202211240521/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

