Hasta el momento, la prevención de ictus en pacientes con diabetes mellitus (DM) se basaba en el control de otros factores de riesgo y comorbilidades, ya que los ensayos clínicos de control glucémico intensivo no habían demostrado eficacia en la reducción de complicaciones macrovasculares. Pero gracias al requerimiento de la FDA de evaluar el riesgo vascular de los fármacos antidiabéticos, se ha producido un importante avance en el conocimiento de sus beneficios sobre el riesgo de muerte vascular, infarto agudo de miocardio e ictus no fatales en los pacientes con DM tipo2 y alto riesgo vascular. Esto supone la necesidad de incorporar estos fármacos en la estrategia de prevención vascular global en pacientes con DM que ya han tenido un ictus. Se presenta una revisión crítica, no sistemática, de los fármacos antidiabéticos que han mostrado algún efecto sobre el riesgo de ictus, interpretando sus resultados desde la perspectiva del neurólogo.
To date, stroke prevention in patients with diabetes mellitus (DM) has been based on the control of other risk factors and comorbidities, as clinical trials aimed at intensive glycemic control have failed to prove the existence of any sort of benefit in reducing macrovascular complications. However, thanks to the FDA's requirement to evaluate the vascular risk of antidiabetic drugs, there has been significant progress in the knowledge of their benefits on the risk of vascular death, acute myocardial infarction and non-fatal stroke in patients with type 2 DM and high vascular risk. This implies the need to incorporate these drugs into the overall vascular prevention strategy in patients with DM who have already suffered a stroke. This manuscript is a critical, non-systematic review on the oral antidiabetics that have demonstrated any sort of effect on stroke risk, interpreting the results of the main clinical trials from the neurologist's point of view.
La diabetes mellitus (DM) es una enfermedad crónica multisistémica que incrementa significativamente el riesgo de ictus, considerándose directamente responsable de hasta el 12-22% del total de ictus1,2. En personas con DM la incidencia anual de ictus es del 0,67%3, siendo el riesgo relativo (RR) mayor en mujeres que en hombres3,4.
La DM es un potente factor de riesgo vascular mediado fundamentalmente por su efecto sobre el desarrollo de aterosclerosis. Sin embargo, el ictus tiene una importante particularidad ya que, a diferencia de la cardiopatía isquémica en la que el sustrato patogénico fundamental es la arteriosclerosis, el ictus tiene una gran variedad de mecanismos patogénicos en los que la arteriosclerosis representa solo el 20-25% del total de los ictus isquémicos. Otros mecanismos implicados son el origen cardioembólico (30%), la enfermedad de pequeño vaso (25%) y otras causas poco frecuentes como los estados de hipercoagulabilidad, las vasculopatías inflamatorias y no inflamatorias, etc. Pero además hasta el 20% de los ictus son hemorrágicos. En este sentido, la DM aumenta el riesgo de ictus de cualquier tipo, tanto isquémico como hemorrágico3, lo que implica que su prevención sea de especial complejidad en esta población. Así, la DM está involucrada en el desarrollo de ictus isquémico aterotrombótico3,5,6, lacunar3,5-9 y cardioembólico3, ya que no hay que olvidar que la DM incrementa hasta en un 40% el riesgo de fibrilación auricular (FA)10.
El riesgo de ictus en pacientes con DM aumenta de forma significativa con la duración de la misma, estimándose que por cada año con DM, el riesgo de ictus isquémico se incrementa en un 3% y se triplica en aquellos con más de 10años de evolución de la DM11. Además, la DM se considera responsable de hasta el 9,1% del total de recurrencias de ictus, cifra muy superior al peso de otras entidades a las que tradicionalmente se les ha dado más relevancia, como la FA, a la que se le atribuye el 4,9% de las recurrencias de ictus12.
Por otra parte, cada vez está cobrando mayor importancia el diagnóstico de prediabetes como estado metabólico intermedio entre el metabolismo glucídico normal y la DM, ya que es un trastorno muy prevalente en pacientes con ictus o ataque isquémico transitorio (AIT), afectando hasta el 23-53% de los casos13, y supone un riesgo de ictus aumentado14.
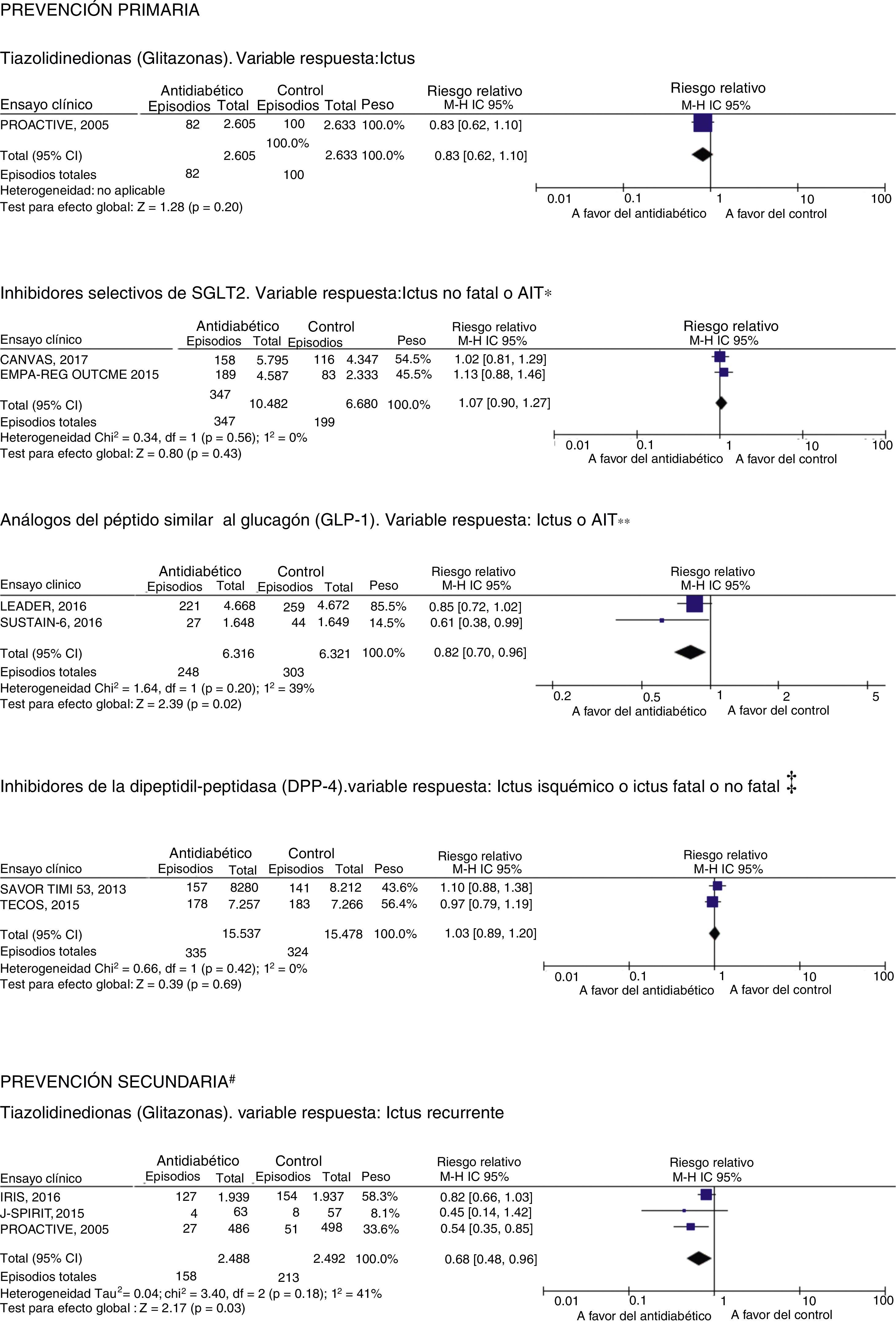
Hasta el momento, la prevención de ictus en pacientes con DM se basaba en el control de otros factores de riesgo y comorbilidades como la HTA o la dislipidemia15, ya que los ensayos clínicos de control glucémico intensivo no habían demostrado un beneficio significativo en la reducción de complicaciones macrovasculares16-18. Sin embargo, en los últimos años estamos asistiendo a una revolución en la prevención de complicaciones vasculares en pacientes con DM tipo2 de alto riesgo tras la publicación de diversos ensayos clínicos que demuestran el beneficio de diversos antidiabéticos en la reducción de muerte vascular, infarto agudo de miocardio e ictus19. Esto supone la necesidad de que los neurólogos comencemos a incorporarlos en la estrategia de prevención vascular global en pacientes con DM tipo2 que ya han tenido un ictus. A continuación se presenta una revisión crítica, no sistemática, de los principales fármacos antidiabéticos que han mostrado, en los últimos años, algún efecto sobre el riesgo de ictus, interpretando sus resultados desde la perspectiva del neurólogo. Para ilustrar los efectos de cada uno de los grupos terapéuticos en prevención de ictus, se realizan diversos metaanálisis originales que se muestran en la figura 1.
Metaanálisis de los principales estudios con antidiabéticos en prevención de ictus en pacientes con DM tipo2 de alto riesgo.
SGLT2: cotransportador de sodio-glucosa 2 (sodium-glucose cotransporter2).
* Datos de frecuencia de ataque isquémico transitorio (AIT) disponibles en EMPAREG-Outcome31.
** Datos del LEADER38 incluyen ictus fatal, no fatal y AIT, mientras que SUSTAIN-6 solo aporta datos de ictus no fatal.
‡ SAVOR-TIMI5343 solo considera ictus isquémico; TECOS42 incluye ictus fatal y no fatal.
# El estudio IRIS26 solo reclutó pacientes con diagnóstico confirmado de resistencia a la insulina, excluyendo diabetes mellitus (DM) tipo2; el estudio J-SPIRIT25 incluye pacientes con prediabetes (intolerancia a la glucosa) o DM tipo2 de reciente diagnóstico; el estudio PROactive47 incluye pacientes con diagnóstico de DM tipo2 y evidencia de enfermedad vascular sintomática.
Actúan activando el receptor PPAR-ϒ aumentando la sensibilidad de la insulina en el músculo esquelético, el hígado y el tejido adiposo19. De esta familia terapéutica, troglitazona fue retirada por hepatotoxicidad y rosiglitazona fue retirada en Europa debido al incremento de riesgo de insuficiencia cardiaca y dudas sobre el efecto del riesgo de infarto de miocardio19. Los estudios que han evaluado el posible beneficio vascular de aleglitazar en pacientes con DM y síndrome coronario agudo (AleCardio)20 y en pacientes con DM o prediabetes (ALEPREVENT)21 fueron prematuramente interrumpidos por futilidad y la demostración de un incremento de efectos adversos graves.
Pioglitazona es el fármaco de este grupo terapéutico que más esperanzas ha generado en cuanto a prevención de ictus tanto en prevención primaria como en secundaria, siendo el único de los antidiabéticos que se ha ensayado específicamente en pacientes con antecedentes de ictus o AIT. Ya en el año 2005, el estudio PROactive22 mostró su beneficio en la prevención de riesgo vascular global en pacientes con DM tipo2 con enfermedad vascular sintomática (tabla 1). Aunque la reducción del riesgo de ictus no alcanzó significación estadística, un análisis posterior circunscrito a los pacientes con ictus previo mostró una reducción significativa del riesgo de recurrencias23. Posteriormente se publicaron los resultados del estudio PROFIT-J, que no pudo obtener conclusiones relevantes debido a su escaso tamaño muestral24.
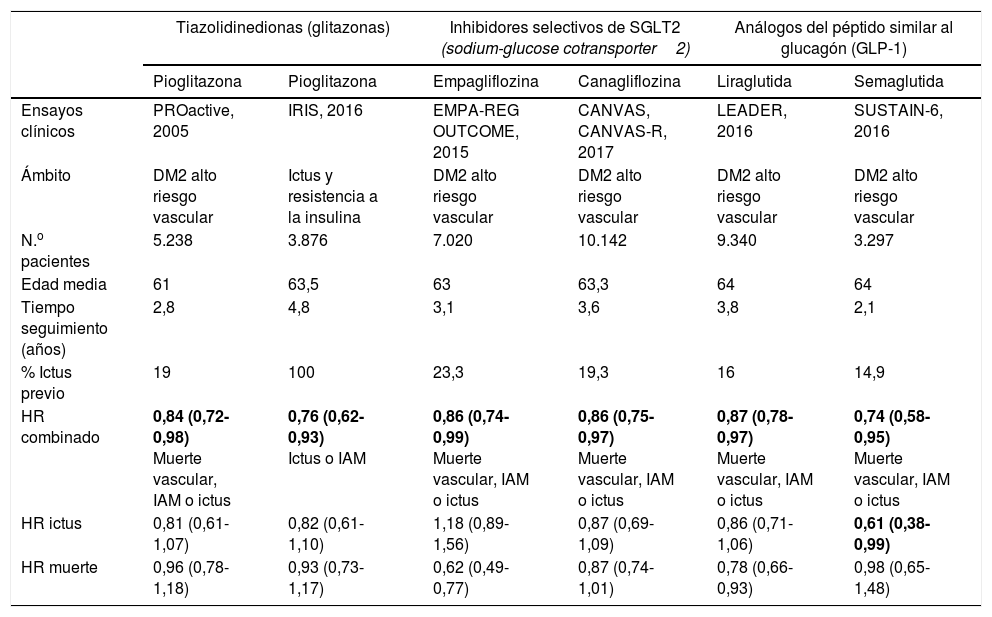
Resumen de las características de los principales fármacos antidiabéticos que muestran reducción de riesgo vascular global
| Tiazolidinedionas (glitazonas) | Inhibidores selectivos de SGLT2 (sodium-glucose cotransporter2) | Análogos del péptido similar al glucagón (GLP-1) | ||||
|---|---|---|---|---|---|---|
| Pioglitazona | Pioglitazona | Empagliflozina | Canagliflozina | Liraglutida | Semaglutida | |
| Ensayos clínicos | PROactive, 2005 | IRIS, 2016 | EMPA-REG OUTCOME, 2015 | CANVAS, CANVAS-R, 2017 | LEADER, 2016 | SUSTAIN-6, 2016 |
| Ámbito | DM2 alto riesgo vascular | Ictus y resistencia a la insulina | DM2 alto riesgo vascular | DM2 alto riesgo vascular | DM2 alto riesgo vascular | DM2 alto riesgo vascular |
| N.o pacientes | 5.238 | 3.876 | 7.020 | 10.142 | 9.340 | 3.297 |
| Edad media | 61 | 63,5 | 63 | 63,3 | 64 | 64 |
| Tiempo seguimiento (años) | 2,8 | 4,8 | 3,1 | 3,6 | 3,8 | 2,1 |
| % Ictus previo | 19 | 100 | 23,3 | 19,3 | 16 | 14,9 |
| HR combinado | 0,84 (0,72-0,98) Muerte vascular, IAM o ictus | 0,76 (0,62-0,93) Ictus o IAM | 0,86 (0,74-0,99) Muerte vascular, IAM o ictus | 0,86 (0,75-0,97) Muerte vascular, IAM o ictus | 0,87 (0,78-0,97) Muerte vascular, IAM o ictus | 0,74 (0,58-0,95) Muerte vascular, IAM o ictus |
| HR ictus | 0,81 (0,61-1,07) | 0,82 (0,61-1,10) | 1,18 (0,89-1,56) | 0,87 (0,69-1,09) | 0,86 (0,71-1,06) | 0,61 (0,38-0,99) |
| HR muerte | 0,96 (0,78-1,18) | 0,93 (0,73-1,17) | 0,62 (0,49-0,77) | 0,87 (0,74-1,01) | 0,78 (0,66-0,93) | 0,98 (0,65-1,48) |
DM2: diabetes mellitus tipo2; HR: hazard ratio; IAM: infarto agudo de miocardio.
En negrita, los valores estadísticamente significativos.
En el ámbito de la prevención secundaria de ictus disponemos de datos de dos ensayos clínicos específicamente diseñados para evaluar el riesgo de ictus recurrente. En el estudio J-SPIRIT25 se observó una tendencia a la reducción del riesgo de recurrencias de ictus en pacientes con prediabetes o DM tipo2 de reciente diagnóstico, aunque sin alcanzar significación estadística debido al pequeño tamaño muestral. En el estudio IRIS26 se incluyeron pacientes que habían tenido un ictus isquémico o AIT en los 6meses anteriores y que presentaban resistencia a la insulina definida por una puntuación mayor de 3 en el índice HOMA-IR (homeostasis model assessment of insulin resistance), que incluye en su fórmula tanto la concentración de glucemia como de insulina en ayunas. Se excluyeron pacientes con diagnóstico de DM así como aquellos con insuficiencia cardiaca y antecedentes de cáncer vesical. Tras un seguimiento medio de 4,8años se observó un beneficio significativo en la variable respuesta principal (ictus fatal o no fatal o infarto de miocardio) (HR 0,76; IC 95%: 0,69-0,93), si bien el análisis de ictus recurrente como variable secundaria no mostró diferencias significativas (HR 0,82; IC 95%: 0,61-1,10) (tabla 1). Es posible que el beneficio sobre la variable principal se deba fundamentalmente a la reducción de infarto de miocardio (2,7% frente a 4%), explicable en parte por la relativa baja edad media de los pacientes incluidos (63años) que contrasta con la de los pacientes con ictus, que suele ser superior a los 70años27.
Como se puede observar en la figura 1, pioglitazona se asocia a una significativa reducción del riesgo de ictus recurrente en pacientes con prediabetes o con DM tipo2 y antecedente de ictus o AIT, hallazgo similar a metaanálisis publicados hasta el momento28,29.
A pesar de estos buenos resultados, lo cierto es que no se ha implementado su uso en la práctica clínica. Son varias las razones que pueden estar influyendo en este hecho: (a) temor a sus efectos secundarios, como fracturas óseas, aumento de peso y edema, cáncer vesical e insuficiencia cardiaca; (b) necesidad de estudiar las concentraciones de insulina para constatar la resistencia a la insulina, determinación que no forma parte de la práctica clínica habitual en pacientes con ictus y no está disponible de forma generalizada en los hospitales; (c) el hecho de que la indicación de prevención secundaria de ictus no esté incluida en la ficha técnica de pioglitazona, al no cumplir el requisito de haber demostrado el beneficio en al menos dos ensayos clínicos30.
Inhibidores selectivos de SGLT2 (sodium-glucose cotransporter2)Actúan inhibiendo el cotransportador de sodio-glucosa (SGLT2) localizado en el túbulo renal, lo que conlleva la eliminación de glucosa por orina, en una cuantía que es proporcional a las concentraciones de glucemia19.
EmpagliflozinaEn el estudio EMPA-REG OUTCOME31 se ha demostrado que el tratamiento con empagliflozina de novo o añadido al tratamiento antidiabético estándar, en pacientes con DM tipo2 de alto riesgo vascular, reduce significativamente el riesgo de la variable combinada muerte vascular, infarto de miocardio no fatal o ictus no fatal (HR 0,86; IC 95%: 0,74-0,99; p<0,001). Este beneficio es fundamentalmente a expensas de la reducción del riesgo de muerte vascular (HR 0,62; IC 95%: 0,49-0,77; p<0,001), sin que se haya podido demostrar reducción del riesgo de infarto de miocardio o de ictus (tabla 1).
En el análisis de ictus se observó una tendencia a mayor número de ictus no fatales en el grupo de empagliflozina en comparación con placebo (HR 1,24; IC 95%: 0,92-1,67; p=0,16). Este discreto incremento del riesgo de ictus llevó a la realización de un informe de la FDA en el que la revisión realizada por la División de Neurología añadió interesantes argumentos para la interpretación de los resultados32. Al haber sido diseñado como estudio de seguridad, la adjudicación de los ictus realizada por el comité de seguridad se realizó con información incompleta, sin exigirse una evaluación neurológica ni la realización de pruebas de neuroimagen en todos los pacientes con sospecha de ictus. Además, las diferencias regionales en la identificación de ictus (mayor en los centros europeos), así como el desequilibrio en algunas comorbilidades como la mayor frecuencia de FA (11,6% frente a 5,8%) y menor proporción de tratamiento anticoagulante en los pacientes con antecedente de FA (88,4% frente a 91,1%) en el grupo de empagliflozina, podría haber comprometido la interpretación de los ictus. Más recientemente, se ha publicado un análisis post-hoc que concluye que la diferencia numérica (no significativa) observada entre grupos se debe fundamentalmente a ictus acontecidos >90días tras la supresión del mismo, por lo que no se atribuye una relación causal con el fármaco33.
Otros aspectos de interés para interpretar adecuadamente los resultados de este ensayo en relación con la falta de efecto de empagliflozina en el riesgo de ictus son: (a) la frecuencia de recurrencias de ictus llamativamente baja en ambos grupos de estudio (0,3%), a pesar de tratarse de una muestra de pacientes considerada de alto riesgo vascular31, lo que cuestiona que la muestra del ensayo sea representativa de la población en riesgo de ictus; (b) la edad media de los pacientes (63años)31, muy inferior a la habitual en pacientes con ictus, que suele ser mayor de 70años27; (c) el hecho de que se hayan considerado todos los ictus en el mismo epígrafe, sin diferenciación entre ictus isquémico o hemorrágico ni considerar los diferentes subtipos etiológicos. Todo ello hace que los resultados del ensayo EMPA-REG OUTCOME en cuanto al riesgo de ictus deban ser interpretados con cautela, máxime cuando existía un claro desequilibrio en la presencia de FA y porcentaje de pacientes en tratamiento anticoagulante. En este sentido, aunque en el análisis post-hoc recientemente publicado no se observaron diferencias significativas en el subtipo etiológico de ictus, llama la atención que el más frecuente fue el de origen cardioembólico33.
CanagliflozinaLos ensayos clínicos CANVAS y CANVAS-R (tabla 1) han demostrado recientemente el beneficio de este fármaco en la prevención de la variable primaria combinada de muerte vascular, infarto de miocardio no fatal o ictus no fatal, con un posible efecto nefroprotector, aunque con un riesgo significativamente aumentado de amputación34. Los dos ensayos incluyeron un total de 10.142 pacientes con DM tipo2 y alto riesgo vascular, definido como historia de enfermedad cardiovascular aterosclerótica sintomática o dos o más de los siguientes factores de riesgo: duración de la DM de al menos 10años, presión arterial sistólica mayor de 140mmHg a pesar de tratamiento antihipertensivo, tabaquismo, micro o macroalbuminuria, concentraciones de colesterol HDL inferiores a 1mmol/L (38,7mg/dL). La edad media de los participantes fue de 63años y el seguimiento medio de aproximadamente 3,5años. Un total de 1.958 pacientes (19,3% de la muestra) habían tenido previamente un ictus. El análisis específico del riesgo de ictus no mostró diferencias significativas en comparación con el grupo placebo: ictus no fatal (HR 0,90; IC 95%: 0,71-1,15); ictus fatal o no fatal (HR 0,87; 0,69-1,09). Estos resultados contrastan con los del estudio EMPAREG-OUTCOME31 en que se observó una tendencia al incremento de ictus, lo que vendría a reforzar la hipótesis de que los resultados del análisis de ictus en dicho ensayo clínico no representan un efecto de grupo y podrían deberse a las circunstancias metodológicas anteriormente referidas. Entre los efectos adversos más frecuentes destacan las infecciones genitales y el riesgo aumentado de fracturas óseas.
Los metaanálisis de los ensayos clínicos publicados con diferentes inhibidores selectivos de SGLT2, que no incluyen todavía los resultados de los estudios CANVAS, muestran resultados contradictorios en cuanto al riesgo de ictus. Así, el metaanálisis de Wu et al.35, que incluyó 57 ensayos clínicos con datos de 7 fármacos de esta familia de antidiabéticos, observó un incremento significativo del riesgo de ictus no fatal (HR 1,30; IC 95%: 1,00-1,68; p=0,049). Sin embargo, más recientemente, el metaanálisis realizado por Saad et al.36, que incluyó 81 estudios, no observó diferencias en el riesgo de ictus o AIT en los pacientes tratados con inhibidores selectivos de SGLT2 frente al grupo control (OR 1,09; IC 95%: 0,87-1,37).
Análogos del péptido similar al glucagón (GLP-1)Estos fármacos tienen la capacidad de mimetizar la acción del péptido similar al glucagón (GLP-1), lo que resulta en un incremento de secreción de insulina con inhibición de la de glucagón19. En esta familia, se ha evaluado el efecto de los siguientes fármacos en prevención vascular global:
LixisenatidaEl ensayo clínico ELIXA, que aleatorizó 6.068 pacientes con DM tipo2 que habían tenido un infarto agudo de miocardio o habían requerido hospitalización por este motivo en los 180días previos, no mostró ningún beneficio en prevención de la combinación de muerte, infarto de miocardio, ictus u hospitalización por angina inestable. De los 6.068 pacientes incluidos, solo 331 (5,4%) habían tenido un ictus, siendo este antecedente significativamente más frecuente en el grupo placebo (6,2% frente a 4,7%; p=0,01). Tras un seguimiento de solo 25meses, no se observaron diferencias significativas en el riesgo de ictus (HR 1,12; IC 95%: 0,79-1,58)37.
LiraglutidaEl ensayo clínico LEADER38 aleatorizó a 9.340 pacientes con DM tipo2 y alto riesgo vascular definido como edad de 50años o más y al menos un proceso vascular coexistente (enfermedad coronaria, enfermedad cerebrovascular, arteriopatía periférica, nefropatía crónica en estadio3 o mayor, insuficiencia cardiaca clase II o III de la New York Heart Association) o edad mayor o igual a 60años y al menos un factor de riesgo vascular como microalbuminuria o proteinuria, hipertensión arterial e hipertrofia del ventrículo izquierdo, disfunción ventricular o un índice tobillo-brazo menor de 0,9. Tras un seguimiento de 3,5años, el grupo de liraglutida presentó un riesgo de evento combinado significativo menor (muerte vascular, infarto agudo de miocardio o ictus no fatales), con un HR de 0,87 (IC 95%: 0,78-0,97). Respecto al riesgo de ictus, se observó una tendencia a favor del grupo de liraglutida, tanto en el análisis de ictus en general (HR 0,86; IC 95%: 0,71-1,06) como en el de ictus fatal (HR 0,64; IC 95%: 0,34-1,19) y no fatal (HR 0,89; IC 95%: 0,72-1,11) o AIT (HR 0,79; IC 95%: 0,54-1,16). Aunque el 16% de los pacientes incluidos tenían antecedentes de enfermedad cerebrovascular, el análisis preespecificado de subgrupos no incluyó la variable ictus previo, por lo que es posible inferir el efecto en los pacientes con enfermedad cerebrovascular establecida.
SemaglutidaEs un análogo del GLP-1 de administración subcutánea y semivida superior a una semana. Aunque en el momento de la elaboración de esta revisión todavía no ha sido aprobado para su uso en DM tipo2, el ensayo SUSTAIN-639, que aleatorizó 3.297 pacientes con DM tipo2, con criterios de alto riesgo vascular similares a los del ensayo LEADER38, ha demostrado un importante beneficio en la reducción del riesgo vascular global en pacientes con DM tipo2 de alto riesgo vascular (HR 0,74; IC 95%: 0,58-0,95), siendo el primero de los antidiabéticos que muestra específicamente un significativo menor riesgo de ictus (HR 0,61; IC 95%: 0,38-0,99) (tabla 1). Otros beneficios adicionales del tratamiento con semaglutida son la mejora del control glucémico y de la presión arterial sistólica, la reducción del peso corporal, así como la reducción del riesgo de nefropatía diabética de nueva aparición o empeoramiento de la previa. Aunque la frecuencia es baja, se ha observado mayor porcentaje de retinopatía diabética en el grupo de semaglutida (3% frente a 1,8%), especialmente en pacientes con retinopatía ya presente al inicio del estudio y que podría ser debida al rápido control glucémico que produce semaglutida, de forma similar a lo que ocurrió en el estudio Diabetes Control and Complications Trial40. Los efectos adversos más frecuentes fueron los gastrointestinales, sin aumento del riesgo de tumores o de pancreatitis.
Inhibidores de la dipeptidil-peptidasa (DPP-4)Actúan bloqueando la degradación del péptido relacionado con glucagón, y otros péptidos como el péptido natriurético cerebral, aumentando la secreción de insulina por las célulasβ y reduciendo la secreción de glucagón por las célulasα19.
Aunque un metaanálisis con datos procedentes de pequeños ensayos clínicos mostraba una tendencia no significativa hacia un beneficio con estos fármacos en prevención de ictus41, ninguno de los tres ensayos clínicos a gran escala que evaluaron la eficacia y seguridad de las gliptinas en cuanto a riesgo vascular global han mostrado un efecto significativo en prevención de ictus42-44. Su principal inconveniente es el incremento del riesgo de insuficiencia cardiaca observado en los ensayos con saxagliptina43 y alogliptina44, efecto que no parece compartir sitagliptina42.
SaxagliptinaEl estudio SAVOR-TIMI53 aleatorizó 16.492 pacientes con DM tipo2 e historia de enfermedad vascular establecida, entre la que se incluía el antecedente de enfermedad cerebrovascular, aunque no se especifica el porcentaje de pacientes con ictus previo. Tras un seguimiento medio de 2,1años, no se observaron diferencias significativas en el riesgo de la variable combinada principal (muerte vascular, infarto de miocardio o ictus) (HR 1,00; IC 95%: 0,89-1,12) ni de la variable secundaria ictus isquémico (HR 1,11; IC 95%: 0,88-1,39)43.
AlogliptinaSe ha ensayado en pacientes con DM tipo2 y síndrome coronario agudo reciente. Hasta el 7,2% de los pacientes incluidos presentaban antecedente de ictus. No se demostró diferencia en el riesgo de la variable primaria (combinación de muerte vascular, infarto de miocardio no fatal o ictus no fatal [HR 0,96; ≤1,16]) ni en ictus no fatal (HR 0,91; IC 95%: 0,55-1,50)44.
SitagliptinaEl ensayo clínico TECOS incluyó 14.671 pacientes con DM tipo2 y enfermedad vascular establecida, con un seguimiento medio de 3años. Hasta el 25,5% de los pacientes incluidos habían tenido un ictus previo. Sitagliptina demostró no inferioridad frente a placebo para la variable principal combinada de muerte vascular, infarto de miocardio no fatal, ictus no fatal u hospitalización por angina inestable (HR 0,98; IC 95%: 0,88-1,09; p<0,001), sin diferencias en cuanto a la frecuencia de efectos adversos. La frecuencia de ictus fatal o no fatal fue similar en ambos grupos (2,4% frente a 2,5%; HR 0,97; IC 95%: 0,79-1,19)42.
DiscusiónEl requerimiento de la FDA de evaluar el riesgo vascular de los fármacos antidiabéticos, paradójicamente, ha supuesto un importante avance en el conocimiento de sus beneficios en cuanto a reducción de riesgo de muerte vascular, infarto agudo de miocardio e ictus no fatales en los pacientes con DM tipo2 y alto riesgo vascular. Estos efectos son constantes en la reducción de riesgo vascular global en los grandes ensayos clínicos realizados con glitazonas, inhibidores selectivos de SGLT2 y análogos del GLP-1.
Con respecto a la reducción de riesgo de ictus, los resultados de los principales ensayos clínicos realizados hasta el momento muestran un beneficio significativo en el caso de semaglutida y tendencias favorables con pioglitazona, canagliflozina y liraglutida. No obstante, existen algunos aspectos metodológicos que hacen posible que se haya subestimado el potencial efecto preventivo de ictus. En primer lugar, la edad media de los pacientes incluidos en los ensayos clínicos (61-64años) es relativamente baja para la habitual en pacientes con ictus, que suele ser mayor de 70años27. Además, el seguimiento de los pacientes ha sido inferior a 5años en todos ellos, por lo que no se puede excluir la posibilidad de que un seguimiento más prolongado hubiese mostrado resultados más contundentes en el análisis de ictus, teniendo en cuenta sus efectos beneficiosos tanto sobre el metabolismo glucídico y lipídico, así como hemodinámicos y antiaterogénicos. De hecho, un modelo teórico de reducción de riesgo vascular con dapagliflozina ha mostrado, en una proyección de 20años, que la reducción del RR de ictus alcanzaría el 9,1%45. En un análisis a 10años de seguimiento del estudio PROactive, los pacientes que continuaban tratamiento con pioglitazona presentaron una tendencia a menor frecuencia de ictus que aquellos que lo habían suspendido (12,5% frente a 13,2%)46.
En prevención secundaria de ictus solo disponemos de datos de pioglitazona, que muestra un beneficio significativo en reducción de riesgo de ictus recurrente en pacientes con DM tipo2 de alto riesgo y una tendencia favorable en pacientes con resistencia a la insulina23,47. Hasta el momento, no se han publicado análisis específicos del efecto de otros antidiabéticos en los subgrupos de pacientes con ictus previo, aspecto que sería de gran interés para los neurólogos.
ConclusionesEn los últimos años se han publicado diversos ensayos clínicos que muestran un claro beneficio en reducción de complicaciones vasculares en paciente con DM tipo2 de alto riesgo, algunos de los cuales muestran, además, beneficio en la reducción de riesgo de ictus, lo que debería ser tenido en cuenta en la elección del fármaco antidiabético más apropiado en pacientes con ictus. Por este motivo, todos los especialistas que tratamos pacientes con DM tipo2 debemos evaluar su riesgo vascular y considerar aquellos fármacos que les ofrecen la mayor protección vascular global. En este sentido, es fundamental que los neurólogos nos impliquemos también en la prevención secundaria de ictus y otras complicaciones vasculares en los pacientes con DM tipo2 y conozcamos las características y el balance beneficio-riesgo de los diferentes fármacos antidiabéticos, que se tienen que ir incorporando al arsenal terapéutico habitual en prevención secundaria junto con los fármacos antitrombóticos, antihipertensivos y estatinas.
Conflicto de interesesBlanca Fuentes ha recibido honorarios por asesoría científica (Bayer, BMS/Pfizer, NovoNordisk, Laboratorios Rubió) y conferencias (Bayer, BMS/Pfizer, Daichi-Sankyo, NovoNordisk).