En las décadas posteriores a la Segunda Guerra Mundial, diversos estudios comenzaron a observar la existencia de diferentes tipos de hepatitis víricas agudas1. En el año 1967 las investigaciones realizadas por Krugman et al2 establecieron la existencia de al menos 2 tipos de hepatitis, una de las cuales se transmitía por vía parenteral. Esta enfermedad, anteriormente conocida como «hepatitis sérica» y actualmente como hepatitis B, es en nuestros días un importante problema de salud. A pesar de que la vacunación universal de los recién nacidos instaurada por la Organización Mundial de la Salud ha permitido controlar la propagación de la enfermedad en muchos países, se estima que hay más de 300 millones de personas afectadas en todo el mundo3,4. De ellas, aproximadamente 500.000-1.000.000 fallecen cada año debido a sus complicaciones, que han convertido a la hepatitis B en la décima causa de muerte en el mundo3. El descubrimiento llevado a cabo por Krugman et al2 en la década de los años sesenta del siglo pasado abrió un gran campo de investigación en torno a esta infección, pero ha sido en los últimos 10 años cuando se han realizado los más importantes avances en el conocimiento de la historia natural y la patogenia de la infección, así como en su diagnóstico serológico y tratamiento.
Virus de la hepatitis B
Características del virus
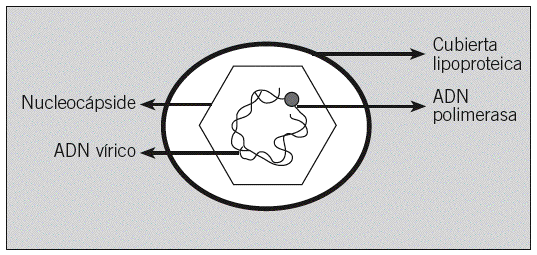
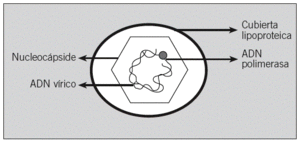
El virus de la hepatitis B (VHB) pertenece a la familia de los hepadnavirus1,3,4. El virión completo es una partícula de aproximadamente 42 nm de diámetro, que recibe el nombre de partícula de Dane. Se compone de una cubierta lipoproteica y de una partícula central o core, constituida por una nucleocápside proteica que envuelve el ADN vírico y un complejo polimerasa (fig. 1).
Fig. 1. Partícula de Dane.
El genoma del VHB está formado por una molécula de ADN de doble hélice que adopta una forma circular incompleta y que está constituida por 4 secuencias de lectura: pre-S-S, pre-C-C, X y P, que codifican diferentes proteínas. La región pre-S-S es la causa de la codificación de los 3 antígenos de superficie: S, pre-S1 y pre-S2. La proteína S, la más abundante, se conoce como antígeno de superficie del VHB (HBsAg). La función de la proteína pre-S2 es aún desconocida y la pre-S1 se ha relacionado tanto con la unión del virión al hepatocito, como con su liberación tras infectar la célula. La región pre-C-C codifica 2 proteínas dependiendo del codón de inicio: la partícula antigénica c, que se localiza en el core (HBcAg), y el antígeno e del VHB (HBeAg)1,3,4. Este último es una proteína liposoluble que parece secretarse a la sangre5 y cuya función no se conoce con exactitud, ya que no forma parte de la estructura del virión y no parece necesaria para la replicación vírica (hay cepas mutantes que no expresan HBeAg). El gen P codifica la síntesis de la ADN polimerasa y el gen X la de una proteína que posee capacidad activadora transcripcional de diversos promotores y que se ha implicado en la patogenia del hepatocarcinoma3,4
El VHB no sintetiza exclusivamente viriones completos, sino que también es la causa de la liberación de partículas esféricas o filamentosas formadas por proteínas de la envoltura (HBsAg). Estas partículas, al no poseer genoma vírico, no son infecciosas, únicamente tienen capacidad antigénica y son más numerosas que las partículas de Dane1.
Ciclo replicativo y patogenia del virus de la hepatitis B
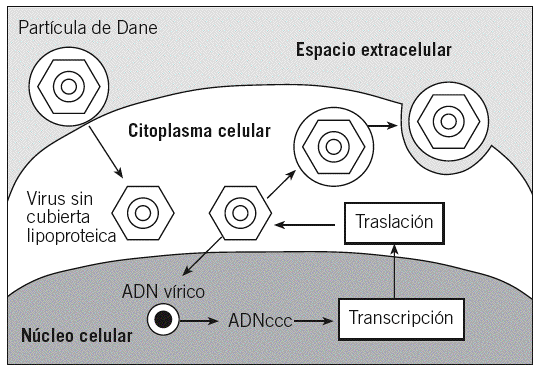
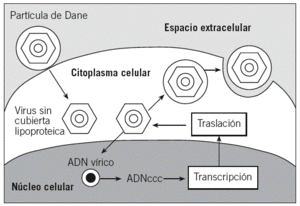
El mecanismo de replicación del VHB es similar al de los retrovirus. Se caracteriza por la síntesis de ADN a partir de ARN mediante una transcriptasa inversa4. En este proceso, el virión del VHB se une a los receptores de la membrana del hepatocito mediante un proceso en el que parece intervenir la proteína pre-S11,6. Posteriormente, la envoltura de la partícula de Dane se fusiona con la membrana de la célula hepática y el core se libera dentro del citoplasma. Éste se dirige al núcleo, dentro del cual se completa la síntesis del ADN vírico hasta convertirse en un ADN circular cerrado covalentemente (ADNccc). Esta estructura es muy estable, parece tener una vida media muy larga y es muy resistente al tratamiento antiviral. A partir del ADNccc se transcribe el ARN vírico, el cual es transportado al citoplasma para transcribir las diversas proteínas que constituyen el VHB. Luego, las proteínas de la nucleocápside encierran en su interior una partícula de ARN pregenómico y el complejo polimerasa. A partir de este ARN pregenómico se lleva a cabo la transcripción inversa, que dará lugar a una cadena de ADN vírico, que posteriormente se unirá a otra cadena para formar la molécula de doble hélice circular incompleta. En este momento está constituido el core del nuevo virus, el cual puede volver a introducirse en el núcleo para repetir el proceso anterior, o bien adquirir las proteínas de la envoltura en la membrana del hepatocito para ser posteriormente excretado de la célula3,4 (fig. 2).
Fig. 2. Esquema de la replicación del virus de la hepatitis B. ADNccc: ADN circular cerrado covalentemente.
Historia natural
La historia natural de la infección por el VHB varía dependiendo de diversos factores epidemiológicos e individuales. La infección primaria puede presentarse desde una forma prácticamente asintomática hasta una hepatitis fulminante, es susceptible de autolimitarse y resolverse o de evolucionar hacia la cronicidad. En el caso de las infecciones crónicas por el VHB, la presencia o ausencia del HBeAg será, como veremos a continuación, un factor determinante en su evolución, pronóstico y tratamiento.
Infección primaria
El período de incubación de la infección por el VHB tiene una duración de 4-10 semanas7. En la fase final de esta etapa se comienza a detectar en suero el HBsAg. Cuando éste aparece, la viremia está bien establecida y se detectan títulos muy elevados de virus en sangre, frecuentemente8 de 109 a 1010 viriones/ml. Una o 2 semanas después comienza el período prodrómico, que se caracteriza por la aparición de síntomas antes de que el paciente presente ictericia7. Por lo general esta fase tiene una duración menor de 5 días, pero puede durar varias semanas o incluso no manifestarse clínicamente7. Se produce la positivización de anticuerpos contra el antígeno del core de tipo inmunoglobulina (Ig) M (HBcAc) y la activación de la respuesta inmunitaria del huésped, junto con síntomas como astenia, anorexia, náuseas, vómitos e intolerancia a las grasas, entre otros. Los HBcAc de tipo IgM permanecen en sangre aproximadamente 6 meses, luego desaparecerán y darán paso a los de tipo IgG, que estarán presentes durante toda la vida9. Debido a la activación de la respuesta inmunitaria se produce daño hepático, el cual se manifiesta con una alteración variable de las transaminasas y una disminución de la cantidad de virus en la sangre y en los hepatocitos1. En este intervalo puede producirse la positivización del HBeAg.
El período de convalecencia se inicia con la desaparición de la ictericia7. Si la infección evoluciona favorablemente, al cabo de uno o 2 meses de la positivización del HBsAg se produce su aclaramiento y, posteriormente, el del HBeAg. El HBcAg no se detecta en ningún momento en el plasma de las personas infectadas, debido a que se encuentra enclaustrado en el interior de la cubierta del core9. Tras un período ventana de una a 2 semanas, aparece en sangre el anticuerpo contra el antígeno de superficie (HBsAc), que persistirá indefinidamente9. En esta fase, en la que tanto el HBsAg como el HBsAc son negativos, la presencia de anticuerpos de tipo IgG frente al antígeno del core será fundamental para demostrar la presencia de infección9.
En resumen, en las hepatitis agudas autolimitadas el HBsAg y el resto de los marcadores antigénicos terminan desapareciendo y se produce su seroconversión. Pequeñas cantidades de ADN vírico pueden persistir en sangre durante años o durante toda la vida; sin embargo, no han demostrado ser infectivas10.
Infección crónica
Cuando el HBsAg se aísla en el suero de los pacientes afectados durante más de 6 meses, probablemente persista ya durante toda la vida y la infección se cronifique11. En estos casos continúa la producción vírica de forma permanente, aunque los valores de viremia en general se mantienen más bajos que en la infección aguda. Aunque el HBsAg persista, los títulos de ADN vírico tienden a disminuir, el HBeAg tiende a aclararse y a producirse su seroconversión. Este hecho suele acompañarse de un aumento de las cifras de alanino-aminotransferasa (ALT) por destrucción inmunitaria de las células hepáticas infectadas1. La antigua creencia de que el ADN vírico circulante desaparece cuando lo hace el HBeAg y aparece el anticuerpo contra el antígeno e (HBeAc) es incorrecta. En la actualidad, con el método de reacción en cadena de la polimerasa se ha conseguido cuantificar cantidades más pequeñas de ADN vírico. Con este método se ha demostrado que al menos el 70-85% de estos pacientes presenta una carga vírica de entre a 103 y 105/ml, y a veces superior1,12. Estas cantidades de ADN vírico únicamente se mantienen si persiste la replicación vírica, por lo que el término «hepatitis crónica replicativa» está hoy en desuso1. Los pacientes con HBeAg negativo y HBeAc positivo que presentan valores bajos de ALT y de ADN vírico circulante tienen un mejor pronóstico de la infección y se les denomina «portadores asintomáticos».
Aproximadamente en un 10-15% de los pacientes en que persiste la infección, los valores de ALT y ADN se mantienen elevados a pesar de no aislarse antígeno e circulante. Estos casos, más frecuentes en el sur de Europa y en Asia, se deben a una mutante pre-core que no produce dicho antígeno1,13,14.
En torno a un 20% de los pacientes con hepatopatía crónica por el VHB evolucionan hacia cirrosis1. Por ello, el riesgo de desarrollar hepatocarcinoma en pacientes con infección crónica por el VHB es unas 100 veces superior al de la población general15, y es recomendable realizar un cribado (mediante ecografía hepática y/o medición de alfafetoproteína) al menos 2 veces al año16.
Diagnóstico serológico
En la hepatitis B, igual que en el resto de las hepatitis de etiología vírica, el diagnóstico se basa en la determinación de diversos marcadores serológicos y víricos, que se relacionan con los diferentes estadios de la infección. Generalmente estas determinaciones se llevan a cabo a partir de muestras de suero o plasma y en pocas ocasiones es necesario material procedente de biopsias. En ningún caso se realiza el cultivo como opción diagnóstica17.
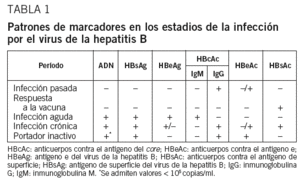
La infección activa (aguda o crónica) se diferencia de aquellos casos en que aparecen marcadores del virus sin que haya infección activa (infección pasada o individuo vacunado) por la presencia del HBsAg (tabla 1):
1. Cuando el HBsAg es negativo, también lo serán el resto de los marcadores antigénicos, y la presencia o ausencia de sus diferentes anticuerpos es lo que determinará el tipo de contacto del paciente con el virus. En el caso de una infección pasada, tanto el HBcAc como el HBsAc y el HBeAc pueden estar presentes. Sin embargo, estos 2 últimos pueden ir desapareciendo a lo largo de la vida y, por tanto, el HBcAc podría ser el único marcador presente.
En los individuos vacunados, la única partícula detectable es el HBsAc, ya que éste es el único antígeno con el que el paciente entra en contacto a través de la vacunación.
2. En el caso de las infecciones activas (HBsAg positivo) el tipo de HBcAc será el marcador determinante para diferenciar la infección aguda de la crónica: IgM en la aguda e IgG en la crónica. En la infección crónica por el VHB, el HBeAg puede ser positivo o bien puede producirse el aclaramiento del antígeno y su seroconversión posterior (HBeAg negativo y HBeAc positivo). Los casos de hepatitis crónica HBeAg positivos son el resultado de un fenómeno de inmunotolerancia debido a una insuficiente respuesta citotóxica por parte de las células T18. Esto permite la perpetuación de la replicación vírica de manera importante y, por tanto, la detección de concentraciones elevadas de ADN vírico en plasma18.
Cuando la respuesta inmunitaria es más eficaz, ésta puede llevar a producir el aclaramiento del HBeAg y la aparición de su anticuerpo. En estos casos la replicación vírica es mucho menos intensa y los valores detectables de ADN vírico son menores18. Los pacientes que presentan este último patrón son los que se denominan «portadores inactivos». El porcentaje de seroconversiones espontáneas HBeAc se estima en torno al 5-15% por año, y cuanto más temprana sea la edad de adquisición de la infección, menores son las posibilidades5,18,19. Sin embargo, es necesario destacar que no en todos los casos en que el HBeAg sea negativo y el HBeAc positivo puede hablarse de portadores inactivos, porque los pacientes infectados por una variante denominada pre-core del VHB también presentan este patrón. Estas variables del VHB son consecuencia de una mutación en el ADN, muy frecuente en nuestro medio, que hace que se interrumpa la producción de HBeAg durante la replicación vírica18. ¿Qué es, por tanto, lo que diferencia a un portador inactivo de un paciente con una variante pre-core?: los valores de ADN-VHB. De forma arbitraria se ha definido como indicativo de hepatitis activa un valor de ADN superior a 105 copias/ml, mientras que valores inferiores serían indicativos del estado de portador inactivo. Sin embargo, esta división no es determinante; en efecto, se ha demostrado en estudios recientes que puede haber valores de ADN-VHB inferiores a 105 tanto en portadores inactivos como en infecciones por variantes pre-core, y también en casos de fibrosis hepática significativa e incluso cirrosis18 (tabla 1).
3. Patrones atípicos:
Mutantes de escape. Producen un déficit de expresión de HBsAg o una alteración en las proteínas del virión que escapan a los tests diagnósticos diseñados20-22. En estos casos, el antígeno de superficie siempre será negativo, a pesar de que puede haber una infección activa con el resto de los marcadores serológicos presentes.
Reactividad aislada del HBsAg en ausencia de HBcAc. En este caso es necesario reproducir la reactividad, para confirmarla, mediante pruebas de neutralización con anticuerpos de superficie. Si no es posible, la presencia aislada del HBsAg es reflejo de reacciones inespecíficas en las pruebas de detección y descarta la infección por el VHB, lo cual suele ser la explicación más frecuente para este patrón serológico23,24. Dicho patrón también puede ser reflejo de un momento muy temprano de la primoinfección aguda, de una infección por el VHB-2 (mutaciones en el gen X, que parecen estar relacionadas con un rápido aclaramiento del HBsAg), de fenómenos de inmunotolerancia ligados a la transmisión vertical del virus o a inmunodepresión y, por supuesto, es el patrón que aparece justamente tras la vacunación23,25-30.
Reactividad aislada del HBcAc, que es compatible con varias situaciones: falsos positivos de la técnica para la detección de HBsAc, falsos negativos en la detección de otros marcadores serológicos, período ventana de una infección aguda que se está resolviendo, infección pasada con aclaramiento progresivo del HBsAc, respuesta inmunitaria incompleta de HBsAc, especialmente en pacientes inmunodeprimidos, e infección crónica activa pero latente (portador silente HBsAg negativo)31-36.
Se han descrito variantes estables de las 4 regiones abiertas de transcripción, pero algunas de ellas tienen mayor relevancia para la salud pública: mutantes del HBsAg, pre-core y del gen X17. El número de variantes del VHB parece ir en aumento en los últimos años debido al uso creciente de los tratamientos antirretrovirales cuya diana es la polimerasa37. En España se ha evaluado la frecuencia de dichas variantes y se ha estimado que el 12,5% de los portadores crónicos están infectados con algunas de ellas38.
Tratamiento
El objetivo del tratamiento en el caso de la infección crónica por el VHB consiste en inhibir la replicación vírica al mínimo y durante el período más prolongado posible. Con esto se pretende disminuir la lesión hepática y evitar o retrasar la evolución hacia cirrosis y/o hepatocarcinoma. Sin embargo, el pool residual de ADNccc que permanece en el núcleo de las células infectadas es muy resistente a los antivirales y es causa de reactivación tras interrumpir el tratamiento18. En la infección aguda por el VHB únicamente se realiza tratamiento sintomático en caso de que sea necesario.
Las indicaciones para el inicio del tratamiento antiviral se basan en la carga vírica y los valores de transaminasas. No se consideran candidatos al tratamiento los pacientes que presenten valores normales de transaminasas (< 2 veces por encima del límite superior de la normalidad) y menos de 105 copias/ml de ADN-VHB16. Algunos autores recomiendan el seguimiento del paciente y otros proponen realizar biopsia hepática y administrar tratamiento si se demuestra actividad16,39. En el caso de las hepatitis crónicas HBeAg negativas, se ha propuesto tratar con cargas víricas superiores a 104 copias/ml, dado que este tipo de hepatitis se asocia, en general, a valores inferiores de ADN vírico39.
En la actualidad hay 4 fármacos comercializados en España para el tratamiento de la infección crónica por el VHB: el interferón alfa (INF-*), el interferón pegilado *2a (PEG-INF-*2a), la lamivudina (3TC) y el adefovir dipivoxilo (ADV). Continúan investigándose nuevas opciones terapéuticas y pronto se comercializará otro fármaco denominado entecavir, ya aprobado por la Food and Drug Administration40.
Las últimas recomendaciones terapéuticas establecen que el INF-* o, mejor, el PEG-INF-*2a, por ser más eficaz, deben ser fármacos de primera línea para el tratamiento de la hepatitis crónica por el VHB40-44. Las ventajas de dicho tratamiento consisten en que es limitado en el tiempo, produce una respuesta sostenida más duradera que el resto de los fármacos y no origina mutantes resistentes40. Sin embargo, tienen el inconveniente de ser fármacos mal tolerados, con efectos secundarios frecuentes y potencialmente graves (cuadro seudogripal, citopenia, alteraciones psiquiátricas, exacerbación de procesos autoinmunitarios o de otras enfermedades sistémicas, entre otros), que en ocasiones suponen una contraindicación absoluta o relativa para su utilización40. Las formas pegiladas del INF-* confieren al fármaco un aumento de su potencia y una vida media más prolongada18. Los estudios en que se ha comparado el PEG-INF-*2a (180 µg/semana por vía subcutánea) con el INF-* convencional han demostrado mejores resultados con el primero tanto en el caso de las hepatitis HBeAg positivas como en las negativas45,46. El PEG-INF-*2b está pendiente de aprobación por la Food and Drug Administration y parece que en los estudios clínicos realizados su eficacia es bastante similar a la del PEG-INF-*2a40,44,47.
La 3TC es un potente inhibidor de la replicación del VHB. Se administra por vía oral a dosis de 100 mg/día y en general se tolera mejor que el INF. Sin embargo, tiene el inconveniente de no erradicar completamente el virus, por lo que en general es necesario mantener el tratamiento durante períodos prolongados. Esto aumenta las resistencias y disminuye la eficacia terapéutica18,48. El efecto adverso más importante, aunque excepcional, es la toxicidad mitocondrial.
El ADV, por su parte, actúa inhibiendo la polimerasa vírica y, al igual que la 3TC, se administra por vía oral (10 mg/día). Aunque también produce resistencias tras el uso prolongado, éstas parecen ser menos importantes que en el caso de la 3TC18. El efecto adverso más importante es la nefrotoxicidad.
En todos los casos es necesario tener en cuenta si la hepatitis es HBeAg positiva o negativa, ya que parece ser que los casos HBeAg negativos, aunque pueden responder bien al tratamiento, tienen una escasa respuesta sostenida49,50.
Los ensayos que han comparado el PEG-INF-*2a y la 3TC, tanto en casos de hepatitis crónica HBeAg positiva como negativa, han demostrado que el primero consigue mejores resultados en cuanto a seroconversión del HBsAg, disminución de los valores de ADN y seroconversión del HBeAg, en caso de que éste sea positivo. Los resultados también son mejores tras la interrupción del tratamiento51,52. Sin embargo, en algunos estudios realizados con el PEG-INF-*2b los autores concluyen que el tratamiento combinado con 3TC proporciona una respuesta virológica sostenida más elevada que el tratamiento con 3TC en monoterapia53. En caso de cirrosis descompensada, la utilización del IFN está contraindicada debido a que la gravedad y la frecuencia de los posibles efectos secundarios superan a las ventajas. En estos casos se debe optar por tratar con 3TC o ADV54,55.
En la actualidad quedan multitud de preguntas sin resolver en relación con el tratamiento de la hepatitis crónica por el VHB, como decidir el fármaco más indicado en el tratamiento de rescate, las ventajas del tratamiento combinado, la duración de la farmacoterapia, entre otras. En este sentido, parece demostrado que la asociación de 3TC y PEG-INF-*2a no mejora los resultados obtenidos con este último en monoterapia51,52. En cuanto a la duración, los estudios realizados con PEG-INF-*2a observan buenos resultados tras un año de tratamiento51,52. En el caso de la 3TC, el aumento del tiempo de tratamiento parece mejorar los resultados, pero el uso prolongado aumenta las resistencias56. Los estudios realizados con ADV demuestran que los resultados tras un año de tratamiento son buenos, pero no se mantienen después de la interrupción; sin embargo, al aumentar la duración del tratamiento a 3 años, los beneficios son más prolongados y las resistencias no tan importantes57.
Hay numerosos fármacos en desarrollo, algunos de ellos, como la emtricitabina o el tenofovir, ya aprobados para su uso en la infección por el virus de la inmunodeficiencia humana. De todos ellos, el entecavir ha obtenido resultados alentadores. Este fármaco es un inhibidor potente y selectivo de la ADN polimerasa58,59. Los estudios preclínicos han demostrado que es un eficaz agente antivírico, reduce la incidencia de hepatocarcinoma y aumenta la supervivencia60. Su eficacia y tolerabilidad también han quedado demostradas en ensayos en fases 2 y 361,62.
Recientemente se han publicado 2 estudios (fase 3) que comparan la 3TC y el entecavir en pacientes con hepatitis B crónica HBeAg negativa y positiva que no habían recibido previamente tratamiento con análogos de los nucleósidos. Los resultados han demostrado que el entecavir parece mejorar los parámetros histológicos, virológicos y bioquímicos en mayor medida que la 3TC, ofreciendo un perfil de seguridad similar y sin evidenciarse resistencias59,63.
Para evaluar la respuesta al tratamiento se han definido de forma consensuada varias categorías16,18: bioquímica (disminución de transaminasas al intervalo normal); virológica (disminución de ADN a valores indetectables y pérdida de HBeAg); completa, que abarca las 2 anteriores, e histológica (disminución del índice de actividad > 2 puntos). La respuesta terapéutica puede medirse durante el tratamiento, al finalizarlo (respuesta mantenida) y al cabo de 6-12 meses de concluido (respuesta sostenida)18.