Exenatida es un análogo de GLP1 diseñado para mejorar el control glucémico en pacientes con obesidad y diabetes mellitus tipo 2 (DM2). Además, presenta otras acciones de control metabólico. El objetivo de este estudio fue valorar si exenatida ayuda a conseguir objetivos de control metabólico en pacientes con obesidad y DM2 tras 24 semanas de tratamiento.
Pacientes y métodoEnsayo clínico abierto en 102 pacientes, 69 mujeres y 33 varones, con edades comprendidas entre 19-77 años (media [DE] de 53,2 [1,1] años, con DM2 de evolución media de 4,88 [0,5] años (extremos entre 1 y 20 años) en tratamiento con antidiabéticos orales (ADO) y obesidad.
ResultadosSe observó una diferencia significativa de la glucosa basal, con reducción promedio de 19,7 (7,1) mg/dl, y de hemoglobina glucosilada (HbA1c) de 0,33 (0,17)%, siendo esta última mayor en pacientes con mal control previo al tratamiento (HbA1c>8,5%), en los que la disminución fue de una media del 2,12 (0,53)%. Se tomó como objetivo establecido respecto a HbA1c < 7%, alcanzado en un 14% más de los pacientes tratados que de los controles (43,6 frente a 57,9; p < 0,05). El peso disminuyó en 4,4 (0,8) kg y el índice de masa corporal en 1,7 (0,3) kg/m2. Se redujeron de forma no significativa el colesterol total (una media de 4,9 [1,5] mg/dl), el colesterol unido a lipoproteínas de baja densidad (colesterol LDL) (una media de 3,2 [3,4] mg/dl, el colesterol unido a lipoproteínas de no alta densidad (de 8,6 [5,6] mg/dl) y el colesterol unido a lipoproteínas de alta densidad (de 2,5 [1,4] mg/dl). En pacientes fuera de objetivo (colesterol LDL>100mg/dl y/o triglicéridos>150mg/dl) sí se observaron diferencias significativas en el colesterol LDL y los triglicéridos. En cuanto a la presión arterial (PA), solo se obtuvieron diferencias significativas en las cifras de PA diastólica (descenso medio de 18,9 [5,7] mmHg), mientras que la PA sistólica se redujo de forma no significativa. Se tomó como objetivo establecido respecto a HbA1c<7%, alcanzado en un 14% más de los pacientes tratados que de los controles (43,6 frente a 57,9; p<0,05).
ConclusionesExenatida es un fármaco efectivo no solo para el control de la glucemia (HbA1c), sino también para otros parámetros como perfil lipídico, PA y peso corporal.
Exenatide is an analogue of GLP1 designed to improve the glycemic control in patients with obesity and type 2 diabetes. It may control other metabolic processes as well. We aimed to evaluate whether exenatide helps to achieve metabolic control goals in patients with obesity and type 2 diabetes (T2DM) after 24 weeks of treatment.
Patients and methodOpen clinical trial in 102 obese patients, with age between 19-77 years (mean [ED] 53,2 [1,1] years), T2DM with mean evolution of 4,88 [0,5] years (range 1 to 20 years) with oral antidiabetic treatment.
ResultsThere was a reduction of 19.7±7.1mg/dl in the fasting glucose average and of 0.33±0.17% in glycated hemoglobin (HbA1c). These last values were higher (2.12±0.53%) in patients with bad control prior to treatment (HbA1c>8.5%). The desirable threshold of HbA1c<7% was fulfilled by 14% more treated than control patients (43.6 vs. 57.9, P<.05). Reductions of 4.4±0.8kg average weight and of 1.7±0.3kg/m2 body mass index were recorded. Although there was not a significant reduction in the overall lipid profile, a decrease of 4.9±5.1mg/dl total cholesterol, 3.2±4.3mg/dl LDL-C, 8.6±5.6mg/dl noHDL-C and 2.5±1, 4mg/dl HDL-C was observed. Patients outside target (LDL>100 and/or triglycerides>150mg/dl) showed significant differences in their concentrations of LDL-C and triglycerides. With respect to blood pressure (BP), significant differences were observed in diastolic BP (-18.9±5.7mmHg) but not in systolic BP (P<.05).
ConclusionsExenatide is an effective drug not only for glycemic control but also for the overall metabolic control of HbA1c, lipid profile, BP and body weight.
La diabetes mellitus tipo 2 (DM2) es una enfermedad crónica de alta prevalencia con un elevado impacto social y sanitario. En el centro de su patogenia se encuentra la resistencia a la insulina, vinculada estrechamente al sobrepeso u obesidad que asocian frecuentemente este tipo de pacientes. Estas circunstancias tienen una repercusión tanto en el tratamiento y evolución de la DM2 como en otras alteraciones cardiovasculares que multiplican el riesgo de sufrir un evento vascular1. El tratamiento intensivo tiende a la normalización de la glucemia y a la de los factores de riesgo como el perfil lipídico y las cifras de presión arterial (PA), reduce las complicaciones microvasculares y la progresión de las macrovasculares2,3. Por lo tanto, nuestros objetivos para pacientes con DM2 no deben limitarse solo a la reducción de las cifras de hemoglobina glucosilada (HbA1c), sino a tratar de manera global el perfil cardiovascular de nuestros pacientes, punto importante a la hora de valorar el inicio o cambio del tratamiento antidiabético.
El efecto incretina se conoce como la amplificación de la respuesta insulínica que se produce tras la ingestión oral de glucosa frente a la administración de una cantidad equivalente por vía intravenosa4. Este efecto es el responsable de hasta el 60% del incremento de la secreción de insulina tras la ingesta. Es mediado principalmente por las hormonas gastrointestinales GLP1 y GIP, conocidas como incretinas, que se producen en las células L y K del tejido intestinal, respectivamente. Nauck et al.5 demostraron en 1986 que el efecto incretina se encontraba disminuido en pacientes con DM2, debido a que en ellos disminuyen las concentraciones de GLP1 tras la ingesta.
La administración exógena de GLP1 disminuye los valores de glucemia, en un proceso dependiente de glucosa, debido a que aumenta la respuesta insulínica y disminuye la concentración de glucagón6, pero además, GLP1 aumenta el número de células β pancreáticas (en experimentación animal), reduce el vaciamiento gástrico y regula el apetito a nivel central, todo lo cual influye en la homeostasis de los hidratos de carbono7.
Exenatida es un mimético con efecto incretina aprobado por la Food and Drug Administration (FDA) en 2005 como alternativa para el control glucémico de pacientes con DM2 tratados con metformina y/o sulfonilureas, y ha demostrado su efectividad en el control glucémico asociado a disminución del peso corporal (a través del enlentecimiento del vaciamiento gástrico y una acción a nivel central, con lo que se consigue una menor ingesta y una sensación de plenitud temprana8), además de efectos beneficiosos sobre otros factores de riesgo cardiovascular9–11 (PA y perfil lipídico). En estudios experimentales en animales (ratones) e in vitro también ha demostrado un efecto antiapoptótico y estimulador del crecimiento sobre las células ß pancreáticas12.
Para estudiar estas acciones se ha realizado un estudio clínico abierto en pacientes ambulatorios del Servicio de Endocrinología y Nutrición del Hospital Universitario Virgen de la Arrixaca desde noviembre de 2008 hasta junio de 2010.
Pacientes y métodoSe han estudiado 102 pacientes, 33 varones (32,4%) y 69 mujeres (67,6%), con edad media (DE) de 52,2 (1,1) años (extremos 19-77 años), diagnosticados de DM2 de acuerdo con los criterios diagnósticos de la American Diabetes Association (ADA)13, que padecían además un estado de obesidad según la Sociedad Española de Endocrinología (SEEDO)14. Todos ellos fueron adecuadamente informados verbalmente y dieron su consentimiento. Se excluyeron aquellos con: diabetes mellitus tipo 1 (DM1) o de otra etiología, pacientes con hipersensibilidad y/o alergia a alguno de los componentes del fármaco, insuficiencia cardíaca o alteración vascular grave, insuficiencia renal grave, enfermedad hepática activa (elevación de transaminasas >3 veces su límite máximo), cirugía abdominal y/o cualquier alteración del tracto gastrointestinal, y tratamiento con insulina.
El tratamiento se inició de acuerdo a la ficha técnica del producto. Durante el primer mes se administró una dosis de 5 μg 2 veces/día y posteriormente 10 μg 2 veces/día. Se recomendó su administración un mínimo de 30 minutos antes de la comida y cena. Por otro lado, se implementó un plan de alimentación y de ejercicio físico regular en cada visita, ajustado de acuerdo al peso, edad y enfermedad de base. A los pacientes con HbA1c inicial <8,5% se les suspendió la terapia con secretagogos e insulinosensibilizadores diferentes de metformina, estandarizando su tratamiento con exenatida+metformina 850mg bid (n=80). A aquellos con HbA1c ≥8,5% se les añadió exenatida a su tratamiento habitual (n=22).
Después de ingresar a los pacientes en estudio, se evaluaron en visitas periódicas. Se determinó la visita final al concluir una media de 24 (2) semanas (fig. 1). Para la evaluación inicial y final se introdujo solo a los pacientes que siguieron el estudio. Como variables de objetivo primario se evaluaron: glucemia basal, HbA1c, peso e índice de masa corporal (IMC), así como tolerancia al fármaco evaluada en tasa de náuseas, vómitos y/o suspensión del tratamiento. Como variables secundarias, se consideraron: colesterol total, colesterol unido a lipoproteínas de baja densidad (colesterol LDL, calculado con la fórmula de Friedewald15), colesterol no HDL (colesterol total menos el colesterol HDL), colesterol unido a lipoproteínas de alta densidad (colesterol HDL), triglicéridos, PA sistólica (PAS) y diastólica (PAD), así como un objetivo combinado de pérdida de peso y mejoría en el control glucémico (descenso de HbA1c). Se consideraron valores objetivo, según las recomendaciones de la ADA14:
- 1.
HbA1c<7%.
- 2.
Colesterol total <200mg/dl.
- 3.
Colesterol LDL <100mg/dl.
- 4.
Colesterol no HDL <130mg/dl.
- 5.
Colesterol HDL >40mg/dl en varones y >50mg/dl en mujeres).
- 6.
Triglicéridos <150mg/dl.
Definimos como objetivo combinado a alcanzar un descenso de HbA1c y pérdida de peso.
Se garantizó la confidencialidad de los pacientes mediante números clave, los pacientes aceptaron el consentimiento bajo información de acuerdo con las leyes nacionales y la Declaración de Helsinki actualizada en el año 2000, Edimburgo, Escocia.
Los datos fueron analizados con SPSS versión 15.0 para Windows (SPSS, Inc., Chicago, IL, USA). Se utilizó la prueba t de Student para variables cuantitativas antes y después del tratamiento, además de Bonferroni como análisis post-hoc. Para variables cualitativas utilizamos la prueba de la ji al cuadrado o exacta de Fisher cuando fuese necesario. Se usó el coeficiente de Pearson para la correlación bivariada. El nivel de significancia se fijó en p<0,05 a 2 colas y los datos se expresaron en medias (error estándar), a menos que se indique de otra manera.
ResultadosLa evolución media de la DM2 fue de 4,88 (0,5) años (extremos 1-20 años). Un total de 54 de ellos (53%) presentaban diagnóstico de hipertensión arterial y 45 (44%) dislipidemia bajo tratamiento. El evento adverso más común fueron lasnáuseas, hasta en un 24,5% de los pacientes, seguidas de vómitos en un 3,9%, mientras que 11 pacientes (10,8%) se retiraron del estudio por intolerancia al fármaco (fig. 1). En la tabla 1 se describen los tratamientos previos al inicio con exenatida en función de la HbA1c. La mayoría de pacientes con HbA1c <8,5% seguían tratamiento con metformina en monoterapia, mientras que los pacientes con HbA1c>8,5% seguían tratamiento con metformina asociado a secretagogos y/o inhibidores de la enzima dipeptidil peptidasa iv (DPPIV). Tras la reevaluación la mayoría de los pacientes siguen tratamiento con exenatida y metformina. No hay diferencias en cuanto al tratamiento previo ni posterior en función de HbA1c inicial.
Descripción del tratamiento hipoglucemiante antes y después de exenatida
| Antes de exenatida | HbA1c<8,5% | HbA1c>8,5% | p |
| Dieta | 1,9% | NS | |
| Metformina | 48,1% | 15,4% | NS |
| Glitazonas | 1,9% | NS | |
| DPPIV | 3,8% | NS | |
| Metformina y DPPIV | 5,8% | 15,4% | NS |
| Metformina y secretagogos | 19,2% | 23,1% | NS |
| Glitazonas y secretagogos | 1,9% | NS | |
| Metformina, glitazonas y secretagogos | 9,6% | 15,4% | NS |
| Metformina, glitazonas, DPPIV | 1,9% | NS | |
| Metformina, glitazonas, DPPIV y secretagogos | 1,9% | NS | |
| Metformina, DPPIV y secretagogos | 1,9% | 23,1% | NS |
| Después de exenatida | HbA1c<8,5% | HbA1c>8,5% | p |
| Byetta® | 33,3% | NS | |
| Byetta® y metformina | 45,8% | 50,0% | NS |
| Byetta®, metformina y glitazonas | 4,2% | NS | |
| Byetta®, metformina y secretagogos | 12,5% | 25,0% | NS |
| Byetta®, metformina, DPPIV y secretagogos | 12,5% | NS | |
| Byetta®, metformina, glitazonas y secretagogos | 12,5% | NS | |
| Byetta® y secretagogos | 4,2% | NS |
DPPIV: enzima dipeptidil peptidasa iv; HbA1c: hemoglobina glucosilada; NS: no significativo.
Las características clínicas, metabólicas y antropométricas basales y finales se indican en la tabla 2. La glucosa sérica en ayunas disminuyó de 159,4 (7,9) a 139,7 (6,8) mg/dl, es decir, hubo reducción promedio de 19,7 (7,1) mg/dl (p<0,01, intervalo de confianza del 95% [IC 95%] -5,3 a -34,0).
Características clínicas, metabólicas y antropométricas antes y después del tratamiento con exenatida durante 24 semanas
| Característica | Inicial | Final | p |
| Glucosa en ayunas (mg/dl) | 159,4 (7,9) | 139,7 (6,8) | 0,009 |
| HbA1c (%) | 7,8 (0,2) | 7,0 (0,2) | 0,001 |
| Peso (kg) | 108,0 (2,8) | 103,6 (3,1) | < 0,001 |
| IMC (kg/m2) | 41,2 (0,9) | 39,5 (1,1) | < 0,001 |
| PAS (mmHg) | 152,4 (9,7) | 140,3 (7,7) | NS |
| PAD (mmHg) | 93,6 (4,2) | 74,7 (4,0) | 0,021 |
| Colesterol total (mg/dl) | 187,4 (5,4) | 182,5 (4,9) | NS |
| Colesterol LDL(mg/dl) | 105,0 (4,5) | 101,7 (4,6) | NS |
| Colesterol HDL (mg/dl) | 45,6 (2,5) | 43,1 (1,9) | NS |
| Colesterol no HDL (mg/dl) | 146,8 (7,1) | 138,3 (6,3) | NS |
| Triglicéridos (mg/dl) | 189,4 (20,7) | 175,1 (15,7) | NS |
Datos en media±error estándar. Valor p evaluado con t de Student.
Colesterol HDL: colesterol unido a lipoproteínas de alta densidad; Colesterol LDL: colesterol unido a lipoproteínas de baja densidad; Colesterol no HDL: diferencia entre el colesterol total y el unido a lipoproteínas de alta densidad; HbA1c: hemoglobina glucosilada; IMC: índice de masa corporal; PAD: presión arterial sistólica; PAS: presión arterial sistólica.
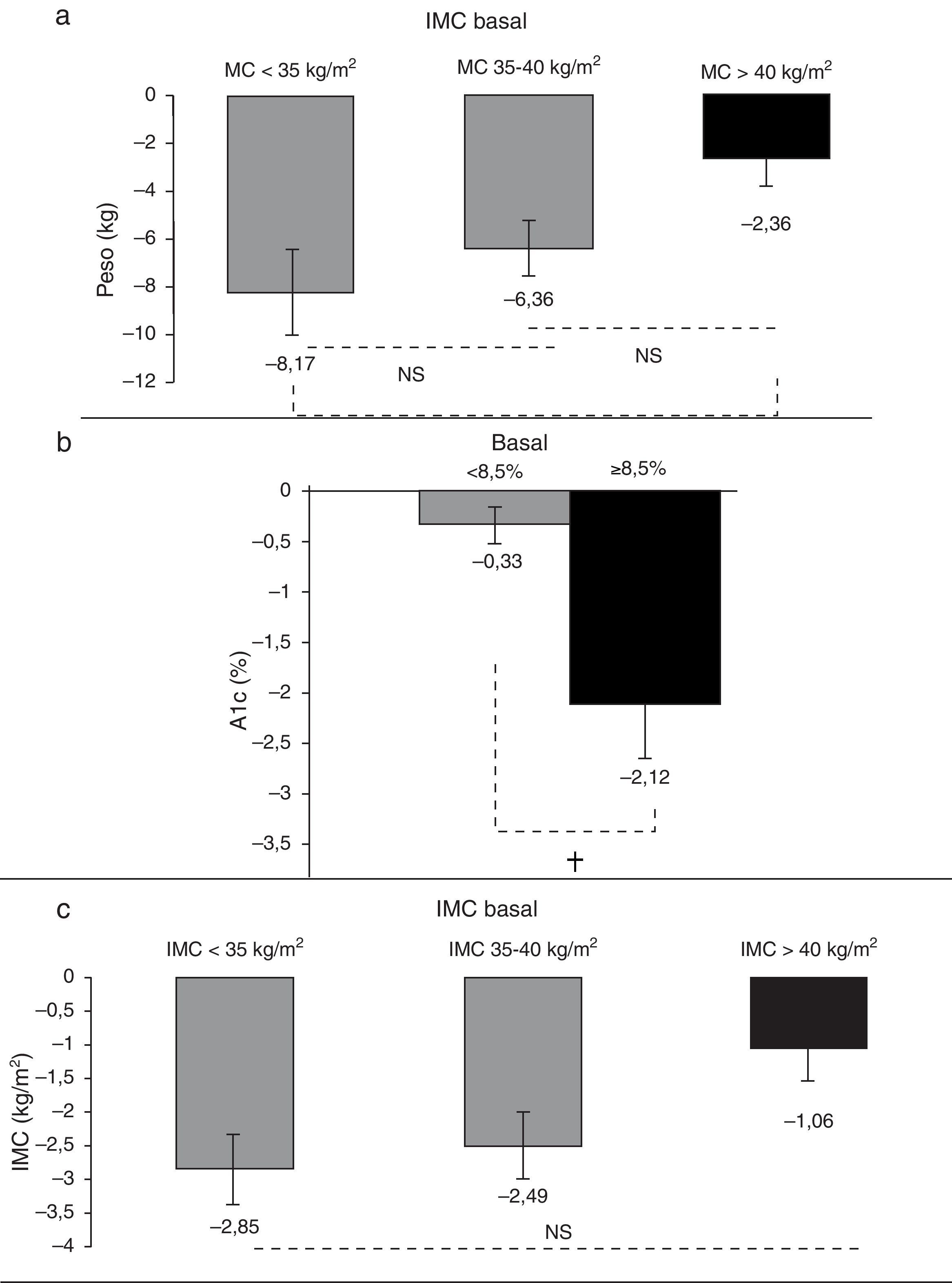
Los valores iniciales de HbA1c fueron de 7,8 (0,2) frente a 7,0 (0,19)% al final (p<0,01). El 43,6% de los pacientes cumplían el objetivo de HbA1c <7% al iniciar el tratamiento, mientras que un 57,9% lo lograron al finalizarlo (p<0,05). Se observó que aquellos que lo iniciaron con valores de HbA1c <8,5% tuvieron una reducción media de 0,33 (0,17)% (p=0,064, IC 95% -0,02 a -0,68), mientras que los pacientes con cifras de HbA1c≥8,5% presentaron una disminución promedio de 2,12 (0,53)% (p=0,004, IC 95% -0,9 a -3,3). Entre estos grupos hubo diferencias significativas (p<0,001) (fig. 2b).
El peso inicial fue de 108,0 (2,8) kg y el final de 103,6 (3,1) kg, con una reducción promedio de 4,4 (0,8) kg (IC 95% -2,7 a -6,2kg; p<0,05). El IMC se redujo de 41,2 (0,9) basal a 39,5 (1,1) kg/m2 al final, con una disminución media de 1,7 (0,3) kg/m2 (IC 95% -1,1 a -2,4kg/m2; p<0,001). Se observó una diferencia significativa entre los pacientes que comenzaron con IMC <35kg/m2, quienes tuvieron una reducción de 8,16 (1,7) kg/m2, y aquellos con ≥40kg/m2, que presentaron una disminución de 2,16 (1,2) kg/m2 (p=0,016). No observamos diferencias en el grupo de IMC entre 35 y 40kg/m2 (fig. 2a y c).
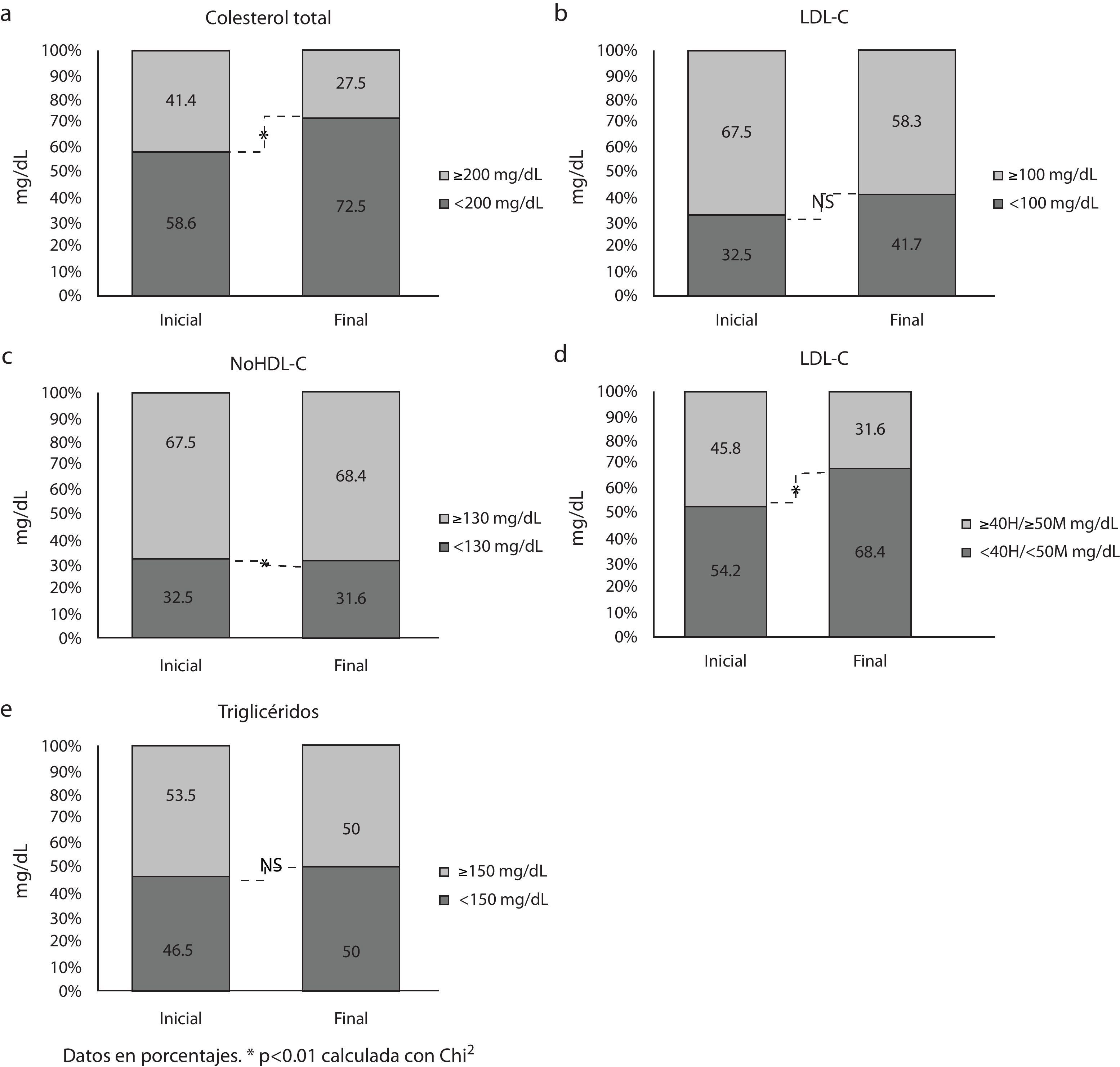
La descripción de los tratamientos hipolipidemiantes antes de la intervención se describe en la tabla 3. Observamos que 2 de los pacientes reevaluados suspendieron el tratamiento y otro redujo la dosis. En lo referente al perfil lipídico, se observó una disminución no significativa del colesterol total de -4,9 (5,1) mg/dl, del colesterol LDL de -3,2 (4,3) mg/dl, del colesterol no HDL de -8,6 (5,6) mg/dl y del colesterol HDL de 2,5 (1,4) mg/dl (fig. 3).
Cambios de colesterol total, colesterol unido a lipoproteínas de baja densidad (colesterol LDL), colesterol unido a lipoproteínas de alta densidad (colesterol HDL), colesterol no HDL (diferencia entre el colesterol total y el unido a lipoproteínas de alta densidad) y triglicéridos después del tratamiento con exenatida durante 24 semanas.
Al iniciar el tratamiento, el 32,5% de los pacientes presentaron colesterol LDL en valores objetivo (<100mg/dl) frente a un 41,7% al finalizar (p=0,76); en aquellos que tenían cifras basales ≥100mg/dl se observó una disminución significativa de 13,6 (6,1) mg/dl (IC 95% -0,5 a -26,8mg/dl, p<0,05) (fig. 3b). No observamos diferencias en el objetivo combinado de HbA1c<7% y LDL<100mg/dl, si bien antes y después el porcentaje de pacientes se encontraba por encima del 20% (antes de exenatida un 20,8% tenían HbA1c<7%+LDL<100md/dl y tras exenatida un 23,5%, p=0,28).
El porcentaje de pacientes con colesterol no HDL en valores basales óptimos fue del 32,5 frente a un 31,6% postratamiento (p=0,01), sin diferencia entre los grupos que se encontraban en valores óptimos y aquellos fuera de estas cifras (fig. 3c).
El colesterol HDL también se redujo respecto al basal, con un 45,8% de los sujetos en parámetros óptimos frente a un 31,6% en la medición subsiguiente (p=0,01). En los pacientes que presentaban cifras objetivo se mostró una regresión a la media, con detrimento de 7,6 (2,5) mg/dl (IC 95% -2,2 a -13,0mg/dl; p=0,011), mientras que aquellos que no tenían valores óptimos inicialmente tuvieron un aumento no significativo (fig. 3d).
Finalmente, el porcentaje de pacientes con cifras objetivo de triglicéridos fue del 46,5% al inicio del estudio en comparación con un 50% al final del mismo (p=0,34); aquellos que empezaron con valores por arriba del objetivo tuvieron una reducción promedio de 58,1 (21,6) mg/dl (IC 95% -13,2 a -102,9mg/dl; p=0,014)(fig. 3e).
No hubo correlación entre los cambios en el peso, IMC, glucosa en ayunas y HbA1c con los cambios observados en colesterol LDL, colesterol no HDL y triglicéridos. Sin embargo, existe una correlación positiva en el grupo de pacientes con colesterol HDL inicial en valores óptimos, entre la reducción en cifras de colesterol HDL y el IMC (p=0,016, R2 0,674).
La tabla 4 muestra el tratamiento antihipertensivo al inicio del estudio. En 2 pacientes fue necesario iniciar tratamiento antihipertensivo y en un tercero aumentar la dosis de su tratamiento previo. Ninguno de ellos se eliminó del estudio. La PAS basal fue de 152,4 (9,7) mmHg frente a 140,3 (7,7) mmHg al final del estudio, y se pudo observar una reducción no significativa de 12,1 (9,6) mmHg (p=0,251, IC 95% +11,3 a -35,5). En cuanto a la PAD, inicialmente se obtuvieron cifras de 93,6 (4,2) mmHg y al final de 74,7 (4,0) mmHg, es decir, una disminución significativa promedio de 18,9 (5,7) mmHg (p=0,021, IC 95% -4,22 a -33,6).
Descripción del tratamiento hipotensor antes de exenatida
| Tratamiento antihipertensivo | Porcentaje |
| Nada | 22,5 |
| IECA | 5,9 |
| ARAII | 10,8 |
| Combinación | 26,5 |
| Inhibidores α | 1,0 |
| Betabloqueantes | 3,9 |
ARAII: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima conversiva de la angiotensina.
Los pacientes con DM2 constituyen un colectivo con elevado riesgo cardiovascular por presentar, junto con una alteración glucémica, otros factores de riesgo cardiovascular. Por ello, el estudio Haffner, de práctica clínica, considera DM como equivalente de enfermedad vascular establecida16,17. El control glucémico intensivo en pacientes con DM2ha demostrado la disminución en la incidencia de complicaciones microvasculares3. En este sentido, el estudio Steno-2 demostró que el control global de todos los factores de riesgo disminuye significativamente el riesgo de eventos cardiovasculares en pacientes con DM2 y microangiopatía18.
Los estudios realizados en España con el fin de evaluar los objetivos de tratamiento alcanzados en pacientes con DM2 son desalentadores. El estudio EPIDIAP (2009)19 evidenció que solo un 5,8% de los pacientes con DM2 estudiados cumplía los objetivos de la ADA. Recientemente, Comi-Diaz et al.20 publicaron un estudio epidemiológico con 1.159 pacientes con DM1 y DM2 de larga evolución donde solo el 4,3% conseguía un buen control de los factores de riesgo evaluados (PA, colesterol LDL, lípidos y glucemia). Estos datos concuerdan con el estudio publicado por Roca-Rodríguez et al.21, donde solo el 9,2% de los pacientes con DM2 consiguen un objetivo de HbA1c<7% y un colesterol LDL <100mg/dl.
Para controlar los diferentes factores de riesgo, estos pacientes deben llevar un seguimiento intensivo, teniendo en cuenta que muchos de ellos son pacientes polimedicados. El uso de pautas de tratamiento personalizadas y sencillas es fundamental para conseguir nuestras metas. El objetivo de nuestro estudio fue valorar el efecto de exenatida sobre los factores de riesgo cardiovascular.
La asociación de exenatida a metformina y/o sulfonilureas ha demostrado en diferentes estudios su eficacia para disminuir la glucemia en ayunas y la HbA1c9,10. Actualmente, se encuentra en el algoritmo secundario para el tratamiento del paciente con DM213. En el 2009, Bhushan et al.22 demostraron, mediante un estudio retrospectivo, una mejoría significativa en la HbA1c agregando, en la práctica clínica, exenatida a la terapia previa de pacientes con DM2 y síndrome metabólico. En nuestros pacientes hemos observado una reducción de los valores de HbA1c y glucemia basal asociada a una importante pérdida de peso. De manera similar, nuestro ensayo clínico demuestra que existe un mayor beneficio sobre control glucémico, logrando que un 14% de los sujetos con DM2 alcancen valores óptimos de HbA1c; más aún, se observó que las ventajas de exenatida son superiores en pacientes mal controlados (HbA1c inicial >8,5%). Por otro lado, el objetivo combinado de HbA1c y de LDL<100mg/dl en nuestro estudio no varió tras el tratamiento, si bien el porcentaje inicial era del 20%, un valor elevado comparado con el de estudios anteriormente citados.
Se ha comunicado una pérdida de peso con exenatida de manera prolongada hasta por más de 3 años11. Nuestros resultados concuerdan con los publicados anteriormente22–25. Sin embargo, observamos un mayor beneficio sobre pacientes con obesidad grado 1-2, en los que la caída de peso es mayor, comparados con aquellos con obesidad mórbida. Este efecto puede deberse a la dificultad que tiene este segundo grupo para alcanzar hábitos alimenticios saludables.
Existe controversia respecto a los cambios del perfil lipídico. Por un lado, estudios previos han demostrado que exenatida redujo de manera significativa todos los componentes del perfil lipídico cuando se evaluó el tratamiento a largo plazo (3,5 años); dichos cambios se correlacionaron con la disminución de peso11. Un estudio más reciente no logró demostrar reducciones significativas, pero sí tendencias en reducción de colesterol total, colesterol LDL y triglicéridos, correlacionado de igual manera con la pérdida de peso23. De manera similar a estos últimos datos, nuestro grupo no pudo demostrar reducciones significativas en colesterol total, colesterol LDL, colesterol no HDL y triglicéridos. Sin embargo, al analizar los datos en aquellos pacientes que se encontraban fuera de objetivos en cada componente, se observó una reducción significativa en los valores de colesterol LDL y triglicéridos, sin correlación con los cambios en el peso o control glucémico, lo que indica un efecto independiente añadido del fármaco.
Por otro lado, existen evidencias de que exenatida incrementa los valores de colesterol HDL de manera significativa a largo plazo11. Nuestros resultados coinciden con los de otras publicaciones en períodos de tiempo más cortos22,23, donde no se observaron beneficios sobre este parámetro; más aún, existe una leve reducción sin significación estadística en los valores de colesterol HDL, lo que nos lleva a pensar que se requiere de un período más prolongado de tratamiento para notar mejoría global en el perfil de lípidos. Además, diferentes estudios han demostrado una reducción de las cifras de PAS y PAD11,26,27 asociadas al uso de exenatida. Nuestra muestra sólo ha demostrado una reducción en las cifras de PAD, si bien existe una tendencia a la reducción en las cifras de PAS.
En conclusión, en pacientes con DM2 asociada a obesidad, es importante la selección del tratamiento antidiabético, buscando no solo la reducción de concentración de HbA1c, sino tratando de manera global los otros factores de riesgo cardiovascular (PA, colesterol LDL y triglicéridos). Exenatida es un análogo de GLP1 que ha demostrado inducir reducciones en las cifras de glucemias y de HbA1c, y que además presenta un efecto anorexígeno que conlleva pérdida de peso. Para demostrar un claro efecto sobre el perfil lipídico y la PA son necesarios estudios más extensos y de duración mayor.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.