El autoanálisis (AA) es una herramienta eficaz, rápida y sencilla de utilizar que aporta gran información tanto al paciente como al médico y enfermero/a acerca del control glucémico del primero. No se discute la eficacia de este método, en el caso de los pacientes con diabetes mellitus (DM) tipo 1 y en aquellos con DM tipo 2 cuyo tratamiento sea exclusivamente insulina, para el buen control metabólico. Estudios previos así lo avalan1-8. Sin embargo, se han publicado estudios controvertidos respecto a la eficacia en los pacientes con DM tipo 2 que reciben tratamiento no insulínico2,8-16, y no existe ninguna evidencia sobre su eficacia en pacientes con tratamiento combinado. Incluso algunos estudios no sólo no confirman que los pacientes con AA mejoren el control glucémico, sino que observan un deterioro de éste8,11.
La ausencia, en el momento de iniciar el estudio, de evidencia clínica de la utilidad del AA en la DM tipo 2, junto a la percepción de los autores en la clínica diaria y en reuniones científicas de la cada vez más amplia difusión de este método de control en este tipo de pacientes, nos llevó a diseñar el presente estudio con los siguientes objetivos: a) comprobar la eficacia del AA en atención primaria para la mejora del control glucémico de los pacientes con DM tipo 2; b) indagar las posibles causas que expliquen la falta de efectividad del método, en su caso, y c) deducir los factores predictivos que permitan seleccionar al buen utilizador del AA. Los resultados obtenidos podrían aplicarse a la consecución de una óptima utilización de este recurso sanitario en el paciente con DM tipo 2.
Pacientes y método
Se trata de un ensayo clínico controlado y aleatorizado realizado en el ámbito de la atención primaria, sobre 100 pacientes con DM tipo 2 adscritos al Programa de Salud Diabetes Mellitus del consultorio El Higuerón, un centro sanitario ubicado en una barriada periférica de Córdoba (El Higuerón) con una población censada al inicio del estudio (abril de 2001) de un total de 2.546 pacientes, de los cuales 1.285 son varones (50,47%) y 1.261, mujeres (49,53%).
Previa explicación del estudio y la solicitud del consentimiento informado de los pacientes, se incluyó en el estudio a todos aquellos con DM tipo 2 que cumplían los siguientes requisitos: a) tener realizada al menos una analítica de control diabético en el año previo al inicio del trabajo que incluyese glucemia, hemoglobina glucosilada (HbA1c) y colesterol con fracción lipídica, y b) no poseer analizador de glucemia capilar para el control de la diabetes o, en el caso de los que disponían de él, haberlo utilizado de forma no pautada ni continuada, por haberlo adquirido previamente motu proprio o haber sido cedido de forma temporal por el personal del centro de salud para la realización de curvas de glucemia por descompensación o cambios en el tratamiento.
Los criterios de exclusión fueron los siguientes: a) pacientes con DM tipo 1; b) pacientes con diabetes gestacional11,17; c) estadios de glucemia basal alterada y de tolerancia alterada de glucosa17; d) pacientes que antes del inicio del estudio habían utilizado el AA de forma continuada en cualquiera de sus pautas; e) pacientes que por diferentes motivos no dieron su consentimiento informado, y f) pacientes de edad avanzada con dificultad para llevar el control estricto de la glucemia en el centro de salud o aquellos que estaban al cuidado de más de un cuidador principal.
El cálculo del tamaño muestral para la comparación de medias de HbA1c en una muestra experimental con datos pareados se realizó considerando una desviación típica poblacional de 1,96, un riesgo alfa de 0,05, un riesgo beta de 0,10, y considerando un contraste bilateral y sin pérdidas. La diferencia de medias considerada relevante fue de al menos el 1% para la HbA1c18 final de cada paciente respecto a la inicial. El tamaño muestral resultante fue de 42 pacientes en cada grupo de estudio.
Se citó por vía telefónica a los pacientes, que se distribuyeron en 2 grupos grupo con AA (GAA) y grupo control (GC) mediante el método de asignación aleatoria por bloques respecto al tipo de tratamiento antidiabético que recibían y, posteriormente a esta estratificación, por asignación al azar generada al efecto.
A los pacientes incluidos en el GAA se les proporcionó durante la primera visita un analizador de glucemia capilar EuroFlash© (Lifescan, Johnson & Johnson, S.A.), que se completaba con las lancetas estériles y las tiras reactivas necesarias para la realización del AA, de acuerdo con las pautas recomendadas por el Grup d'Estudi de la Diabetis a l'Atenció Primària de Salut (GEDAPS)17, además de indicárseles que anotaran, en un documento que se les facilitó, el valor de cada determinación de glucosa obtenido. Se añadieron 6 tiras por trimestre para la realización de determinaciones adicionales, y se indicó a los pacientes que debían anotar el motivo por el cual realizaban dicha determinación (síntomas de hipoglucemia, enfermedad aguda, transgresión alimentaria, fallo del medidor o cualquier otro motivo). El investigador no dio ninguna pauta de modificación del tratamiento, sino que se dejó a criterio del propio paciente la consideración o no de introducir algún cambio en el tratamiento en función del valor de glucosa obtenida modificación de la dieta, ejercicio o dosis de insulina o de antidiabéticos orales (ADO) o notificación del valor de la glucemia a su médico o enfermera. El médico encargado de la asistencia sanitaria del paciente, y por tanto de realizar cambios en el tratamiento antidiabético, desconocía a qué grupo de estudio pertenecía éste, si bien el estudio no es ciego, ya que los pacientes sí conocían el grupo al que pertenecían.
El seguimiento de los pacientes se prolongó durante un período de 12 meses, con controles trimestrales.
Un único investigador que no realizaba intervención terapéutica alguna sobre los paciente se encargó de recoger todos los datos del estudio. En la primera consulta, al inicio del estudio, se realizaron: captación y asignación de los pacientes al GAA o GC; recogida de las variables poblacionales (tabla 1); recogida de variables de diabetes (tabla 1) y solicitud de fondo de ojo; exploración completa por sistemas y aparatos; solicitud de analítica de primer trimestre (parámetros bioquímicos incluidos en la tabla 2); cumplimentación del cuestionario ECODI (Escala de Conocimientos en Diabetes)19, concebido para su aplicación a una población con DM tipo 2 independientemente del tipo de tratamiento y de su nivel cultural; a los pacientes asignados al GAA se les pasó además el cuestionario BSMBG (Self-Testing Blood Glucose Questionnaire), que es una herramienta para predecir qué pacientes de la población de diabéticos podrían tener problemas a la hora de utilizar el analizador de glucemia capilar20. Este cuestionario valora los aspectos emocionales que pueden hacer que el paciente sea reacio al uso del analizador. Igualmente se entregó a los pacientes del GAA el material de AA y de la hoja de recogida de glucemias.
En las consultas posteriores, efectuadas a los 3, 6, 9 y 12 meses, se realizaron: exploración completa por sistemas y aparatos; anotación de la analítica correspondiente a ese trimestre y solicitud de la del siguiente trimestre (con similares parámetros bioquímicos); anotación de las variables de AA para los pacientes que pertenecían al GAA (tabla 1). Los datos del analizador de glucemia capilar se extrajeron de éste y se volcaron al ordenador mediante el programa de Gestión de Datos en Diabetes in Touch (Lifescan, Johnson & Johnson, versión 1.3.0.0, 1998). Dicho programa permite extraer de la memoria del analizador todas las mediciones que se haya realizado el paciente, hasta un máximo de 150.
Análisis estadístico
Conforme se realizaba la recogida de datos, éstos se iban incluyendo en la base de datos diseñada al efecto mediante el programa informático R-SIGMA (Horus Hardware S.A.). Para el análisis estadístico de los datos se utilizó el programa SPSS para Windows (versión 9 estándar, 18 de diciembre de 1988, SPSS Inc.).
Se realizó un examen descriptivo de la totalidad de la muestra incluida en el estudio mediante un análisis de distribución de frecuencias para las variables cualitativas, expresado en frecuencias absolutas o porcentajes con un intervalo de confianza (IC) del 95%; para las variables cuantitativas se emplearon medidas de centralización como la media aritmética, y de dispersión como la desviación estándar o su IC del 95%.
Posteriormente se realizó un estudio descriptivo de los 2 grupos en que se había dividido la muestra (GAA y GC), seguido de un análisis bivariante, por lo que se utilizó el test de la *2 en el caso de las variables cualitativas y el test de la t de Student para las cuantitativas en la comparación de medias independientes, y el test de la t de Student pareado cuando las variables cuantitativas a comparar correspondiesen a diferentes valores de una variable en el tiempo para un mismo paciente. La comparación múltiple de medias se realizó mediante el análisis de la variancia (ANOVA). La comparación de proporciones se realizó mediante el test que lleva esta misma denominación. El nivel de significación estadística considerado fue un valor de p menor de 0,05.
La eficacia del AA se estimó en función de los 2 parámetros utilizados habitualmente para valorar el grado de control del paciente diabético: a) descenso de la HbA1c de un 1% al final del estudio respecto al principio18, y/o b) descenso del 25% de la glucemia al final respecto a la inicial21.
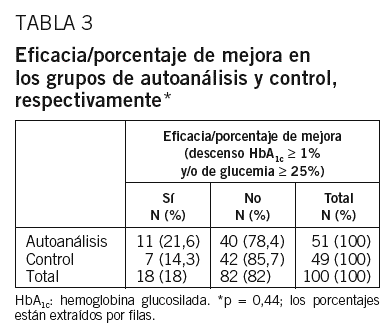
Para el GC no podemos utilizar el término «eficacia», ya que no hubo ningún tipo de intervención. Por ello utilizamos el concepto de «porcentaje de mejora» como término equivalente al de eficacia del AA.
Las variables que en el estudio bivariante mostraron asociación significativa (p < 0,05) con la eficacia del AA, y en las que además el sentido de la asociación tenía relevancia clínica, se introdujeron en un modelo de regresión logística para poder hallar los predictores independientes de la eficacia del AA. Se utilizó el método de regresión logística múltiple mediante el método paso a paso (stepwise selection) con eliminación hacia atrás de las variables (backward elimination). Se determinó la posible existencia de factores de confusión. Se empleó el estadístico de Wald, con un nivel de significación de p inferior a 0,05 para introducir o suprimir las variables. En el caso de variables cualitativas policotómicas, se construyeron variables indicadores (dummies) mediante el método parcial, considerando como categoría de referencia aquélla con menor asociación con la efectividad del AA. Este modelo de regresión nos permitió hallar un modelo matemático predictor de la eficacia del AA. La capacidad del modelo matemático para clasificar correctamente a cualquier par de sujetos elegidos al azar en cuanto a la eficacia o no del AA lo proporciona el área bajo la curva de la eficacia diagnóstica.
Según los datos hallados en otros estudios realizados en el ámbito de la atención primaria, se determinó la efectividad del AA, tanto del método de manera global como de forma particular para cada paciente, de acuerdo con las siguientes formulaciones11,12:
Efectividad global del método. Se calculó mediante la siguiente fórmula:
P = [0,80 (1-P HbA1c > 7,5) (1-P CT > 200) (1-P HDL < 40) (1-P TG é 150) (1-P PAS é 130) (1-P PAD é 85) (1- P fumador)] 100
donde P es la probabilidad de que un diabético usuario del AA se beneficie (es decir, que según los criterios europeos de control22 el paciente se encuentre con un control bueno y/o aceptable) del AA en las condiciones de aplicación indicada por los profesionales. Para ello se acepta una eficacia (ideal) del 80% en el uso de las tiras reactivas. CT es el colesterol total; HDL, lipoproteínas de alta densidad; TG, triglicéridos; PAS, presión arterial sistólica, y PAD, presión arterial diastólica.
Efectividad individual del método. Se evaluó de acuerdo con el valor de la HbA1c aislada aplicando la siguiente ecuación:
P = [0,80 (1-P HbA1c > 7,5)] 100
Tal como sucedía en el caso del término «eficacia», para el GC, en lugar de considerar la efectividad del método, se utilizó el porcentaje de mejora.
Resultados
En el momento del inicio del estudio, el número de diabéticos adscritos al Programa de Salud Diabetes Mellitus era de 149. De ellos, se excluyó del estudio a 49 (7 pacientes con DM tipo 1, otros 7 con glucemia basal alterada, 17 que utilizaban con antelación al estudio el AA, 13 que no dieron su consentimiento para participar en él y 5 de edad muy avanzada y con varios cuidadores). De los 100 pacientes incluidos en el estudio, el 51% (n = 51) se asignó, al GAA y 49 (49%), al GC.
Respecto a las características poblacionales por grupo de estudio, en el GAA la edad media fue de 65,25 años (IC del 95%, 62,40-68,11), el índice de masa corporal medio al inicio del estudio fue de 32,18 kg/m2 (IC del 95%, 30,26-34,10), el índice de analfabetismo del 35,3%, la proporción de amas de casa del 56,9%, la media de tiempo de evolución de la diabetes de 6,98 años (IC del 95%, 5,08-8,89), la presencia del hábito tabáquico del 15,7% (IC del 95%, 7,48-29,14) y la frecuentación anual media (desviación estándar) a la consulta fue de 10,61 (5,16) visitas para la consulta médica y de 10,10 (3,52) visitas a la de enfermería.
En el GC la edad media fue de 68,98 años (IC del 95%, 66,08-71,88), el índice de masa corporal al inicio de 31,98 kg/m2 (IC del 95%, 30,72-32,35), el índice de analfabetismo del 32,7%, la proporción de amas de casa del 53,1%, la evolución media de la diabetes de 7,26 años (IC del 95%, 4,91-9,60), la presencia del hábito tabáquico del 10,2% (IC del 95%, 3,82-23,01) y la frecuentación media anual a consultas de 10,20 (5,75) visitas para la consulta médica y de 9,59 (4,12) visitas a la de enfermería.
No hubo diferencias significativas entre las características analizadas de ambos grupos de estudio tanto globalmente como en el análisis ajustado por sexos.
El índice de Katz para todos los pacientes del estudio fue de A (independiente para las 6 actividades de la vida diaria), salvo en una paciente que, por lo avanzado de su edad, precisaba de mayor ayuda por parte de los cuidadores principales, y un paciente que presentaba una amputación traumática de ambas piernas, lo cual le imposibilitaba para la mayoría de las tareas habituales. La presencia de comorbilidad fue del 93,5% (IC del 95%, 83,5-94,91) para las mujeres y del 89,5% (IC del 95%, 74,26-96,57) entre los varones. Tampo-co hubo diferencias significativas para ambas variables entre los 2 grupos de estudio.
Los resultados de la puntuación del ECODI por grupos de estudio resultó menor en los pacientes del GC, con una media de 49,96 (21,53), que en el GAA, donde la media fue de 58,63 (20,82) (p = 0,04).
Variables de resultado
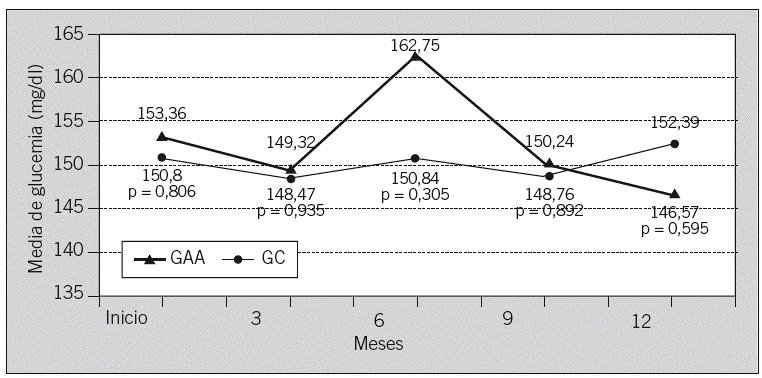
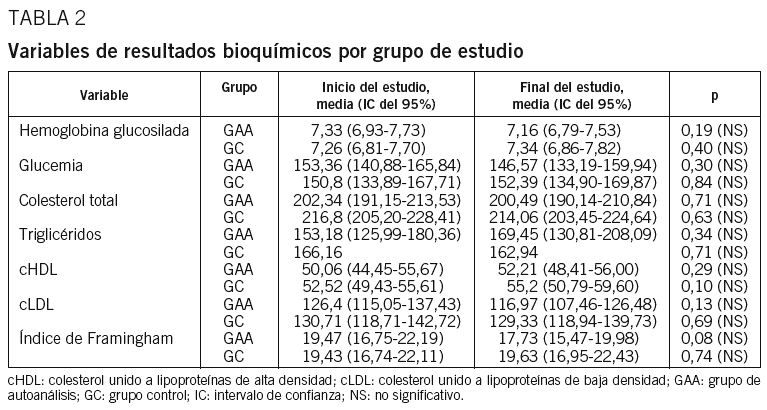
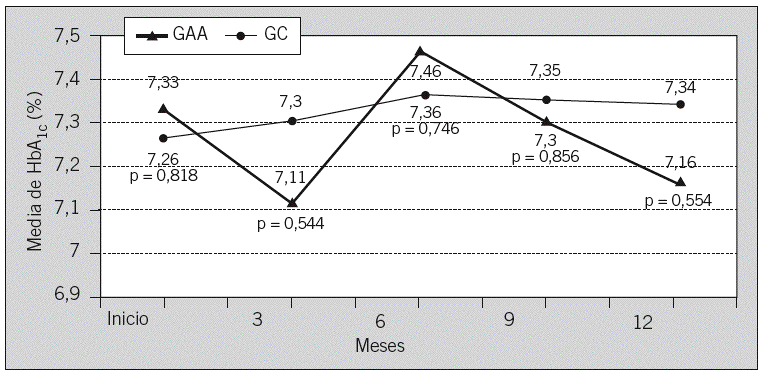
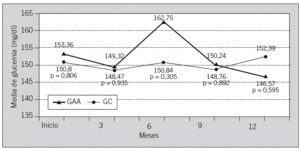
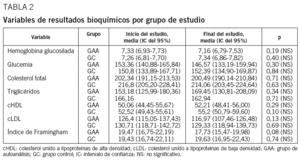
En la tabla 2 se observan los principales resultados de las variables analíticas incluidas en el estudio. En las figuras 1 y 2 se representa la evolución de la glucemia y la HbA1c a lo largo del estudio en ambos grupos.
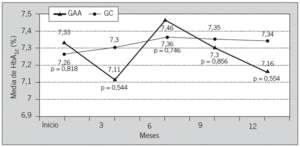
Fig. 1. Representación de la evolución de las medias de glucemia durante el tiempo de estudio en los grupos de autoanálisis (GAA) y control (GC). No se observaron diferencias significativas entre las medias intergrupos.
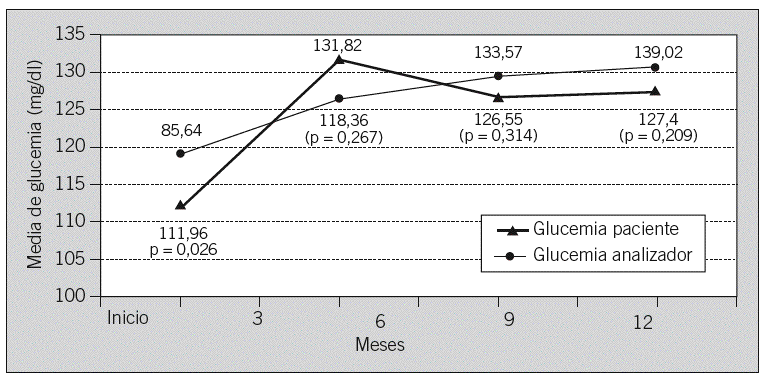
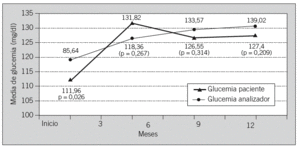
La media de los valores de glucemia capilar anotados en la hoja por parte de los pacientes en la mayor parte de los controles (exceptuando el del primer trimestre; p = 0,026) fue inferior a la obtenida del volcado directo de estas glucemias desde el autoanalizador al ordenador, aunque sin diferencias significativas (fig. 3).
Fig. 2. Representación de la evolución de las medias de la hemoglobina glucosilada (HbA1c) durante el tiempo de estudio en los grupos de autoanálisis (GAA) y control (GC). No se observaron diferencias significativas entre las medias intergrupos.
Fig. 3. Representación de la evolución de las medias de la glucemia extraídas del analizador y las anotadas manualmente por los pacientes en el grupo de autoanálisis.
Estimación de la eficacia del autoanálisis
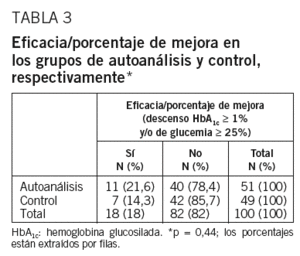
Según los 2 criterios de eficacia del AA antes descritos, éste fue eficaz en el 21,6% de los pacientes del GAA, frente al 14,3% de los del GC, sin que esta diferencia alcanzara la significación estadística (p = 0,44) (tabla 3). Considerando únicamente el descenso de la HbA1c é 1%, éste se produjo en el 15,69% de los pacientes del GAA, frente al 4,08% del GC (p = 0,092). El método fue eficaz en un 21,1% de los varones y en el 21,9% de las mujeres, sin diferencias significativas.
Respecto al nivel de estudios, tampoco se hallaron diferencias estadísticamente significativas en la eficacia del AA (p = 0,314), aunque fue ligeramente más eficaz en los grupos con un nivel cultural inferior analfabetos (22,2%) y pacientes sin estudios pero que sabían leer y escribir (21,1%). En cuanto al nivel sociolaboral, en el grupo de amas de casa demostró ser más eficaz el AA, aunque sin diferencias significativas (p = 0,631).
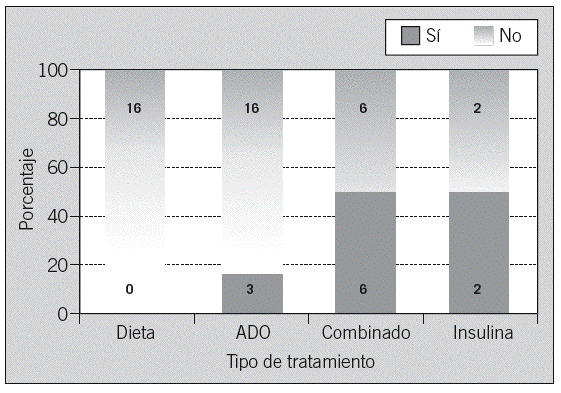
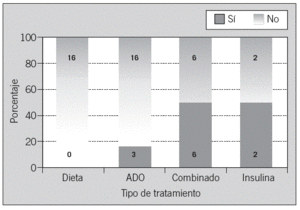
El análisis por grupo de tratamiento mostró que la eficacia del AA fue mayor en los grupos de pacientes con tratamiento combinado y con tratamiento exclusivamente insulínico (un 50% en ambos casos). No se observó ninguna mejoría en el grupo de tratamiento exclusivo con dieta. Las diferencias fueron estadísticamente significativas (p = 0,006) (fig. 4).
Fig. 4. Eficacia del autoanálisis por grupos de tratamiento (n = 51). ADO: antidiabéticos orales. p = 0,006.
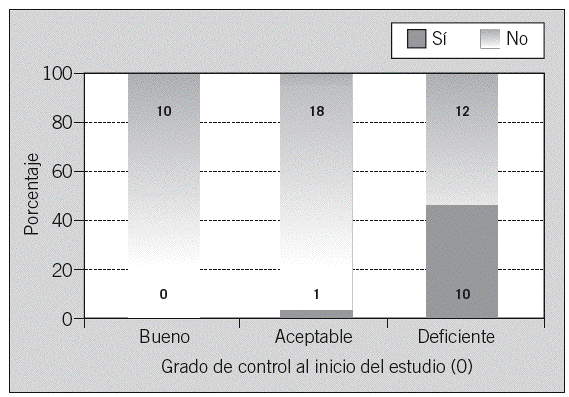
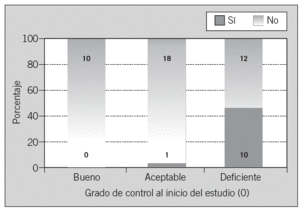
En la figura 5 se muestra la posible relación entre la eficacia del AA y el grado de control metabólico al inicio del estudio. El AA resultó ser más eficaz entre los pacientes que partían de un control deficiente, y el grado de control metabólico no se modificó en el caso de que el paciente partiese de un control bueno o aceptable. Esta relación resultó estadísticamente significativa (p = 0,001).
Fig. 5. Relación entre la eficacia del autoanálisis y el criterio inicial (mes 0) de control (n = 51). p = 0,001.
Respecto al análisis de la eficacia del AA según los años de evolución de la DM, los pacientes en quienes el AA fue eficaz presentaron una evolución media de su enfermedad de 13,36 (10,93) años, frente a 5,23 (3,69) años en los pacientes en los que no fue eficaz (p = 0,0001).
No se encontraron diferencias significativas entre el riesgo cardiovascular (índice de Framingham) y la eficacia o no del AA (p = 0,97), ni respecto a la puntuación de la escala de conocimientos en diabetes ECODI (p = 0,96) ni en el análisis de la escala BSMBG y la eficacia del AA (p = 0,57).
El análisis de la asociación entre el número de determinaciones de glucemias realizadas por el paciente y su grado de control metabólico al final del estudio mostró un mayor uso del AA entre los pacientes con peor control metabólico, con una media de 60,57 (40,06) tiras anuales en los pacientes con buen control frente a 210 (126,77) en aquellos con criterio de control deficiente (p = 0,033).
Los pacientes en los que el AA fue eficaz realizaron un mayor número de determinaciones adicionales durante el período de estudio media de 38,5 (43,7) que aquellos en los que el AA fue ineficaz media de 31,43 (72,5). Esta diferencia no alcanzó la significación estadística (p = 0,76).
Respecto al consumo total de tiras por los pacientes, el AA fue más eficaz en los que consumieron mayor cantidad media de consumo anual de tiras de 191,55 (115,21) en los pacientes en quienes fue eficaz, frente a una media de 123,72 (96,89) en quienes no lo fue. Esta diferencia fue casi significativa (p = 0,054).
Cálculo de la efectividad del autoanálisis
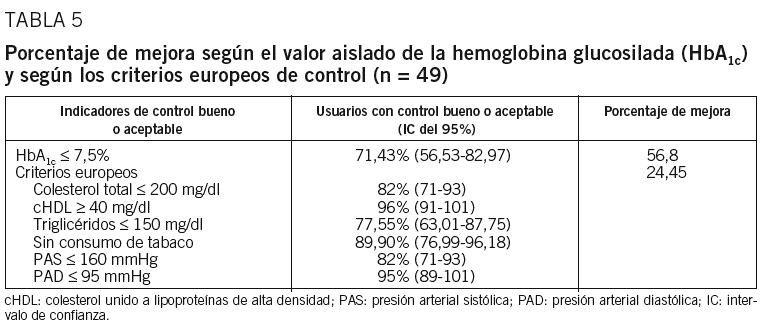
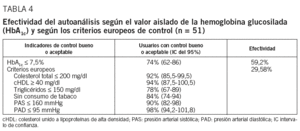
En la tabla 4 se expone la proporción de pacientes con control metabólico bueno o aceptable y sus IC del 95% en función de cada indicador, así como el cálculo de la efectividad tanto para el valor aislado de la HbA1c como para la totalidad de los criterios europeos de control metabólico. En la tabla 5 se observan las mismas variables en relación con el porcentaje de mejora del control metabólico en el GC.
A pesar de existir diferencia a favor del GAA en cuanto a la efectividad en función de la HbA1c aislada respecto al porcentaje de mejora en el GC, no encontramos diferencias significativas (diferencia de proporciones, 0,017; IC del 95% de la proporción, de 0,19 a 0,23; p = 0,86) ni para la totalidad de los criterios europeos de control (diferencia de proporciones, 0,58; IC del 95% de la proporción, de 0,14 a 0,24; p = 0,58) (tabla 6).
Análisis de regresión logística
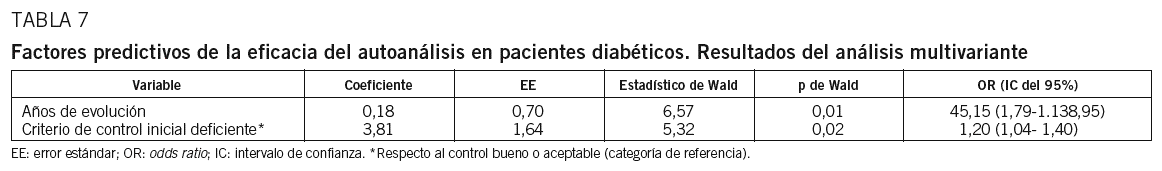
El análisis multivariante identificó los siguientes predictores independientes de la eficacia del AA: a) el número de años de evolución de la DM, y b) un control deficiente de la enfermedad (según los criterios europeos de control) al inicio del estudio (tabla 7). No hubo evidencia de falta de ajuste del modelo matemático obtenido, ya que la significación del estadístico de Hosmer-Lemeshow fue de p = 0,66. La precisión global del modelo fue del 88,24%. Respecto a su validez diagnóstica, la sensibilidad fue del 54,5%, su especificidad del 97,5%, el valor predictivo positivo del 85,7% y el valor predictivo negativo del 11,4%. El modelo matemático obtenido tiene una significación estadística de p < 0,001.
La ecuación obtenida para el cálculo de la probabilidad de la eficacia del AA es la siguiente:
1 + e[5,48 + (3,81criterio de control inicial) + + (0,18años de evolución)]
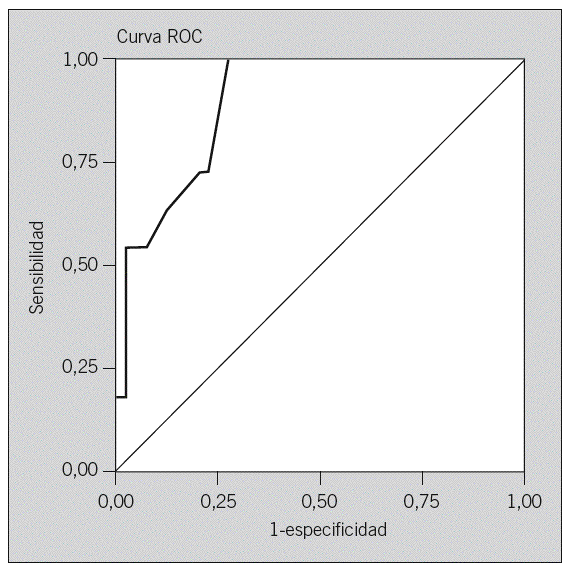
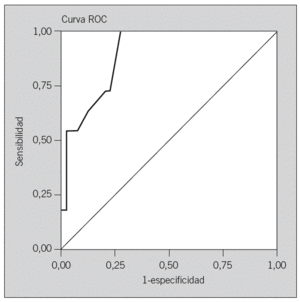
Finalmente, en la figura 6 se expone la curva de eficacia diagnóstica obtenida para valorar el poder discriminante del modelo de regresión logística. El área bajo la curva de eficacia diagnóstica fue del 89,9% (p < 0,001), con unos IC del 95% del 81,2-98,5%. El punto de corte que según la curva de eficacia diagnóstica que mejor discrimina la eficacia del AA fue el del 74% (sensibilidad del 72,7% y especificidad del 77,5%); es decir, todo paciente con una probabilidad estimada igual o superior a ésta es candidato al AA.
Fig. 6. Curva de eficacia diagnóstica (ROC) para valorar el poder discriminante del modelo matemático de regresión logística predictivo de la eficacia del autoanálisis (área bajo la curva de eficacia diagnóstica, 89,9%; intervalo de confianza del 95%, 81,2-98,5%).
Discusión
El estudio que se presenta pone de manifiesto que el AA de la glucemia capilar por parte del paciente diabético es una nueva herramienta que, aunque puede mejorar el control metabólico de la DM tipo 2, requiere una cuidadosa selección de pacientes y, por tanto, no puede utilizarse de manera indiscriminada. La baja eficacia del AA obtenida por los pacientes de nuestro estudio (21,6%) así lo corrobora.
El AA ha demostrado en el manejo y control del paciente con DM tipo 1 unos resultados satisfactorios en términos de eficacia. Estos buenos resultados se han ido extrapolando progresivamente al control del paciente con DM tipo 2, esta vez sin una evidencia científica que respalde su utilidad, ya que los estudios existentes son en su mayor parte retrospectivos11,12,14,15,23, sin grupo control10,16, difícilmente comparables debido a diferentes aspectos metodológicos, con resultados dispares y ciertamente controvertidos. Asimismo, tan sólo estudios realizados en nuestro país se desarrollan en pacientes del marco de la atención primaria11,12,19,24,25.
El diseño de este estudio, un ensayo clínico controlado y aleatorizado, junto con el número de pacientes incluidos (n = 100), superior a las muestras de los estudios más importantes realizados sobre el AA en pacientes con DM tipo 2, que se encuentran en un intervalo de 12 a 7314, confiere a nuestro estudio una mayor potencia que los existentes respecto al AA en el momento de inicio de nuestra investigación. El tiempo de intervención de nuestro trabajo (12 meses) está dentro del intervalo de los de otros estudios, en los que va desde 6 hasta 24 meses. No obstante, el aumento del período de seguimiento a más de 12 meses no ha podido demostrar mejores resultados que no del AA y el grado de control metabólico según los criterios europeos de control22 no se encontraron diferencias significativas, aunque se observó un desplazamiento de pacientes del grupo de control deficiente al de aceptable en los que cumplimentaban correctamente el AA (p = 0,29), y del grupo de aceptable al de buen control en el grupo de pacientes que no cumplían correctamente las pautas de AA (p = 0,25). Estos resultados son clínicamente lógicos, aunque carecen de la significación estadística esperada.
La bibliografía médica no refleja un consenso acerca del número de determinaciones que deben realizarse los pacientes que utilizan el AA14,26. En nuestro estudio hemos tomado la pauta del GEDAPS17 (número de determinaciones mínimas de AA) por considerarla a priori la más sencilla de aplicar a nuestra población. Poco más de la mitad de los pacientes (el 54,9%) realizaron correctamente las pautas indicadas, si bien ello no influyó en los resultados de la eficacia del AA (p = 0,19). De estos resultados se podría concluir que, al no influir en la eficacia el grado de cumplimentación, posiblemente las pautas sean demasiado exigentes.
Para Rost et al27, el aumento del número de determinaciones con el AA puede ser lo que mejore el control metabólico, debido también a un cambio positivo más global en el conjunto de comportamientos del enfermo respecto a su propia enfermedad. En nuestro estudio se ha detectado una asociación significativa entre el número de determinaciones de glucemias realizadas por el paciente y su grado de control metabólico al final del estudio, con un mayor uso del AA entre aquellos con peor control metabólico, si bien esto no se refleja claramente en la eficacia del método. Conclusiones similares encontraron Harris et al26, que apreciaron una mayor tendencia a utilizar el AA entre los pacientes con control metabólico peor.
Para analizar la fiabilidad con que el paciente anotaba manualmente las glucemias obtenidas mediante AA, se compararon las medias de las glucemias realizadas y anotadas por los pacientes con los valores que quedaban registrados en el analizador; la glucemia media obtenida de los valores que anotaban los pacientes fueron menores que la resultante de las glucemias extraídas del analizador, aunque sin hallar una diferencia estadísticamente significativa al final del estudio (p = 0,209). Estas diferencias podrían atribuirse a que, debido al índice de analfabetismo, algunos pacientes pedían a familiares que les anotasen en la hoja los datos obtenidos o el valor que ellos recordaban de la determinación realizada. El hecho de que los pacientes anotasen deliberadamente valores inferiores a los reales por «temor» a ser recriminados por el médico o la enfermera podría ser una hipótesis a demostrar.
En 1996, en un estudio realizado en Barcelona, Llamas et al28 tomaron 2 grupos de pacientes con DM tipo 2, uno tratado con insulina y otro tratado con ADO. En ambos grupos se observó mejoría de la HbA1c y de la glucemia en el grupo de AA, aunque no de forma significativa. Igualmente, Fox et al29 encuentran valores de HbA1c significativamente inferiores en los pacientes que utilizan el AA, con una media del 8,5% (1,4%), respecto a los que no lo usan media del 10,2% (1,7%). En nuestro caso existió una mejoría de la HbA1c tras un año de estudio en los pacientes que utilizaron el AA, con una media del 7,16% (1,31%), frente a los que no, en quienes la media fue del 7,34% (1,67%), si bien esta mejoría no fue estadísticamente significativa (p = 0,56).
Cohen y Zimmet30, en un estudio realizado en 1983, encontraron una mejoría de la glucemia y una disminución del peso en los pacientes en tratamiento dietético o con ADO y que utilizaban el AA. Tal como sucedía con los valores de HbA1c, la glucemia también mejoró en nuestros pacientes, sobre todo en los que seguían tratamiento combinado y con ADO, al terminar el año de estudio, aunque tampoco se observó significación estadística. Nuestros pacientes en tratamiento exclusivamente dietético no obtuvieron ninguna mejoría de las cifras de HbA1c ni de las de glucemia, lo que puede explicarse por su mejor grado de control metabólico inicial, que haría que su concienciación sobre la enfermedad sea menor.
Sin embargo, existen en la bibliografía diversos estudios sobre el AA con resultados opuestos a los anteriores, en los que no se demuestra que el AA mejore el control metabólico de los pacientes con DM tipo 25,10,16. Faas et al15, en una revisión de 6 ensayos clínicos en los cuales se comparaba el AA frente a la no realización del mismo, encontraron que tan sólo en uno de estos estudios resultó beneficioso el AA de forma estadísticamente significativa al disminuir la HbA1c. Respecto a nuestros resultados, la eficacia del AA valorada en función del descenso de la HbA1c dio una diferencia no significativa (p < 0,1) en el GAA comparado con el GC.
Otro de los puntos clave es el estudio de la efectividad del AA. Para ello comparamos nuestro trabajo con el realizado por Clua et al11, para quienes la efectividad obtenida no parece depender tanto del AA como de otras circunstancias asociadas, como ya apuntaran Rost et al27. Estos mismos autores, en un trabajo realizado en 199911, evaluaron la efectividad (entendida como la probabilidad de que se cumplieran los criterios de control bueno o aceptable) del uso del AA frente al no uso. Esta efectividad alcanzó valores del 6,81% si sólo se consideraba el criterio de la HbA1c, y del 68,7% si se consideraba la totalidad de los criterios europeos de control. Sobre la base de estos cálculos, en nuestro estudio obtuvimos una efectividad del 59,2% considerando exclusivamente el valor de la HbA1c, y del 29,5% respecto del total de parámetros biológicos.
Respecto a la comparación con el GC, donde lo que medimos fue el porcentaje de mejora del control metabólico, a pesar de obtener una diferencia a favor del GAA, ésta no fue significativa, lo que apoya la necesidad de seleccionar a los pacientes candidatos a beneficiarse del AA.
De los resultados del presente estudio se desprende que los pacientes subsidiarios de AA deben seleccionarse previamente, ya que el uso indiscriminado de esta técnica obtiene una baja eficacia. Por tanto, es un método que no debería emplearse sistemáticamente en la totalidad de la población con DM tipo 2. Pero ¿cuáles son los criterios que deben seguirse para saber si el AA va a ser de utilidad para un determinado paciente con DM tipo 2? Nuestro análisis de regresión logística mostró 2 variables predictoras de la eficacia del AA: el tiempo de evolución de la enfermedad, por un lado, y la presencia de un deficiente control metabólico de la enfermedad, por otro. Así, cuanto mayor es el tiempo de evolución de la enfermedad, mayor es la tasa de éxito del AA (p < 0,05). Este hecho podría explicarse en un principio por la mayor experiencia que el paso del tiempo da al paciente sobre su enfermedad; sin embargo, nuestros resultados no corroboran esta hipótesis, ya que no se apreciaron diferencias significativas en la puntuación de la escala ECODI entre los pacientes en los que el AA fue eficaz frente a los que no. Tampoco es explicable por la dificultad o el obstáculo que la realización de la técnica del AA supone para la calidad de vida del paciente, como lo demuestra la ausencia de diferencias significativas respecto a la escala BSMBG, que valora este aspecto.
En cuanto a la presencia inicial de control metabólico deficiente como variable predictora de la eficacia del AA, es congruente imaginar que los pacientes con un mal control de su diabetes entiendan que deben hacer lo posible para mejorar su control metabólico, mientras que un paciente con un control aceptable no perciba la necesidad de mejorarlo.
La precisión diagnóstica global del modelo de regresión logística obtenido fue aceptable (88,24%), por lo que podría ser una herramienta a tener en cuenta para seleccionar qué pacientes con DM tipo 2 serían candidatos al AA por su mayor probabilidad de resultar eficaz. En nuestro caso, el punto de corte que mejor discrimina la eficacia del AA (curva de eficacia diagnóstica) es del 74%, de lo que se deduce que todo paciente con una probabilidad igual o superior al 74% sería candidato a utilizar el AA con una razonable probabilidad de éxito.
No obstante, sería conveniente evaluar y validar este modelo en otras poblaciones antes de considerarlo útil para la práctica clínica.
Agradecimiento
A todos nuestros pacientes. Los autores quieren expresar igualmente su agradecimiento a los laboratorios Lifescan por su colaboración al suministrar el soporte material e informático necesario para llevar a cabo el presente trabajo.