Los antidiabéticos orales inhibidores del cotransportador sodio-glucosa (iSGLT2) reducen la morbimortalidad cardiovascular en la DM2. El aumento de la rigidez arterial puede participar en esta morbimortalidad. El objetivo de este trabajo fue analizar el efecto de la administración de dapagliflozina en la rigidez arterial.
Pacientes y métodosEstudio observacional, prospectivo que incluyó a 32 pacientes con DM2. Antes del inicio de dapagliflozina y a los 6 y 12 meses, se analizaron parámetros bioquímicos en sangre y orina. Basalmente y a los 12 meses se determinó la velocidad de pulso carótida-femoral (VPc-f) mediante tonometría. El análisis de los cambios en las variables y su interrelación se hizo mediante ANOVA de datos repetidos, test de Wilcoxon y regresión múltiple.
ResultadosSe objetivó un descenso significativo de la VPc-f. No se evidenció asociación entre descenso de VPc-f y cambios de la glucemia, la uricemia, la presión arterial ni del peso.
ConclusionesDapagliflozina, en sujetos con DM2, produce, a medio-largo plazo, una disminución de la rigidez arterial.
Oral antidiabetic inhibitors of the sodium-glucose cotransporter (SGLT2i) reduce cardiovascular morbidity and mortality in DM2. The increase in arterial stiffness can participate in this morbidity and mortality. The aim of this study was to analyse the effect of the administration of dapagliflozin on arterial stiffness.
Patients and methodsProspective observational study that included 32 patients with DM2. Before starting dapagliflozin, and at 6 and 12 months, biochemical parameters in blood and urine were analysed. Before starting dapagliflozin and at 12 months the velocity of the carotid-femoral pulse (VPc-f) was determined by tonometry. Changes in the variables and their interrelation was analysed by repeated data ANOVA, Wilcoxon's test and multiple regression.
ResultsA significant decrease in the VPc-f was observed. There was no association between decreased VPc-f and changes in blood glucose, uric acid, blood pressure or weight.
ConclusionsDapagliflozin, in subjects with DM2, produces a medium to long-term decrease in arterial stiffness.
La diabetes mellitus tipo 2 (DM2) presenta una elevada incidencia de morbimortalidad cardiovascular (CV)1. El aumento de la rigidez arterial (RA) observado en la DM2 puede contribuir a este hecho2. Los nuevos fármacos antidiabéticos inhibidores del cotransportador de sodio glucosa tipo 2 (iSGLT2) reducen la mortalidad total y la morbimortalidad CV en los sujetos con DM23. Estos beneficios CV de los iSGLT2 derivan de la reducción de la glucemia, del peso y de la presión arterial (PA), del aumento de la natriuresis, de la preservación de la función renal y de posibles efectos CV directos4. Se propone también, como mecanismo adicional, una disminución de la RA promovida por los iSGLT24. Sin embargo, no hay trabajos que analicen a largo plazo el efecto de los iSGLT2 sobre la RA en pacientes con DM2. El propósito de esta investigación fue estudiar, prospectivamente, en sujetos con DM2, el efecto a largo plazo de un iSGLT2, dapagliflozina, sobre la velocidad de pulso carótida femoral (VPc-f), medida estándar de la RA.
Pacientes y métodosDiseño y población del estudioEstudio observacional, prospectivo, longitudinal. Se incluyó a 32 sujetos diagnosticados de DM2 en los que, según práctica clínica habitual, estaba indicado el tratamiento con dapagliflozina 10mg/día. Todos los pacientes dieron su consentimiento informado para participar.
VariablesAntes del inicio de terapia con dapagliflozina, a los 6 meses y a los 12 meses de tratamiento, se obtuvo sangre para determinaciones bioquímicas y hematológicas habituales, y orina de 24 h y primera orina matinal para determinación de creatinina, glucosa, sodio, ácido úrico y albúmina. La estimación del filtrado glomerular (FGe) se hizo mediante la fórmula Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI). Se diagnosticó nefropatía diabética en presencia de descenso del FGe (˂ 60ml/min/1,73 m2 y/o albuminuria (albúmina/creatinina en orina ≥ 300mg/g) y exclusión de otras causas de nefropatía.
La medida de la PA se realizó, en cada una de las visitas, con un Omron M1 (Omron Healthcare Co. Ltd, Kyoto, Japon), siguiendo las recomendaciones de la sociedad europea de hipertensión.
Previo a la terapia con dapagliflozina y a los 12 meses del tratamiento, se determinó la VPc-f, usando el SphygmoCor Xcel (AtCor Medical Ply Ltd Suite 11, 1059-1063 Victoria Road West Ryde, NSW 2114 Australia). La onda de pulso carotídeo se midió mediante tonometría de aplanamiento (micromanómetro de alta fidelidad [Millar Instrument]) y, simultáneamente, se midió la onda de pulso femoral con un manguito inflado sobre arteria femoral. La VPc-f se calculó como el cociente entre la distancia corregida entre los sitios de medida de la onda de pulso y el tiempo de retardo entre las ondas de pulso carotídeo y femoral. Se consideró como resultado el promedio de 2 registros de alta calidad.
Análisis estadísticoLos resultados se expresan como media ± desviación estándar o como mediana y rango intercuartil, dependiendo de la distribución investigada por el test de Shapiro-Wilk. Las variables categóricas se expresan como frecuencias. El análisis de las diferencias entre los valores basales y a los 6 y 12 meses se realizó mediante ANOVA de medidas repetidas. La comparación de los valores de la VPc-f basal y a los 12 meses se realizó con el test de Wilcoxon. El estudio de la participación de variables con posibilidad de afectar a la VPc-f se realizó mediante la regresión múltiple. El análisis estadístico se realizó con el SPSS 22 (IBM Corp. Released 2013. IBM SPSS Statistics for Windows, Version 22.0. Armonk, NY: IBM Corp). Valores de p < 0,05 se consideraron significativos.
ResultadosDe los 32 pacientes que iniciaron el estudio, 4 (2 hombres y 2 mujeres) interrumpieron el estudio antes de los 6 meses (2 por micosis genital, uno por dispepsia y uno por pérdida de seguimiento). Comparados con el resto de los pacientes que culminaron el seguimiento, aquellos 4 pacientes eran de mayor edad (66,5 ± 10 vs. 53,9 ± 8,7 años), tenían más duración de la DM (17,5 ± 6 vs. 13 ± 7,5 años), menor FGe (81,5 ± 21 vs. 95,6 ± 17ml/min/1,73 m2), mayor VPc-f (11,7 ± 2,3 vs. 9,8 ± 1,4 m/s) y similar HbA1c (8,7 ± 1,2 vs. 8,6 ± 1,3%).
La edad era 53,9 ± 8,7 años, el 61% varones. La duración de la DM era 13 ± 7,5 años. El 14% tenía antecedentes de enfermedad CV, el 18% retinopatía y el 32% nefropatía diabética. El 96% tomaba hipoglucemiantes por vía oral (metformina 89%; sulfonilureas [SU) 14%; inhibidores de dipeptidildipeptidasa [iDPP4]) 50%; glinidas 10%; glitazonas 3,6%). Un 14% recibía terapia con agonistas del receptor GLP-1 (péptido similar a glucagón) y el 64% eran tratados con insulina glargina. Durante el seguimiento, en 3 pacientes se suspendió la terapia con SU, en uno la terapia con agonistas GLP-1 y en 2 casos se redujo/suspendió la insulina. El peso inicial era 93,7 ± 17,6kg, observándose un descenso significativo del mismo a los 6 y 12 meses de la terapia con dapagliflozina (91,4 ± 18kg, p = 0,000 y 92,0 ± 18,4kg, p < 0,007, respectivamente). La PA arterial sistólica (PAS) a los 6 meses (136,5 [19] mmHg) (mediana [rango intercuartil]) y a los 12 meses (136,5 [22] mmHg) fue inferior a la PAS previa al inicio de dapagiflozina (144,5 [29]) (p = 0,000). También se comprobó un descenso significativo de la PA diastólica (PAD) a los 6 y 12 meses (78 [10] y 77 [12] mmHg vs. 83,5 [11] mmHg, respectivamente, p = 0,001). No se observaron modificaciones significativas de la frecuencia cardiaca.
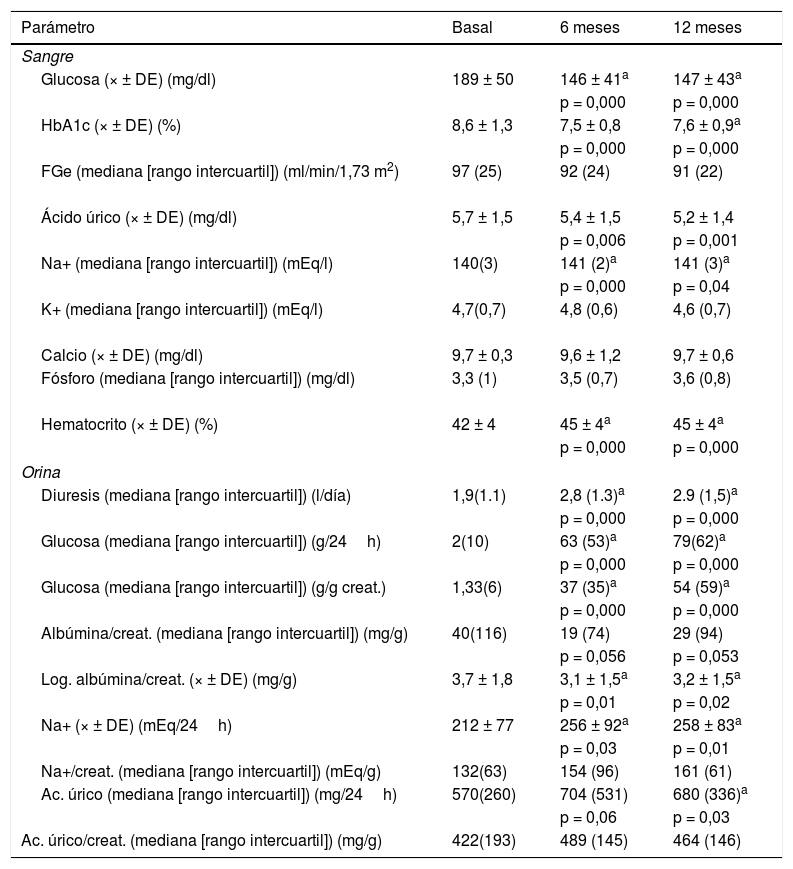
Las modificaciones de los parámetros hematológicos y bioquímicos en sangre y orina se observan en la tabla 1.
Valores de parámetros hematológicos y bioquímicos en sangre y orina basales, a los 6 y a los 12 meses
| Parámetro | Basal | 6 meses | 12 meses |
|---|---|---|---|
| Sangre | |||
| Glucosa (× ± DE) (mg/dl) | 189 ± 50 | 146 ± 41a | 147 ± 43a |
| p = 0,000 | p = 0,000 | ||
| HbA1c (× ± DE) (%) | 8,6 ± 1,3 | 7,5 ± 0,8 | 7,6 ± 0,9a |
| p = 0,000 | p = 0,000 | ||
| FGe (mediana [rango intercuartil]) (ml/min/1,73 m2) | 97 (25) | 92 (24) | 91 (22) |
| Ácido úrico (× ± DE) (mg/dl) | 5,7 ± 1,5 | 5,4 ± 1,5 | 5,2 ± 1,4 |
| p = 0,006 | p = 0,001 | ||
| Na+ (mediana [rango intercuartil]) (mEq/l) | 140(3) | 141 (2)a | 141 (3)a |
| p = 0,000 | p = 0,04 | ||
| K+ (mediana [rango intercuartil]) (mEq/l) | 4,7(0,7) | 4,8 (0,6) | 4,6 (0,7) |
| Calcio (× ± DE) (mg/dl) | 9,7 ± 0,3 | 9,6 ± 1,2 | 9,7 ± 0,6 |
| Fósforo (mediana [rango intercuartil]) (mg/dl) | 3,3 (1) | 3,5 (0,7) | 3,6 (0,8) |
| Hematocrito (× ± DE) (%) | 42 ± 4 | 45 ± 4a | 45 ± 4a |
| p = 0,000 | p = 0,000 | ||
| Orina | |||
| Diuresis (mediana [rango intercuartil]) (l/día) | 1,9(1.1) | 2,8 (1.3)a | 2.9 (1,5)a |
| p = 0,000 | p = 0,000 | ||
| Glucosa (mediana [rango intercuartil]) (g/24h) | 2(10) | 63 (53)a | 79(62)a |
| p = 0,000 | p = 0,000 | ||
| Glucosa (mediana [rango intercuartil]) (g/g creat.) | 1,33(6) | 37 (35)a | 54 (59)a |
| p = 0,000 | p = 0,000 | ||
| Albúmina/creat. (mediana [rango intercuartil]) (mg/g) | 40(116) | 19 (74) | 29 (94) |
| p = 0,056 | p = 0,053 | ||
| Log. albúmina/creat. (× ± DE) (mg/g) | 3,7 ± 1,8 | 3,1 ± 1,5a | 3,2 ± 1,5a |
| p = 0,01 | p = 0,02 | ||
| Na+ (× ± DE) (mEq/24h) | 212 ± 77 | 256 ± 92a | 258 ± 83a |
| p = 0,03 | p = 0,01 | ||
| Na+/creat. (mediana [rango intercuartil]) (mEq/g) | 132(63) | 154 (96) | 161 (61) |
| Ac. úrico (mediana [rango intercuartil]) (mg/24h) | 570(260) | 704 (531) | 680 (336)a |
| p = 0,06 | p = 0,03 | ||
| Ac. úrico/creat. (mediana [rango intercuartil]) (mg/g) | 422(193) | 489 (145) | 464 (146) |
creat.: creatinina; FGe: filtrado glomerular estimado.
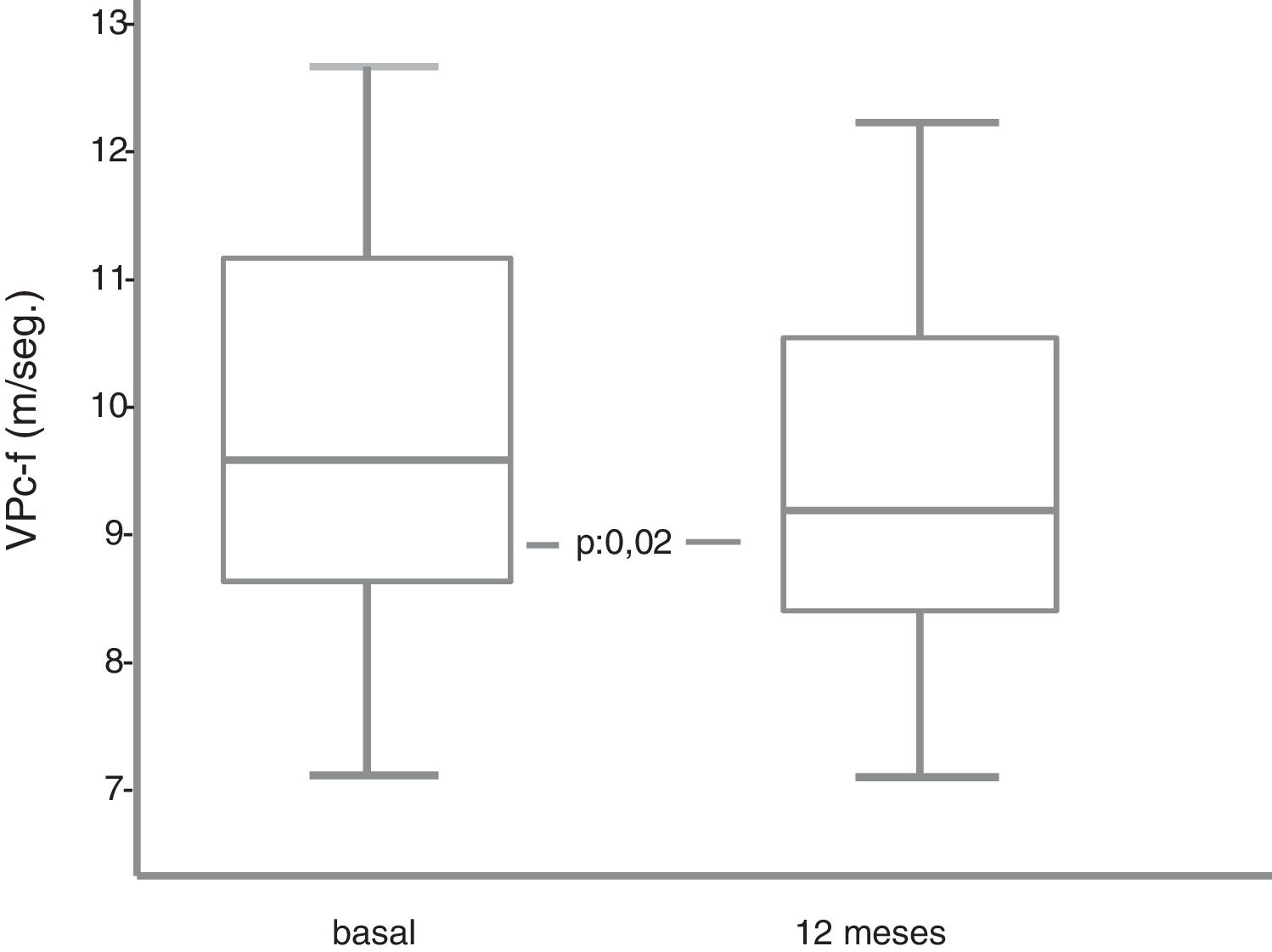
El 42,8% de los pacientes tenían valores basales elevados (≥ 10 m/s) de la VPc-f. Entre los 9 pacientes con nefropatía diabética, el 44% tenía valores elevados de la VPc-f. Este porcentaje se reducía al 37% entre los que no tenían nefropatía. A los 12 meses de terapia, la VPc-f disminuyó significativamente (9,1 [8,4-10,1] vs. 9,65 [8,75-11,2] m/s (p = 0,02) (fig. 1). La variación porcentual fue cuantitativamente, pero no significativamente, superior en los pacientes con valores basales elevados de la VPc-f (–7,8% [–3- –19%] vs. –2,8% [2- –9%]). En el análisis de regresión múltiple ni el descenso del peso, la PA, la HbA1c, los cambios del FGe ni de la uricemia mostraron participación significativa en las modificaciones de la VPc-f.
DiscusiónComo en otros estudios, nuestros datos confirman que dapagliflozina produce una disminución mantenida de la glucemia, el peso, la PA y la uricemia4.
Nuestro principal hallazgo es que, por primera vez, se demuestra que dapagliflozina produce a medio-largo plazo una disminución de la RA en sujetos con DM2 que puede tener beneficios CV y renales al disminuir la PA central y atenuar el daño inducido por la pulsatilidad. No evaluamos los cambios ecocardiográficos estructurales ni la función cardiaca. Sí observamos una disminución de la albuminuria en la que puede participar el descenso de VPc-f juntamente con los cambios hemodinámicos intrarrenales, y la disminución de peso y PA inducidos por dapaglifozina.
Los mecanismos subyacentes de la disminución de VPc-f no están claros. La RA está influida por factores neurohumorales y estructurales. En sujetos con DM2 la administración de dapagliflozina, de forma aguda, reduce la VPc-f, independientemente de los cambios de la PA5. El descenso persistente de la VPc-f al cabo de 12 meses sugiere que puede existir un componente estructural en la reducción de la RA.
La enfermedad renal crónica con reducción del FG se asocia a un aumento de la RA6. En nuestro estudio, los sujetos en los que coexistía DM con nefropatía tenían una VPc-f basal más alta; sin embargo, tras terapia con dapaglifozina, solo observamos un ligero descenso no significativo del FG, por lo que esta variable no parece contribuir a los cambios observados de la RA.
La hiperglucemia induce cambios en colágeno que aumentan la RA7. Un mejor control glucémico se socia a una atenuación/prevención del aumento de la RA en DM2. En nuestro estudio, se observa descenso significativo mantenido de la HbA1c, pero no objetivamos relación significativa entre modificaciones de la glucemia y de la VPc-f. Por otra parte, la disminución de la PA, el peso, la dosis de insulina y la administración de algunos fármacos antihipertensivos se asocian al descenso de la VPc-f8. En nuestro estudio, solo se redujo/suspendió la insulina en 2 casos, fueron mínimos los cambios de otros agentes hipoglucemiantes con posibles efectos vasculares, no se modificó la terapia antihipertensiva y, en el estudio de regresión, ni las modificaciones de peso ni de la PA se evidenciaron como variables explicativas significativas, probablemente por el número limitado de casos, de la reducción de la VPc-f. Tampoco la disminución significativa de la uricemia, atribuible a aumento de la excreción urinaria de ácido úrico, evidenció relación significativa con el descenso de la VPc-f.
En la DM2 hay un aumento del contenido total de Na+. Hay un nexo entre el incremento del contenido de Na+ y cambios estructurales y funcionales de grandes arterias, independientes de la PA, con aumento de RA9. Los iSGLT2, al inhibir el cotransportador sodio-glucosa y el intercambiador Na+/H+ en túbulo proximal, inducen natriuresis. Los pocos estudios que han cuantificado el efecto natriurético de los iSGLT2 han observado un aumento transitorio de la excreción urinaria de sodio. Nosotros observamos una ligera disminución del Na+ sérico, que atribuimos a un descenso de la glucemia y un aumento persistente de la natriuresis que, sin embargo, no alcanzó significación estadística cuando se relacionó con excreción urinaria de creatinina. En ausencia de control riguroso de ingesta de sodio, es difícil la valoración de la natriuresis. Creemos, sin embargo, que nuestros datos suscitan un probable aumento persistente de natriuresis por dapagliflozina que, por otra parte, ha demostrado reducir el contenido tisular de Na+ en sujetos con DM210. El aumento de la natriuresis, juntamente con la reducción del contenido de Na+ de la fibra muscular lisa del miocardiocito y la pared vascular por inhibición del intercambiador Na+/H+, puede contribuir a la reducción de la RA.
ConclusionesEn sujetos con DM2 la administración de dapaglifozina produce a medio-largo plazo un descenso de la RA en el que pueden intervenir múltiples mecanismos: reducción de glucemia, PA, peso, ácido úrico y del contenido corporal de Na+, entre otros.
El carácter longitudinal del estudio con datos a medio-largo plazo, sin modificaciones relevantes en la terapia concomitante, refuerza nuestros resultados. Sin embargo, nuestro estudio tiene limitaciones: su carácter observacional, la falta de control de la ingesta de sodio y el número reducido de enfermos. Dado que los 4 pacientes que no culminaron el seguimiento tenían valores más elevados de VPc-f y el hecho de que en nuestro estudio el descenso de la VPc-f parece ser de mayor magnitud en los casos en los que aquella es anormalmente alta, es posible que la inclusión de esos pacientes reforzara nuestros hallazgos. Son necesarios estudios aleatorizados a largo plazo en DM2 con análisis de eventos CV para confirmar el efecto beneficioso de los iSGLT2 en la RA y su participación en los beneficios CV, y su comparación con los nuevos agentes hipoglucemiantes con posibles efectos vasculares.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.