Los virus del género Phlebovirus, transmitidos por dípteros de la familia Psychodidae, son una causa de síndrome febril autolimitado durante el verano-otoño en los países mediterráneos. En el caso del virus Toscana, pueden ser causa de meningitis y meningoencefalitis. En España se ha detectado la presencia de los virus Toscana, Granada, Nápoles, Sicilia, Arbia y Arrabida-like. La presencia casi generalizada de vectores del género Phlebotomus, especialmente de Phlebotomus perniciosus, en los que se han detectado varios de estos virus, hace muy probable que aparezcan de manera regular infecciones en humanos en nuestro país, siendo este riesgo moderado para el virus Toscana y bajo para el resto, en las zonas con mayor actividad del vector. La mayor parte de las enfermedades pasarían inadvertidas y solo el virus Toscana puede tener un mayor impacto por la aparición de casos graves.
The genera Phlebovirus transmitted by Diptera belonging to the Psychodidae family are a cause of self-limited febrile syndrome in the Mediterranean basin in summer and autumn. Toscana virus can also cause meningitis and meningoencephalitis. In Spain, Toscana, Granada, Naples, Sicily, Arbia and Arrabida-like viruses have been detected. The almost widespread distribution of Phlebotomus genus vectors, and especially Phlebotomus perniciosus, in which several of these viruses have been detected, makes it very likely that there will be regular human infections in our country, with this risk considered moderate for Toscana virus and low for the other ones, in areas with the highest vector activity. Most of the infections would be undiagnosed, while only Toscana virus would have a greater impact due to the potential severity of the illness.
El género Phlebovirus (flebovirus) pertenece a la familia Phenuiviridae y orden Bunyaviridae. Dicho género comprende 10 especies y más de 100 virus antigénicamente diferentes y se divide a su vez en 2grupos: los transmitidos por flebótomos y el grupo Uukuniemi, transmitido por garrapatas. Los flebovirus transmitidos por flebótomos (FTF), que circulan por la región del Mediterráneo, se resumen en la tabla 1.
Flebovirus transmitidos por flebótomos, patógenos (o potencialmente patógenos) para humanos en la región mediterránea
| Especie | Virus |
|---|---|
| Nápoles | Nápoles, Toscana, Massilia, Teherán, Granada, Púnica, Fermo, Saddaguia, Arrabida, Zerdali |
| Salehabad | Salehabad, Arbia, Adria, Alcube, Edirne, Adana, Valle del Medjerda |
| Sicilia | Sicilia, Chipre, Turquía, Utique |
| Corfú | Corfu, Sicilia-like, Gime 1, Gime 2, Olbia, Provencia |
| Karimadab | Karimabad |
En general, las infecciones por FTF cursan de forma asintomática y, en ocasiones, originan un síndrome febril de 3-7 días de duración que se ha denominado «fiebre de papatasi», con una sintomatología similar a la gripe. El periodo de incubación de los FTF en una persona infectada suele ser corto, de unos 3-6 días4, y el inicio es brusco con fiebre, mialgias, cefalea, conjuntivitis, náuseas, vómitos y diarrea, que se resuelven, por lo general, en el plazo de una semana. También son comunes la leucocitopenia, la trombocitopenia y la elevación de las enzimas hepáticas y de la creatincinasa5. El virus Granada podría también asociarse a síndromes febriles con exantema o infección respiratoria de las vías altas6.
La enfermedad neuroinvasiva se ha descrito, casi únicamente, asociada a la infección por virus Toscana7. En estos casos, la presentación clínica puede incluir, además de los síntomas ya mencionados, fotofobia, nistagmo, rigidez de nuca, signo de Kerning, déficit neurológico focal y alteración del nivel de consciencia. En el líquido cefalorraquídeo (LCR) se puede encontrar pleocitosis linfocítica con 5-10 células/ml, con niveles normales de glucosa y proteínas, lo que es característico de las meningitis asépticas. El pronóstico generalmente es bueno, sin secuelas, aunque se han descrito casos de encefalitis grave, cefalea persistente, hipoacusia, alteraciones de la personalidad permanentes, bajo nivel de consciencia prolongado con convulsiones, hidrocefalia y afasia o paresias persistentes durante meses tras la fase aguda7-13. Otras complicaciones graves descritas son la epidídimo-orquitis, la coagulación intravascular diseminada y las manifestaciones hemorrágicas12.
La detección de casos más habitual, en el caso del virus Toscana, es la esporádica. El resto de los FTF, debido a que los síntomas son leves, se suelen detectar exclusivamente cuando se presentan en forma de brotes. Hasta la fecha, se considera que son enfermedades exclusivamente humanas5.
Los FTF se pueden detectar mediante cultivo en determinadas líneas celulares, como las células Vero (riñón de mono verde africano, Cercopithecus aethiops) y LLC-MK2 (Rhesus, Macaca mulatta), así como en células BHK-21 (riñón de hámster), siendo las células Vero las más utilizadas5. Existen técnicas moleculares que pueden detectar concentraciones bajas del virus y que se diseñan ad hoc para virus específicos. Actualmente, la técnica más utilizada para el diagnóstico molecular de estos virus es la reacción en cadena de la polimerasa en tiempo real (RT-PCR), la cual es más sensible y rápida. Hay que tener en cuenta que, debido a la variabilidad genética del virus, estas técnicas podrían ser poco sensibles para la detección de cepas que circulan en otras zonas13. La detección de anticuerpos específicos IgM e IgG se realiza mediante técnicas inmunoenzimáticas (ELISA) o inmunofluorescencia indirecta (IFI), en suero y LCR. Aunque la sensibilidad de estas técnicas es muy alta, se pueden dar reacciones cruzadas entre los distintos flebovirus ya que son antigénicamente similares, especialmente al utilizar técnicas de IFI. Para confirmar el diagnóstico serológico se realizan pruebas de seroneutralización13,14.
Existen algunos agentes efectivos frente a FTF in vitro. Así, el selenazol, la ribavirina, el interferón alfa y la proteína MXA derivada del interferón son inhibidores del virus Sicilia y los derivados de la pyrazina T-705 y T-1106 son inhibidores del virus Nápoles. La ribavirina se ha utilizado con éxito como profilaxis postexposición en soldados expuestos al virus Sicilia5. Para el virus Toscana, no existe un tratamiento específico. Por el momento, no hay vacunas frente a los flebovirus. La prevención a nivel individual se basa en la utilización de las medidas para evitar las picaduras, principalmente en los meses más cálidos del año, cuando existe mayor riesgo de transmisión.
Transmisión de la enfermedad y ciclo biológicoEl único mecanismo de transmisión de los FTF conocido es vectorial y los principales vectores competentes son los flebótomos que pertenecen al orden Diptera, familia Psychodidae. Los géneros involucrados en la transmisión son Lutzomyia, en el continente americano, y Phlebotomus en Europa, fundamentalmente las especies Phlebotomus perniciosus (P. perniciosus), Phlebotomus ariasi (P. ariasi), Phlebotomus papatasi (P. papatasi) y Phlebotomus perfiliewi (P. perfiliewi).
El ciclo biológico de los flebótomos consta de 4 estadios: huevo, larva, pupa y adulto, y puede tardar en completarse unos 2meses en condiciones óptimas. La hembra realiza 4-5 puestas a lo largo de su vida, con unos 40-60 huevos en cada puesta. Lugares característicos para la ovoposición son los terrenos húmedos y bien resguardados como los huecos de los muros, la mampostería deteriorada, las grietas profundas en el suelo y las madrigueras15. El insecto adulto tiene una vida corta, rara vez superior a 4 semanas. Busca su alimento en un radio de unos 50 m de los lugares donde se reproduce, aunque ocasionalmente se puede desplazar a mayores distancias. En general, se desplaza mediante vuelos cortos, dando pequeños saltos. A diferencia de los mosquitos, tiene un vuelo muy silencioso. Es activo una vez se ha puesto el sol y durante las primeras horas de la noche, momento que suele aprovechar la hembra para picar tanto en el interior como en el exterior de las casas, dependiendo de la especie. La actividad de los flebótomos es mayor en los meses más cálidos, entre junio y octubre16,17.
La transmisión del virus a los humanos y a los animales se produce por la picadura del flebótomo infectado. En estos insectos, el virus se replica y se disemina hasta las glándulas salivales; mediante la picadura de las hembras, es transmitido a diferentes animales. La transmisión inversa se produce cuando el flebótomo hembra se alimenta de sangre de animales o humanos infectados en periodo virémico18. Se han encontrado FTF tanto en flebótomos machos como hembras, lo que sugiere la existencia de transmisión transovárica o vertical. Este mecanismo es de suma importancia, ya que permitiría la supervivencia del virus en las generaciones subsiguientes de flebótomos. También se ha demostrado la infección experimental de las hembras por vía venérea, lo que sería un modo de amplificación de la infección en el vector en ausencia de otros reservorios19. Los flebótomos se vuelven infectantes unos 7 días después de adquirir el virus y permanecen así durante toda su vida4.
Se considera que los flebótomos actúan como reservorio principal del virus. Se han detectado anticuerpos frente a FTF en diversos animales domésticos como perros, gatos, cabras y ovejas en distintos lugares de la cuenca mediterránea. Sin embargo, el único FTF que se ha detectado en sangre de animales es el virus Toscana, aunque parece que la viremia es de corta duración, por lo que su papel como reservorios es aún controvertido. En los seres humanos sintomáticos se ha podido observar que la viremia es corta, lo que, al igual que ocurriría con los animales, hace improbable su actuación como reservorios6,20, aunque en el caso del virus Nápoles se ha señalado recientemente esta posibilidad utilizando estimaciones realizadas mediante modelos matemáticos21.
Según estos datos, tanto los animales como los humanos podrían considerarse hospedadores accidentales sirviendo de refugio temporal y de vehículo para acceder al reservorio principal, el flebótomo. Los vertebrados aumentarían así las posibilidades de supervivencia y transmisión de estos virus.
Medidas de control vectorialLos programas de control vectorial que se desarrollan dentro de las estrategias de prevención de las administraciones, tanto locales como nacionales repercuten en la densidad de vectores. En general, estos programas constituyen una medida muy eficaz para reducir o interrumpir la transmisión de las infecciones. Sin embargo, en el caso concreto de los flebótomos, se muestran poco eficaces y se llevan a cabo solo de forma esporádica y dirigidos fundamentalmente al control de la leishmaniasis, cuyo vector es también el flebótomo. Por una parte, los hábitos de las hembras de la mayoría de las especies que se encuentran en España son exofágicos (pican en el exterior) y exofílicos (descansan en el exterior durante la etapa de maduración de los huevos), lo que hace que los insecticidas aplicados dentro de las casas sean menos efectivos. Por otra parte, las poblaciones de flebótomos se encuentran en diferentes estadios y la acción de los insecticidas piretroides sobre las fases larvarias es nula o muy limitada debido a lo inaccesible de los pocos hábitats de cría que se conocen y a la dificultad para determinar con precisión dónde se están desarrollando en realidad. Por tanto, estas poblaciones se distribuyen en zonas muy amplias, donde existe un gran número de potenciales refugios y áreas de cría de muy variada tipología. Por estos factores, los efectos de los tratamientos de desinsectación pueden dar resultados contradictorios y muy limitados en el tiempo. En algunos contextos han resultado eficaces los tratamientos ambientales por nebulización o termonebulización con insecticidas piretroides en áreas con especial densidad del vector y riesgo de transmisión por su cercanía a lugares habitados (parques interurbanos fundamentalmente) y también el rociamiento de insecticidas piretroides con mayor capacidad residual en muros, registros, solares, granjas, tajeas, etc. en áreas cercanas a las viviendas o incluso en el interior del casco urbano22. Hay que tener en cuenta que la creciente resistencia a los insecticidas, por suerte no muy extendida en flebótomos, y la paulatina reducción del número de insecticidas autorizados y comercializados en la Unión Europea para su uso en programas preventivos de control vectorial reduce notablemente las herramientas disponibles para la prevención23.
Otras actuaciones centradas en el medio ambiente han demostrado ser eficaces en el control de los vectores, como la destrucción y la modificación del hábitat (p. ej., el enfoscado de grietas en las paredes y del pavimento y la retirada y cubrición de rocas), la creación de barreras físicas para impedir la actividad del vector (p. ej., cierre y sellado de registros de pluviales y de pozos y cierre o colocación de mallas en las rejillas de ventilación de los sótanos) y la limitación de áreas de refugio y de alimentación (desbrozado, eliminación de vegetación excesiva y retirada de cúmulos de leña, restos vegetales y otros restos orgánicos, limpieza del alcantarillado y control de plagas de animales potenciales fuentes de alimentación del vector)22.
Situación de los flebótomos y los flebovirus en EspañaSe han identificado 11 especies de flebótomos en España perteneciente a 2géneros: Sergentomyia y Phlebotomus. Aunque P. perniciosus y P. ariasi son las especies de flebótomos más extendidas en nuestro país, otras, como P. papatasi y Phlebotomus sergenti se distribuyen en mayor o menor medida por el territorio. La distribución principal de estos vectores es en el sur y centro de la península y la costa mediterránea, así como las Islas Baleares. En España no está documentada la presencia de P. perfiliewi, el transmisor del virus Toscana más abundante en Italia. Otras especies como Phlebotomus langueroni, Phlebotomus mascitti, Phlebotomus alexandri y Phlebotomus chaubadi se encuentran de forma puntual, mientras que Phlebotomus similis, Phlebotomus tobbi y Phlebotomus neglectus no están presentes en nuestra geografía24-28. En las Islas Canarias la presencia del género Phlebotomus es escasa: se ha encontrado P. perniciosus y P. ariasi en densidades muy bajas, así como Phlebotomus fortunatarum, un endemismo de estas islas29.
La densidad de flebótomos varía en función de la climatología y el uso del suelo. En muchas zonas de España las poblaciones, sobre todo de P. perniciosus, tienen 2picos de abundancia, uno en primavera y comienzos de verano y otro en otoño. El pico de otoño seguramente es más importante en la transmisión de los FTF, porque se detectan un porcentaje mayor de hembras que han ingerido sangre previamente y, por lo tanto, será más alta la posibilidad de estar infectadas. En la provincia de Madrid se detectó la presencia de P. perniciosus desde el mes de mayo hasta noviembre con 2picos de abundancia, en julio y en septiembre. En la misma zona, P. ariasi presentó actividad desde mayo hasta octubre, pero solo con un pico de abundancia en agosto. En España, se ha observado que la densidad de P. perniciosus es mayor en las zonas más secas y áridas con temperaturas más cálidas, predominando en las zonas denominadas meso y termomediterráneas. Por otra parte, P. ariasi se adapta mejor a las zonas más frías y altitudes por encima de los 600-900 m (zonas supramediterráneas)24-26,30. En cuanto al uso del suelo, P. perniciosus y P. ariasi predominan en zonas agrícolas no urbanas, con ausencia de carreteras asfaltadas, en los muros protegidos del viento, sobre todo en la cara sur y este y en zonas donde hay ganado y aves31. En los mapas de riesgo realizados en el estudio en la provincia de Granada se encontró que la probabilidad de que P. perniciosus estuviera presente aumentaba en los edificios de fecha de construcción más antigua25,26.
En España se tienen indicios de la presencia de virus Toscana, Granada, Nápoles, Sicilia, Arbia y Arrabida-like en humanos, animales y flebótomos, aunque solo se han identificado casos humanos asociados a Toscana (tablas 2 y 3).
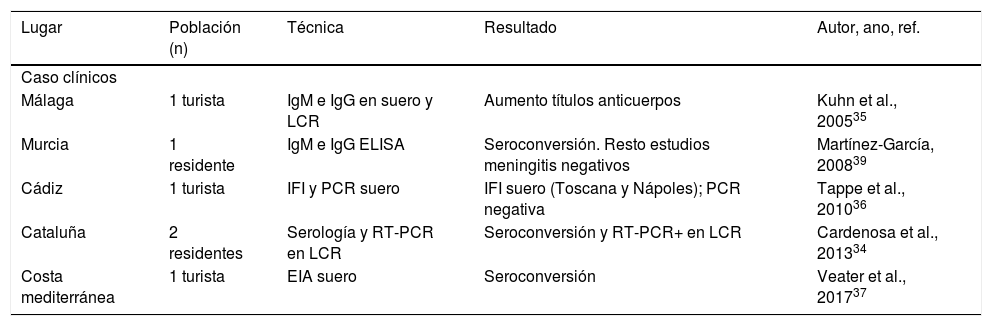
Casos humanos de meningitis aséptica por virus Toscana en España
| Lugar | Población (n) | Técnica | Resultado | Autor, ano, ref. |
|---|---|---|---|---|
| Caso clínicos | ||||
| Málaga | 1 turista | IgM e IgG en suero y LCR | Aumento títulos anticuerpos | Kuhn et al., 200535 |
| Murcia | 1 residente | IgM e IgG ELISA | Seroconversión. Resto estudios meningitis negativos | Martínez-García, 200839 |
| Cádiz | 1 turista | IFI y PCR suero | IFI suero (Toscana y Nápoles); PCR negativa | Tappe et al., 201036 |
| Cataluña | 2 residentes | Serología y RT-PCR en LCR | Seroconversión y RT-PCR+ en LCR | Cardenosa et al., 201334 |
| Costa mediterránea | 1 turista | EIA suero | Seroconversión | Veater et al., 201737 |
| Estudios retrospectivos en series de meningitis asépticas | ||||
| Granada | Casos entre 1988-1996 (n: 184) | Cultivo LCR | 15 positivos (8%) | Mendoza-Montero et al., 199843 |
| España | Casos entre 1993-1999 (n: 81) | EIA IgG e IgM en suero y LCR | 7 positivos (8,6%) | Echevarría et al., 200341 |
| España | Casos entre 1988-2002 (n: 724) | Cultivo LCR | 17 positivos (2,3%) | Navarro et al., 200438 |
| España | Casos entre 2000-2005 (n: 382) | IFI sueros | 19 positivos (4,9%) | De Ory et al., 200944 |
| Mallorca | Casos entre 2007-2008 (n: 22) | RT-PCR LCR | 0 positivos | Leyes et al., 201142 |
EIA: enzimoinmunoanálisis; IFI: inmunofluorescencia indirecta; IgG: inmunoglobulina G; IgM: inmunoglobulina M; LCR: líquido cefalorraquídeo; PCR: reacción en cadena de la polimerasa.
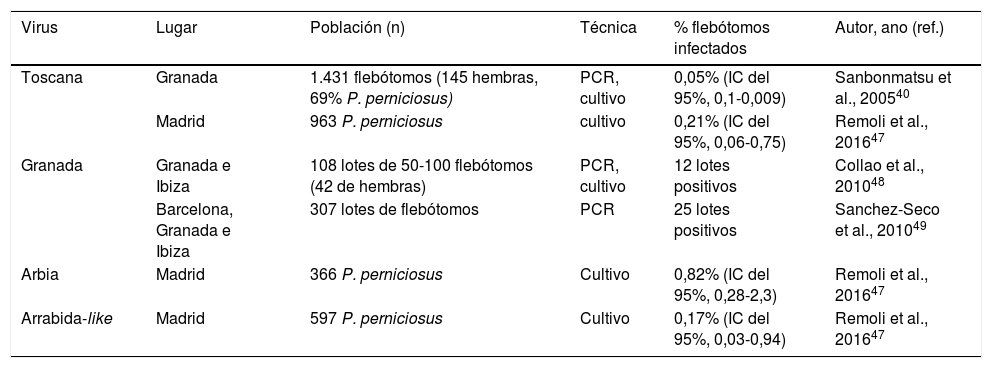
Detección de flebovirus en flebótomos en España
| Virus | Lugar | Población (n) | Técnica | % flebótomos infectados | Autor, ano (ref.) |
|---|---|---|---|---|---|
| Toscana | Granada | 1.431 flebótomos (145 hembras, 69% P. perniciosus) | PCR, cultivo | 0,05% (IC del 95%, 0,1-0,009) | Sanbonmatsu et al., 200540 |
| Madrid | 963 P. perniciosus | cultivo | 0,21% (IC del 95%, 0,06-0,75) | Remoli et al., 201647 | |
| Granada | Granada e Ibiza | 108 lotes de 50-100 flebótomos (42 de hembras) | PCR, cultivo | 12 lotes positivos | Collao et al., 201048 |
| Barcelona, Granada e Ibiza | 307 lotes de flebótomos | PCR | 25 lotes positivos | Sanchez-Seco et al., 201049 | |
| Arbia | Madrid | 366 P. perniciosus | Cultivo | 0,82% (IC del 95%, 0,28-2,3) | Remoli et al., 201647 |
| Arrabida-like | Madrid | 597 P. perniciosus | Cultivo | 0,17% (IC del 95%, 0,03-0,94) | Remoli et al., 201647 |
La primera descripción de la presencia de FTF en España la realizó Eitrem en 1991, con la publicación de un caso clínico de infección por virus Toscana en un turista sueco que había visitado Cataluña32. Desde entonces, el virus ha sido detectado en casos esporádicos de meningitis o meningoencefalitis en residentes de las comunidades de Cataluña y Murcia, así como en viajeros que habían visitado Andalucía y la costa mediterránea33-37. Del mismo modo, se han realizado estudios retrospectivos en LCR o sueros de personas que habían tenido meningitis aséptica, en las que no se había llegado a ningún diagnóstico etiológico: de 1.393 casos estudiados en distintos lugares, utilizando diferentes técnicas, 58 (4,2%, IC del 95%, 3,1-5,2) resultaron positivos (tabla 2). Los casos positivos fueron más frecuentes en personas procedentes del medio rural, con inicio de síntomas entre junio y octubre38. Añadido a esto, se han descrito algunas complicaciones graves de la enfermedad en los casos detectados en nuestro país, como hipoacusia, paresias o afasia39,40.
La presencia de Toscana en España se ha demostrado también mediante estudios de detección de anticuerpos. La prevalencia media de seropositivos oscila, según los estudios, entre el 5 y el 26%, con diferencias regionales. El primer estudio, realizado entre 1988 y 1996, usando técnicas de IFI detectó que las áreas con mayores seroprevalencias eran Palma de Mallorca (61%), Jerez (31%), Barcelona (28%) y Granada (27%), a diferencia de las localidades del norte, como Santiago de Compostela (11%) y San Sebastián (11%), que tuvieron las prevalencias más bajas8. Estas observaciones se han corroborado en parte en estudios posteriores, donde las prevalencias superaron el 25% de la población general en Granada y Mallorca, en contraste con Madrid y Cataluña, donde no superaron el 5%34,40-42. En Cataluña y Granada se ha observado una relación dependiente de la edad, con mayores seroprevalencias en adultos y ancianos34,40.
Del mismo modo, se ha descrito una exposición importante al virus Toscana en animales domésticos. En la provincia de Granada se encontró seropositividad en sueros de todas las especies de animales domésticos estudiados mediante técnicas de IFI. Las mayores tasas de seroprevalencia se detectaron en caballos (64%), gatos (60%) y perros (48%). También se detectaron anticuerpos en ovejas (33%), cerdos (22%), cabras (18%) y vacas (18%)45. Por otra parte, se ha demostrado la presencia de virus Toscana en el vector. En 2003, en estudios llevados a cabo en la red Enfermedades Víricas Transmitidas por Artrópodos y Roedores (EVITAR), se mostró la presencia de material genético de Toscana en un 0,05% de los flebótomos capturados en la provincia de Granada40. Esta prevalencia, claramente inferior a la identificada en las zonas endémicas de Italia, donde el virus se detecta en un 0,2% de los vectores, ha llevado a explicar en parte durante años la también menor incidencia de la enfermedad en el sur de España, comparada con la región central de Italia40,46. Recientemente, en el municipio de Madrid se ha detectado virus Toscana en el 0,21% de P. perniciosus, similar a la encontrada en la región de Toscana en Italia40,47.
Virus GranadaEl virus Granada se ha aislado en flebótomos en el sur de España, sin que se haya confirmado hasta la fecha ningún caso en humanos. El análisis completo de su genoma indica que el virus Granada podría ser el resultado de la recombinación genética del virus Massilia, que aportaría los segmentos L y S, y otro flebovirus no identificado que aportaría el segmento M48. Se han realizado varios estudios de seroprevalencia en humanos utilizando técnicas de inmunofluorescencia directa, mostrando una prevalencia de anticuerpos frente a virus Granada del 15% en la población de la provincia de Granada, si bien mediante esta técnica se pueden producir reacciones cruzadas con Toscana6,48. Mediante neutralización viral, la estimación de la seroprevalencia de este virus en 2estudios en Granada fue del 2 y el 2,8%6,48. En un estudio realizado en flebótomos capturados en Granada e Ibiza entre los años 2004 y 2005 se pudo detectar mediante PCR y secuenciación el virus Granada en el 11% de los lotes estudiados48.
Virus Nápoles, Sicilia, Arbia y Arrabida-likeLos virus Nápoles y Sicilia no se han detectado en España ni en humanos, animales ni flebótomos. Los anticuerpos frente a estos virus u otros relacionados se han detectado en un estudio realizado en sueros de donantes obtenidos entre 1988 y 19968 pero se considera que habría que analizar con más profundidad la especificidad de la señal obtenida en este estudio con base en los conocimientos actuales.
Los virus Arbia y Arrabida-like sí se han aislado recientemente en nuestro país en flebótomos infectados en el municipio de Fuenlabrada de Madrid (tabla 3)47. De momento, se desconoce la implicación que este hallazgo puede tener para la salud humana.
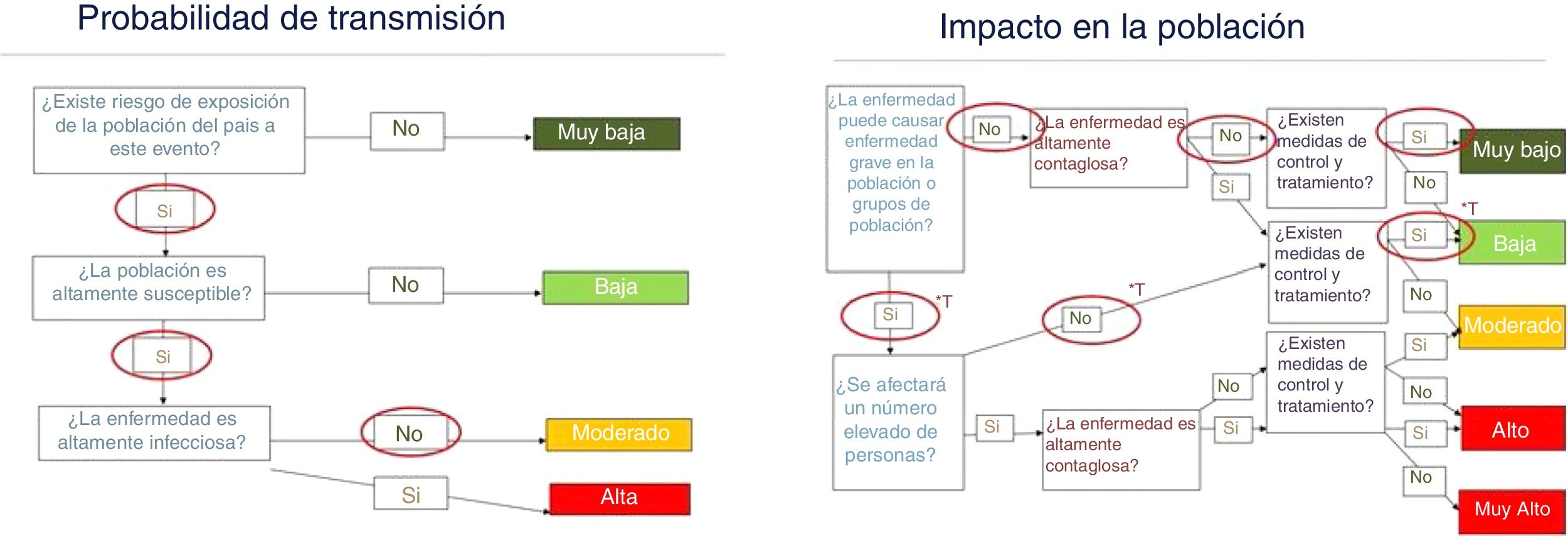
Evaluación del riesgo para EspañaEl riesgo para la salud pública de las enfermedades infecciosas está condicionado por el riesgo de transmisión y el impacto que la enfermedad ocasiona en la población. La metodología utilizada para esta evaluación está basada en la mejor evidencia disponible, así como las valoraciones cualitativas de expertos en los campos de la infectología, la epidemiología, la microbiología, la entomología y la salud pública, utilizando la metodología propuesta por el Centro de Control de Enfermedades Europeo50. Las conclusiones de esta evaluación sirven para orientar los planes de preparación de respuesta y las medidas de salud pública a nivel nacional.
Los factores que contribuyen a la urgencia y extensión de los FTF son complejos y están relacionados, entre otros, con características de los propios virus, las condiciones ambientales favorables para el vector, y los factores que favorecen el contacto de los vectores con el ser humano. Los FTF tienen una alta tasa de mutaciones, lo que conlleva la generación rápida de nuevos serotipos virales. Ello podría condicionar la aparición de nuevos virus o variantes más trasmisibles o más patógenos para el ser humano. Por otra parte, existe la posibilidad de introducción de nuevos virus de FTF a través de viajeros virémicos procedentes de otros continentes51. Es previsible que el aumento generalizado de las temperaturas que está experimentando el planeta, junto con los cambios en el uso del suelo, favorecerán que los flebótomos vayan colonizando regiones más septentrionales y también zonas con mayor altitud52. Los cambios demográficos y medioambientales pueden favorecer el contacto de los vectores con los seres humanos. La rápida transformación de zonas rurales y agrícolas en zonas urbanas, y el consiguiente abandono de las prácticas agrícolas, han dado paso a terrenos ecológicamente degradados donde podría proliferar el vector. El enorme desarrollo urbanístico en España y, en concreto, el incremento en el número de viviendas unifamiliares con jardín, que ha tenido lugar fundamentalmente alrededor de grandes urbes53, así como la modificación del entorno de las grandes ciudades creando amplios espacios verdes protegidos, incrementan las condiciones propicias para que el flebótomo se desarrolle en la proximidad del hábitat de los seres humanos. De forma general, la población española sería susceptible a la infección por FTF, si bien un pequeño porcentaje podría estar protegido por la presencia de anticuerpos generados en una exposición previa. La población con mayor riesgo de infección sería, obviamente, la que reside en zonas donde el vector es más abundante, sobre todo en las épocas del año en que las densidades son mayores y el vector está más activo.
Las infecciones por FTF cursan generalmente de forma asintomática y en ocasiones originan un síndrome febril autolimitado con una sintomatología similar a la gripe. Si tenemos en cuenta la gravedad de la enfermedad para medir el impacto, solamente el virus Toscana generaría cuadros graves: meningoencefalitis en general autolimitadas, aunque no exentas de complicaciones ocasionales. Sin embargo, hay razones para pensar que las infecciones por FTF, y en especial las causadas por virus Toscana, están infradiagnosticadas. Según los diferentes autores, la etiología de las meningitis asépticas quedaría sin un diagnóstico claro en un 40-60% de los casos, pudiendo llegar a ser de hasta el 81% según las series54-57. En España, se estima que el virus Toscana sería la casusa del 2,3-8% de las meningitis asépticas que quedan sin diagnóstico, según los estudios retrospectivos realizados en el contexto la investigación. Este escenario puede ser debido en parte al bajo grado de sospecha de los clínicos, pero también a que la prueba diagnóstica no está disponible en la mayoría de los centros sanitarios ni está incluida en los paneles diagnósticos de las meningitis asépticas.
Con los datos disponibles, el riesgo de transmisión de los FTF es moderado en las zonas cálidas y secas del país, y la costa mediterránea en los meses de verano y otoño, y bajo en el resto del territorio y en los meses fríos. La probabilidad de que se detecten casos sintomáticos por virus Toscana sería moderada y no se puede descartar que aparezcan en forma de brotes en lugares donde las densidades de flebótomos son más altas. Para el resto de FTF, esta probabilidad es muy baja, puesto que la mayoría de los casos serían asintomáticos. La ausencia de pruebas diagnósticas específicas para algunos de estos virus, junto con la escasa sospecha clínica entre los profesionales sanitarios en el momento actual, contribuye a que un gran porcentaje de casos no se detecten, dificultando de este modo la toma de medidas de control. Esto, a su vez, podría aumentar la probabilidad de transmisión. A pesar de que algunos casos de enfermedad por virus Toscana pueden ser graves, la mayoría no lo son, por lo que el impacto general de la enfermedad para la población española se considera bajo para Toscana y para el resto de los FTF muy bajo (fig. 1).
Evaluación de riesgo para la salud pública de los flebovirus transmitidos por flebótomos en territorios y condiciones climáticas favorables para el desarrollo y la actividad del vector.
Fuente: elaboración propia basada en el esquema de evaluación de riesgo del Centro Europeo de control de Enfermedades.
*T: estimación realizada únicamente para el virus Toscana.
Parece necesario aumentar el conocimiento científico sobre los FTF en España, para lo que resultaría importante incluir estos virus en los esquemas diagnósticos de los las meningitis asépticas en los laboratorios de microbiología, al menos en las zonas donde exista más riesgo. Para ello, habría que disponer de metodología diagnóstica específica para diferenciar los diferentes FTF, desarrollando nuevos métodos a nivel molecular y utilizando la técnica de neutralización del virus, debido al alto grado de reactividad cruzada existente a nivel serológico. Para el control de la densidad de vector, sería importante desarrollar estrategias dentro de las distintas administraciones con capacidad para realizar las actuaciones ambientales de modificación del hábitat del vector y la aplicación de insecticidas apropiados, pero siempre de forma selectiva. Actualmente, existe un Plan Nacional de Preparación y Respuesta frente a Enfermedades Transmitidas por Vectores, que debe ser ampliado para abarcar el control de los flebótomos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.