La hiperlipemia familiar combinada (HFC) es la dislipemia primaria más frecuente. Cursa con un fenotipo lipídico altamente aterógeno y, por ello, con aterosclerosis prematura. Su prevalencia en la población general de los países occidentales es del 1-2% y en el grupo de pacientes con cardiopatía isquémica precoz, del 20%1. Se caracteriza por el aumento tanto de las lipoproteínas ricas en triglicéridos como de los valores plasmáticos de apolipoproteína B. Su base molecular es la hiperproducción hepática de lipoproteínas de muy baja densidad (VLDL), que está causada por la gestión deficiente de los ácidos grasos libres en los tejidos periféricos. La HFC puede presentarse bajo 3 fenotipos distintos: a) elevación de lipoproteínas de baja densidad (LDL) o fenotipo IIA; b) elevación de VLDL o fenotipo IV, y c) aumento de ambas lipoproteínas, o fenotipo IIB. Es característico el cambio de fenotipo lipoproteínico del probando y sus familiares a lo largo del tiempo en función, fundamentalmente, de factores exógenos2.
La HFC constituye un modelo de resistencia a la insulina (RI)3 independientemente de la presencia o no de obesidad abdominal4 y del fenotipo lipoproteínico5, y presenta por ello una prevalencia aumentada de hiperinsulinismo, tolerancia anormal a la glucosa, glucemia alterada en ayunas, hipertensión y obesidad6.
En la población general con obesidad abdominal y RI se han identificado un estado proinflamatorio y un aumento del estrés oxidativo, descrito en estudios realizados en humanos y animales7,8.
El proceso inflamatorio desempeña un papel fundamental en el inicio y la progresión de la arteriosclerosis. La secreción de moléculas inflamatorias y la generación de estrés oxidativo por parte de los macrófagos activados en el espacio endotelial contribuyen al crecimiento de la placa de ateroma y a su posterior complicación9,10. Los factores de riesgo metabólicos (dislipemia, disglucemia, hiperinsulinismo y RI), al estimular todo el proceso, favorecen la enfermedad cardiovascular11.
La generación de especies reactivas de oxígeno puede producir daño celular en diversos componentes, entre ellos el ADN. Durante los procesos de oxidación se produce 8-oxo-7,8-dihidrodesoxiguanosina trifosfato (8-oxo-dGTP), el cual modifica las bases en el ADN y genera 8-oxo-7,8-dihidro-2'-desoxiguanosina (8-oxo-dG), que se considera un sustrato mutágeno importante para la replicación del ADN12. De este modo, 8-oxo-dG es un marcador de daño del ADN nuclear y mitocondrial mediado por las especies reactivas de oxígeno y por el estrés oxidativo13-15.
La hipótesis que planteamos en este trabajo es que en la HFC, como modelo de dislipemia mixta con RI y cardiopatía isquémica precoz, los valores de 8-oxo-dG deben de estar aumentados. El objetivo es comparar los valores de 8-oxo-dG, como indicador de la situación de estrés oxidativo, entre personas sanas y pacientes con HFC, y estudiar su relación con parámetros clínico-biológicos de RI.
Sujetos y método
Sujetos
Hemos estudiado por muestreo consecutivo a 40 pacientes (15 mujeres y 25 varones) con diagnóstico de HFC procedentes de nuestra unidad. Su intervalo de edad fue de 31 a 62 años, y su índice de masa corporal (IMC), entre 18,8 y 34,8. Se estudió también a 20 voluntarios sanos (8 mujeres y 12 varones) normolipémicos y no diabéticos (intervalo de edad de 24 a 64 años; IMC entre 20,1 y 34,8), que formaban parte del personal hospital y a los que se seleccionó de forma consecutiva.
Los criterios diagnósticos de HFC fueron: dislipemia, con concentraciones de colesterol total y triglicéridos mayores del percentil 90 (colesterol total $ 5,16 mmol/l; triglicéridos $ 1,71 mmol/l, o ambos); valores de apolipoproteína B de 1,2 g/l o superiores, e historia familiar con patrón autosómico dominante de una dislipemia con fenotipo lipoproteínico múltiple (IIa, IIb o IV). Los criterios de inclusión para el grupo control fueron: concentración de colesterol total menor de 5,16 mmol/l; cifra de triglicéridos inferior a 1,71 mmol/l y de apolipoproteína B menor de 1,2 g/l; glucosa en ayunas inferior a 7 mmol/l, y ausencia de antecedentes personales o familiares de dislipemia o enfermedad cardiovascular prematura. En ambos grupos se exigió una edad entre 18 y 65 años y se incluyó a personas de ambos sexos.
Los criterios de exclusión fueron: obesidad grave (IMC $ 35), fluctuaciones ponderales superiores al 10% del peso corporal total en los últimos 3 meses, seguimiento de dietas hipocalóricas para adelgazar, medicación hipolipemiante o cualquier fármaco capaz de modificar la glucosa, insulina o lípidos plasmáticos, así como fármacos que modifiquen el estrés oxidativo y la inflamación, y cuya administración no pudiera interrumpirse 6 semanas antes de iniciar el estudio; ingesta de alcohol de 30 g/día o superior, hábito tabáquico (ex fumador desde hacía menos de un año), valores de tirotropina superiores a 5 mU/ml, enfermedad hepática avanzada (con insuficiencia hepática), colestasis definida por valores de gammaglutamil transpeptidasa por encima de 32 mU/ml, bilirrubina directa mayor de 0,2 mg/dl y cifra de fosfatasas alcalinas superior a 250 mU/ml (valores máximos del intervalo de la normalidad de nuestro laboratorio), creatinina sérica por encima de 196 mmol/l, embarazo o lactancia hasta los 3 meses posteriores, enfermedad neoplásica metastásica, diabetes, hipertensión arterial, paciente en prevención secundaria (infarto agudo de miocardio, angina de pecho con test de esfuerzo positivo, angioplastia transluminal o derivación aortocoronaria, accidente cerebrovascular agudo) y cualquier infección contraída en las 6 semanas previas al estudio.
El estudio recibió la aprobación del Comité Ético de nuestro hospital y los participantes dieron su consentimiento por escrito.
Método
Se diseñó un estudio de casos y controles. Todas las mediciones fueron realizadas por el mismo investigador. En ambos grupos se recogieron parámetros clínicos, antropométricos y bioquímicos.
Parámetros clínicos. Se realizó una anamnesis detallada en la que se prestó especial atención al hábito tabáquico (número de cigarrillos/día; en el caso de los ex fumadores, se anotaron, además del número de cigarrillos/día, el número de años que habían fumado y el año en que dejaron de fumar), consumo de alcohol (g/día), ejercicio físico (min/semana) y fármacos de consumo habitual u ocasional que coincidie sen con el período de estudio. En los casos de HFC se registraron los años de evolución de la dislipemia y episodios cardiovasculares presentados hasta la fecha de inclusión en el estudio. La presión arterial se determinó con un esfigmomanómetro de mercurio tras 10 min de reposo en decúbito supino; se anotó el valor medio de 3 mediciones separadas por 5 min.
Parámetros antropométricos. Se recogieron los siguientes: peso (kg), estatura (m), IMC (kg/m2) y perímetro de la cintura, medido en el punto medio entre la espina ilíaca anterosuperior y el margen costal inferior. Para la medición se utiliza una cinta métrica graduada en centímetros y el sujeto se halla bipedestación y con los brazos en posición anatómica16.
Parámetros bioquímicos. El análisis se realizó tras 12 h de ayuno nocturno y sin medicación hipolipemiante (período de lavado de 6 semanas). Se efectuaron determinaciones plasmáticas por métodos enzimáticos de colesterol total17, triglicéridos18, colesterol unido a lipoproteínas de alta densidad (cHDL) tras precipitación con ácido fosfotúngstico-cloruro de magnesio19 y colesterol unido a LDL (cLDL; calculado por la fórmula de Friedewald). La apolipoproteína B se determinó por inmunoturbidimetría20. La determinación de glucosa se realizó por método enzimático21 y la de insulina plasmática, por enzimoinmunoanálisis22.
Para la determinación de 8-oxo-dG, la sangre se recogió en tubos heparinizados y se conservó en frío (4 oC) para su inmediato procesamiento. La cuantificación de la base mutágena 8-oxo-dG se realizó por cromatografía líquida de alta resolución (HPLC) y detección electroquímica en conexión en serie con detector UV para establecer la relación 8-oxo-dG/dG a partir de ADN genómico extraído de los linfocitos, en las condiciones descritas por Oltra et al23. Para la separación de 8-oxo-dG se utilizó el modelo Waters 515 HPLC. Dicha separación se llevó a cabo usando una columna Spherisorb ODS2 de 5 mm (4,6 3 250 mm), con una tasa de flujo de 1 ml/min. El tampón para 8-oxo-dG fueron 50 mmol/l de fosfato potásico con pH de 5,1 en un 5% de acetonitrilo, y la duración fue de 7,5 min. El evaluador de la determinación de 8-oxo-dG desconocía si las muestras procedían de controles o de pacientes con HFC.
Análisis estadístico
Las variables cuantitativas se expresan como media (desviación estándar) y las cualitativas como porcentajes o número total. Para la comparación de las variables cuantitativas entre grupos se utilizó la prueba de ANOVA. Para corregir factores de confusión se aplicó el análisis por ANCOVA. Las variables de confusión introducidas para la comparación entre grupos fueron la edad, el sexo y la cintura. Para la comparación de las variables cualitativas entre grupos se empleó el test de la x2 o el test de Fisher cuando la número era inferior a 5.
Las correlaciones bivariadas entre variables se estudiaron con la prueba de Pearson. También se analizó la correlación multivariada mediante regresión lineal, siendo la variable dependiente 8-oxo-dG e introduciendo en el modelo las variables que habían mostrado significación en el estudio de correlación simple.
Resultados
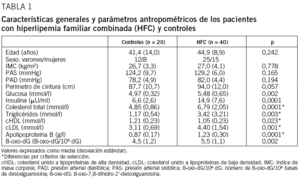
Las características generales, medidas antropométricas y parámetros bioquímicos de ambos grupos se recogen en la tabla 1. Al comparar a los afectados de HFC con los controles no encontramos diferencias estadísticamente significativas en la edad, el sexo y el IMC ni en el perímetro de la cintura. No observamos diferencias significativas en las cifras de presión arterial. Por los criterios de selección, hubo diferencias en los parámetros lipídicos: colesterol total, triglicéridos, cLDL, cHDL y apolipoproteína B.
Encontramos diferencias significativas en los valores de glucosa e insulina plasmática, que fueron mayores en el grupo de HFC: glucosa plasmática media (desviación estándar) de 4,97 (0,32) y 5,48 (0,65) mmol/l en controles y HFC, respectivamente (p = 0,002); insulina plasmática media de 6,6 (2,6) y 14,9 (7,6) mU/l en controles y HFC, respectivamente (p = 0,0001). Estas diferencias significativas se mantuvieron al corregir las variables por el perímetro de la cintura.
Los valores medios de 8-oxo-dG fueron significativamente mayores en los pacientes con HFC respecto a los controles: 5,5 (1,1) y 4,5 (1,2), respectivamente (p = 0,002). Estas diferencias se mantuvieron al corregir por el perímetro de la cintura.
En la tabla 2 se muestran las correlaciones (r de Pearson) en el grupo de pacientes con HFC entre 8-oxo-dG y las variables relacionadas con la RI (perímetro de cintura, glucosa, insulina, cHDL y triglicéridos). Se encontró una relación estadísticamente significativa y positiva de 8-oxo-dG con la insulina y los triglicéridos, y negativa con el cHDL.
El estudio de regresión lineal múltiple recogido en la tabla 2 mostró una relación estadísticamente significativa en los pacientes con HFC entre los valores de 8-oxo-dG y los de insulina, sin que se encontrara significación estadística con los triglicéridos y el cHDL. Por lo tanto, la insulina predice de forma independiente los valores de 8-oxo-dG.
Discusión
En el estudio se ha utilizado la HFC como dislipemia mixta primaria, que sirve de modelo de RI y cardiopatía isquémica precoz. Los factores que confluyen en la HFC (hiperlipemia, hiperinsulinismo, disglucemia, hipertensión y obesidad) son proinflamatorios, y en la última década la relación entre el proceso inflamatorio y la enfermedad cardiovascular ha quedado estrechamente establecida, como lo demuestra el crecimiento exponencial del número de publicaciones sobre este campo, hasta el punto de considerar la arteriosclerosis una enfermedad inflamatoria24. Además, se propone el estrés oxidativo como el mecanismo patogénico que enlaza la RI con la disfunción endotelial y la enfermedad cardiovascular13.
En este trabajo hemos observado que los pacientes con HFC presentan valores de 8-oxo-dG significativamente mayores que el grupo control, con independencia del grado y tipo de obesidad. La 8-oxo-dG se ha usado como indicador del estrés oxidativo intracelular y es un marcador de daño del ADN, tanto nuclear como mitocondrial, mediado por las especies reactivas de oxígeno en placas arterioscleróticas en humanos25 y en pacientes con insuficiencia cardíaca26. Así, el hecho de que los valores de 8-oxo-dG sean superiores en los pacientes con HFC respecto a los controles pone de manifiesto que en los primeros, en el medio intracelular, y concretamente en el ADN, hay un desequilibrio entre los sistemas prooxidantes y antioxidantes que genera un exceso de producción de especies reactivas de oxígeno, las cuales actúan de forma indirecta activando el proceso inflamatorio, con la consiguiente disfunción endotelial, y directamente generan un proceso oxidativo sistémico que también conduce a la disfunción endotelial.
Cabría pensar que la presencia de unos valores más elevados de 8-oxo-dG en los pacientes con HFC podría deberse a la aglutinación en ellos de factores de riesgo clásicos aumento de LDL, VLDL, triglicéridos y apolipoproteína B, disglucemia, RI, obesidad e hipertensión, que actuarían como factores estimulantes de la reacción inflamatoria y generarían estrés oxidativo27. Sin embargo, al estudiar la relación de la 8-oxo-dG con parámetros clínico-biológicos de RI y otros factores de riesgo cardiovascular, en los pacientes con HFC se observó una relación significativa positiva de 8-oxo-dG con la insulina y los triglicéridos, y una relación negativa con el cHDL. El estudio multivariante mostró que sólo la insulinemia en pacientes con HFC predice el estrés oxidativo (8-oxo-dG). En personas con RI, como son los pacientes con diabetes, se han encontrado resultados similares, de forma que los valores de 8-oxo-dG se han relacionado con las concentraciones de insulina8,11,28,29.
Los factores de riesgo clásicos no explican totalmente el exceso de riesgo cardiovascular de los pacientes con HFC. En éstos, la inflamación de bajo grado crónicamente mantenida y la producción aumentada de estrés oxidativo podrían contribuir a explicar la mayor disfunción endotelial y, en consecuencia, el riesgo aumentado de aterosclerosis prematura30.
En el futuro podría ser recomendable valorar la utilidad de incorporar marcadores de estrés oxidativo como la 8-oxo-dG a los factores de riesgo clásicos a la hora de establecer con mayor precisión la estratificación del riesgo cardiovascular. De forma similar, se han llevado a cabo estudios para evaluar la utilidad de la determinación de las concentraciones de un marcador inflamatorio, la proteína C reactiva de alta sensibilidad, como factor de riesgo de enfermedad cardiovascular en diversos planos: mortalidad en pacientes fumadores de alto riesgo31, relación con el riesgo en varones32 y mujeres33 aparentemente sanos y en ancianos34, predicción de enfermedad cardiovascular en mujeres35, riesgo de enfermedad coronaria36,37 y relación con la mortalidad total, mortalidad cardiovascular y factores de riesgo cardiovascular en varones38. Un estudio prospectivo y metaanálisis mostró una asociación significativa entre los valores basales de diversos marcadores de inflamación crónica y el riesgo de enfermedad coronaria39.
En resumen, los pacientes con HFC, que constituye un modelo de dislipemia mixta con RI, presentan valores de 8-oxo-dG significativamente mayores que los controles, tras corregir por el perímetro de la cintura. En estos pacientes se observa una relación positiva, independiente y significativa de 8-oxo-dG con la insulinemia. La asociación entre insulinemia y estrés oxidativo podría explicar en parte el aumento de riesgo cardiovascular en estos pacientes. Para confirmar esta hipótesis deben realizarse estudios prospectivos con la intención de valorar la utilidad de marcadores de oxidación como la 8-oxo-dG a la hora de complementar la estratificación del riesgo cardiovascular.