En el cáncer de mama hormonosensible, HER-2 negativo, con ganglios negativos, la presencia de un riesgo genómico bajo permite tratar solo con hormonoterapia adyuvante, obteniendo unas excelentes tasas de supervivencia. La justificación de este estudio es demostrar que también se obtienen unas excelentes tasas de supervivencia tratando solo con hormonoterapia adyuvante mediante la evaluación del riesgo clínico.
Pacientes y métodosEstudio descriptivo, observacional y retrospectivo entre 2006 y 2016 de la cohorte de cáncer de mama hormonosensible, HER-2 negativo, con ganglios negativos, tamaño del tumor mayor de 1cm o entre 0,6 y 1cm con características desfavorables. Revisión retrospectiva de los registros de salud. Datos de mortalidad del Registro Nacional de Defunciones.
ResultadosUn total de 203 pacientes fueron evaluables para la supervivencia. Ciento veintitrés (60,50%) fueron tratadas solo con hormonoterapia adyuvante, 77 (37,90%) con quimioterapia-hormonoterapia, una (0.50%) solo con quimioterapia y 2 (1%) no recibieron ningún tratamiento. La tasa de supervivencia global a los 5 años fue del 97% (intervalo de confianza [IC] del 95% 94-100). La tasa de intervalo libre de metástasis a distancia fue del 94% (IC 95% 90-98). En el subgrupo de pacientes tratadas solo con hormonoterapia la tasa de supervivencia global y del intervalo libre de metástasis a distancia a los 5 años fue del 98% (IC 95% 95-100) y 97% (IC 95% 93-100), respectivamente.
ConclusionesLas pacientes con cáncer de mama hormonosensible, HER-2-negativo, con ganglios negativos, tratadas solo con hormonoterapia según su riesgo clínico, obtienen resultados de supervivencia similares a los descritos cuando son tratadas solo con hormonoterapia según su riesgo genómico.
In endocrine-sensitive, HER-2 negative, node negative breast cancer, the presence of a low genomic risk allows treatment with adjuvant endocrine therapy alone, obtaining excellent survival rates. The justification for this study is to show that excellent survival rates are also obtained by treating with adjuvant hormone therapy alone, based on clinical risk assessment.
Patients and methodsA descriptive, observational and retrospective study was performed between 2006 and 2016 with endocrine-sensitive, HER-2 negative, node negative breast cancer, greater than 1cm or between 0.6 and 1cm with unfavourable features. Retrospective review of health records. Mortality data of the National Registry of Deaths.
ResultsA total of 203 patients were evaluable for survival. One hundred and twenty-three (60.50%) were treated with adjuvant endocrine therapy alone, 77 (37.90%) with chemotherapy and endocrine therapy, one (0.50%) with chemotherapy alone and 2 (1%) were not treated. The overall survival rate at 5 years was 97% (95% confidence interval [CI] 94-100). Distant recurrence-free interval was 94% (95% CI 90-98). In the subgroup of patients treated with endocrine therapy alone, overall survival and distant recurrence-free interval rates at 5 years were 98% (95% CI 95-100) and 97% (95% CI 93-100), respectively.
ConclusionsPatients with endocrine-sensitive, HER-2-negative, node negative breast cancer treated with endocrine therapy alone according to their clinical risk have similar survival outcomes as those treated with endocrine therapy according to their genomic risk.
En el cáncer de mama precoz los factores pronósticos y predictivos son tenidos en cuenta en las guías clínicas o son incluidos en algoritmos multivariantes para la toma de decisiones acerca del tratamiento sistémico adyuvante. Como ejemplos, el consenso de St. Gallen, la guía del National Comprehensive Cancer Network –NCCN– o la de la American Society of Clinical Oncology –ASCO–1–3, y la herramienta Adjuvant! Online4.
La tecnología del ADN ha contribuido a mejorar nuestro conocimiento del cáncer de mama5. Ha proporcionado pruebas directas que demuestran que el cáncer de mama es una enfermedad heterogénea desde el punto de vista molecular6. Además, esta tecnología ha generado el desarrollo de una taxonomía molecular y de firmas genómicas pronósticas, muchas de las cuales han sido aprobadas hace años por las agencias reguladoras y autorizadas en Andalucía desde hace algo más de un año7–12.
La primera generación de firmas genómicas tiene capacidad discriminatoria en el cáncer de mama con receptores de estrógenos positivos, donde la proliferación es posiblemente el determinante principal del pronóstico y de los resultados del tratamiento13. OncotypeDX (21-gene signature) ha mostrado poseer significación pronóstica en el cáncer de mama con receptores de estrógenos positivos e identifica a aquellas pacientes que más probablemente se beneficiarán de la quimioterapia9,14–16. A pesar de dicha contribución, la información pronóstica proporcionada por OncotypeDX debería ser usada junto con los factores clinicopatológicos clásicos.
En una cohorte específica de mujeres con cáncer de mama hormonosensible, HER-2 negativo y con ganglios negativos, con un tamaño mayor de 1,1cm o entre 0,6 y 1cm si el grado era intermedio o alto (criterios para indicar quimioterapia según la guía NCCN), incluidas en el ensayo TAILORx17, no se ofreció quimioterapia adyuvante siempre que la puntuación de OncotypeDX se situara entre 0 y 10 (riesgo genómico bajo), siendo tratadas solo con hormonoterapia. En este estudio de 1.626 mujeres, la tasa de supervivencia global (SG) fue del 98%, la de supervivencia libre de enfermedad invasiva (SLEI), del 93,8%, y la de intervalo libre de enfermedad a distancia, del 99,3%. Los autores concluyeron que este subgrupo de pacientes puede ser tratado solo con hormonoterapia basándose en el riesgo genómico17. En otro estudio observacional prospectivo, 124 pacientes con cáncer de mama hormonosensible, HER-2 negativo y con ganglios negativos fueron clasificadas de bajo riesgo genómico mediante 70-gene signature, pero de alto riesgo clinicopatológico. De ellas, el 76% no recibió quimioterapia adyuvante y el 98% sobrevivió 5 años sin reaparición de la enfermedad18. Por último, los recientes resultados del ensayo clínico Mindact19 proporcionan pruebas de que las mujeres con cáncer de mama hormonosensible y HER-2 negativo con bajo riesgo genómico pueden evitar la quimioterapia sin perder supervivencia, aunque el riesgo clínico sea alto.
Las pacientes con cáncer de mama hormonosensible, HER-2 negativo y con ganglios negativos, con un tamaño del tumor mayor de 1,1cm o entre 0,6 y 1cm con grado intermedio o alto, tratadas solo con hormonoterapia, sin quimioterapia, según los factores pronósticos clásicos, la comorbilidad y la decisión de la paciente, tendrían, según nuestra hipótesis, tasas de supervivencia equiparables a las obtenidas por las pacientes tratadas solo con hormonoterapia, sin quimioterapia, según el riesgo genómico. La revisión retrospectiva de los resultados de salud de este subgrupo de pacientes ofrece una oportunidad única para reafirmar que la pronosticación con los factores clásicos es en nuestro medio tan útil como la pronosticación con las firmas genómicas.
Pacientes y métodosSe trata de un estudio descriptivo, observacional, retrospectivo, unicéntrico, realizado en el Servicio de Oncología Médica de un hospital universitario. Fue registrado en la página web de la Agencia Española de Medicamentos y Productos Sanitarios con el código JBC-TRA-2016-02. Se obtuvo el preceptivo informe favorable del Comité de Ética de la Investigación.
Se seleccionó la cohorte atendida en el centro en los últimos 10 años (1 de enero de 2006 a 31 de diciembre de 2015). Se identificaron las pacientes de la base de datos del Servicio de Oncología Médica. Se recogieron de forma retrospectiva los datos relacionados con las pacientes y con el tratamiento recibido de las historias de salud de Oncología Médica. Para conocer el estado vital y la fecha de fallecimiento de las pacientes se consultó el Índice Nacional de Defunciones.
Pacientes intervenidas quirúrgicamente por carcinoma infiltrante de mama con receptores de estrógenos y/o progesterona positivos, HER-2 negativo y ganglios negativos para metástasis, con un tamaño tumoral igual o mayor de 1,1cm o entre 0,6 y 1cm si el grado histológico era intermedio o alto (con indicación de quimioterapia adyuvante según la guía de práctica clínica NCCN), fueron aptas para incluir en el estudio. Podían haber sido tratadas con hormonoterapia, con hormonoterapia más quimioterapia o con abstención de tratamiento sistémico adyuvante.
Las variables independientes analizadas relacionadas con la paciente fueron: edad, sexo, capacidad funcional (medida por la escala del Eastern Collaborative Oncology Group)20, estado menopáusico y comorbilidad (medida por la escala de Charlson)21. Las variables independientes analizadas relacionadas con el tumor mamario fueron: tamaño tumoral, estadio patológico, grado histológico, tipo histológico y estado de los receptores de estrógenos y progesterona (se consideraron positivos si la expresión inmunohistoquímica era igual o superior al 1%). Las variables independientes relacionadas con el tratamiento fueron: tipo de cirugía, tipo de tratamiento hormonal adyuvante y tipo de tratamiento quimioterápico adyuvante.
Las variables dependientes analizadas fueron: SG, SLEI e intervalo libre de metástasis a distancia (ILMD)22. La SG se calculó midiendo el intervalo entre la cirugía y uno de los siguientes sucesos: muerte por cáncer de mama, muerte por cualquier otra causa diferente al cáncer de mama y muerte por una causa desconocida. La SLEI se calculó midiendo el intervalo entre la cirugía y uno de los siguientes sucesos: recidiva infiltrante local homolateral, recidiva infiltrante local o regional, metástasis a distancia, muerte por cáncer de mama, muerte por cualquier otra causa diferente al cáncer de mama, muerte por una causa desconocida, carcinoma de mama infiltrante contralateral y cáncer invasivo no mamario. El ILMD se calculó midiendo el intervalo entre la cirugía y uno de los siguientes sucesos: metástasis a distancia y muerte por cáncer de mama22.
Como se trata de un estudio retrospectivo, se incluyeron todas las pacientes de los últimos 10 años. Con una precisión de un 3% y una potencia de estudio de un 80%, suponiendo que la supervivencia sea superior al 95%, se estimó en unas 200 pacientes las que debían incluirse en el estudio.
Se realizó un análisis descriptivo de las variables. Para las cualitativas se utilizó la frecuencia absoluta y relativa, y para las cuantitativas, la media, la mediana y la desviación estándar. Para la comparación de variables cualitativas se aplicó el test de la chi cuadrado con corrección de Fisher, y para variables cuantitativas, el test de la t-Student. Para el cálculo de la supervivencia se utilizó el método de Kaplan-Meier, y el test de Log-Rank fue empleado para comparar las curvas de supervivencia. Para el análisis estadístico de los datos se utilizó el programa SPSS® versión 15. En el análisis estadístico se consideró p<0,05 para indicar significación estadística.
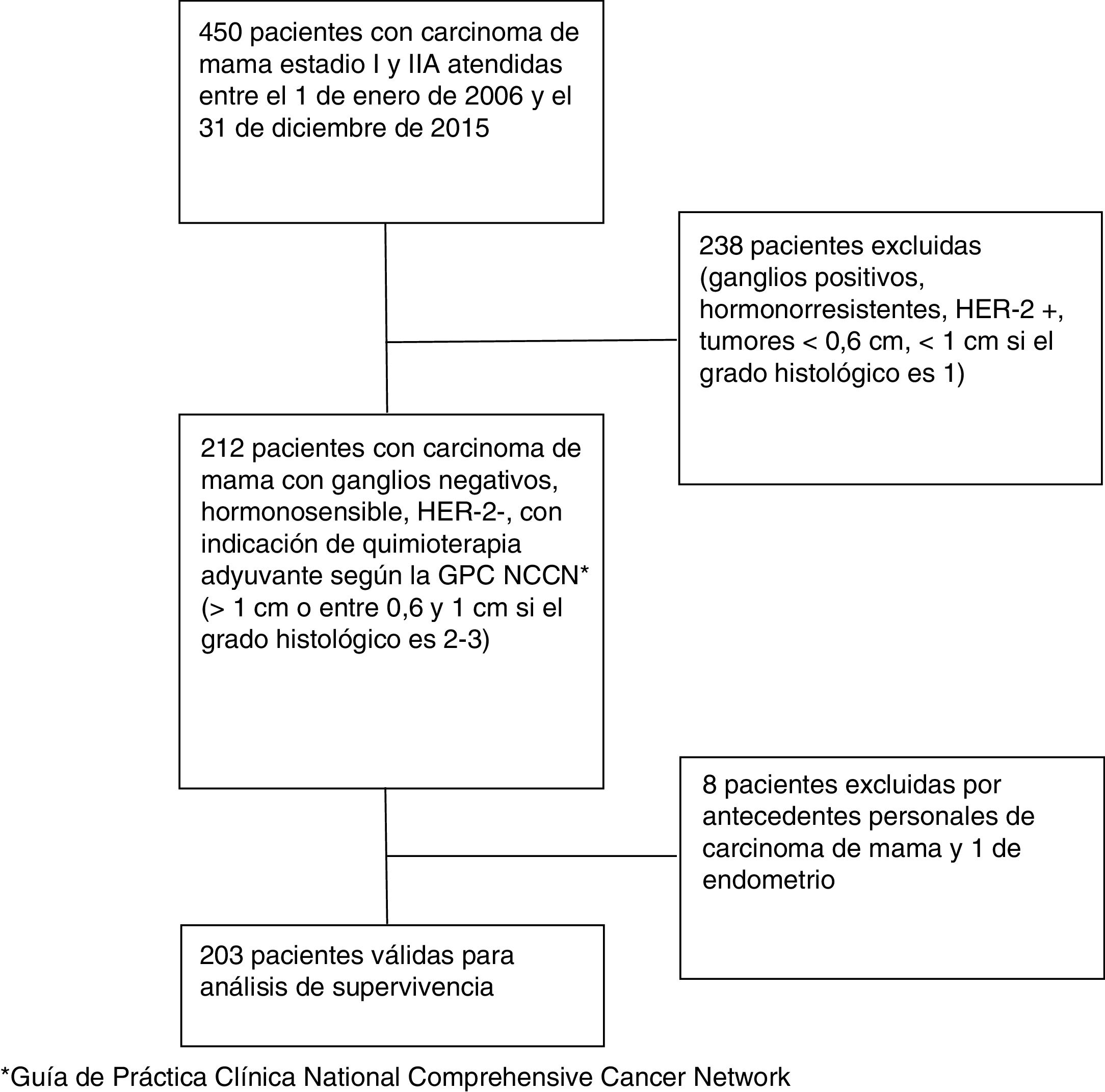
ResultadosSe revisaron las historias de salud de 450 pacientes con carcinoma de mama en estadio i y iiA. De ellas, 238 pacientes fueron excluidas por presentar ganglios positivos, ser hormonorresistentes o HER-2 positivo, por tener tumores menores de 0,6cm o por tener tumores menores de 1cm con grado histológico 1. Quedaron 212 pacientes con carcinoma de mama con ganglios negativos, hormonosensible, HER-2 negativo, mayor de 1cm o entre 0,6 y 1cm si el grado histológico era 2 o 3. De estas, 8 pacientes fueron excluidas por tener antecedentes personales de carcinoma de mama y una de endometrio. Finalmente, 203 pacientes eran válidas para el análisis de supervivencia (fig. 1).
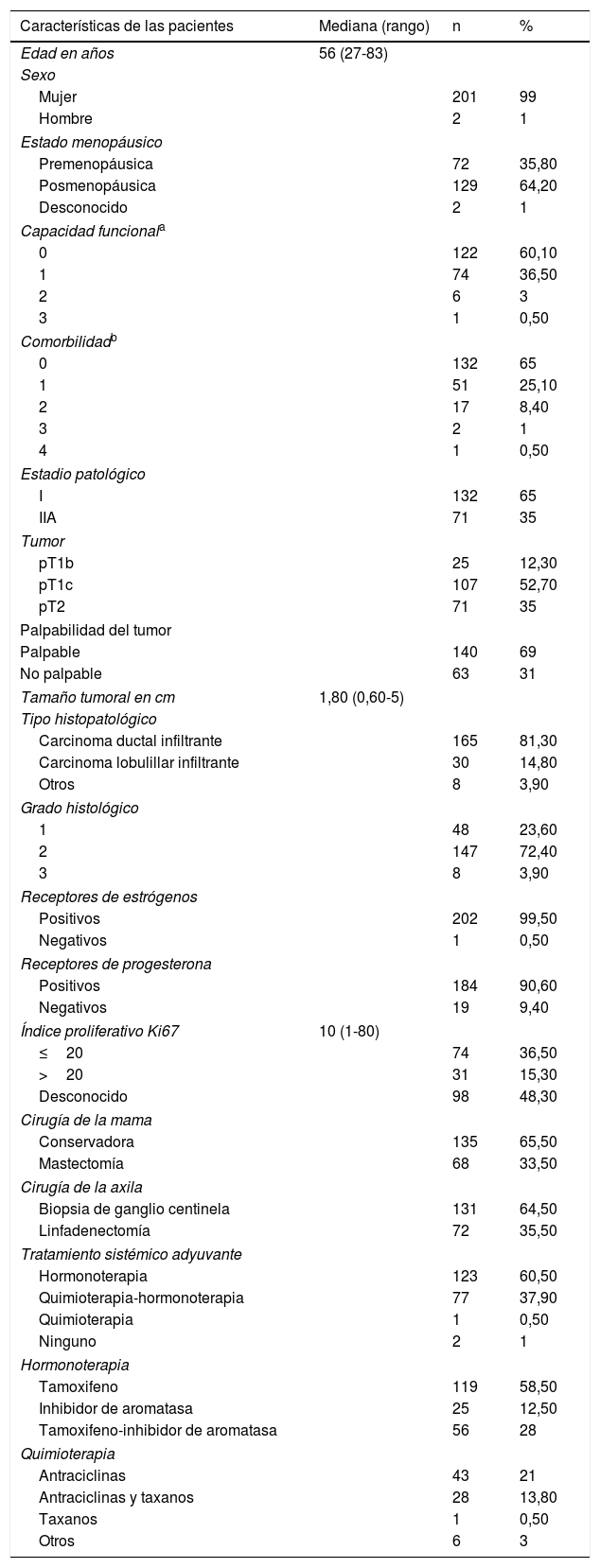
La información sobre las características de las pacientes está resumida en la tabla 1.
Características de las 203 pacientes
| Características de las pacientes | Mediana (rango) | n | % |
|---|---|---|---|
| Edad en años | 56 (27-83) | ||
| Sexo | |||
| Mujer | 201 | 99 | |
| Hombre | 2 | 1 | |
| Estado menopáusico | |||
| Premenopáusica | 72 | 35,80 | |
| Posmenopáusica | 129 | 64,20 | |
| Desconocido | 2 | 1 | |
| Capacidad funcionala | |||
| 0 | 122 | 60,10 | |
| 1 | 74 | 36,50 | |
| 2 | 6 | 3 | |
| 3 | 1 | 0,50 | |
| Comorbilidadb | |||
| 0 | 132 | 65 | |
| 1 | 51 | 25,10 | |
| 2 | 17 | 8,40 | |
| 3 | 2 | 1 | |
| 4 | 1 | 0,50 | |
| Estadio patológico | |||
| I | 132 | 65 | |
| IIA | 71 | 35 | |
| Tumor | |||
| pT1b | 25 | 12,30 | |
| pT1c | 107 | 52,70 | |
| pT2 | 71 | 35 | |
| Palpabilidad del tumor | |||
| Palpable | 140 | 69 | |
| No palpable | 63 | 31 | |
| Tamaño tumoral en cm | 1,80 (0,60-5) | ||
| Tipo histopatológico | |||
| Carcinoma ductal infiltrante | 165 | 81,30 | |
| Carcinoma lobulillar infiltrante | 30 | 14,80 | |
| Otros | 8 | 3,90 | |
| Grado histológico | |||
| 1 | 48 | 23,60 | |
| 2 | 147 | 72,40 | |
| 3 | 8 | 3,90 | |
| Receptores de estrógenos | |||
| Positivos | 202 | 99,50 | |
| Negativos | 1 | 0,50 | |
| Receptores de progesterona | |||
| Positivos | 184 | 90,60 | |
| Negativos | 19 | 9,40 | |
| Índice proliferativo Ki67 | 10 (1-80) | ||
| ≤20 | 74 | 36,50 | |
| >20 | 31 | 15,30 | |
| Desconocido | 98 | 48,30 | |
| Cirugía de la mama | |||
| Conservadora | 135 | 65,50 | |
| Mastectomía | 68 | 33,50 | |
| Cirugía de la axila | |||
| Biopsia de ganglio centinela | 131 | 64,50 | |
| Linfadenectomía | 72 | 35,50 | |
| Tratamiento sistémico adyuvante | |||
| Hormonoterapia | 123 | 60,50 | |
| Quimioterapia-hormonoterapia | 77 | 37,90 | |
| Quimioterapia | 1 | 0,50 | |
| Ninguno | 2 | 1 | |
| Hormonoterapia | |||
| Tamoxifeno | 119 | 58,50 | |
| Inhibidor de aromatasa | 25 | 12,50 | |
| Tamoxifeno-inhibidor de aromatasa | 56 | 28 | |
| Quimioterapia | |||
| Antraciclinas | 43 | 21 | |
| Antraciclinas y taxanos | 28 | 13,80 | |
| Taxanos | 1 | 0,50 | |
| Otros | 6 | 3 | |
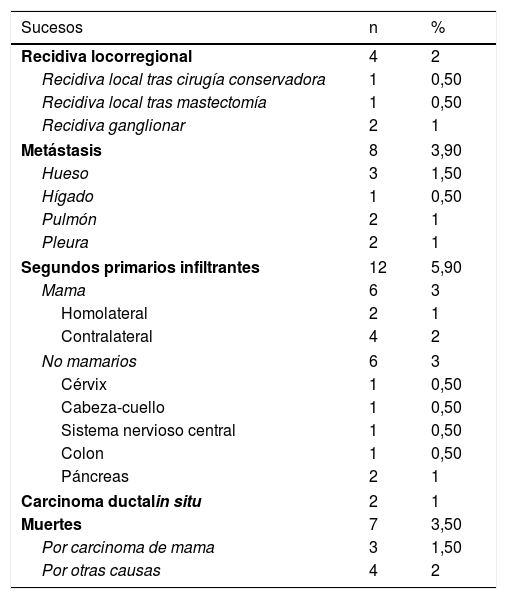
La mediana de seguimiento de las pacientes fue de 53 meses (rango 2-127 meses). En este tiempo sucedieron diferentes acontecimientos, que están recogidos en la tabla 2.
Sucesos en las 203 pacientes
| Sucesos | n | % |
|---|---|---|
| Recidiva locorregional | 4 | 2 |
| Recidiva local tras cirugía conservadora | 1 | 0,50 |
| Recidiva local tras mastectomía | 1 | 0,50 |
| Recidiva ganglionar | 2 | 1 |
| Metástasis | 8 | 3,90 |
| Hueso | 3 | 1,50 |
| Hígado | 1 | 0,50 |
| Pulmón | 2 | 1 |
| Pleura | 2 | 1 |
| Segundos primarios infiltrantes | 12 | 5,90 |
| Mama | 6 | 3 |
| Homolateral | 2 | 1 |
| Contralateral | 4 | 2 |
| No mamarios | 6 | 3 |
| Cérvix | 1 | 0,50 |
| Cabeza-cuello | 1 | 0,50 |
| Sistema nervioso central | 1 | 0,50 |
| Colon | 1 | 0,50 |
| Páncreas | 2 | 1 |
| Carcinoma ductalin situ | 2 | 1 |
| Muertes | 7 | 3,50 |
| Por carcinoma de mama | 3 | 1,50 |
| Por otras causas | 4 | 2 |
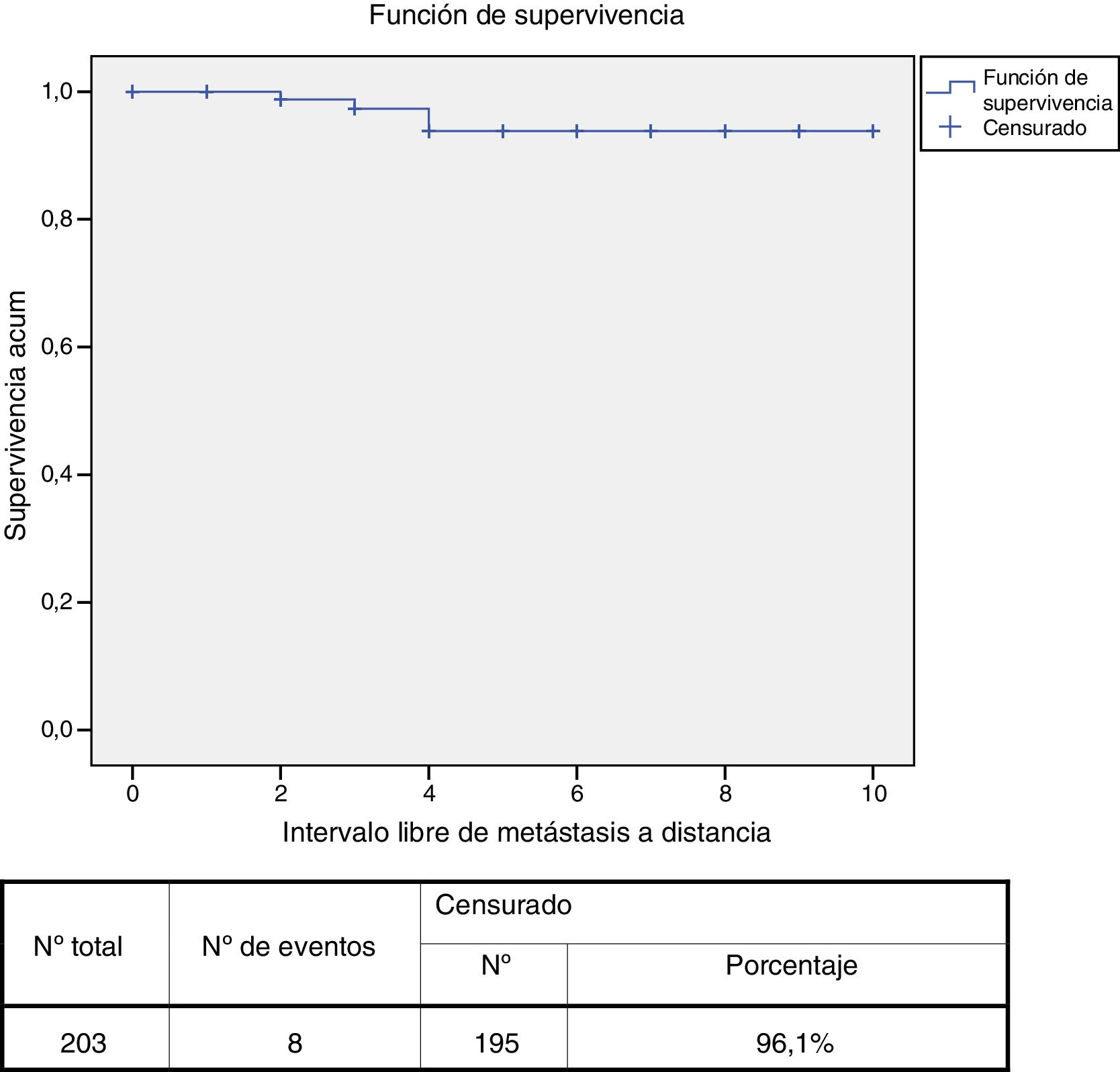
En ningún caso se alcanzó la mediana de tiempo de supervivencia por falta de sucesos. La SG a los 5 años fue del 97% (intervalo de confianza para el 95% [IC 95%] 94-100) y del 90% (IC 95% 83-97) a los 10 años. La SLEI a los 5 años fue del 85% (IC 95% 79-92) y a los 10 años del 75% (IC 95% 64-86). El ILMD a los 5 y a los 10 años fue el mismo: 94% (IC 95% 90-98) (fig. 2).
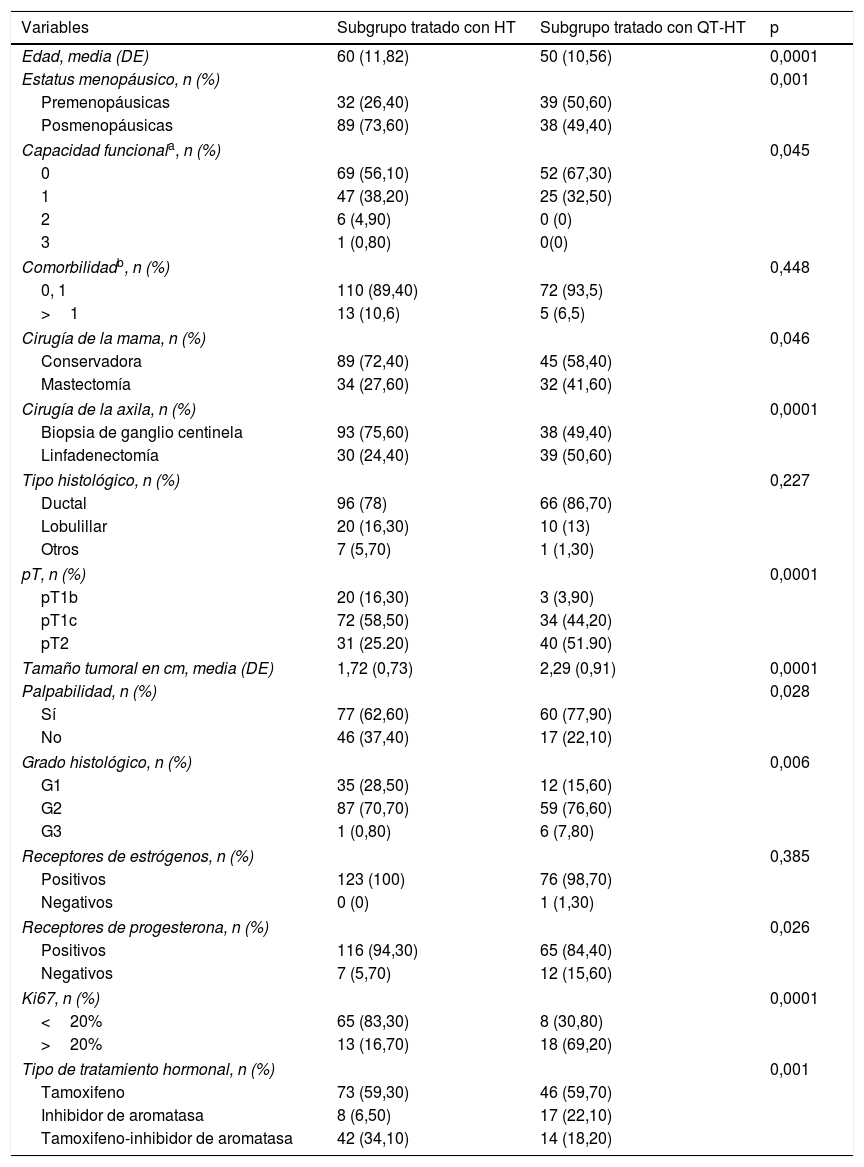
Las mujeres tratadas solo con hormonoterapia eran mayores, con más frecuencia posmenopáusicas, con peor capacidad funcional, con mayor frecuencia operadas mediante cirugía conservadora y biopsia de ganglio centinela por tumores más pequeños, con más frecuencia no palpables, de grado histológico más bajo, con menor negatividad de receptores de progesterona y con menor índice proliferativo Ki67 que las mujeres tratadas con quimioterapia-hormonoterapia (tabla 3).
Características de las 123 pacientes tratadas solo con hormonoterapia adyuvante y de las 77 pacientes tratadas con tratamiento combinado de quimioterapia y hormonoterapia
| Variables | Subgrupo tratado con HT | Subgrupo tratado con QT-HT | p |
|---|---|---|---|
| Edad, media (DE) | 60 (11,82) | 50 (10,56) | 0,0001 |
| Estatus menopáusico, n (%) | 0,001 | ||
| Premenopáusicas | 32 (26,40) | 39 (50,60) | |
| Posmenopáusicas | 89 (73,60) | 38 (49,40) | |
| Capacidad funcionala, n (%) | 0,045 | ||
| 0 | 69 (56,10) | 52 (67,30) | |
| 1 | 47 (38,20) | 25 (32,50) | |
| 2 | 6 (4,90) | 0 (0) | |
| 3 | 1 (0,80) | 0(0) | |
| Comorbilidadb, n (%) | 0,448 | ||
| 0, 1 | 110 (89,40) | 72 (93,5) | |
| >1 | 13 (10,6) | 5 (6,5) | |
| Cirugía de la mama, n (%) | 0,046 | ||
| Conservadora | 89 (72,40) | 45 (58,40) | |
| Mastectomía | 34 (27,60) | 32 (41,60) | |
| Cirugía de la axila, n (%) | 0,0001 | ||
| Biopsia de ganglio centinela | 93 (75,60) | 38 (49,40) | |
| Linfadenectomía | 30 (24,40) | 39 (50,60) | |
| Tipo histológico, n (%) | 0,227 | ||
| Ductal | 96 (78) | 66 (86,70) | |
| Lobulillar | 20 (16,30) | 10 (13) | |
| Otros | 7 (5,70) | 1 (1,30) | |
| pT, n (%) | 0,0001 | ||
| pT1b | 20 (16,30) | 3 (3,90) | |
| pT1c | 72 (58,50) | 34 (44,20) | |
| pT2 | 31 (25.20) | 40 (51.90) | |
| Tamaño tumoral en cm, media (DE) | 1,72 (0,73) | 2,29 (0,91) | 0,0001 |
| Palpabilidad, n (%) | 0,028 | ||
| Sí | 77 (62,60) | 60 (77,90) | |
| No | 46 (37,40) | 17 (22,10) | |
| Grado histológico, n (%) | 0,006 | ||
| G1 | 35 (28,50) | 12 (15,60) | |
| G2 | 87 (70,70) | 59 (76,60) | |
| G3 | 1 (0,80) | 6 (7,80) | |
| Receptores de estrógenos, n (%) | 0,385 | ||
| Positivos | 123 (100) | 76 (98,70) | |
| Negativos | 0 (0) | 1 (1,30) | |
| Receptores de progesterona, n (%) | 0,026 | ||
| Positivos | 116 (94,30) | 65 (84,40) | |
| Negativos | 7 (5,70) | 12 (15,60) | |
| Ki67, n (%) | 0,0001 | ||
| <20% | 65 (83,30) | 8 (30,80) | |
| >20% | 13 (16,70) | 18 (69,20) | |
| Tipo de tratamiento hormonal, n (%) | 0,001 | ||
| Tamoxifeno | 73 (59,30) | 46 (59,70) | |
| Inhibidor de aromatasa | 8 (6,50) | 17 (22,10) | |
| Tamoxifeno-inhibidor de aromatasa | 42 (34,10) | 14 (18,20) | |
DE: desviación estándar; HT: hormonoterapia; QT-HT: quimioterapia-hormonoterapia.
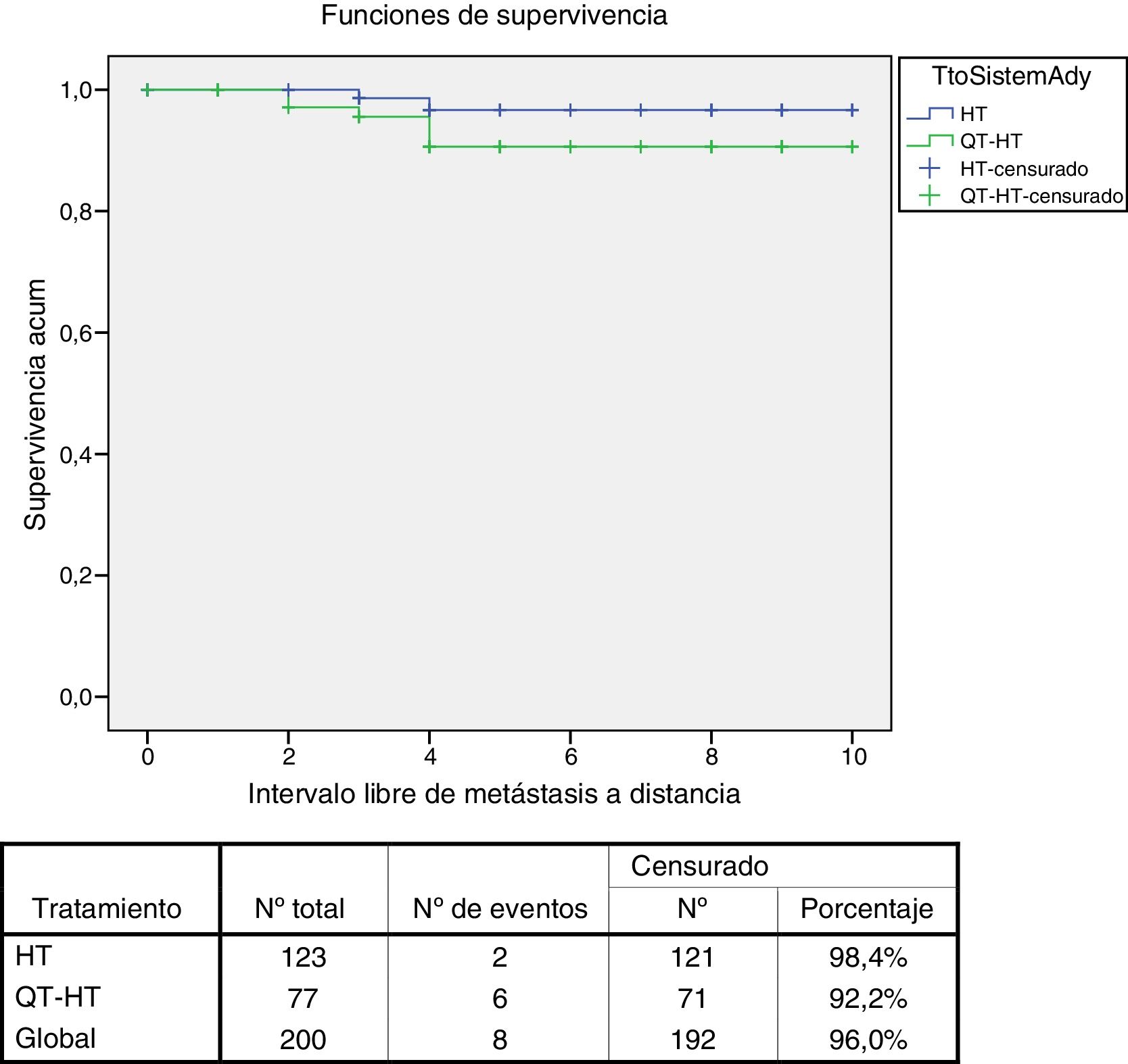
En este subgrupo de 123 mujeres (60,50%) tratadas únicamente con hormonoterapia la SG a los 5 años fue del 98% (IC 95% 95-100) y a los 10 años, del 88% (IC 95% 77-99). La SLEI a los 5 años fue del 85% (IC 95% 75-95) y a los 10 años, del 71% (IC 95% 53-87). El ILMD a los 5 y 10 años fue del 97% (IC 95% 93-100) (fig. 3). En el subgrupo de 77 mujeres (37,90%) tratadas con quimioterapia-hormonoterapia la SG a los 5 años fue del 96% (IC 9% 91-100) y a los 10 años, del 94% (IC 95% 88-100). La SLEI a los 5 años fue del 86% (IC 95% 77-95) y a los 10 años, del 78% (IC 95% 73-91). El ILMD a los 5 y 10 años fue del 91% (IC 95% 84-98) (fig. 3). No se han encontrado diferencias estadísticas en ninguna de las curvas de supervivencia entre los subgrupos tratados con hormonoterapia y con quimioterapia-hormonoterapia.
DiscusiónLos resultados de este estudio proporcionan pruebas de que en este grupo de pacientes con cáncer de mama hormonosensible, HER-2 negativo y con ganglios negativos se producen pocos sucesos y disfrutan de una alta supervivencia. Estos resultados se obtienen indicando el tipo de tratamiento sistémico adyuvante (hormonoterapia sola o quimioterapia más hormonoterapia) basándose en los factores pronósticos clásicos, en la comorbilidad y en la decisión informada de las pacientes. En concreto, en las pacientes tratadas solo con hormonoterapia se obtienen resultados de supervivencia equiparables a los obtenidos por las mujeres tratadas solo con hormonoterapia mediante la valoración del riesgo genómico17,18. Globalmente se trata de una población de buen pronóstico (tamaño tumoral mediano de 1,8cm, axila negativa y mediana de tasa proliferativa del 10%). El subgrupo tratado solo con hormonoterapia posee aún mejor pronóstico y en estas mujeres el tratamiento de quimioterapia podría constituir un sobretratamiento23. Los sucesos relacionados con la recidiva del cáncer de mama (recidivas locorregionales, metástasis y muertes por cáncer de mama) fueron en realidad menos frecuentes que aquellos no relacionados con la recidiva (segundos primarios y muertes por otras causas). Esto podría explicar las diferencias entre las tasas de SLEI y de ILMD (85 y 94% en todas las pacientes y 85 y 97% en el subgrupo tratado solo con hormonoterapia, respectivamente).
La cuestión aún por dilucidar es si la determinación del riesgo genómico ofrece más información que aquella de la que ya se dispone proveniente de los parámetros clinicopatológicos clásicos. Dunkler et al.24 reanalizaron los datos de una cohorte empleada para validar la firma 70-gene signature y demostraron que su contribución al pronóstico de mujeres con cáncer de mama más allá de la ofrecida por los parámetros clásicos fue mínima. Por otra parte, una comparación entre la información pronóstica de OncotypeDX y de 4 marcadores inmunohistoquímicos (receptores de estrógenos, de progesterona, HER-2 y Ki67) demostró que estos 4 marcadores equivaldrían a OncotypeDX25.
Una clara utilidad de la determinación del riesgo genómico es la proporcionada por los resultados del ensayo Mindact19. En las pacientes incluidas en este ensayo clínico (ganglios negativos y positivos hasta 3 ganglios), la presencia de riesgo clínico alto, pero riesgo genómico bajo, permite evitar el tratamiento de quimioterapia, ya que la tasa de supervivencia sin metástasis a distancia a los 5 años fue solo un 1,5% menor en las pacientes que no recibieron quimioterapia19. En el ensayo Mindact19 aproximadamente el 46% de las mujeres con cáncer de mama con alto riesgo clínico podrían ahorrarse la quimioterapia.
A pesar de las limitaciones que más adelante se exponen, los resultados del presente estudio tienen importantes implicaciones para los clínicos, los gestores y los pagadores de la salud, ya que muestran que los criterios clinicopatológicos clásicos son suficientes en un subgrupo de pacientes con ganglios negativos y excelentes características para evitar el uso de la quimioterapia porque su omisión no compromete los resultados de supervivencia (97% de ILMD a los 5 y 10 años) en el 60,50% de las mujeres tratadas solo con hormonoterapia. Los autores no estamos de acuerdo, por tanto, con que los estudios de Sparano et al.17 y Drukker et al.18 añadan pruebas sobre la utilidad de las firmas genómicas en esta población con características clinicopatológicas tan favorables. De hecho, de acuerdo con un panel de consenso europeo26, ninguno de los test genómicos ha alcanzado el mayor nivel de evidencia en el cáncer de mama.
La realidad es que los oncólogos realizan estimaciones sobre los riesgos y los beneficios de la quimioterapia adyuvante de forma variable27. También las directrices nacionales e internacionales difieren en sus recomendaciones1–3 y, en última instancia, la decisión de recibir o no quimioterapia adyuvante es tomada por la paciente, que debe estar adecuadamente capacitada para ello. En un mismo escenario riesgo-beneficio, diferentes pacientes pueden tomar también decisiones distintas27.
La principal limitación del estudio deriva de su carácter retrospectivo, con los posibles errores cometidos durante el proceso de selección de la población de estudio o durante las mediciones, o errores ocasionados por la falta de comparabilidad de los grupos analizados, así como las limitaciones para generalizar los resultados observados en la población en estudio. El tamaño muestral suficiente (aunque no comparable con el de estudios de registros poblacionales nacionales) mitiga en parte estos sesgos. Otra limitación importante es el seguimiento corto, de solo 5 años, para una enfermedad que a 10 y 15 años sigue presentando recaídas, pero en los estudios de evaluación del riesgo genómico de Sparano et al.17 y Drukker et al.18 el seguimiento no fue mucho mayor (61 y 69 meses, respectivamente).
ConclusionesLas mujeres con cáncer de mama hormonosensible, HER-2-negativo, con ganglios negativos, tratadas solo con hormonoterapia según su riesgo clínico, obtienen resultados de supervivencia muy alta, similares a los descritos cuando son tratadas solo con hormonoterapia según su riesgo genómico. A causa de esta equivalencia en supervivencia, la evaluación del riesgo genómico podría ser prescindible.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.