La transfusión de productos sanguíneos contribuye diariamente a mejorar la calidad asistencial y, por tanto, a la recuperación total o parcial de la salud de nuestros ciudadanos, pero también, como todos sabemos, puede ser la causa de efectos adversos de gravedad variable. Aunque este aspecto se ha reducido de manera considerable, la relación entre el beneficio y la posibilidad teórica de efecto indeseable debe estar siempre presente cuando se valora la posibilidad de transfundir.
Esta guía sobre la transfusión de componentes sanguíneos tiene una clara finalidad: el llamar la atención de todos los profesionales usuarios de esta alternativa terapéutica sobre la importancia de optimizar las indicaciones de la transfusión.
Además, no podemos olvidar la frecuente escasez de estos productos. El incremento incesante de la demanda secundaria a la progresiva complejidad asistencial y al mayor volumen de pacientes obliga a gestionar exquisitamente nuestros almacenes de derivados sanguíneos. Una de nuestras prioridades es, por lo tanto, evitar, tanto las transfusiones innecesarias como la infratransfusión, y realizar indicaciones correctas.
La guía no es sólo un instrumento sobre qué transfundir y en qué cantidad, sino que pretende influir en la cultura básica de la medicina transfusional de nuestros profesionales incorporando la reflexión sobre conceptos esenciales en la utilización de un material fundamental y escaso.
Transfusión de los diferentes componentes sanguíneos
Hay una serie de factores que se han de tener en cuenta en el momento de indicar una transfusión.
En primer lugar, que se trata de un tratamiento transitorio. La transfusión de un componente sanguíneo es solamente una medida transitoria, la deficiencia volverá a producirse a menos que su causa se identifique debidamente y corrija (siempre que sea posible).
En segundo lugar, que ha de ser un tratamiento personalizado. Hay que tener presentes varios factores, como la edad, la enfermedad de base y la sintomatología, entre otros. Se ha de tratar a los pacientes, no a los resultados del laboratorio. Éstos nos indican si hay anemia, plaquetopenia o alguna anomalía en la coagulación de la sangre, pero no determinan si un paciente ha de ser transfundido o no.
Por otra parte se ha de seleccionar con qué realizar el tratamiento. Si se decide que es necesario realizar la transfusión, se ha de seleccionar el producto sanguíneo más eficaz y que comporte menos riesgo para el paciente. En determinadas intervenciones quirúrgicas electivas se ha de considerar seriamente la posibilidad de utilizar técnicas de autotransfusión en el preoperatorio (contactando previamente con el banco de sangre) o durante la intervención quirúrgica (hemodilución normovolémica, recuperadores de sangre, y otros).
HEMATIES
Descripción
La finalidad de la transfusión de hematíes es aumentar la capacidad de transporte de oxígeno a los tejidos gracias a la hemoglobina (Hb) que contienen en su interior.
Los productos utilizados habitualmente son los concentrados de hematíes procedentes de la donación de sangre total tras su separación mediante centrifugación. La racionalización de la hemoterapia basada en componentes hace que la transfusión de sangre total sea restringida únicamente a ciertas situaciones (fundamentalmente autodonación predepósito en cirugía programada). Los concentrados de hema tíes también pueden obtenerse a partir de una donación de eritroaféresis cuyo resultado tiene unas características similares al procedente de una unidad de sangre total.
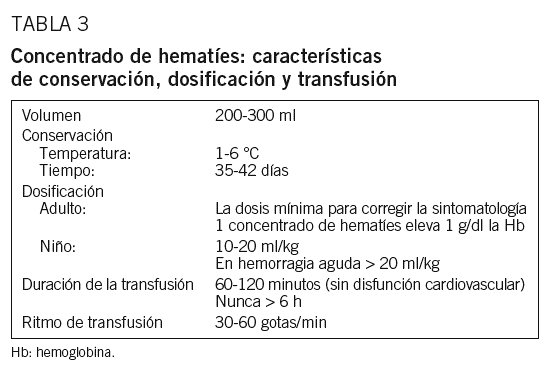
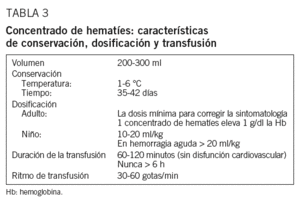
Durante una donación de sangre se extrae un volumen comprendido entre 405 y 495 ml, que, cuando se utiliza solución conservante, se recogen en 63 ml de citrato, fosfato, dextrosa (CPD). Tras centrifugar de manera intensa los hematíes se sedimentan en el fondo y se obtiene un sobrenadante claro por encima, el plasma, y la capa leucoplaquetaria entre ambos. A continuación se extrae el plasma y la capa leucoplaquetaria, y por último se añade una solución conservante constituida por glucosa, adenina, cloruro sódico y manitol (SAG-manitol), con lo que el hematocrito resultante de este concentrado de hematíes se sitúa entre el 55 y 65%, con un contenido de Hb superior a los 40 g (concentrado de hematíes leucorreducido)1,2. El volumen aproximado del producto se sitúa entre 200 y 300 ml.
En la actualidad, en la mayoría de los centros españoles se procede a la leucorreducción de todos los componentes sanguíneos celulares en el momento de su preparación, con lo que se obtiene un contenido leucocitario inferior al millón de elementos por unidad1-3.
Conservación
Los concentrados de hematíes en SAG-manitol pueden conservarse hasta 42 días a temperaturas entre 1 y 6 °C, siempre y cuando la etiqueta del producto no indique otra cosa (hematíes irradiados, hematíes lavados, sistema abierto y otras circunstancias); en ese caso la caducidad se modificará de acuerdo con las nuevas especificaciones del producto y constará en la etiqueta.
Indicaciones
Las transfusiones de hematíes están indicadas en el tratamiento de las situaciones sintomáticas donde haya un déficit en la capacidad de transporte de oxígeno:
Anemia en pacientes adultos (tabla 1)
Anemia aguda. Generalmente está producida por hemorragia aguda como la que ocure en intervenciones quirúrgicas, traumatismos, hemorragia digestiva aguda, y otras. Las pérdidas son de sangre total pero su corrección debe hacerse con diferentes componentes sanguíneos. Aquí hay que diferenciar el mantenimiento de la volemia, del de transporte de oxígeno.
La volemia, establecida aproximadamente en un 7% del peso corporal total, se ha de mantener siempre cerca del 100%, ya que el margen de seguridad es muy pequeño.
En cambio, el margen de seguridad para el transporte de oxígeno a los tejidos es mucho más amplio, pues para un gasto cardíaco de 5 l/min y una Hb de 15 g/dl, la oferta de oxígeno es de unos 1.000 ml/min; de ellos se consumen 250 ml. Los valores mínimos de Hb aceptados como seguros son en muchos países, de 7 g/dl para pacientes con buen estado general y en situación estable; por encima de este valor es necesario justificar la transfusión por las circunstancias de cada paciente como situaciones en que aumentar el gasto cardíaco, en enfermedades respiratorias, riesgo de isquemia miocárdica, y otras4,5.
Las proteínas plasmáticas y de la coagulación tienen un margen de seguridad aún mayor, superior al 100% de la volemia.
Por tanto, la reposición debe hacerse siempre escalonada. El siguiente modelo puede servir de guía:
En primer lugar, la reposición de la volemia debe realizarse con soluciones cristaloides (Ringer-lactato o suero fisiológico) y coloides sintéticos (dextranos, gelatinas y almidones).
Además, debe asegurarse el transporte de oxígeno a los tejidos cuando, en un sujeto previamente sano, la Hb es menor de 7 g/dl4,5.
Por último, hay que reponer los factores de coagulación, sobre todo cuando las pérdidas son aproximadamente del 100% de la volemia y según el estudio de hemostasia.
Anemia pre y peroperatoria
Hay que señalar que no existe un valor de Hb o hematocrito determinado por debajo del cual no se puede practicar una anestesia general o regional. Pueden servir de orientación las siguientes pautas transfusionales6.
En el enfermo quirúrgico normovolémico sin signos de descompensación cardiopulmonar con anemia que debe ser sometido a intervención en breve plazo, sólo se transfundiría si la concentración de Hb es inferior a 7 g/dl, preferentemente durante el acto quirúrgico o en el postoperatorio inmediato.
Por el contrario, en los enfermos con síntomas de enfermedad vascular (cerebral o coronaria) o respiratorios crónicos (que tienen afectado el transporte de oxígeno), está justificada la transfusión preoperatoria con el objeto de aumentar las concentraciones de Hb por encima de 8 g/dl.
Es necesario recordar que los pacientes con anemia crónica (insuficiencia renal crónica, mielodisplasias, etc.) toleran bien valores de Hb más bajas (5-6 g/dl).
Se debe recordar que muchos de los pacientes con cirugía programada pueden beneficiarse de la realización de autotransfusión entre los 35 y los 7 días previos a la intervención. El empleo de sangre autóloga es una práctica transfusional mucho más segura y supone un riesgo mucho menor para el paciente. Aunque tienen el inconveniente del frecuente desaprovechamiento de las bolsas extraídas.
Anemia postoperatoria
En situaciones de estabilidad hemodinámica (paciente normovolémico) y sin evidencias de hemorragia en adultos jóvenes es difícil justificar transfusiones de hematíes con valores de Hb superiores a 7 g/dl. Los pacientes con signos de enfermedad cerebrovascular o coronaria, respiratoria crónica, mayores de 70 años y sépticos, entre otros, requieren generalmente valores más altos de Hb6.
Anemia crónica en pacientes adultos
Como norma general, la transfusión sólo está indicada cuando la anemia es sintomática y refractaria al tratamiento etiológico. En pacientes asintomáticos, en ausencia de factores de riesgo, la transfusión no está indicada independientemente de los valores de Hb, como es el caso de las anemias ferropénicas de hasta 5 g/dl, en las que han de evitarse las transfusiones si no hay una repercusión cardíaca4,5,7.
La decisión de transfundir dependerá de criterios clínicos cuando la concentración de Hb esté comprendida entre 5 y 10 g/dl, y por encima de 10 g/dl la transfusión casi nunca está indicada. La mayoría de los pacientes requieren transfusiones repetidas si no alcanzan valores mayores de 5 g/dl.
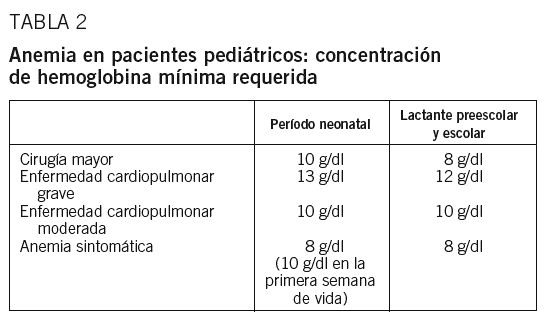
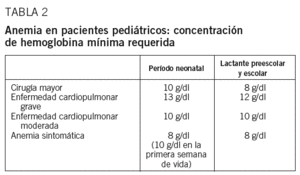
Anemia en pacientes pediátricos
Hay que hacer una distinción según la edad del niño8 (tabla 2).
Durante el período neonatal (primer mes de vida), hay indicación de transfundir si la cifra de Hb < 10 g/dl y cirugía mayor; si la Hb < 10 g/dl y enfermedad cardiopulmonar moderada; si Hb < 10 g/dl en la primera semana de vida y clínica anémica, si Hb < 13 g/dl y enfermedad cardiopulmonar grave, que precisa ventilación mecánica y/o oxígeno suplementario con FiO2 >= 0,4; si la Hb < 8 g/dl y anemia sintomática (síndrome apneico, taquicardia, taquipnea, mala curva ponderal); y en casos de hemorragia aguda con pérdida >= 25% de la volemia o con síntomas clínicos de hipoxia persistentes tras la corrección de la hipovolemia con cristaloides/coloides.
En los lactantes y niños en edad preescolar y escolar hay indicación de transfundir si se produce pérdida sanguínea aguda con síntomas clínicos de hipoxia persistentes tras la corrección de la hipovolemia con cristaloides/coloides; si en el preoperatorio se detecta una Hb < 8 g/dl en cirugía urgente o que no puede corregirse con tratamiento específico; en situaciones de postoperatorio con Hb < 8 g/dl y clínica de anemia; si el valor de Hb < 12 g/dl y hay enfermedad cardiopulmonar grave que precisa ventilación mecánica y/o oxígeno suplementario con FiO2 >= 0,4 y si la Hb < 10 g/dl y hay enfermedad cardiopulmonar moderada que precisa oxígeno suplementario con FiO2 < 0,4.
Por último, hay que tener en cuenta las recomendaciones específicas en los niños con anemias drepanocíticas homocigotas. Conviene situarlos con Hb preoperatoria de 10-13 g/dl y una tasa de Hb S que no sea superior al 30-40%, garantizando, además, una adecuada hidratación, oxigenación y mantenimiento de temperatura corporal. En caso de cirugía cardiovascular, neurocirugía, cirugía ortopédica y accidentes cerebrovasculares isquémicos es deseable mantener la Hb en el intervalo superior de los valores descritos y la tasa de HbS incluso por debajo del 30%. En el caso de intervención quirúrgica, la obtención de estos valores puede efectuarse mediante transfusiones programadas durante las 2-4 semanas previas. Si se precisa una preparación rápida por indicación quirúrgica urgente o ictus isquémico puede recurrirse a una eritroféresis o, en su defecto, a una exanguinotransfusión de un volumen. En crisis vasooclusivas graves (pulmonares, hepáticas, esplénicas) o en las que no responden al tratamiento médico (hiperhidratación, analgesia) puede estar indicada la transfusión, aunque debe individualizarse la prescripción. Los pacientes con rasgo drepanocítico no suelen requerir medidas especiales salvo en determinados casos que se intervengan con circulación extracorpórea o cirugía ortopédica con isquemia.
Contraindicaciones
La transfusión no debe usarse en caso de anemias tratables con productos específicos (hierro, eritropoyetina y otros), excepto en anemias sintomáticas que requieran tratamiento inmediato7.
La transfusión de hematíes como expansores plasmáticos, o de manera «profiláctica», o para mejorar el estado general del paciente, o como sustitutos del tratamiento específico de cada anemia, son situaciones en las que se está haciendo un uso inapropiado de los glóbulos rojos.
Dosificación
Cada unidad de sangre completa o de concentrado de hematíes contiene Hb suficiente para elevar, como media, la Hb del paciente en 1 g/dl o en 3 puntos el porcentaje del hematocrito, que en los pacientes adultos normovolémicos puede valorarse realizando un control de las concentraciones de Hb/hematocrito a partir de los 15 min de finalizar la transfusión (tabla 3).
En adultos se administrará la dosis mínima, necesaria para eliminar la sintomatología, hemos de huir del concepto clásico: una dosis = 2 unidades. En muchas ocasiones, un solo concentrado de hematíes es suficiente para aliviar la sintomatología del paciente y proseguir con el tratamiento etiológico. En pacientes de edad avanzada o con problemas cardiovasculares es aconsejable no transfundir más de una unidad de manera sucesiva o incluso transfundir fracciones de ella5,9.
En niños variará según la edad y la situación clínica, pero en general la dosis es de 10 a 20 ml/kg, salvo en caso de hemorragia aguda en que será > 20 ml /kg (tabla 3).
Administración
Debe respetarse el grupo ABO, de manera que haya compatibilidad entre los hematíes del donante y los anticuerpos circulantes del receptor. Excepto en casos de extrema urgencia, se requiere la realización de pruebas de compatibilidad serológica entre donante y receptor10,11.
Antes de iniciar la transfusión se verificará la correcta identificación y correspondencia del receptor y la unidad que se va a administrar. Además, se recomienda recomprobar el grupo ABO del paciente mediante una nueva muestra de sangre extraída en la cabecera del receptor 1.
La transfusión se iniciará lentamente, a un ritmo de 10 gotas/min, vigilando la aparición de posibles efectos adversos durante los primeros 5 a 10 min. La velocidad de infusión se mantendrá, posteriormente, a la velocidad que tolere la situación cardiovascular del paciente. Habitualmente, para un adulto sin disfunciones cardiovasculares, una unidad de concentrado de hematíes se transfundirá en 1 o 2 h. Dado que para la mayoría de los equipos de transfusión la equivalencia se sitúa aproximadamente en 15 gotas/1 ml, ello supone un ritmo de infusión de 30 a 60 gotas/min.
Se ha de evitar el alargamiento del tiempo de transfusión, a excepción de pacientes con insuficiencia cardíaca o con riesgo de presentarla, cardiópatas, pacientes oligoanúricos, personas de edad avanzada y en casos de anemia intensa. En estos casos será necesario disminuir el ritmo de infusión y, en cualquier caso, el tiempo de transfusión nunca excederá las 6 h, y se puede requerir, para evitarlo, el fraccionamiento de las unidades por medio de circuito cerrado estéril para asegurar así la correcta conservación (tabla 3).
PLAQUETAS
Descripción
Las plaquetas son elementos sanguíneos esenciales para la detención de las hemorragias. Circulan en número de entre 125 y 300 * 109/l12.
Existen dos tipos de concentrados de plaquetas. Por un lado, están los concentrados de plaquetas obtenidos a partir de donaciones de sangre total. Dependiendo del tipo de fraccionamiento realizado pueden encontrarse en forma: a) Individual, contienen una cantidad aproximada de 6 * 1010 plaquetas suspendidas en un volumen de plasma que varía entre 50 y 70 ml, se mezclan en el momento de la transfusión, precisándose aproximadamente un concentrado individual por cada 10 kg de peso de receptor1,2; b) mezcla, que se obtiene durante el fraccionamiento, con la obtención de un producto intermedio la capa leucoplaquetaria que contiene la mayoría de las plaquetas y leucocitos de la bolsa de sangre total. Mezclando de 4 a 6 de estos componentes, mediante dispositivos estériles, conseguimos una unidad terapéutica de plaquetas, con un contenido aproximado de 2,5 * 1011 plaquetas en un volumen de 250-300 ml de plasma, o bien en una solución aditiva para plaquetas, siempre que mantenga un 30% de plasma1,2.
El otro tipo de concentrado de plaquetas son los que se obtienen mediante plaquetoféresis; obtenidos de un único donante mediante procedimientos de aféresis. Deben contener más de 2,5 * 1011 plaquetas suspendidas en un volumen de plasma de alrededor de 250 ml1,2.
En la actualidad, en la mayoría de los centros españoles se procede a la leucorreducción, de todos los componentes sanguíneos celulares en el momento de su preparación, resultando un contenido leucocitario inferior al millón de elementos por unidad1,2,13.
Conservación
Independientemente del método de obtención, los concentrados de plaquetas se almacenan a una temperatura mantenida entre 20 y 24 oC en agitación continua, como máximo durante 5 días.
Indicaciones
Pacientes adultos
Los concentrados de plaquetas se transfunden para prevenir o tratar hemorragias en pacientes con defectos cualitativos y/o cuantitativos de las plaquetas (tabla 4).
Transfusión profiláctica
Su indicación se basa en el recuento de plaquetas y en otros datos clínicos del paciente. En principio estará indicada la transfusión si el recuento de plaquetas es inferior a 10 * 109/l. Cuando se asocian otros factores de riesgo hemorrágico, como infecciones graves, tratamiento anticoagulante, y otros, la cifra de plaquetas por debajo de la cual generalmente se transfunde es de 20 * 109/l14.
En pacientes trombocitopénicos a los cuales es necesario realizar algún tipo de procedimiento invasivo (biopsia, endoscopia, colocación catéter venoso central, y otros) la cifra de plaquetas por debajo de la cual se recomienda transfundir es 50 * 109/l. En caso de intervenciones en territorios en los cuales, incluso pequeñas pérdidas hemáticas pueden tener consecuencias graves, como por ejemplo el sistema nervioso central o el globo ocular, se recomienda transfundir si el recuento plaquetario es inferior a 100 * 109/l14.
Existen evidencias en la bibliografía médica que sugieren que en casos de trombocitopenia grave, estables de larga evolución como por ejemplo en la aplasia medular grave, se puede disminuir el umbral de transfusión profiláctica a menos de 5 * 109/l sin que ello aumente la mortalidad por hemorragia14.
Transfusión terapéutica
La transfusión terapéutica de plaquetas se realiza cuando hay una alteración cuantitativa y/o cualitativa de las plaquetas y el paciente presenta una hemorragia atribuible al defecto plaquetario. En ausencia de otros defectos funcionales, se recomienda transfundir plaquetas si existe hemorragia y el recuento de plaquetas es inferior a 50 * 109/l14.
Pacientes pediátricos
El recuento plaquetario en los recién nacidos es similar al de los adultos, pero en el período neonatal, y especialmente en los prematuros, se observan alteraciones del funcionalismo plaquetario y de los factores de la coagulación que hace recomendable mantener recuentos superiores al de los adultos.
En los neonatos prematuros se aconsejan las transfusiones profilácticas de plaquetas cuando el recuento plaquetario es inferior a 50 * 109/l y, en caso de existir otros factores que aumenten el riesgo de hemorragia, el umbral para transfundir se eleva a 100 * 109/l. Los neonatos a término, si no presentan otras alteraciones de la coagulación ni otros factores de riesgo, es poco probable que presenten un episodio de hemorragia con recuentos plaquetarios superiores a 10 * 109/l (tabla 4)7.
Contraindicaciones
En general, la transfusión profiláctica de plaquetas se reserva para los pacientes que presentan un defecto en la producción medular de estos elementos sanguíneos, y muy raramente se necesita en las trombocitopenias secundarias a un aumento de la destrucción como en la púrpura trombocitopénica autoinmunitaria. Estas transfusiones están relativamente contraindicadas en los pacientes afectados de púrpura trombocitopénica trombótica o de trombocitopenia inducida por la heparina debido al riesgo potencial de contribuir a la aparición de fenómenos trombóticos (tabla 4)14.
Dosificación
Para un adulto, la dosis habitual de concentrados de plaquetas individuales es de un concentrado por cada 10 kg de peso. Es decir, un adulto requiere entre 5 y 7 unidades. En el caso de los neonatos la dosis es de una unidad por cada 5 kg de peso, aproximadamente 10 ml/kg de peso (tabla 5)15.
En condiciones normales, la transfusión a un adulto de una dosis terapéutica de plaquetas obtenida de donaciones de sangre total o bien por plaquetoféresis produce un aumento en el recuento de unas 30 a 50 * 109/l plaquetas que puede ser valorado realizando un recuento plaquetario entre los 10 y 60 min después de finalizar la transfusión.
El rendimiento de la transfusión de plaquetas puede calcularse de forma más exacta (útil para definir la refractariedad a las transfusiones) mediante el cálculo del incremento corregido del recuento (ICR):
Si, repetidamente, el ICR a la hora de la transfusión de un concentrado de plaquetas de obtención reciente y ABO compatible es inferior a 7,5 * 109/l o a las 18 h es inferior a 4,5 * 109/l, el paciente se considerará refractario a las transfusiones de plaquetas16.
Administración
No se precisan pruebas de compatibilidad eritrocitaria si el contenido de hematíes del concentrado de plaquetas es inferior a 2 ml. Es conveniente que la transfusión sea ABO compatible entre el plasma del donante y los hematíes del receptor. Respecto al antígeno Rh(D), la aloinmunización en caso de transfusión de plaquetas de donantes Rh(D) positivo a pacientes Rh(D) negativo puede evitarse mediante la administración de inmunoglobulina anti-D en los casos que se considere (mujeres en edad fértil)7.
La transfusión debe realizarse a través de un filtro de 170-200 µm y tan rápidamente como sea tolerada por el receptor, por lo general entre 20 y 30 min. Dado que la mayoría de los equipos de transfusión la equivalencia se sitúa en 15 gotas = 1 ml, lo que supone un ritmo de infusión de 125 a 225 gotas/min (tabla 5). En caso de riesgo de sobrecarga hídrica, se enlentecerá el ritmo de infusión. En cualquier caso el tiempo de transfusión nunca excederá las 4 h para reducir el riesgo de contaminación bacteriana del producto.
Componentes irradiados
Los componentes celulares se irradian para prevenir el riesgo de la enfermedad del injerto contra el huésped asociada a la transfusión, una complicación inmunitaria de la transfusión de componentes celulares con muy baja incidencia, pero con un alto índice de mortalidad.
Se debe a la infusión de linfocitos T viables e inmunocompetentes que se injertan en el receptor y proliferan desarrollando una lesión tisular que está, principalmente, mediada por las células natural killer (NK).
El riesgo es superior en receptores con la inmunodeficiencia o inmunodepresión y en los que tienen con identidad HLA donante-receptor, como transfusión procedente de donantes emparentados en primer o segundo grado, o pacientes transfundidos con productos seleccionados HLA compatibles17,18.
Los componentes que deben ser irradiados incluyen la sangre total, los concentrados de hematíes, los concentrados de plaquetas y los concentrados de granulocitos.
Los pacientes seleccionados para recibir estos productos son:
Indicaciones específicas en pediatría: a) transfusión intra útero; b) exanguinotransfusión; c) prematuridad de menos de 1.200 g de peso, y d) inmunodeficiencia celular congénita.
Indicaciones comunes a niños y adultos: a) transfusión de donante HLA compatible, toda transfusión de plaquetas HLA compatibles o de donantes familiares; b) receptor de trasplante de progenitores hematopoyéticos; c) semanas previas y durante la recogida de progenitores hematopoyéticos; d) pacientes con enfermedad de Hodgkin, y e) pacientes tratados con análogos de las purinas: fludarabina, cladribina y pentostatina.
PLASMA FRESCO CONGELADO
Descripción
El plasma fresco congelado (PFC) es la parte líquida de la sangre, separada y congelada en las horas siguientes a la extracción para conservar al máximo las concentraciones de los diferentes factores de la coagulación. El plasma puede obtenerse mediante la separación en componentes de una donación de sangre total, su volumen en este caso es de 200-300 ml, o bien a partir de una donación de plasmaféresis, siendo en este caso el volumen de 300-600 ml1,2.
En España, la legislación establece que el PFC se ha de transfundir tras haberle aplicado alguna medida que aumente su perfil de seguridad. Entre las medidas que contempla la norma se encuentra el «cuarentenar» el plasma durante un período de varios meses hasta que el donante realiza una nueva donación. La negatividad para los marcadores infecciosos en esta nueva donación permite la liberación y transfusión de la unidad anterior cuarentenada. Otras medidas recogidas en la normativa son tratar el plasma con medios para la atenuación de patógenos como el azul de metileno o solvente detergente, o la utilización simultánea de PFC y concentrados de hematíes o plaquetas del mismo donante cuando el paciente requiera más de un tipo de componente sanguíneo.
El PFC es la fuente fundamental de obtención de derivados plasmáticos: concentrados de factores de la coagulación del PFC se realiza a temperatura inferior a 30 °C durante como máximo 1 año o a 18 °C o temperaturas inferiores durante como máximo 6 meses1.
Indicaciones
Las indicaciones de utilización del PFC son muy limitadas y perfectamente establecidas. La observación estricta de estas indicaciones permitirá evitar exponer a los pacientes a riesgos innecesarios. Siempre que sea posible deberán utilizarse alternativas que no conlleven riesgo de transmisión de enfermedades infecciosas19.
De forma general, el PFC está indicado en pacientes con hemorragia activa o pacientes que deban ser sometidos a intervenciones quirúrgicas con déficit de múltiples factores de coagulación (hemorragias graves, exanguinotransfusión, coagulación intravascular diseminada [CID]), pacientes con déficit congénitos para los que no existe concentrado purificado e inactivado disponible (factor V, factor X), y en pacientes con púrpura trombótica trombocitopénica (PTT) y síndrome hemolítico urémico19.
De forma específica, la Conferencia de Consenso sobre utilización de PFC, auspiciada por el Ministerio de Sanidad y Consumo en 1993, establece20:
Indicaciones en las que su uso está establecido y su eficacia demostrada
PTT.
Púrpura fulminante del recién nacido, secundaria a deficiencia congénita de la Proteína C o la proteína S, siempre que no se disponga de concentrados específicos de esos factores.
Exanguinotransfusión en neonatos para reconstituir el concentrado de hematíes cuando no se disponga de sangre total.
Indicaciones en las que su uso está condicionado a la existencia de una hemorragia grave y alteraciones de las pruebas de coagulación
En pacientes que reciben transfusión masiva.
Trasplante hepático.
Reposición de los factores de la coagulación en las deficiencias congénitas cuando no existan concentrados de factores específicos.
Situaciones clínicas con déficit de vitamina K que no permitan esperar la respuesta a la administración de vitamina K intravenosa o no respondan adecuadamente a ella (malabsorción, enfermedad hemorrágica del recién nacido, y otras).
Neutralización inmediata del efecto de los anticoagulantes orales.
Hemorragias secundarias a tratamientos trombolíticos.
CID
Cirugía cardíaca con circulación extracorpórea.
En pacientes con insuficiencia hepatocelular grave y hemorragia microvascular difusa o hemorragia localizada con riesgo vital.
Reposición de los factores plasmáticos de la coagulación deplecionados durante el recambio plasmático cuando se haya utilizado albúmina como solución de recambio.
Indicaciones en ausencia de clínica pero con alteración de las pruebas de coagulación
En pacientes con déficit congénito de coagulación, cuando no existan concentrados de factores específicos, ante la eventualidad de una actuación agresiva, procedimientos invasivos y/o traumáticos.
En pacientes que reciben a anticoagulación oral que precisen cirugía inminente y, por consiguiente, no se pueda esperar el tiempo necesario para la corrección de la hemostasia con vitamina K administrada por vía intravenosa, de 6 a 8 h.
Situaciones en las que su uso no está indicado
Todas aquellas que puedan resolverse con terapias alternativas o coadyuvantes (antifibrinolíticos, acetato de desmopresilo, concentrados específicos).
Como expansor de volumen o para recuperación o mantenimiento de presión oncótica y/o arterial.
Como parte integrante de esquemas de reposición predeterminados (por ejemplo: 1 unidad de PFC por cada 2 o 3 de CH).
Prevención de hemorragia intraventricular del recién nacido prematuro.
Como aporte de inmunoglobulinas.
Uso profiláctico en pacientes diagnosticados de hepatopatía crónica con alteración de las pruebas de coagulación que serán sometidos a procedimientos invasivos menores.
En pacientes con hepatopatía crónica e insuficiencia hepatocelular avanzada en fase terminal.
El PFC no debe utilizarse como aporte nutricional o para la corrección de hipoproteinemia, ni en alimentación parenteral prolongada o inespecíficamente en el paciente séptico. Tampoco debe utilizarse como aporte de componentes del complemento, ni como aporte de factores de coagulación en el recambio plasmático, excepto lo aclarado anteriormente.
Corrección del efecto anticoagulante de la heparina.
Reposición del volumen en las hemorragias del recién nacido con policitemia.
Ajuste del hematocrito de los concentrados de hematíes que van a ser transfundidos a los recién nacidos.
Dosificación
La dosis de plasma depende de la causa y del estado del paciente. Tanto para pacientes adultos como pediátricos, la dosis habitual para la restauración de factores es de 10-20 ml/kg. Con esta dosis aumentaría la concentración de los factores de coagulación en un 20% aproximadamente inmediatamente tras la infusión9. Es importante la evaluación y el control postransfusional del paciente mediante pruebas como el tiempo de protrombina y el tiempo de la tromboplastina parcial activado (tabla 6).
Administración
No se precisan pruebas cruzadas, pero sí la compatibilidad ABO con los hematíes del receptor.
Para su transfusión el plasma será descongelado a temperatura controlada de 30 a 37 °C (en un baño María o calor seco) en un tiempo aproximado de 20 min. El plasma debe ser transfundido inmediatamente una vez descongelado, o conservado de 1 a 6 °C durante no más de 24 h, procurando que sea transfundido antes de las 6 h, para garantizar el aporte correcto de los factores de coagulación lábiles1,2.
La transfusión se comenzará lentamente, a un ritmo de 10 gotas/min, vigilando la aparición de posibles efectos adversos; la velocidad de infusión se mantendrá posteriormente a la velocidad que tolere la situación cardiovascular del paciente.
Habitualmente, para un adulto sin disfunción cardiovascular, una unidad de plasma de un volumen de 200-300 ml se transfundirá en 20-30 min, y una unidad de plasmaféresis de un volumen de 300 a 600 ml en 30-60 min, dado que para la mayoría de los equipos de transfusión la equivalencia se sitúa en 15 gotas = 1 ml, lo que supone un ritmo de infusión de 125 a 175 gotas/min. En pacientes con insuficiencia cardíaca o con riesgo de experimentarla, cardiópatas, pacientes oligoanúricos, personas de edad avanzada, será necesario disminuir el ritmo de infusión y en cualquier caso el tiempo de transfusión nunca excederá las 2 h para preservar los factores lábiles de la coagulación (tabla 6).
CRIOPRECIPITADO
Descripción
El crioprecipitado es la fracción de las proteínas plasmáticas que son insolubles en frío. Se prepara mediante la descongelación de una unidad de PFC a 4 °C, tras lo cual se centrifuga para sedimentar el precipitado. Tras eliminar el sobrenadante, el sedimento con 15 a 20 ml de plasma se vuelve a congelar y se conserva a temperaturas inferiores a 30 °C durante como máximo 1 año. El crioprecipitado debe contener más de 70 U de factor VIII y 140 mg de fibrinógeno por unidad19.
Indicaciones
El crioprecipitado puede estar indicado en el tratamiento de deficiencias congénitas y adquiridas de los factores anteriormente citados siempre y cuando no se disponga de concentrados del factor necesitado viralmente inactivados.
Dosificación
Inicialmente 1 U/10 kg y seguir según el control clínico.
Administración
El crioprecipitado debe descongelarse a temperatura controlada de 30 a 37 °C (baño María o calor seco). Una vez descongelado, el crioprecipitado debe mantenerse a temperatura ambiente hasta su transfusión que, en el caso de que haya sido abierto el circuito, debe transfundirse antes de transcurridas 6 h desde su apertura (tabla 7).
AUTOTRANSFUSION
Los componentes sanguíneos son instrumentos terapéuticos de disponibilidad limitada, además de no estar exentos de producir efectos adversos potencialmente graves en el receptor. Por ello, especialmente en aquellas situaciones, como la cirugía, donde el momento de la necesidad transfusional se conoce con antelación, es posible tomar medidas que disminuyan la exposición a componentes sanguíneos homólogos.
De las diversas alternativas actualmente disponibles para disminuir la exposición a componentes homólogos aquí nos centraremos en los procesos basados en el uso de la propia sangre del receptor (tabla 8).
Donación autóloga predepósito
Consiste en la extracción, el almacenamiento y, finalmente, la transfusión de la propia sangre del paciente. La indicación se establece generalmente en pacientes programados para diferentes tipos de cirugía. Esta alternativa posibilita la eliminación de ciertos riesgos como la transmisión de enfermedades virales, la aloinmunización a antígenos celulares o la aparición de la mayoría de las reacciones transfusionales. Sin embargo, no evita efectos indeseables como la contaminación bacteriana, la sobrecarga de volumen, o los derivados de los errores transfusionales7.
Los responsables de cada banco de sangre o centro de transfusión deben establecer los criterios de selección, extracción y otros elementos clave del procedimiento. Cada centro debe diseñar los criterios de exclusión. En principio, el criterio absoluto de exclusión es la anemia (Hb inferior a 11 g/dl), la presencia de un proceso infeccioso actual o reciente que pueda asociarse a bacteriemia o, según establece la ley, la positividad de alguno de los marcadores de infección de determinación obligatoria. No se recomienda la utilización homóloga de las unidades autólogas no transfundidas.
Los pacientes que participan en un programa deben conocer exactamente las características del procedimiento de selección, extracción, caducidad, efectos adversos, posibilidad de necesitar transfusiones homólogas, etc., y firmar el correspondiente consentimiento informado.
El protocolo habitual de donación es de una unidad por semana, y la última donación debe efectuarse al menos 72 h antes de la intervención quirúrgica. En determinadas situaciones podría utilizarse eritropoyetina para aumentar el número de unidades extraídas.
Hemodilución normovolémica
Consiste en la extracción de 1 o más unidades de sangre poco antes de la intervención con infusión simultánea de coloides o cristaloides, para su transfusión posterior. Estas unidades se pueden mantener a temperatura ambiente hasta 6 h. Para almacenamientos durante más tiempo, la temperatura debe ser de 1-6 °C7.
El procedimiento debe asegurar la esterilidad de la extracción, así como el etiquetado y almacenamiento correctos, junto con la realización de las pruebas de laboratorio adecuadas para garantizar la idoneidad del producto y evitar errores de identificación.
Recuperación intra y postoperatoria
Mediante la recolección de sangre recuperada del campo operatorio o de un circuito extracorpóreo (o de drenajes, cavidades articulares, etc., en el caso de la recuperación post operatoria).
Existen diferentes métodos de obtención y procesamiento estéril, precisándose su filtración antes de la reinfusión. Hasta las 6 h puede mantenerse a temperatura ambiente, y a partir de ahí, y hasta 24 h, mediante refrigeración a 1-6 °C (sólo en el caso de la recuperación intraoperatoria).
Generalmente, el método está contraindicado en caso de padecer el paciente infección o neoplasia. Asimismo, no podrá realizarse si se utilizan soluciones yodadas sobre el campo quirúrgico o si se produce contaminación7.