En las últimas décadas se ha producido en el mundo un incremento paralelo en la prevalencia de obesidad y diabetes mellitus tipo 2, dato no sorprendente si tenemos en cuenta que el aumento de grasa visceral es el principal factor de riesgo para el desarrollo de diabetes mellitus tipo 2 en individuos genéticamente predispuestos. La intervention centrada en el control intensivo de la glucemia en la diabetes mellitus tipo 2 con los tratamientos clâsicos aumenta el riesgo de ganancia de peso y aparicion de hipoglucemias. Por el contrario, la pérdida de peso mediante cambios en el estilo de vida, fârmacos y/o cirugîa mejora simultâneamente la mayorîa de factores de riesgo cardiovascular, incluida la hiperglucemia. La intervention intensiva sobre el estilo de vida induce un beneficio global en el paciente con diabetes mellitus tipo 2, pero la pérdida ponderal a largo plazo es modesta y no ha demostrado reducir la morbimortalidad cardiovascular. La aparicion de nuevos grupos terapéuticos para la diabetes mellitus tipo 2 o la obesidad, que consiguen mejorar simultâneamente la HbA1c, el peso y otros factores de riesgo cardiovascular sin producir hipoglucemias, representa un salto cualitativo en el manejo de los pacientes con diabesidad. Un inhibidor del cotransportador sodio-glucosa tipo 2 y un agonista del receptor de GLP1 recientemente han demostrado reducir la mortalidad cardiovascular y total en la diabetes mellitus tipo 2 con enfermedad cardiovascular. Ademâs, la cirugîa bariâtrica ha mostrado una râpida remision de la diabetes mellitus tipo 2 en un gran porcentaje de pacientes y reduce la mortalidad especffica para diabetes. La aparicion de nuevos tratamientos plantea la posibilidad de cambiar la estrategia terapéutica glucocéntrica actual por una estrategia adipocéntrica.
In recent decades, there has been a worldwide parallel increase in the prevalence of obesity and type 2 diabetes mellitus (T2DM), which is not surprising, given that increased visceral fat is the main risk factor for the development of T2DM in genetically predisposed individuals. An intervention focused on intensive blood glucose control in T2DM with classic drugs increases the risk of weight gain and the rate of hypoglycaemia. In contrast, weight loss through lifestyle changes, drugs and/or surgery simultaneously improves most cardiovascular (CV) risk factors, including hyperglycemia. Intensive intervention on lifestyle induces an overall benefit in patients with T2DM, but long-term weight loss is modest and has not been shown to reduce CV morbidity and mortality. The emergence of new therapeutic classes for T2DM and obesity, which simultaneously improve HbA1c, weight and other CV risk factors without inducing hypoglycaemia, represents a major change in the management of patients with diabesity. A sodium-glucose cotransporter-2 inhibitor and a GLP-1 receptor agonist have recently been shown to decrease CV and total mortality in type 2 diabetic patients with CV disease. Furthermore, bariatric surgery rapidly induces remission or improvement of T2DM in a large percentage of patients and reduces diabetes-related mortality. The emergence of new therapies raises the possibility of changing the current glucose-centred therapeutic strategy for a weight-centred approach.
La diabetes mellitus tipo 2 (DM2) es una enfermedad compleja, en la que factores genéticos y epigenéticos interactúan con un ambiente tóxico que promueve el desarrollo de la obesidad1. El riesgo de DM2 aumenta exponencialmente a medida que el índice de masa corporal (IMC) se eleva por encima de 25 kg/m22,3. El exceso de peso es la norma en individuos con DM2, y se estima que el 50 y el 80% tienen IMC > 30 y 25 kg/m2, respectivamente4. Es probable que las medidas antropométricas, como el IMC o la circunferencia de la cintura, infraestimen la prevalencia real de obesidad central, definida como un incremento en la grasa abdominal, en la población con DM25.
Un exceso de grasa abdominal visceral libera ácidos grasos libres al torrente circulatorio, lo que induce un perfil lipídico aterogénico, un depósito de grasa ectópica, una disminución de la secreción de insulina y la interferencia con la señalización de esta en los tejidos muscular y hepático, lo que causa resistencia insulínica. La adiposidad abdominal incrementa además los valores de factores proinflamatorios y protrombóticos, causando disfunción endotelial, daño vascular, hipertensión arterial y, finalmente, un aumento en la incidencia de enfermedad cardiovascular (CV)6. La obesidad es también un factor de riesgo independiente para la microangiopatía diabética1. Además, ciertos tipos de cáncer son más frecuentes en pacientes con obesidad y diabetes. La asociación de todas estas comorbilidades con la DM2 y la obesidad representa un problema sociosanitario de primer orden, que genera un incremento de la mortalidad de estos pacientes y un aumento del gasto sanitario7.
Limitaciones de los tratamientos clásicos en el control de la diabetes mellitus tipo 2La DM2 es una enfermedad multifactorial que muestra una gran heterogeneidad en los procesos patogénicos implicados. Schwartz et al8, basándose en el conocido esquema patogénico de De Fronzo denominado “octeto ominoso”, han abogado recientemente por una reclasificación de la diabetes basada en 11 vías patogénicas de la hiperglucemia, muchas de las cuales contribuyen a la disfunción de la célula beta, denominador común final de todos los tipos de diabetes. Estas vías son la reducción del efecto incretina, el defecto de las células alfa y beta pancreáticas, la resistencia insulínica en hígado, músculo y tejido adiposo, la alteración de la regulación del metabolismo de la glucosa mediada por el sistema nervioso central, las alteraciones de la microbiota intestinal, la inflamación sistémica, la alteración en el vaciamiento gástrico y/o absorción intestinal de glucosa por deficiencia de amilina y el incremento de la reabsorción renal de glucosa. Esta multicausalidad en la patogénesis de la DM2 tiene importantes implicaciones terapéuticas. Ningún fármaco antidiabético en el momento actual cubre la mayoría de los defectos fisiopatológicos, por lo que se precisan en casi todos los pacientes terapias en combinación para mantener un buen control glucémico a largo plazo9. Por otro lado, el tratamiento debería seleccionarse en función de las alteraciones patogénicas conocidas en el paciente y no basarse simplemente en una reducción de la hemoglobina glucosilada (HbA1c). Dichos tratamientos deberían iniciarse precozmente en la historia natural de la DM2, con objeto de prevenir un deterioro progresivo de la célula beta y tendrían que favorecer la pérdida ponderal sin incrementar el riesgo de hipoglucemias, las cuales se asocian con mayor morbimortalidad CV. Además, idealmente deberían tener un efecto beneficioso o al menos neutro sobre otros factores de riesgo CV (FRCV) como la presión arterial (PA) o el perfil lipídico.
Paradójicamente, si exceptuamos la metformina, la mayoría de los tratamientos clásicos para la hiperglucemia en la DM2 (sulfonilureas, glinidas, glitazonas, insulinas) conducen a un incremento de peso, y algunos de ellos (sulfonilureas, glinidas, insulinas) pueden aumentar el riesgo de hipoglucemias10. Otros tratamientos de aparición más reciente no inducen hipoglucemias y tienen un efecto ponderal neutro (inhibidores de alfaglucosidasas, inhibidores de la dipeptidil peptidasa 4 [iDPP4]), pero no favorecen el objetivo de pérdida de peso en el paciente diabético obeso. La ganancia ponderal deteriora en muchos casos otros FRCV y diversas comorbilidades de la obesidad, como la apnea del sueño, la hipoventilación, la osteoartrosis o la insuficiencia cardíaca7. Los tratamientos clásicos, además, no consiguen controlar la glucemia a largo plazo en un porcentaje relevante de pacientes, incluso añadiendo terapias insulínicas complejas11.
El control glucémico intensivo reduce las complicaciones microvasculares de la DM2, por lo que el abordaje glucocéntrico se ha establecido como el modelo terapéutico dominante en todos los consensos y recomendaciones para el tratamiento de esta enfermedad. Sin embargo, los grandes estudios de intervención centrados en el control intensivo de la glucemia con fármacos clásicos no lograron demostrar una reducción de episodios CV en pacientes diabéticos tipo 2, excepto en el subgrupo de pacientes asignados a metformina en el UKPDS12. Los 2 principales problemas observados en estos estudios fueron la ganancia de peso y la aparición de hipoglucemias graves en las ramas de intervención intensiva, lo que podría haber mitigado el potencial efecto favorable del control glucémico, aunque análisis posteriores no han logrado demostrar una relación causal entre ambos factores y un peor pronóstico CV. Es necesario destacar que en el seguimiento epidemiológico de los estudios UKPDS y VADT, los pacientes que habían sido asignados a control intensivo presentaron una reducción de episodios CV varios años después de la finalización del estudio, lo que apuntaría a un efecto legado o de memoria hiperglucémica13,14. Varios metaanálisis sugieren que el tratamiento intensivo de la hiperglucemia puede tener un efecto estadísticamente significativo, pero modesto sobre los episodios CV, especialmente infarto de miocardio no mortal, pero sin efecto significativo sobre la mortalidad15.
Además del efecto CV beneficioso de la metformina, existen datos sobre la seguridad CV de otros fármacos antidiabéticos clásicos. La pioglitazona mostró en el estudio PROactive, un estudio de prevención secundaria, una reducción del 16% de un objetivo compuesto secundario (infarto de miocardio, accidente cerebrovascular y mortalidad CV), pero no en el criterio de valoración principal (que también incluía episodios vasculares periféricos), y se observó un aumento de la incidencia de insuficiencia cardíaca16. Se han publicado 3 estudios de seguridad CV con iDPP4. Los estudios SAVOR-TIMI 53 con saxagliptina, EXAMINE con alogliptina y TECOS con sitagliptina, todos ellos frente a placebo, no mostraron incremento ni reducción del riesgo CV en pacientes de alto riesgo, aunque se observó un 27% de incremento en el riesgo de hospitalización por insuficiencia cardíaca con saxagliptina17–19.
Descenso de peso como factor clave para alcanzar el control glucémicoModificación del estilo de vidaLa pérdida de peso reduce la glucolipotoxicidad y, por tanto, mejora la sensibilidad a la insulina, el control glucémico, la PA y el perfil lipídico y disminuye la necesidad de antidiabéticos en pacientes con DM2, ya sea mediante modificación del estilo de vida (MEV), fármacos o cirugía bariátrica20. Sin embargo, el mantenimiento a largo plazo de los cambios del estilo de vida en el paciente diabético es muy complicado en la práctica clínica. Los pacientes obesos con DM2 presentan una especial dificultad para perder peso con MEV. Una revisión sistemática de 22 ensayos clínicos aleatorizados en DM2, que estudiaron el efecto de la MEV o la terapia conductual frente al tratamiento habitual, con un seguimiento de 1 a 5 años, mostró una diferencia ponderal de tan solo 1,7 kg, sin diferencias significativas en la HbA1c21. El estudio Look-AHEAD22 mostró que una intervención intensiva sobre el estilo de vida en DM2 consigue una pérdida ponderal media al año del seguimiento del 8,6% en el grupo de intervención, frente al 0,7% en el grupo control, obteniendo además un descenso de la HbA1c desde el 7,3 al 6,6%, una mejoría de la PA, del cHDL (colesterol unido a lipoproteínas de alta densidad), del valor de triglicéridos y de la microalbuminuria, y una reducción en el número y/o dosis de fármacos para la diabetes, la hipertensión o la dislipemia. El estudio finalizó antes de la fecha prevista (mediana de seguimiento, 9,6 años), al no alcanzarse el objetivo primario de reducción de morbimortalidad CV23. No obstante, la pérdida de peso fue mayor en el grupo de intervención que en el grupo de control al final del estudio (el 6,0 frente al 3,5%) y la MEV también produjo una mayor reducción en la HbA1c y todos los FRCV, a excepción del cLDL (colesterol unido a lipoproteínas de baja densidad), como consecuencia de un mayor uso de estatinas en el grupo control. Además, la intervención intensiva del estilo de vida consiguió un menor uso de insulina, antihipertensivos y estatinas, un mayor porcentaje de remisión parcial de la DM2, un menor riesgo de enfermedad microvascular, una disminución de incontinencia urinaria, apnea del sueño y depresión, una mejoría de la disfunción sexual, la calidad de vida y la movilidad, y una reducción de los costes sanitarios24.
Una cuestión relevante que surge tras los resultados del estudio Look-AHEAD es si un cambio en el patrón de dieta pautada hubiera cambiado el resultado final del estudio. Aunque la revisión de la American Association of Clinical Endocrinologists20 concluye que no hay diferencias relevantes entre diferentes patrones alimentarios en el tratamiento de la DM2, un reciente metaanálisis encontró una mayor respuesta ponderal y glucémica con la dieta mediterránea en comparación con otros patrones dietéticos25. Esta ventaja ha sido reconocida en las últimas recomendaciones de la American Diabetes Association26. En el estudio PREDIMED, realizado en España en personas con alto riesgo CV, una dieta mediterránea suplementada con aceite de oliva virgen extra o frutos secos redujo la incidencia de morbimortalidad CV en comparación con una dieta baja en grasas27. En el subgrupo de diabéticos (aproximadamente un 50% de la muestra), la reducción de riesgo fue de un 29%, similar a la de la cohorte total. Actualmente está en marcha en España el estudio PREDIMED-plus, un ensayo de prevención primaria en individuos con IMC 27-40 kg/m2 y síndrome metabólico, aleatorizados a un patrón de dieta mediterránea suplementada con aceite de oliva y frutos secos, sin restricción calórica, programa de actividad física ni objetivos de pérdida de peso, o a un patrón de dieta mediterránea hipocalórica suplementada con aceite de oliva y frutos secos, más actividad física y objetivos de pérdida de peso (el 8% de reducción ponderal). El objetivo primario final es una combinación de episodios clínicos CV mayores (infarto, ictus o muerte CV).
Tanto en el metaanálisis de Norris et al21 como en el estudio Look-AHEAD23 se ponen de manifiesto las dificultades de los pacientes con DM2 para alcanzar y mantener el objetivo de pérdida ponderal. Varios factores pueden contribuir a esta observación clínica. En pacientes con resistencia a la insulina, la hiperinsulinemia promueve la síntesis y almacenamiento de triglicéridos en los adipocitos, lo que resulta en una expansión del tejido adiposo. La reducción de la glucosuria impide la pérdida de calorías por la orina. Algunos fármacos antidiabéticos pueden promover una mayor ganancia de peso y acentuar el círculo vicioso6. Finalmente, los pacientes obesos responden a una pérdida de peso inicial mediante una reducción de las hormonas anorexígenas y un incremento de la ghrelina, que persisten incluso cuando el sujeto ha recuperado gran parte del peso, lo que representa una respuesta evolutiva para defender el peso corporal basal28. Por ello, en la gran mayoría de pacientes diabéticos con sobrepeso u obesidad, se precisan tratamientos farmacológicos o quirúrgicos para vencer la resistencia fisiológica del organismo a la pérdida mantenida de peso.
Cirugía bariátrica/metabólicaLos resultados más espectaculares en el tratamiento de la DM2 centrado en la pérdida de peso se han obtenido en pacientes sometidos a cirugía bariátrica (CB). Aparte de la reducción ponderal mantenida en el tiempo (diferencia media -26 kg respecto al grupo control en un metaanálisis)29, uno de los efectos más destacados de la CB es la remisión o mejoría de la DM2. Además, en estudios de cohortes se ha observado una reducción de la mortalidad total (sobre todo por enfermedad CV y cáncer), y de la mortalidad específica para DM respecto a los pacientes que recibieron un tratamiento convencional para la obesidad12.
Los mecanismos exactos para la remisión de la diabetes no son claros y parecen incluir tanto efectos dependientes como independientes de la pérdida de peso. La mejoría en la hiperglucemia se observa pocos días después de la realización de una técnica malabsortiva, como el bypass gástrico en Y de Roux y la derivación biliopancreática, en parte debido al aumento de la liberación de péptido similar al glucagón tipo 1 (GLP1) y posiblemente otros péptidos intestinales30. Por el contrario, las operaciones restrictivas, como la banda gástrica ajustable laparoscópica, parecen mejorar la DM2 como resultado de la pérdida de peso. Dos metaanálisis recientes mostraron tasas de remisión de la diabetes después de la CB del 63,5 y el 72% a corto plazo31,32. Sin embargo, a pesar de los efectos precoces de la CB en la DM2, el 50% de los pacientes que experimentan remisión muestra recidiva posterior de la DM230,33. Los factores generalmente asociados con mayores tasas de remisión de la diabetes incluyen una menor duración y gravedad de la enfermedad, menor edad, procedimientos malabsortivos, mayor porcentaje de pérdida de peso y mantenimiento a largo plazo de la pérdida de peso34. En el momento actual, las principales guías de práctica clínica incluyen la opción de CB en pacientes con DM2 e IMC > 35 kg/m220,35. Recientemente se ha publicado una declaración conjunta de 6 sociedades internacionales de diabetes que extiende la opción de cirugía metabólica, es decir, dirigida al tratamiento de la hiperglucemia, a pacientes con DM2 e IMC de 30-35 kg/m2 con mal control glucémico, a pesar de tratamiento óptimo con fármacos orales e inyectables, considerando la cirugía el tratamiento de elección en pacientes con DM2 y obesidad mórbida, independientemente de su tratamiento de base y control metabólico36.
Tratamiento farmacológicoLos discretos resultados a largo plazo de la MEV y la limitación de la CB a un número reducido de pacientes con DM2 plantea la necesidad de nuevos fármacos que consigan simultáneamente un control de la glucemia y del peso del paciente. En los últimos años han aparecido diversos grupos terapéuticos que cumplen estos requisitos (tabla 1).
Fármacos con efecto favorable sobre el control glucémico y el peso del paciente con diabetes mellitus tipo 2 (DM2).
| • Fármacos aprobados para el tratamiento de la DM2 que secundariamente inducen pérdida de peso |
| – arGLP1: exenatida, exenatida LAR, liraglutida, lixisenatida, albiglutida, dulaglutida |
| – iSGLT2: dapagliflozina, canagliflozina, empagliflozina |
| – Análogos de la amilina: pramlintida* |
| • Fármacos aprobados para el tratamiento de la obesidad que secundariamente mejoran el control glucémico |
| – Inhibidores de la lipasa pancreática: orlistat |
| – Agonistas serotoninérgicos: lorcaserina* |
| – arGLP1 dosis altas: liraglutida 3 mg |
| – Combinaciones de fármacos: bupropión-naltrexona, topiramato- fentermina* |
arGLP1: agonistas del receptor del péptido similar al glucagón tipo 1; iSGLT2: inhibi dores del cotransportador sodio-glucosa tipo 2.
Fármacos antidiabéticos con efecto favorable sobre el peso. Los agonistas del receptor de GLP1 (arGLP1) son una familia farmacológica de péptidos de administración subcutánea que estimulan el receptor del GLP1 humano, aunque ya existen algunos de administración oral, como semaglutida, en desarrollo clínico (tabla 2). Desde un punto de vista práctico, resulta útil la clasificación de los arGLP1 en agonistas de vida media corta y larga7. Los arGLP1 de vida media larga producen una estimulación prolongada del receptor de GLP1, que condiciona un mejor control de la glucemia basal y de la HbA1c. Los arGLP1 de vida media corta tienen un efecto menos marcado sobre la glucemia en ayunas y la secreción de insulina basal, pero inducen un descenso más acentuado de la glucemia posprandial en la comida en la que se administran. El efecto sobre la glucemia posprandial de los arGLP1 de vida media corta parece mediado por un retardo en el vaciamiento gástrico, que condiciona una absorción más lenta de glucosa, puesto que los valores de insulina posprandial tras su administración son bajos. Por el contrario, el efecto sobre el vaciamiento gástrico de los arGLP1 de vida media larga se pierde tras unas semanas de tratamiento por un mecanismo de taquifilaxia37. Los arGLP1 reducen el apetito e incrementan la sensación de saciedad. El efecto parece estar mediado por receptores vagales periféricos y receptores localizados en diversas regiones del sistema nervioso central7.
Clasificación de los agonistas del receptor del péptido similar al glucagón tipo 1 (arGLP-1).
| • Por su estructura química: |
| – Incretinomiméticos (derivados de la exendina 4): exenatida, exenatida LAR, ITCA 650 (bomba exenatida)*, lixisenatida, efpeglenatida* |
| – Análogos de GLP1 humano: liraglutida, albiglutida, dulaglutida, semaglutida* |
| • Por su duración de acción: |
| – Vida media corta: exenatida, lixisenatida |
| – Vida media intermedia: liraglutida |
| – Vida media larga: exenatida LAR, albiglutida, dulaglutida, semaglutida*, efpeglenatida*, ITCA 650 (bomba exenatida)* |
| • Por el tamaño molecular: |
| – Pequeño tamaño: exenatida, exenatida LAR, ITCA 650 (bomba exenatida)*, lixisenatida, liraglutida, semaglutida* |
| – Gran tamaño: dulaglutida, albiglutida, efpeglenatida* |
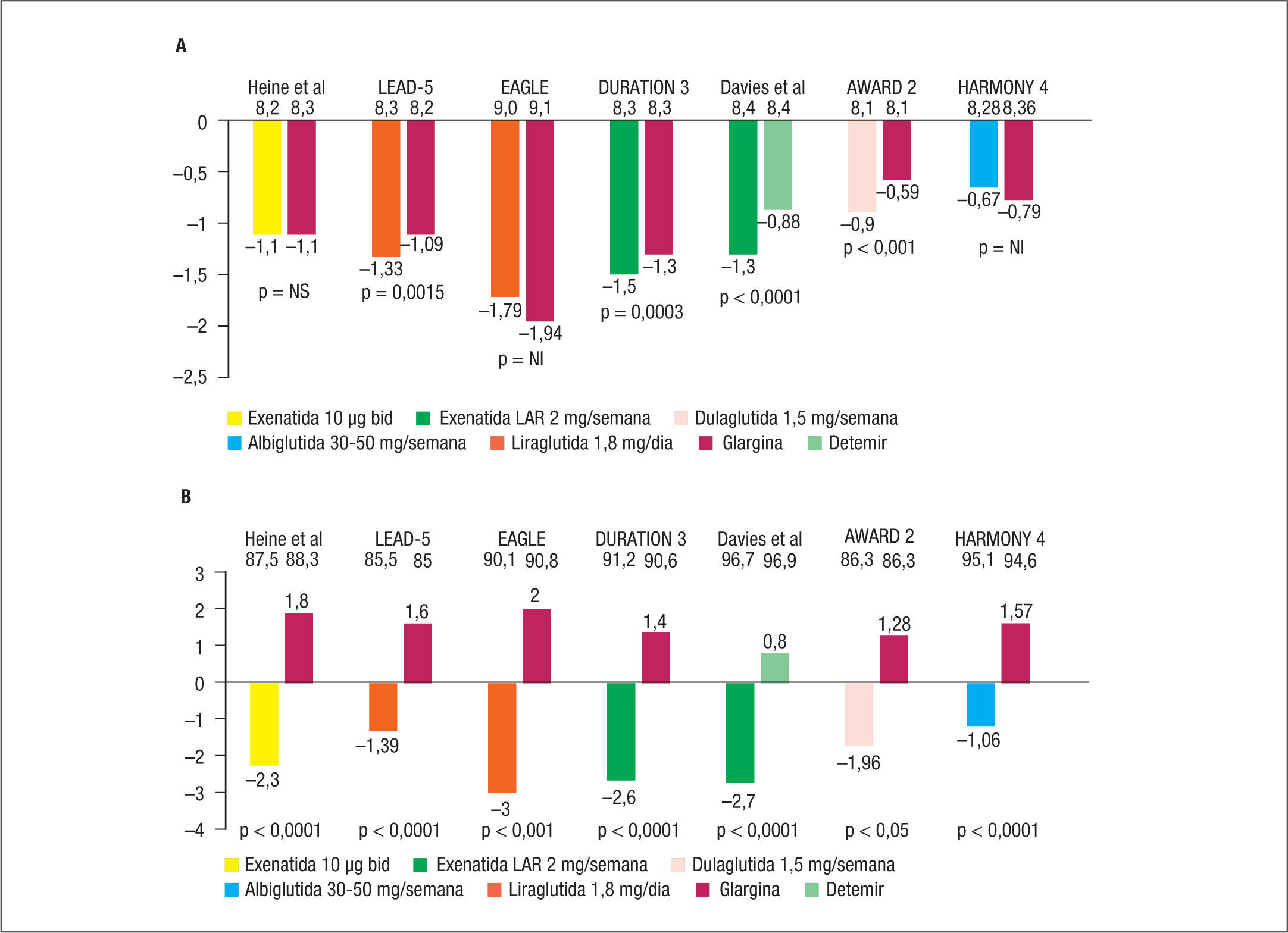
El desarrollo clínico de los arGLP1 comprende múltiples ensayos clínicos aleatorizados, controlados con placebo o comparador activo.7 Estos ensayos clínicos han mostrado no inferioridad o superioridad de los arGLP1 frente a la mayoría de fármacos antidiabéticos en el descenso de la HbA1c y el peso. Además parecen tener una mayor durabilidad de efecto que otros fármacos como las sulfonilureas38. Especialmente relevante es la superioridad o no inferioridad en el control glucémico de los arGLP1 cuando se comparan con la insulinoterapia basal, incluso con HbA1c muy elevadas, a pesar de la opinión preconcebida entre muchos médicos de que la insulina es el fármaco hipoglucemiante más potente (fig. 1)39. Las propiedades complementarias de los arGLP1 y las insulinas basales han propiciado su uso en combinación, e incluso ya está disponible una combinación fija de liraglutida/degludec en Europa40. La combinación fija lixisenatida/glargina ha completado su desarrollo clínico y se encuentra a la espera de aprobación por las agencias reguladoras41.
Estudios comparativos directos entre agonistas del receptor del péptido similar ai glucagón tipo 1 (arGLP1) e insulinas basaies. A) Efecto sobre la hemoglobina glucosilada (HbA1c). B) Efecto sobre el peso. NI: cumple criterio de no inferioridad; NS: diferencia no significativa. Modificada de referencia 39.
Los arGLP1 presentan beneficios adicionales a su eficacia antidiabética intrínseca, como bajo riesgo de hipoglucemias, reducción del peso corporal y de la PA sistólica y mejoría del perfil lipídico. La reducción de peso se produce fundamentalmente a expensas de grasa, especialmente de grasa visceral. Recientemente se han comunicado los resultados de 2 estudios de seguridad CV con arGLP1. En el estudio ELIXA, la lixisenatida (un arGLP1 incretinomimético de vida media corta) tuvo un efecto neutro sobre la morbimortalidad CV frente a placebo en pacientes con DM2 y síndrome coronario agudo42. Sin embargo, en el estudio LEADER, la liraglutida (un análogo de GLP1 humano de vida media intermedia y mayor efecto antihiperglucémico que la lixisenatida) redujo de forma significativa en un 13% un objetivo compuesto de mortalidad CV, infarto no mortal o ictus no mortal frente a placebo en pacientes con DM2 y alto riesgo CV43. La reducción de la mortalidad CV fue del 22% y se observó además una reducción del 22% en episodios microvasculares renales. No hubo una reducción del riesgo de hospitalización por insuficiencia cardíaca. Los autores argumentan que la reducción de morbimortalidad CV con liraglutida, probablemente sea consecuencia de una modificación en la progresión de la enfermedad vascular aterosclerótica inducida por sus efectos pleiotrópicos. La semaglutida, un análogo de GLP1 humano de administración semanal, también ha mostrado una reducción significativa de morbimortalidad CV en pacientes con DM2 y alto riesgo CV (estudio SUSTAIN 6), pero los resultados están pendientes de publicación.
Las náuseas, los vómitos y la diarrea son los efectos adversos más frecuentes en pacientes tratados con arGLP1. Los arGLP1 de vida media larga inducen un ligero incremento de la frecuencia cardíaca, cuyas causas y relevancia clínica aún se están estudiando37. Se han comunicado algunos casos de pancreatitis aguda en pacientes tratados con estos fármacos en la fase de poscomercialización. Sin embargo, un análisis integrado de 19 ensayos clínicos con exenatida, que incluyó 5.594 pacientes, y los estudios ELIXA y LEADER, no encontraron ningún incremento en el riesgo de pancreatitis aguda42–44. En el estudio LEADER hubo una mayor frecuencia de eventos agudos por litiasis biliar43.
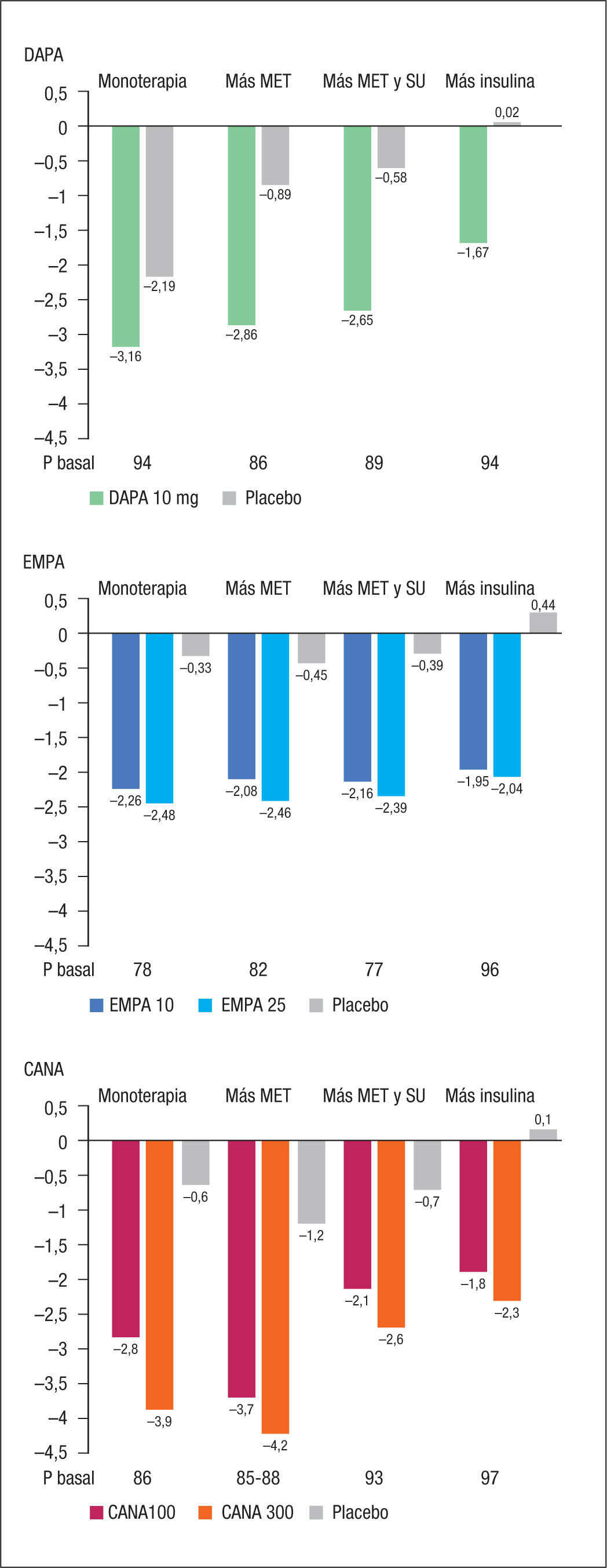
Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) son un grupo de fármacos de administración oral que inducen la eliminación de 60-80 g de glucosa al día por orina45. La glucosuria origina un descenso de la glucemia basal, la glucemia posprandial y la HbA1c, así como una disminución de peso secundaria a la pérdida de calorías por la orina, que se acompaña de una reducción del perímetro de la cintura y de la masa grasa, especialmente de tejido adiposo visceral (fig. 2). Datos experimentales en roedores y estudios clínicos en pacientes con DM2 sugieren que la glucosuria inducida por dapagliflozina se acompaña de hiperfagia compensadora que limita la pérdida ponderal46,47. En ensayos clínicos con comparador activo se han mostrado no inferiores o superiores a otros antidiabéticos orales en el descenso de la HbA1c, siendo superiores en descenso de peso o PA7,48. La incidencia de hipoglucemias es similar a la observada con placebo. El principal efecto adverso del grupo son las infecciones genitales, cuya frecuencia se duplica con relación al comparador, especialmente en mujeres (7-10%), aunque estas infecciones suelen ser leves7. Recientemente se han comunicado casos de cetoacidosis diabética euglucémica en pacientes tratados con iSGLT2, algunos de ellos diabéticos tipo 1, identificándose algunos factores desencadenantes como cirugía, ingesta de alcohol o reducción inapropiada de la dosis de insulina49. No se ha observado, sin embargo, aumento de riesgo de cetoacidosis en ensayos clínicos a largo plazo50. Se ha descrito una leve disminución de la masa ósea femoral con canagliflozina a los 2 años en pacientes con DM2 de entre 55 y 80 años, acompañada de un incremento en los marcadores de formación y resorción ósea, que se atribuye parcialmente a la pérdida ponderal51. En el estudio de seguridad CV CANVAS, la canagliflozina incrementó el riesgo de fracturas en miembros superiores e inferiores en comparación con placebo52. Dado el inicio precoz de la aparición de fracturas con canagliflozina en este estudio, es poco probable que dicho efecto adverso sea secundario a la pérdida de masa ósea, sino más bien a la mayor frecuencia de caídas como consecuencia de la depleción de volumen inducida por el fármaco. No se ha observado aumento de riesgo de fracturas con otros iSGLT2 en las indicaciones autorizadas.
Efecto sobre el peso de los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) frente a placebo. Todas las diferencias son estadísticamente significativas. CANA: canagliflozina; DAPA: dapagliflozina; EMPA: empagliflozina; MET: metformina; SU: sulfonilureas. Modificada de referencia 7.
Recientemente se ha comunicado por la Food and Drug Administracion (FDA) y la European Medicines Agency (EMA) un incremento de las amputaciones de los dedos de los pies en los grupos de canagliflozina de los estudios CANVAS y CANVAS-R, cuya etiología y relevancia clínica actualmente se está evaluando53. Este efecto adverso no se ha observado con el resto de iSGLT2. Además, la FDA también ha comunicado algunos casos de insuficiencia renal aguda en pacientes tratados con canagliflozina o dapagliflozina, relacionados en su mayor parte con depleción de volumen54. Paradójicamente, como veremos más adelante, los iSGLT2 se caracterizan por un efecto protector renal a largo plazo.
Los beneficios CV de estos fármacos se están estudiando en ensayos clínicos cuyo objetivo primario es la morbimortalidad CV. El estudio EMPA-REG OUTCOME, publicado en 2015, mostró que la empagliflozina redujo en pacientes diabéticos con enfermedad CV un objetivo compuesto de morbimortalidad CV (14%), la hospitalización por insuficiencia cardíaca (35%), la mortalidad CV (38%) y la mortalidad por cualquier causa (32%)50. El objetivo compuesto renal (progresión a macroalbuminuria, duplicación de la creatinina, inicio de diálisis o muerte de causa renal) se redujo en un 39%55. Hubo una mejoría global en los FRCV de los pacientes asignados a empagliflozina (HbA1c, peso, cintura, PA sistólica y cHDL), excepto cLDL, que mostró un leve incremento. A diferencia del efecto progresivo de reducción de riesgo CV con liraglutida en el estudio LEADER, la reducción de riesgo con empagliflozina se produce de forma muy precoz y parece mediada fundamentalmente por cambios hemodinámicos causados por el fármaco sobre la precarga, la poscarga y la modulación del tono arteriolar aferente en el riñón, aunque no es descartable un efecto pleiotrópico sobre múltiples FRCV e incluso la inducción de un estado cetogénico que proporcione sustratos con mayor eficiencia energética (cuerpos cetónicos) al corazón y al riñón.
En definitiva, los excelentes resultados obtenidos en los estudios de seguridad CV LEADER y EMPA-REG OUTCOME apoyan la utilización en la DM2 de fármacos antidiabéticos con capacidad de mejorar simultáneamente varios FRCV, entre ellos la pérdida ponderal, con bajo riesgo de hipoglucemias.
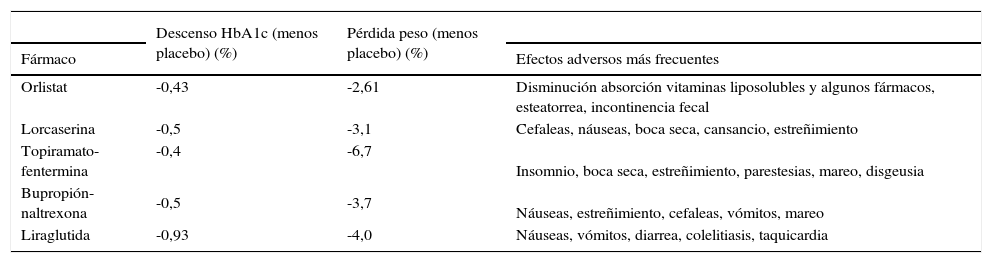
Fármacos para el tratamiento de la obesidad con efecto favorable sobre el control glucémico. Algunos fármacos autorizados para la pérdida de peso en el paciente obeso han mostrado en ensayos clínicos un beneficio adicional sobre el control glucémico en los pacientes con DM256 (tabla 3).
Efecto de fármacos aprobados para la obesidad en pacientes con diabetes mellitus tipo 2 (DM2).
| Descenso HbA1c (menos placebo) (%) | Pérdida peso (menos placebo) (%) | ||
|---|---|---|---|
| Fármaco | Efectos adversos más frecuentes | ||
| Orlistat | -0,43 | -2,61 | Disminución absorción vitaminas liposolubles y algunos fármacos, esteatorrea, incontinencia fecal |
| Lorcaserina | -0,5 | -3,1 | Cefaleas, náuseas, boca seca, cansancio, estreñimiento |
| Topiramato-fentermina | -0,4 | -6,7 | Insomnio, boca seca, estreñimiento, parestesias, mareo, disgeusia |
| Bupropión-naltrexona | -0,5 | -3,7 | Náuseas, estreñimiento, cefaleas, vómitos, mareo |
| Liraglutida | -0,93 | -4,0 | Náuseas, vómitos, diarrea, colelitiasis, taquicardia |
El orlistat, un inhibidor de la lipasa gastrointestinal, ha demostrado una reducción de un 3% del peso basal a los 6-12 meses restando el efecto del placebo1. Datos agrupados de 7 ensayos clínicos controlados con placebo mostraron un descenso significativo de la HbA1c del 0,74% en pacientes diabéticos57. La lorcaserina es un agonista selectivo serotoninérgico 2C que induce una pérdida media de unos 3 kg restando el efecto del placebo58. El estudio BLOOM-DM con lorcaserina en pacientes diabéticos mostró un descenso de la HbA1c del 0,9%, estadísticamente superior al placebo59. La combinación del antiepiléptico topiramato con el agonista noradrenérgico fentermina es el fármaco más potente en la actualidad para el tratamiento de la obesidad, y logra pérdidas > 10% del peso basal a 2 años60. En pacientes diabéticos, esta combinación consigue también un descenso de la HbA1c del 1,6%, estadísticamente superior al placebo61. La combinación del inhibidor de la recaptación de dopamina y noradrenalina bupropión con el antagonista opiáceo naltrexona consigue reducciones de hasta el 5,2% restando el efecto del placebo1. En el estudio COR-Diabetes en DM2 se redujo significativamente la HbA1c en un 0,6%62. Finalmente, el arGLP1 liraglutida ha sido autorizado para el tratamiento de la obesidad a dosis altas (3 mg) tras su desarrollo clínico en el programa SCALE, que también incluyó diabéticos. En el estudio SCALE Diabetes, liraglutida 3 mg logró una pérdida ponderal del 6%, frente al 2% el placebo, y una reducción de la HbA1c del 1,3%, frente al 0,3% el placebo63.
Peso y adherencia terapéuticaEn los pacientes con DM2 existe una adherencia al tratamiento de alrededor de un 60%, lo que indica que muchos pacientes no están recibiendo el beneficio teórico de estos fármacos64. Una mala adherencia compromete la efectividad y seguridad del tratamiento antidiabético, lo que se asocia a una mayor morbimortalidad. Por el contrario, una buena adherencia se asocia a mejor control glucémico, menor frecuencia de hospitalización, menor absentismo laboral y menor coste sanitario65.
En los últimos años se han publicado varios estudios que muestran que una aproximación adipocéntrica en el manejo de la DM2 se acompaña de un mayor grado de adherencia terapéutica. En la encuesta del estudio SHIELD, los pacientes que perdieron peso tenían una adherencia a la medicación significativamente superior a la de los pacientes que ganaron peso65. Se apreció además una relación directa entre porcentaje de peso perdido y grado de adherencia al tratamiento. En un estudio danés se estudiaron las preferencias de pacientes con DM2 en relación con varias características relativas al tratamiento de la diabetes. Los pacientes dieron un mayor valor a la pérdida de peso (3-6 kg), seguido de un descenso de 1 punto en la HbA1c, estando dispuestos a aceptar la inyección si ello iba asociado a una pérdida de 1,4 kg66. Un estudio británico llegó a conclusiones similares en pacientes tratados con fármacos incretínicos, y los pacientes con mayor IMC, HbA1c más elevada y mayor tiempo de evolución de la DM2 mostraron una mayor preferencia por arGLP1 frente a iDPP4, a pesar de la inyección67. Los cuestionarios de calidad de vida relacionados con el grado de satisfacción con el tratamiento y con la pérdida de peso muestran mejores resultados con arGLP1 e iSGLT268,69.
ConclusionesUn nuevo modelo terapéutico para el tratamiento de la DM2 es ahora posible, dado que disponemos de un número creciente de fármacos para el tratamiento de la diabetes y la obesidad que simultáneamente mejoran la HbA1c y el IMC. Algunos expertos han mostrado su opinión favorable a un cambio al modelo adipocéntrico. La combinación de varios fármacos antidiabéticos con efectos beneficiosos sobre el peso se está valorando en ensayos clínicos. En breve se publicarán los datos del estudio DURATION 8, que estudia la combinación de dapagliflozina con exenatida LAR en comparación con cada uno de los fármacos por separado en pacientes con DM2 mal controlados con metformina.
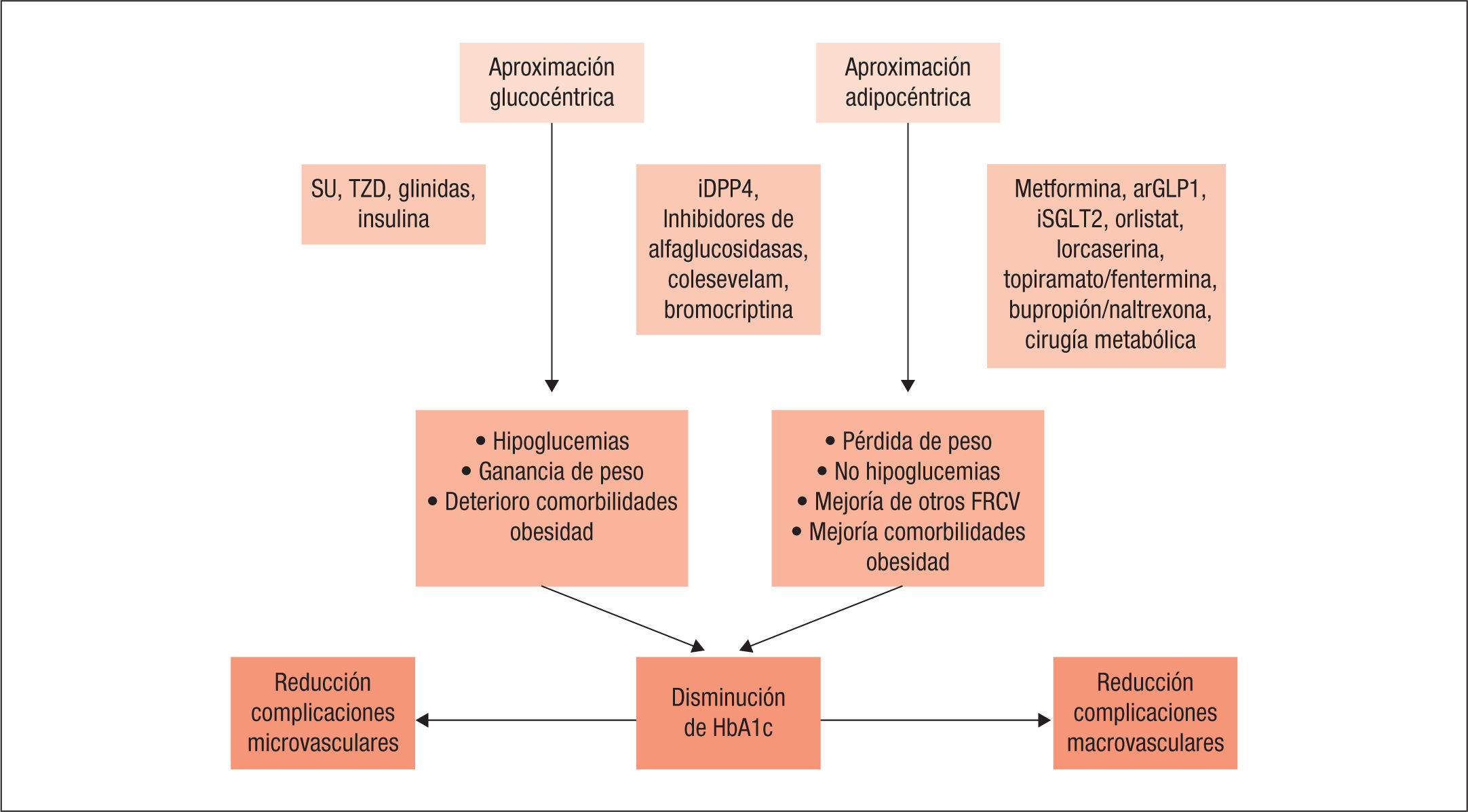
En conclusión, los beneficios obtenidos en el estudio Look-AHEAD en pacientes con DM2 tras pérdida ponderal, los excelentes resultados de la CB en pacientes con DM2, los impactantes resultados de los estudios de seguridad CV con empagliflozina y liraglutida y la aparición de varios grupos farmacológicos que favorecen la pérdida de peso con potencial efecto sinérgico sobre varios FRCV, apoyan la implementación del control integral del diabético a través de la pérdida ponderal (fig. 3).
Esquema teórico de las estrategias giucocéntrica y adipocéntrica en el tratamiento de la diabetes meilitus tipo 2. Los fármacos situados en el centro tienen un efecto ponderal neutro. La superioridad de una de ellas sobre la morbimortalidad, todavía no se ha estudiado en ensayos clínicos aleatorizados. arGLP1: agonistas del receptor del péptido similar al glucagón tipo 1; FRCV: factores de riesgo cardiovascular; HbA1c: hemoglobina glucosilada; iDPP4: inhibidores de la dipeptidil peptidasa 4; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; SU: sulfonilureas; TZD: tiazolidindionas. Modificada de referencia 12.
El autor declara que ha recibido honorarios en los últimos 5 años por conferencias, actividades formativas, asesorías científicas y trabajos de investigación de las siguientes empresas farmacéuticas: Abbott, Almirall, AstraZeneca, Boehringer, Esteve, Ferrer, Janssen, Lilly, MSD, Novo-Nordisk, Roche y Sanofi.