La pérdida de peso puede mejorar el control metabólico de los pacientes con diabetes mellitus tipo 2, aunque la eficacia del tratamiento convencional es limitada. La cirugía bariátrica ha demostrado que, además de producir pérdidas de peso importantes y mantenidas, puede en la mayoría de casos mejorar o resolver la diabetes. Los cambios anatómicos y la modificación en la secreción de las hormonas intestinales pueden explicar la mayor eficacia de las técnicas malabsortivas. En la actualidad la cirugía bariátrica es una alternativa terapéutica en los sujetos diabéticos tipo 2 con obesidad grave de difícil control metabólico con el tratamiento convencional y la investigación se centra en el efecto de las hormonas intestinales, en desarrollar nuevas técnicas y en conocer qué papel puede jugar la cirugía bariátrica en sujetos sin obesidad.
Weight loss can improve metabolic control in patients with type 2 diabetes mellitus but the results of conventional therapy in this respect have been discouraging. Besides achieving significant and sustained weight loss, bariatric surgery can improve or resolve type 2 diabetes mellitus in the majority of patients. Anatomical modifications and changes in the secretion of intestinal hormones can explain the superiority of malabsorptive techniques. Currently, bariatric surgery offers a therapeutic alternative for type 2 diabetes patients with severe obesity and poor metabolic control under conventional therapy. Ongoing research will provide insights regarding the effect of intestinal hormones, new surgery techniques and the possible benefits of bariatric surgery in non-obese patients.
En España, la diabetes mellitus tipo 2 afecta a 2,5 millones de personas1 y comporta un elevado coste social y económico debido principalmente a la elevada morbimortalidad que causan las complicaciones crónicas micro y macrovasculares2. La obesidad es el principal factor de riesgo para la diabetes; así, un 90% de los pacientes con diabetes tiene un índice de masa corporal (IMC) ≥ 25 kg/m2, y alrededor de un 50%, obesidad3. El cambio en el estilo de vida de los últimos años, caracterizado por un consumo de alimentos de alta densidad calórica junto a un progresivo sedentarismo, está provocando un aumento de la obesidad tanto en países industrializados como en aquellos en vías de desarrollo4, hecho que contribuye de una forma decisiva al incremento progresivo de la prevalencia de diabetes. En este sentido, se estima que a escala mundial la epidemia de diabetes tipo 2 aumentará de los 240 millones actuales a más de 380 millones en el año 20255.
Actualmente, a pesar de disponer de un amplio arsenal terapéutico para la diabetes tipo 2, el control metabólico que se consigue en gran parte de los pacientes no es el recomendado. Además, cuando la obesidad se asocia a la diabetes, el control metabólico se convierte en un auténtico reto clínico. Así, varios fármacos para tratar la diabetes, y entre ellos la insulina, tienen un efecto perjudicial sobre el peso. Además, el aumento ponderal puede disminuir la eficacia de los tratamientos convencionales e incide negativamente en otros aspectos como la motivación y/o el cumplimiento6. Los principales estudios que evalúan la eficacia de estrategias terapéuticas intensivas en la diabetes tipo 2 han demostrado que no todos los pacientes del grupo de tratamiento intensivo alcanzan los objetivos de control metabólico y que, además, los sujetos de este grupo presentan una mayor ganancia ponderal con respecto al grupo de tratamiento convencional7,8.
Poires et al9 en 1995 fueron los pioneros en hablar de «curación» de la diabetes tipo 2 con la cirugía bariátrica. Describieron, en una serie de 141 sujetos, la normalización del metabolismo de la glucosa en el 83% de los pacientes con diabetes tipo 2 y en el 99% de los que tenían intolerancia oral a la glucosa. Desde entonces, trabajos posteriores han definido con mayor precisión la eficacia de las diferentes técnicas de cirugía bariátrica, los factores predictores y los mecanismos implicados. En la actualidad, la American Diabetes Association contempla la cirugía bariátrica como una opción terapéutica a tener en cuenta en la diabetes tipo 2 con un IMC ≥ 35 kg/m2, especialmente si tiene comorbilidades asociadas y es de difícil control farmacológico10.
La cirugía bariátricaLa evaluación y control de un paciente candidato a cirugía bariátrica requiere un equipo multidisciplinar, en el que figuran cirujanos, endocrinólogos, dietistas, anestesistas y psiquiatras, entre otros. Este procedimiento quirúrgico está cada vez más presente en la cartera de servicios hospitalarios, y esto se ve reflejado en un aumento progresivo del número de intervenciones. En este sentido, en Cataluña se pasó de 51 intervenciones en 1996 a 544 en el año 200311.
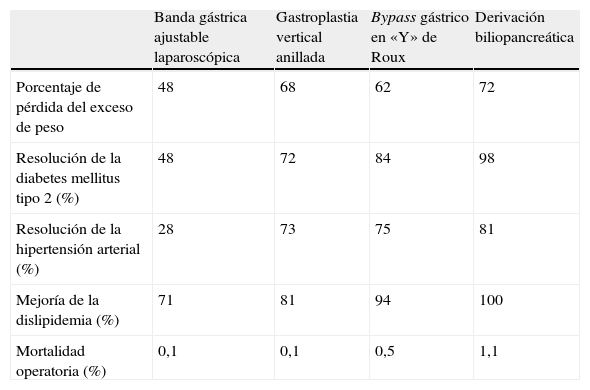
Las técnicas de cirugía bariátrica se clasifican según el mecanismo para perder peso en restrictivas, malabsortivas o mixtas. Las técnicas restrictivas como la banda gástrica ajustable laparoscópica (BGAL) o la gastroplastia vertical anillada (GVA) disminuyen la capacidad del estómago con la consiguiente reducción de la ingesta alimentaria. Las técnicas malabsortivas como la derivación biliopancreática (DBP) acortan la longitud del intestino, disminuyendo la absorción de nutrientes. Producen mayores pérdidas ponderales y más mantenidas, pero con una mayor mortalidad peroperatoria y un mayor riesgo de déficits nutricionales12. El bypass gástrico en «Y» de Roux laparoscópico (BGYRL) es una técnica mixta que combina la restricción gástrica mediante una gastrectomía y la malabsorción mediante el bypass del duodeno y la parte proximal de yeyuno. Esta técnica ofrece un mejor equilibrio entre eficacia y efectos adversos, por lo que se ha convertido en la técnica de referencia y la más utilizada11,13. En la tabla 1 se exponen los principales resultados del metaanálisis de Buchwald et al12 que incluyó 22.094 pacientes, y evaluó la pérdida de peso, el efecto sobre las comorbilidades y la mortalidad peroperatoria de las diferentes técnicas de cirugía bariátrica.
Resultados de las diferentes técnicas de cirugía bariátrica
| Banda gástrica ajustable laparoscópica | Gastroplastia vertical anillada | Bypass gástrico en «Y» de Roux | Derivación biliopancreática | |
| Porcentaje de pérdida del exceso de peso | 48 | 68 | 62 | 72 |
| Resolución de la diabetes mellitus tipo 2 (%) | 48 | 72 | 84 | 98 |
| Resolución de la hipertensión arterial (%) | 28 | 73 | 75 | 81 |
| Mejoría de la dislipidemia (%) | 71 | 81 | 94 | 100 |
| Mortalidad operatoria (%) | 0,1 | 0,1 | 0,5 | 1,1 |
Fuente: resultados del metaanálisis de Buchwald et al12 que incluyó 22.094 pacientes.
La cirugía bariátrica es considerada por una parte de la opinión pública y por algunos profesionales de la salud como un procedimiento peligroso y como la última alternativa para tratar la obesidad. Sin embargo, el riesgo de complicaciones y la mortalidad peroperatoria no son superiores a los de otras cirugías abdominales como la colecistectomía14. Además, este riesgo debe ponderarse con los beneficios a largo plazo como la mejoría de las comorbilidades12, la disminución de la mortalidad15 y ser coste-eficiente16. Un estudio prospectivo sueco de base poblacional realizado en 2.010 obesos intervenidos de cirugía bariátrica (7,4% con diabetes tipo 2) describió una disminución del 30% en el riesgo global de mortalidad, a expensas fundamentalmente de la cardiovascular15.
Efectos en la diabetes tipo 2Por regla general, los estudios de cirugía bariátrica definen resolución de la diabetes cuando el paciente mantiene valores normales de glucemia y/o hemoglobina glucosilada, sin necesidad de terapia farmacológica. Hay que resaltar dos estudios que confirman la superioridad de la cirugía bariátrica con respecto al tratamiento médico convencional de la obesidad, en conseguir resolución de la diabetes a largo plazo17,18. Uno prospectivo del grupo Swedish Obese Subjects, con 4.047 pacientes obesos, en el que presentaron criterios de resolución de diabetes un 72% del grupo quirúrgico respecto a sólo un 21% en el grupo de tratamiento convencional17. Asimismo, la prevalencia de diabetes tipo 2 a los 8 años aumentó en el grupo control y se mantuvo estable en los intervenidos de cirugía bariátrica. Por otra parte, Dixon et al18 diseñaron uno de los escasos ensayos clínicos aleatorizados en cirugía bariátrica y demostraron que la resolución de la diabetes tipo 2 era posible en un 73% de los sujetos tratados con BGAL respecto a un 13% en el grupo control.
La tasa de resolución de diabetes con la cirugía bariátrica muestra una gran variabilidad, hecho atribuible a las limitaciones que presentan los diferentes estudios, entre las que cabe citar que pocos son aleatorizados, con frecuencia datos de interés no están disponibles, se utilizan diferentes criterios para definir resolución o no se incluyen pacientes consecutivos19. Quizás la mejor referencia para conocer la tasa de resolución de diabetes sea el metaanálisis de Buchwald et al12, en el que aproximadamente un 15% de los sujetos tenían diabetes, y de éstos un 76,8% presentaron resolución y un 86% mejoría o resolución.
Predictores de resolución de la diabetes tipo 2Uno de los principales factores que va a determinar la probabilidad de curación de diabetes en un paciente sometido a cirugía bariátrica va a ser el tipo de técnica utilizada. En el metaanálisis anterior la mayor tasa de resolución, con un 98,9%, fue para la DBP, seguida del BGYRL, con un 84%, y por último las técnicas restrictivas, 72% para la GVA y 48% para la BGAL12. Otros factores que predicen la resolución de la diabetes con la cirugía bariátrica son un menor tiempo de evolución de la diabetes, el tratamiento con fármacos orales respecto a la insulinoterapia y un menor perímetro de cintura abdominal20,21. Por lo tanto, los pacientes con diabetes tipo 2 con un mayor deterioro de la célula beta, porque tienen un mayor tiempo de evolución y requieren la administración exógena de insulina para controlar las glucemias, son los que se beneficiarán menos de la cirugía bariátrica.
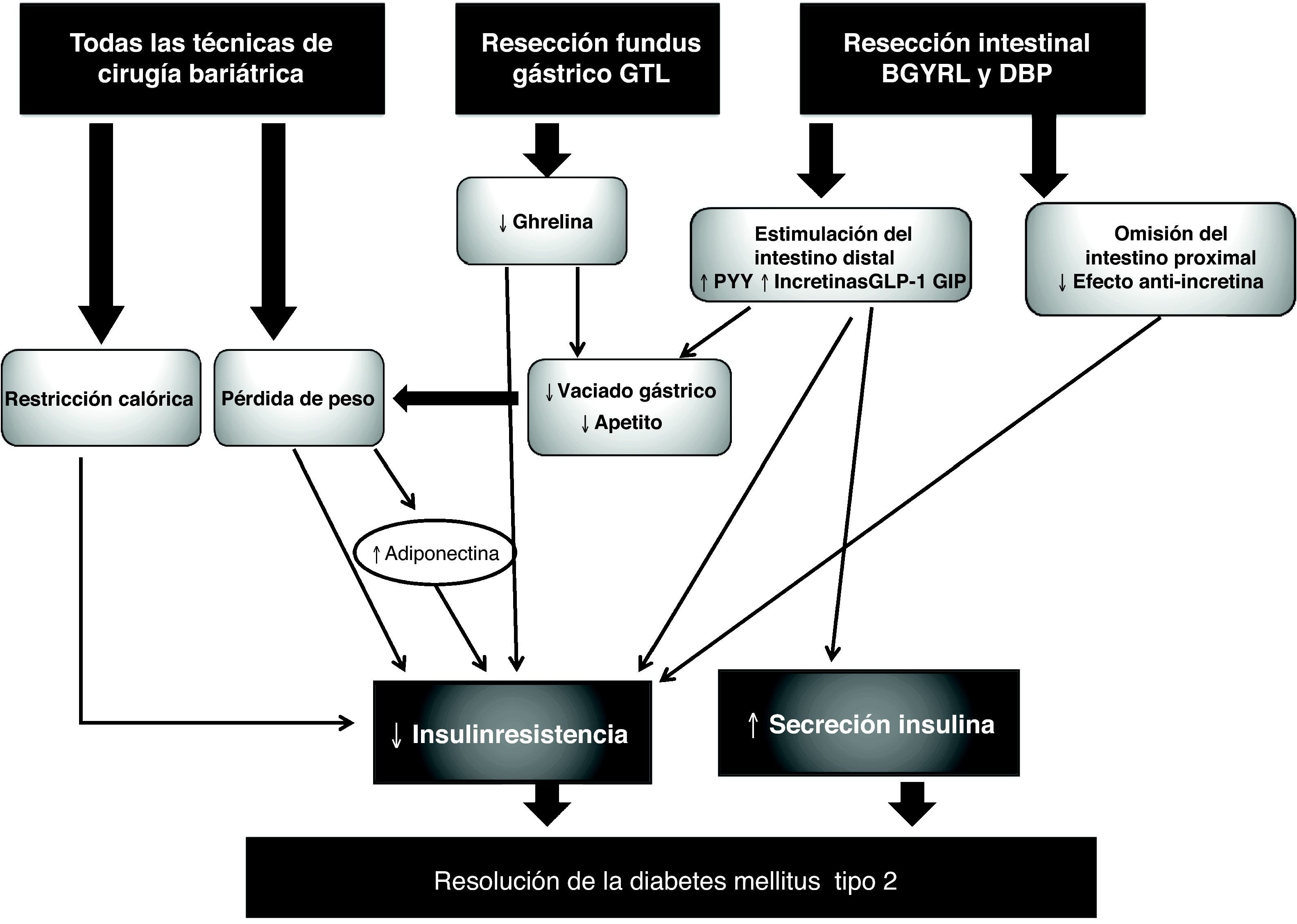
Mecanismos implicados en la mejoría de la diabetes tipo 2Los mecanismos fisiopatológicos por los cuales la cirugía bariátrica mejora la diabetes no están esclarecidos, pero parecen ser una combinación de la pérdida de peso, la disminución de la ingesta calórica, cambios hormonales y mecanismos relacionados con las modificaciones anatómicas tras la cirugía. En la figura 1 se esquematizan los posibles mecanismos de resolución de la diabetes con la cirugía bariátrica.
Cuando empezó a realizarse la cirugía bariátrica, se especulaba que el efecto más evidente de la intervención, la pérdida de peso, era la única causante de la resolución de la diabetes. Se ha descrito una relación directa entre la pérdida de peso y la resolución de la diabetes con técnicas restrictivas como la BGAL18,22. En cambio, en las técnicas con componente malabsortivo la mejoría del metabolismo de la glucosa va más allá de la pérdida de peso y se produce a los pocos días, cuando aún no se han conseguido pérdidas de peso importantes9. Se ha descrito mejoría de la resistencia a la insulina a los seis días medida mediante test de tolerancia oral a la glucosa y HOMA23, y aumento de la sensibilidad a la insulina a los 30 días de la cirugía valorada mediante clamp euglucémico24.
Efecto de la disminución de la ingesta calórica en la glucemia basalLos pacientes sometidos a cirugía bariátrica reciben en el postoperatorio una dieta con un contenido calórico mínimo, que va progresando hasta alcanzar una dieta completa en las siguientes semanas. La disminución de la ingesta calórica tiene efectos beneficiosos sobre el metabolismo de la glucosa25. Aun así, varios estudios sugieren que éste no es el principal factor implicado en la reducción de la glucemia plasmática. Así, no se podría explicar por qué las diferentes técnicas producen diferentes tasas de resolución de diabetes12, ni por qué la resolución con las técnicas malabsortivas se produce de forma más precoz23. En este sentido, Lima et al26 constataron que los pacientes diabéticos en los que las concentraciones de glucosa no habían mejorado con una dieta baja en calorías sí lo habían hecho tras un BGYRL.
Efectos hormonalesEl hecho de que la resolución de la diabetes tipo 2 después de BGYRL y la DBP se produzca cuando aún no se han alcanzado pérdidas ponderales significativas, y que la tasa de curación sea mayor que con las técnicas restrictivas, sugiere la participación de algún mecanismo hormonal intestinal en la mejoría del metabolismo glucídico9. A continuación se expone de forma breve la fisiopatología y el efecto de la cirugía bariátrica en los péptidos y hormonas más explorados.
Se conocen dos hormonas con efecto incretina: el glucagon like peptide 1 (GLP-1) y el glucose-dependent insulinotropic peptide (GIP). El GLP-1 se sintetiza en las células L situadas en el íleon distal y el GIP en las células K del intestino proximal. El estímulo para su secreción es el paso de nutrientes por el intestino. Ambos péptidos actúan directamente sobre la célula beta, estimulando la secreción de insulina. Además, GLP-1 enlentece la motilidad gástrica, ayudando a controlar la glucemia posprandial, induce saciedad estimulando el sistema nervioso central y puede mejorar la sensibilidad a la insulina a nivel muscular27,28. La secreción de GLP-1 está atenuada en sujetos obesos y en mayor medida en sujetos con diabetes29. La administración continua de GLP-1 en pacientes diabéticos produce una disminución de los valores de glucosa, hemoglobina glucosilada y del peso30. En los últimos años se han desarrollado fármacos para tratar la diabetes basados en estas hormonas: los análogos de GLP-1 e inhibidores de la DPP-4, la enzima que cataboliza el GLP-131. Los valores de GLP-1 aumentan después del BGYRL y la DBP de forma precoz e independiente de la pérdida de peso32,33. También se ha documentado un incremento de GLP-1 con las técnicas restrictivas, pero en estudios comparativos siempre es menor al observado con las técnicas puramente malabsortivas o mixtas34,35. La respuesta de GIP tras la cirugía bariátrica ha sido menos analizada y, aunque los datos disponibles son contradictorios, parece existir un ascenso del GIP los primeros días después del BGYRL, para volver a disminuir a las pocas semanas32,36. No se ha descrito ningún efecto con las técnicas restrictivas34,35.
El péptido YY se secreta, al igual que el GLP-1, en las células L del yeyuno distal. Aumenta la saciedad y enlentece el vaciado gástrico37, por lo que ha sido investigado como fármaco para perder peso38. Los valores de péptido YY aumentan al igual que GLP-1 ya durante los primeros días después de un BGYRL39. Le Roux et al40 detallaron que esta elevación se mantiene hasta dos años después de la cirugía, y que los valores están en clara relación con la saciedad y la pérdida de peso.
La ghrelina es una hormona que se secreta principalmente en el fundus gástrico, estimula el apetito y regula el peso corporal. Su administración en el animal de experimentación aumenta el depósito graso y la resistencia a la insulina41. Los resultados tras el BGYRL son controvertidos y podrían estar condicionados por el grado de resección del fundus gástrico42,43.
La leptina y la adiponectina son hormonas sintetizadas por el adipocito y sus valores están en relación con los depósitos grasos44. La leptina disminuye el apetito y aumenta la resistencia a la insulina43. Su concentración disminuye con las diferentes técnicas de cirugía bariátrica de forma proporcional a la pérdida de peso45. La adiponectina aumenta la sensibilidad a la insulina a nivel periférico, habiéndose documentado un aumento de su concentración después de BGYRL, DBP y BGAL43,45.
Efecto de las modificaciones anatómicasLos cambios anatómicos tras el BGYRL o la DBP pueden tener un efecto beneficioso sobre el metabolismo de la glucosa por diferentes mecanismos. Esto ha generado dos hipótesis, la del intestino proximal y la del intestino distal. La primera sugiere que el hecho de puentear el estómago, el duodeno y el yeyuno proximal disminuye la secreción de hormonas con efecto antiincretina que se secretan en estas áreas tras el paso de la comida, mejorando consecuentemente la resistencia a la insulina46. Para evaluar el efecto del intestino proximal, Rubino et al47 desarrollaron un estudio en ratas Goto-Kakizaki (GK), un modelo de animales no obesos con diabetes, y las sometieron a dos intervenciones diferentes. A un grupo les excluyó el duodeno y el yeyuno proximal mediante un bypass duodenoyeyunal (BDY) y a otro grupo les acortó la misma longitud de intestino, pero manteniendo intacto el intestino proximal mediante una gatroyeyunostomía. El grupo sometido a BDY presentó mejoría de la diabetes a los 10 días, a diferencia de las sometidas a una gatroyeyunostomía. Cuando posteriormente se revirtieron los procedimientos quirúrgicos, la diabetes volvió a empeorar cuando el BDY se convirtió en gastroyeyunostomía, y mejoró cuando se hizo la conversión inversa. A pesar de estos hallazgos, todavía no se ha detectado ningún mediador hormonal secretado en la parte proximal del intestino.
La hipótesis del intestino distal (hindgut) sugiere que el paso rápido de nutrientes al intestino distal va a estimular la secreción de hormonas con efecto incretina y, en consecuencia, van a mejorar el metabolismo de la glucosa. Varios experimentos en roedores han intentado comprobar esta hipótesis mediante la transposición ileal (TI), en la cual un segmento de íleon distal rico en células L es resecado y conectado proximalmente en el yeyuno. Patriti et al48 compararon en ratas GK obesas la TI con un grupo control al que se realizaba el mismo número de resecciones intestinales, pero sin transposición. Las ratas intervenidas de TI mejoraron la tolerancia a la glucosa, la sensibilidad a la insulina, la secreción de GLP-1 y la estructura microscópica de la célula beta en comparación con el grupo control.
Un estudio reciente intenta distinguir cuál de los dos mecanismos, el del intestino proximal o el del intestino distal, tiene más eficacia en controlar la diabetes, mediante la comparación de la TI, el BDY y un grupo control de ratas GK49. Ambas técnicas consiguen mejorar el metabolismo de la glucosa de forma similar, pero los valores de GLP-1 fueron superiores con BDY, sugiriendo que ambos mecanismos pueden tener una eficacia similar en mejorar el metabolismo glucídico, que el mecanismo del intestino distal estaría mediado por GLP-1, mientras que el mecanismo del intestino proximal puede estar mediado por otros factores aún desconocidos.
Nuevas expectativasLa gastrectomía tubular laparoscópica (GTL)50 es una técnica restrictiva que se empezó a utilizar como un primer paso para disminuir peso antes de realizar una técnica malabsortiva en pacientes con IMC > 60 kg/m2. Consiste en la creación de un tubo estrecho de estómago a través de la resección de la mayor parte de este. Se ha sugerido que la GTL es más que una técnica restrictiva, ya que se ha señalado que es igual de eficaz que el BGYRL para conseguir la resolución de la diabetes51–53 y que ésta se produce de forma más precoz que con otras técnicas restrictivas54, hallazgo que puede justificarse por el descenso de la ghrelina con la resección gástrica, disminuyendo por lo tanto sus efectos diabetógenos55.
El hecho de que los efectos de la cirugía intestinal sobre la diabetes vayan más allá de la pérdida de peso hace que se esté suplantando el término «cirugía bariátrica» por el de «cirugía metabólica»56. Este cambio conceptual ha provocado que se esté realizando cirugía bariátrica en sujetos diabéticos con un IMC < 35 kg/m2, y por otra parte que se estén ensayando nuevas técnicas cuyo objetivo no es la pérdida de peso sino tratar la diabetes, como el BDY y la TI, con resultados por el momento esperanzadores57.
Uno de los aspectos más debatidos en los últimos años ha pivotado en el punto de corte a partir del cual estaría indicada la cirugía bariátrica58. Se han publicado numerosos estudios en pacientes con diabetes e IMC < 35 kg/m2 que han usado tanto técnicas de cirugía bariátrica clásicas como innovadoras, con resultados satisfactorios. Fried et al59 revisaron 16 estudios, con un total de 343 sujetos diabéticos con IMC < 35 kg/m2, y demostraron resolución de la diabetes en un 85,3% de los casos. La pérdida de peso fue discreta pero nunca superior a lo esperable, de forma que los pacientes obesos pasan a tener sobrepeso y los que tienen sobrepeso pasan a tener un IMC normal. A pesar de ello, son estudios de pequeño tamaño muestral y con un seguimiento corto que no permiten definir la seguridad y eficacia a largo plazo.
Recientemente, el Diabetes Surgery Summit, grupo multidisciplinar de expertos, ha intentado esclarecer los aspectos más controvertidos de la cirugía bariátrica en un documento de consenso que constituye los cimientos de la «cirugía para la diabetes». Subraya que, en pacientes con diabetes tipo 2 mal controlada e IMC de 30-35 kg/m2, la cirugía gastrointestinal podría ser una alternativa, pero nunca una opción de primera línea. En estos casos, la técnica recomendada sería el BGYRL, reservando las nuevas técnicas quirúrgicas para ensayos clínicos aprobados y registrados60.
ConclusionesLos estudios experimentales en modelos animales y humanos, además de ayudarnos a conocer los mecanismos de acción de la cirugía bariátrica, han permitido ampliar el conocimiento en la fisiopatología de la diabetes. La cirugía bariátrica es en la actualidad el tratamiento más efectivo para la obesidad grave. La no despreciable mortalidad peroperatoria está claramente compensada por sus efectos a largo plazo: la disminución de la mortalidad y la resolución de comorbilidades asociadas a la obesidad, como la diabetes tipo 2. La técnicas malabsortivas y las mixtas obtienen mejores tasas de resolución de la diabetes tipo 2 y más precoces que las restrictivas, probablemente debido a la alteración del tránsito intestinal y sus efectos beneficiosos sobre el eje enteroinsular.
El espectro clínico de la diabetes mellitus tipo 2 es muy amplio. Así, en un extremo se situaría la diabetes asociada a sobrepeso u obesidad leve, en la que las modificaciones del estilo de vida y los fármacos hipoglucemiantes orales consiguen alcanzar los objetivos terapéuticos en un porcentaje no despreciable de casos. En el extremo opuesto se situaría la diabetes asociada a obesidad grave, de muy difícil control pese a utilizar altas dosis de insulina en monoterapia o terapia combinada, con complicaciones crónicas avanzadas. En el primer escenario clínico sería obviamente precipitado indicar la cirugía bariátrica, mientras que en el segundo llegaríamos demasiado tarde, tanto por el deterioro de la capacidad de secreción de insulina como por el alto riesgo de la cirugía. Por tanto, a mitad de camino entre ambas situaciones estaría probablemente la ventana terapéutica de la cirugía bariátrica, de forma que incluiría obesidad avanzada de difícil control, secreción beta pancreática mantenida y riesgo quirúrgico asumible.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.