La gran mayoría de los pacientes con diabetes tipo 2 presenta un exceso de adiposidad. Existe un amplio consenso en que el adecuado tratamiento de la diabetes tipo 2 requiere un abordaje simultáneo del sobrepeso/obesidad y del resto de los factores de riesgo cardiovascular. Las intervenciones no farmacológicas (dieta, ejercicio) representan la piedra angular del tratamiento del paciente con diabetes tipo 2. La pérdida de peso a través de la modificación de los estilos de vida ha demostrado claros beneficios en el paciente con diabetes tipo 2, requiriendo un enfoque individualizado y multidisciplinario, con programas estructurados dotados de recursos específicos. La ganancia de peso asociada al tratamiento con algunos fármacos antidiabéticos (secretagogos, glitazonas, insulina) puede dificultar el control glucémico, comprometer la adherencia al tratamiento, empeorar el perfil de riesgo vascular de los pacientes y limitar los beneficios del tratamiento. Por ello, la tendencia actual es abordar el tratamiento de la diabetes tipo 2 desde un punto de vista adipocéntrico, dando prioridad a los fármacos antidiabéticos que presenten un efecto ponderal neutro o que favorezcan la pérdida de peso (metformina, terapias incretínicas, inhibidores del cotransportador sodio-glucosa tipo 2). La cirugía metabólica representa una alternativa eficaz para los pacientes con diabetes tipo 2 y un índice de masa corporal > 35 kg/m2 y permite la remisión de la diabetes en una alta proporción de casos, especialmente si la enfermedad no está muy evolucionada. Recientemente se ha publicado un consenso suscrito por diversas sociedades científicas españolas que realiza una serie de recomendaciones concretas sobre la actuación diagnóstica y terapéutica ante el paciente con diabetes y obesidad.
Most patients with type 2 diabetes have excess adiposity. There is wide consensus that adequate treatment of type 2 diabetes requires a simultaneous approach to overweight/obesity and the remaining cardiovascular risk factors. Non-pharmacological interventions (diet, exercise) represent the cornerstone of the treatment of patients with type 2 diabetes. Weight loss through lifestyle modification has shown clear benefits in these patients, requiring an individualised and multidisciplinary approach with structured programmes endowed with specific resources. The weight gain associated with some antidiabetic drugs (secretagogues, glitazones, insulin) can hamper glycaemic control, compromising treatment adherence, worsening vascular risk profile, and limiting the benefits of treatment. Therefore, the current tendency is to adopt a weight-centred approach to the treatment of type 2 diabetes, giving priority to those antidiabetic drugs that have a neutral effect on weight or that favour weight loss (metformin, incretin therapies, sodium-glucose cotransporter-2 inhibitors). Metabolic surgery is an effective alternative for patients with type 2 diabetes and a BMI ≥35 kg/m2 and allows remission of diabetes in a large proportion of patients, especially if the disease is not very advanced. A consensus document supported by various Spanish scientific societies has recently been published. This document makes a series of specific recommendations on the diagnostic and therapeutic approach to patients with diabetes and obesity.
La obesidad y el sobrepeso constituyen el principal factor de riesgo modificable de diabetes tipo 2, y son responsables del 44% de la carga de diabetes1. España es uno de los países desarrollados con mayores tasas de prevalencia de obesidad (23%) y sobrepeso (39%) en población adulta2. Según los resultados del estudio Di@betes3, la prevalencia de obesidad y de obesidad abdominal en los españoles con diabetes conocida es del 50 y el 68%, respectivamente. Se ha estimado que el índice de masa corporal (IMC) ha experimentado un incremento de 0,4 kg/m2 por década en los últimos 30 años4, lo que justifica en gran medida el incremento paralelo en la prevalencia de diabetes, que en nuestro país se sitúa actualmente en el 13,8% de la población adulta3.
Las intervenciones orientadas a la reducción del peso corporal mediante modificaciones del estilo de vida han demostrado su eficacia en la prevención de la diabetes tipo 2 en sujetos en riesgo5,6, e incluso son superiores a la obtenida con medidas farmacológicas5, lo cual ilustra la estrecha relación entre el sobrepeso/obesidad y la diabetes tipo 2.
En todos los pacientes con diabetes se recomienda establecer, tanto en el momento del diagnóstico como durante el seguimiento, el grado de obesidad según el IMC y, en los pacientes con sobrepeso, determinar el perímetro de la cintura.
El IMC es el parámetro ponderal más utilizado en la práctica clínica, y son indicativos de sobrepeso los valores > 25 kg/m2 y de obesidad los valores > 30 kg/m2. Sin embargo debemos considerar que el IMC infraestima la prevalencia real de sobrepeso y obesidad cuando esta se estima como adiposidad corporal total7.
El aumento de la grasa intraabdominal o visceral se relaciona mejor que el IMC con el desarrollo de diabetes y de otros factores de riesgo de enfermedad cardiovascular8,9. El perímetro de la cintura es una medida sencilla que presenta una buena correlación con la adiposidad intraabdominal o visceral y es un marcador independiente de riesgo cardiovascular, por lo que se recomienda su determinación en los pacientes con diabetes tipo 2, especialmente en los que presentan sobrepeso o normopeso8.
Importancia de la reducción del peso corporal en el paciente con diabetes tipo 2. Papel de la modificación del estilo de vidaLa reducción del peso, mediante el incremento de la actividad física y el seguimiento de una dieta hipocalórica, es una recomendación universal de las actuales guías de práctica clínica y representa la base del tratamiento para todos los pacientes con diabetes tipo 2 con sobrepeso/obesidad10–14.
Las intervenciones intensivas sobre modificación del estilo de vida que han demostrado su eficacia reúnen las siguientes características: multidisciplinariedad, individualización (considerar preferencias y aptitudes del paciente), estructuración (mínimo de 14 sesiones individuales o en grupo durante un mínimo de 6 meses) y dotación con recursos específicos, no siendo suficiente el simple consejo médico. También es importante que las modificaciones del estilo de vida se refuercen regularmente10–14.
Asimismo, los objetivos de pérdida de peso que se planteen deben ser realistas, evitando crear expectativas irreales que generen frustración en los pacientes.
Está demostrado que las modificaciones en el estilo de vida constituyen la estrategia terapéutica más coste-efectiva para la prevención de la diabetes tipo 25,15.
En pacientes con diabetes tipo 2, la pérdida de peso, aunque sea discreta, disminuye la resistencia a la insulina, facilita el control glucémico y retrasa la necesidad de instaurar tratamiento farmacológico16–18. Pérdidas ponderales importantes, como las que se asocian a la cirugía metabólica, pueden conseguir la remisión de la diabetes tipo 219. Además, la pérdida de peso mejora de forma global el perfil de riesgo vascular, facilitando el control de la dislipemia y de la hipertensión arterial.
El estudio Look-AHEAD16, aunque no alcanzó el objetivo primario de reducción de la morbimortalidad cardiovascular, ha confirmado los múltiples beneficios que aporta la pérdida de peso a los pacientes con diabetes tipo 2. Los pacientes sometidos a una intervención intensiva del estilo de vida (dieta, ejercicio, terapia conductual) consiguieron reducciones significativas en la hemoglobina glucosilada A1c (HbA1c) (-0,6% el primer año y -0,22% los 10 años siguientes), en la condición física y en todos los factores de riesgo cardiovascular, con excepción de los valores de cLDL (colesterol unido a lipoproteínas de baja densidad). También demostró que es posible mantener una pérdida significativa de peso a largo plazo (el 50% de los participantes de la intervención intensiva mantuvo una pérdida de peso del 5% del peso basal), con independencia del sexo, la etnia o el tratamiento antidiabético recibido, y es destacable que la mayor pérdida de peso y la mejor adherencia al programa se observaron en los pacientes mayores de 65 años. Además, la pérdida ponderal mejoró el perfil lipídico, la presión arterial y los índices del síndrome de apnea obstructiva del sueño, y redujo la limitación de la movilidad, los síntomas depresivos, la disfunción eréctil y la incontinencia urinaria. Finalmente, la intervención redujo los costes médicos, incluidos los correspondientes a hospitalización y medicación.
Impacto del tratamiento antidiabético en el peso corporalLos estudios epidemiológicos confirman que los pacientes con diabetes tipo 2 presentan un incremento progresivo de peso a lo largo de su enfermedad20. Esta ganancia de peso incrementa la resistencia a la insulina, condiciona la necesidad de intensificar el tratamiento farmacológico y empeora el control glucémico21.
Los fármacos hipoglucemiantes tienen un efecto variable en el peso corporal. La insulina incrementa el peso entre 1,8 y 6,6 kg, las sulfonilureas entre -0,3 y 4,0 kg y las tiazolidindionas entre 0,18 y 1,5 kg22. Otros fármacos presentan un efecto ponderal neutro, como los inhibidores de la dipeptidil peptidasa 4 (iDPP4)23,24. La metformina presenta un efecto ponderal neutro o favorable (-2 kg en comparación con placebo)25,26, al igual que los inhibidores de la alfa glucosidasa27. Los fármacos antidiabéticos que han mostrado una mayor reducción de peso son los agonistas del receptor del péptido similar al glucagón tipo 1 (arGLP1) (-2,9 kg comparado con placebo, antidiabéticos orales o insulina)28 y los inhibidores del cotransportador sodio-glucosa tipo 2 (iSLGT2) (-1,8 a -2,3 kg en comparación con placebo)29. Los fármacos antidiabéticos que reducen el peso presentan un beneficio adicional sobre la presión arterial. Los arGLP1 reducen la presión arterial sistólica en -2,2 mmHg30 y los iSGLT2 en -4,45 mmHg31.
Algunos fármacos antidiabéticos obesogénicos (sulfonilureas, glinidas, insulina) tienen en común que inducen un estado de hiperinsulinismo y, en consecuencia, se asocian a un mayor riesgo de hipoglucemias32. El incremento de peso asociado a las glitazonas se debe tanto a la retención hidrosalina como a su efecto adipogénico. Los arGLP1 inducen pérdida de peso por mecanismos periféricos (plenitud posprandial por retraso del vaciamiento gástrico) y centrales (efecto anorexígeno a nivel hipotalámico). Por otro lado, los iSGLT2 provocan pérdida de peso por la pérdida calórica asociada a la glucosuria.
La ganancia de peso asociada al tratamiento antidiabético representa una barrera para los objetivos de control glucémico y limita la adherencia terapéutica del paciente33. Diversos estudios34,35 sugieren que el mantenimiento/reducción del peso es uno de los principales determinantes de las preferencias de los pacientes a la hora de valorar el tratamiento.
Además, la ganancia de peso iatrogénica asociada al tratamiento antidiabético empeora el perfil de riesgo vascular de los pacientes y puede limitar los beneficios cardiovasculares a largo plazo36. Algunos de los fármacos que aumentan el peso se han asociado a un peor pronóstico cardiovascular, como las sulfonilureas37, la rosiglitazona38 y la insulina39. El incremento de peso, junto con el incremento de las hipoglucemias, se ha relacionado con el incremento de mortalidad asociada al tratamiento antidiabético intensivo observado en el estudio ACCORD (Action to Control Cardiovascular Risk in Diabetes)40.
Por otro lado, evitar la ganancia de peso asociada al tratamiento antidiabético ha demostrado ser coste-efectivo. Estudios realizados con bases de datos administrativas muestran que la reducción del peso en pacientes con diabetes tipo 2 disminuye los costes relacionados con la diabetes41,42, especialmente en pacientes obesos41. Un estudio observacional retrospectivo realizado en España encontró que una disminución de 1 punto en el IMC en pacientes con diabetes tipo 2 reduce los costes sanitarios un 9,4% en pacientes obesos y un 2,7% en pacientes no obesos43. Algunos análisis farmacoeconómicos señalan que el tratamiento con fármacos antidiabéticos que reducen el peso corporal, como los arGLP144,45 y los iSGLT246, resulta coste-efectivo.
Tratamiento farmacológico del paciente con diabetes tipo 2 y obesidadEl tratamiento del paciente con diabetes tipo 2 y obesidad dependerá tanto del grado de obesidad como de las características del paciente (edad, comorbilidad asociada) y de sus preferencias. El peso corporal se ha incorporado como una variable diferenciadora de la decisión terapéutica en diferentes guías clínicas11,47.
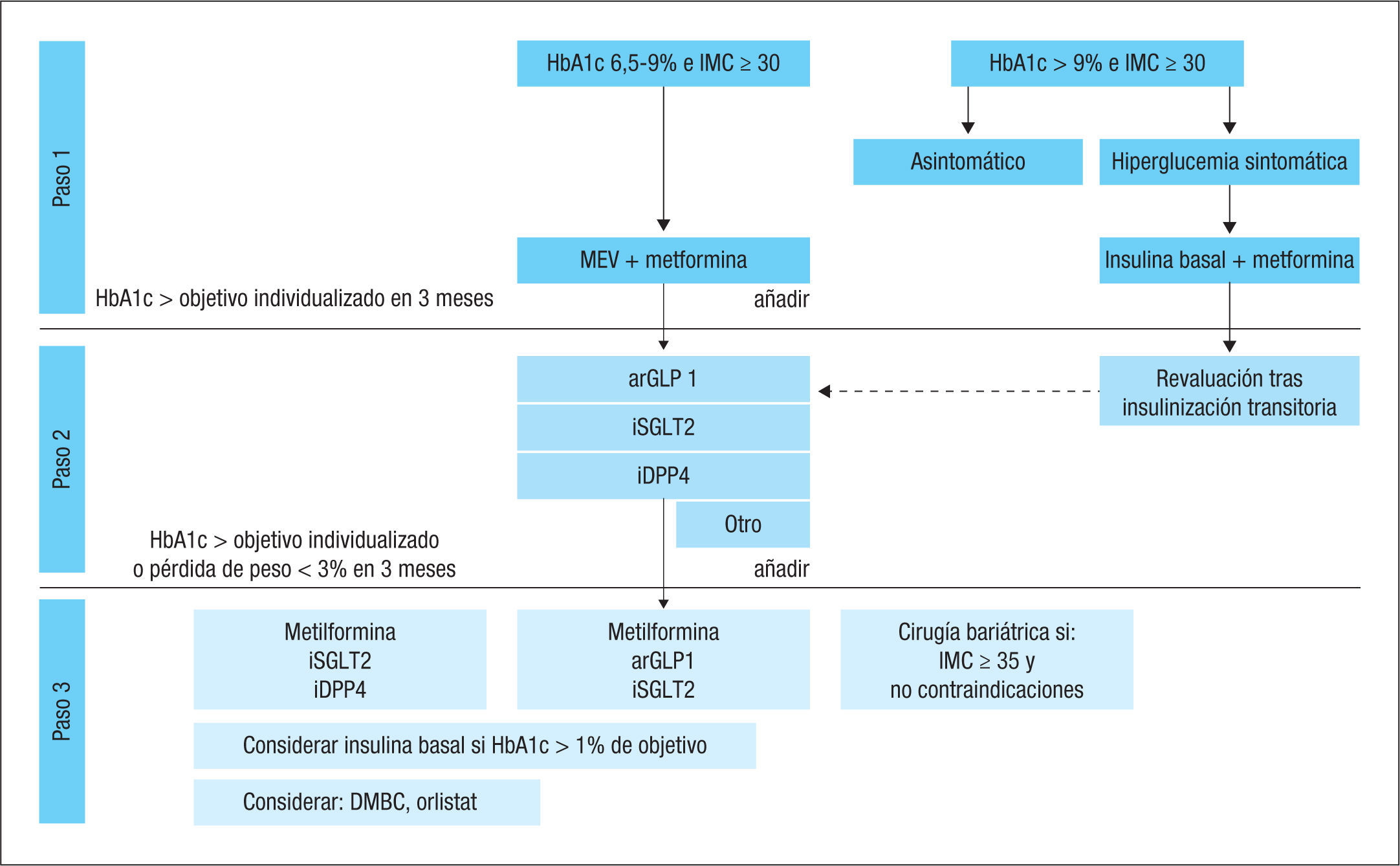
Recientemente, varias sociedades científicas españolas han publicado unas recomendaciones para el abordaje del paciente con diabetes tipo 2 y obesidad48. El algoritmo terapéutico recomendado se muestra en la figura 1. La metformina es el fármaco más coste-efectivo y se recomienda como primera opción terapéutica. Como segundo fármaco se propone a los agentes reductores del peso (ar-GLP1 e iSGLT2) o que presentan un efecto ponderal neutro (iDPP4), dejando al resto de grupos farmacológicos como opciones menos preferentes, pero que pueden tener cabida según el juicio clínico basado en las características del paciente.
Tratamiento antidiabético en el paciente con diabetes tipo 2 y obesidad. arGLP1: agonista del receptor del péptido similar al glucagón tipo 1; DMBC: dieta muy baja en calorías; HbA1c: hemoglobina glucosilada; iDPP4: inhibidor de la dipeptidil peptidasa 4; IMC: índice de masa corporal; iSGLT2: inhibidor del cotransportador sodio-glucosa tipo 2; MEV: modificaciones del estilo de vida. Reproducido con permiso de Revista Clínica Española (referencia 49).
Los arGLP1 proporcionan mayor potencia hipoglucemiante y en un subgrupo de pacientes pueden inducir una pérdida ponderal importante. En pacientes tratados con arGLP1 se considera que no existe respuesta terapéutica si a los 6 meses de tratamiento la HbA1c no ha bajado ≥ 1% y el peso corporal no se ha reducido ≥ 3% (criterios NICE). No obstante, pérdidas de peso inferiores se pueden considerar clínicamente significativas. Por otro lado, no todos los arGLP1 presentan el mismo perfil de eficacia en la reducción de peso, y la albiglutida es el que se asocia a una menor reducción ponderal. Los iSGLT2 son eficaces, tanto sobre la pérdida de peso como en el descenso de la HbA1c, con independencia del tiempo de evolución de la diabetes. Los iDPP4 tienen un efecto ponderal neutro, por lo que pueden considerarse una alternativa en pacientes con contraindicación o intolerancia a los arGLP1 o a los iSGLT2. El uso de terapias incretínicas no se recomienda en pacientes con antecedentes de pancreatitis. Los iSGLT2 se asocian a candidiasis genital y son menos eficaces en caso de insuficiencia renal moderada-avanzada, y su uso no se recomienda en ficha técnica en pacientes con filtrado glomerular [FG] < 60 ml/min. Según su ficha técnica, los arGLP1 no deben usarse en caso de insuficiencia renal avanzada (exenatida y liraglutida en FG < 45 ml/min; lixisenatida en FG < 30 ml/min). Los iDPP4 pueden usarse en casos de insuficiencia renal avanzada ajustando dosis (salvo la linagliptina, que no requiere ajuste de dosis).
Debe especificarse que la triple terapia con metformina, arGLPl e iSGLT2, incluida en el tercer escalón del algoritmo, no está sustentada por ahora con ensayos clínicos que avalen su eficacia y seguridad.
Por último, la cirugía metabólica es una alternativa eficaz en pacientes con diabetes tipo 2 y un IMC ≥ 35 kg/m2, aunque también ha demostrado ser útil en pacientes con un IMC < 35 kg/m249. Las técnicas de cirugía bariátrica malabsortivas (bypass gástrico o biliopancreático) y mixtas restrictivas-malabsortivas (como el bypass gástrico en Y de Roux) son más eficaces que las restrictivas (gastrectomía en manga, bandas gástricas) y obtienen una mayor tasa de remisión de la diabetes19, si bien su tasa de complicaciones perioperatorias es mayor.
En cualquier caso, es imprescindible la toma de decisiones compartidas sobre el tratamiento con un paciente bien informado teniendo en cuenta sus preferencias y prioridades. Hay que considerar que la falta de adherencia debe valorarse como la primera causa de mal control antes de cambiar la pauta terapéutica, y que un mayor número de tomas se asocia a más incumplimiento terapéutico.
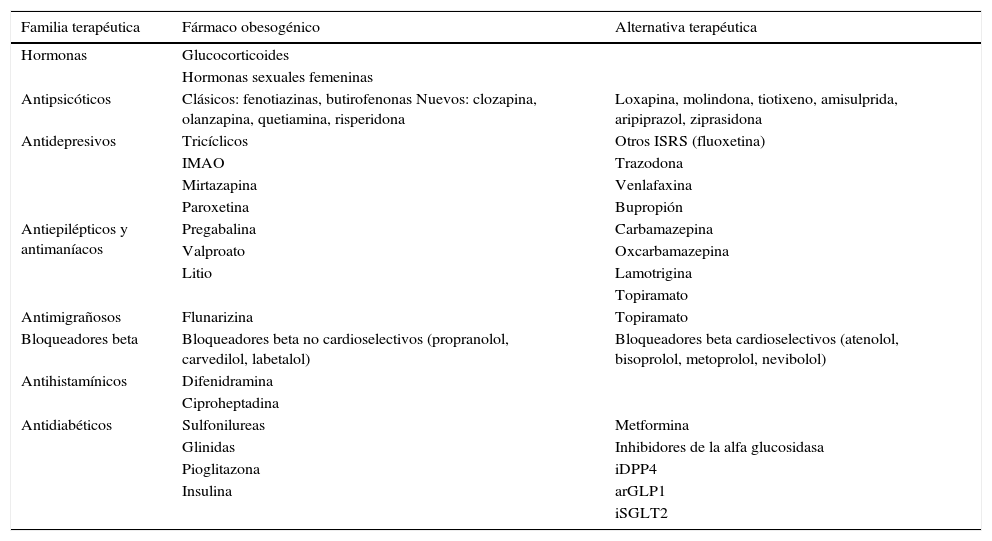
Por último, ante un paciente con diabetes tipo 2 y obesidad se recomienda valorar la retirada o sustitución de los fármacos asociados que sean potencialmente obesogénicos (tabla 1). La respuesta individual a estos fármacos es variable. Debe sopesarse si clínicamente se considera conveniente y seguro suspender o sustituir el fármaco obesogénico por otro de la misma familia que induzca menos ganancia de peso o que facilite la pérdida de peso, considerando siempre la patología prioritaria y atendiendo al criterio del médico responsable del paciente.
Fármacos obesogénicos y potenciales alternativas.
| Familia terapéutica | Fármaco obesogénico | Alternativa terapéutica |
|---|---|---|
| Hormonas | Glucocorticoides | |
| Hormonas sexuales femeninas | ||
| Antipsicóticos | Clásicos: fenotiazinas, butirofenonas Nuevos: clozapina, olanzapina, quetiamina, risperidona | Loxapina, molindona, tiotixeno, amisulprida, aripiprazol, ziprasidona |
| Antidepresivos | Tricíclicos | Otros ISRS (fluoxetina) |
| IMAO | Trazodona | |
| Mirtazapina | Venlafaxina | |
| Paroxetina | Bupropión | |
| Antiepilépticos y antimaníacos | Pregabalina | Carbamazepina |
| Valproato | Oxcarbamazepina | |
| Litio | Lamotrigina | |
| Topiramato | ||
| Antimigrañosos | Flunarizina | Topiramato |
| Bloqueadores beta | Bloqueadores beta no cardioselectivos (propranolol, carvedilol, labetalol) | Bloqueadores beta cardioselectivos (atenolol, bisoprolol, metoprolol, nevibolol) |
| Antihistamínicos | Difenidramina | |
| Ciproheptadina | ||
| Antidiabéticos | Sulfonilureas | Metformina |
| Glinidas | Inhibidores de la alfa glucosidasa | |
| Pioglitazona | iDPP4 | |
| Insulina | arGLP1 | |
| iSGLT2 |