Pretendemos determinar los factores predictores de enfermedad tromboembólica pulmonar (ETEP) en pacientes con infección por SARS-CoV-2 (COVID-19) atendidos en el servicio de urgencias de un hospital terciario durante la primera ola pandémica.
MétodosEstudio observacional unicéntrico realizado en una cohorte retrospectiva de pacientes con infección confirmada por SARS-CoV-2 (o alta sospecha clínico-radiológica de COVID-19) sometidos a despistaje de ETEP mediante tomografía computarizada de arterias pulmonares (TCAP). Se exploraron los factores predictores de ETEP mediante regresión logística, creándose dos modelos predictivos (sin o con los valores de dímeros-D).
ResultadosDe un total de 274 TCAP realizados, 70 procedimientos presentaron hallazgos diagnósticos de ETEP, representando una incidencia acumulada del 25,54% (intervalo de confianza [IC] 95%: 20,49-31,14). En el modelo no ajustado por el nivel de dímeros-D, la frecuencia respiratoria >22rpm (odds ratio [OR]: 3,162; IC 95%: 1,627-6,148; p=0,001) y la ausencia de hallazgos sugerentes de COVID-19 en la radiología simple de tórax (OR: 3,869; IC 95%: 0,869-17,225; p=0,076) fueron predictores de ETEP. En el segundo modelo se mantuvo la presencia de taquipnea (OR: 4,967; IC 95%: 2,053-12,018; p<0,001), identificándose además un nivel de dímeros-D>3.000ng/mL (OR: 7,494; IC 95%: 3,038-18,485; p<0,001).
ConclusionesLa presencia de taquipnea (>22rpm) y la ausencia de hallazgos radiológicos sugestivos de infección por SARS-CoV-2 en la radiografía simple de tórax, además de los valores de dímero-D>3.000ng/mL, fueron identificados como factores predictores de ETEP en pacientes con COVID-19.
To determine the predictive factors of pulmonary thromboembolic (PTE) in patients with SARS-CoV-2 infection (COVID-19) assessed in the emergency department at a tertiary hospital during the first pandemic wave.
MethodsObservational single-center study conducted in a retrospective cohort of patients with confirmed SARS-CoV-2 infection (or high clinical-radiological suspicion) who underwent PTE screening by computed tomography pulmonary angiography (CTPA). Predictive factors of PTE were explored using logistic regression, creating two predictive models (without or with D-dimer values).
ResultsOut of a total of 274 CTPA performed, 70 procedures presented diagnostic findings of PTE, representing a cumulative incidence of 25.54% (95% confidence interval [CI]: 20.49-31.14). In the non–D-dimer based model, respiratory rate>22bpm (odds ratio [OR]: 3.162; 95% CI: 1.627-6.148; p=0.001) and the absence of findings suggestive of COVID-19 in plain chest X-ray (OR: 3.869; 95% CI: 0.869-17.225; p=0.076) were predictors of PTE. In the D-dimer-based model, tachypnea remained as a predictive factor (OR: 4.967; 95% CI: 2.053-12.018; p<0.001), as well as D-dimers>3,000ng/ml (OR: 7.494; 95% CI: 3.038-18.485; p<0.001).
ConclusionsThe presence of tachypnea (>22bpm) and the absence of radiological findings suggestive of SARS-CoV-2 infection in the chest X-ray, in addition to D-dimer values>3,000 ng/mL, were identified as predictive factors of PTE in patients with COVID-19.
La infección por el coronavirus del síndrome respiratorio agudo 2 (severe acute respiratory syndrome coronavirus 2 [SARS-CoV-2]) se describió por primera vez en diciembre de 2019 en Wuhan, provincia de Hubei, China1. Desde entonces, la enfermedad por coronavirus 2019 (coronavirus disease 2019 [COVID-19]) se ha diseminado hasta ser una pandemia afectando a más de 106 millones de personas en prácticamente todos los países del mundo. La mortalidad global a febrero de 2021 supera los 2,3 millones de personas, siendo España uno de los países más afectados en Europa occidental, con más de 63.000 fallecidos2.
Numerosos estudios avalan la capacidad del SARS-CoV-2 de invadir las células del endotelio vascular a través de la enzima convertidora de angiotensina 2 (ECA 2) expresada en la superficie de la célula. Este fenómeno se acompaña posteriormente de inflamación endotelial, activación del complemento, generación de trombina, reclutamiento de plaquetas y leucocitos, y el inicio de respuestas inmunitarias innatas y adaptativas, provocando un estado trombofílico subyacente con predisposición a la formación de fenómenos trombóticos en diferentes localizaciones.
Existen determinados parámetros que permiten valorar esta situación protrombótica, tales como la presencia de niveles elevados de dímero-D y otras alteraciones de la coagulación3, proteína C reactiva (PCR), ferritina, lactato deshidrogenasa (LDH), marcadores de daño miocárdico y porción amino-terminal del pro-péptido natriurético tipo B (NT-proBNP)4.
Es prioritario incidir en el diagnóstico de la enfermedad tromboembólica sobreañadida a la enfermedad COVID-19 desde el mismo momento del ingreso del paciente con la finalidad de guiar la aplicación de estrategias dirigidas de anticoagulación profiláctica y terapéutica, según proceda. El objetivo del presente estudio, por tanto, es identificar los factores asociados a la presencia de enfermedad tromboembólica pulmonar (ETEP) en pacientes con diagnóstico confirmado (o elevada sospecha) de COVID-19, y el desarrollo de un modelo predictivo que permita determinar, desde el servicio de urgencias, la probabilidad de esta complicación.
Material y métodosDiseño del estudioRealizamos un estudio analítico observacional unicéntrico basado en una cohorte retrospectiva, siguiendo las recomendaciones STROBE para estudios observacionales. El estudio fue aprobado por el Comité de Ética de la Investigación con medicamentos (CEIm) del Hospital Universitario 12 de Octubre (código 20/229).
Pacientes y ámbito de estudioFueron incluidos en el estudio los pacientes adultos atendidos en el servicio de urgencias del Hospital Universitario 12 de Octubre con elevada sospecha epidemiológica, clínica, radiológica y/o confirmación microbiológica (mediante reacción en cadena de polimerasa [RT-PCR]) de infección por SARS-CoV-2 (COVID-19) que fueron sometidos a una tomografía computarizada de arterias pulmonares (TCAP) ante la sospecha de ETEP en el periodo comprendido entre el 15 de marzo y el 25 de abril de 2020. Los criterios aplicados para solicitar el despistaje de ETEP fueron la baja correlación entre la clínica respiratoria y la normalidad de la radiografía simple, la ausencia de mejoría de la saturación de O2 a pesar de la administración de oxigenoterapia a flujo elevado, y/o la elevación del dímero-D en ausencia de otros parámetros inflamatorios. Se excluyeron aquellos pacientes en los que existiera imposibilidad para la realización del TCAP a pesar de su indicación (alergia a contrastes, claustrofobia, etc.), aquellos en los que el TCAP fue realizado por una indicación diferente, o en los que no se pudiera acceder a la información clínica.
Se localizaron a través del registro informatizado del servicio de radiología todos los pacientes a los que se realizó un TCAP durante dicho periodo, excluyéndose aquellos casos que no cumplían los criterios de elegibilidad. Fueron recogidas una serie de variables demográficas, epidemiológicas, clínicas, analíticas y radiológicas mediante un formulario estandarizado a través de la historia clínica electrónica del hospital, incluyéndose a continuación en una base de datos anonimizada. Estas variables fueron seleccionadas por su potencial relación con la variable de desenlace (presencia de ETEP) en función de su plausibilidad fisiopatológica y de la literatura publicada al respecto.
Protocolo de tomografía computarizada de arterias pulmonaresTodos los procedimientos de TCAP se realizaron mediante un tomógrafo de 64 o 16 filas (Phillips Brilliance, Phillips Medical System, Eindhoven, Holanda). Los parámetros de adquisición fueron: 120kVp, 50-350mA con modulación de dosis, colimación de 64×0,625mm o 16×0,75mm, tiempo de rotación de 0,8s, y espesor de corte de reconstrucción de 2mm y 1mm de intervalo de reconstrucción en ventanas mediastínica y parenquimatosa.
Se utilizó la técnica de bolus tracking con un umbral de 150unidades Hounsfield (UH) medidas en la arteria pulmonar principal, después de la inyección intravenosa de 50-90mL de medio de contraste yodado no iónico (Ioexol 350mg/mL, GE Healthcare, Cork, Irlanda). El caudal fue de 4mL/s utilizando un inyector (Medrad, Stellant, Pittsburgh, PA, EE.UU.).
Todas las exploraciones fueron informadas por un médico radiólogo de urgencias o torácico con al menos 15 años de experiencia, o por un residente de radiología de cuarto año supervisado por un radiólogo adjunto. Las posibles discrepancias en la interpretación del TCAP se resolvieron mediante consenso.
Objetivos principales y secundariosSe planteó como objetivo principal identificar los factores predictores de la presencia de ETEP en el TCAP. Como objetivos secundarios se realizó un estudio descriptivo de las características epidemiológicas, clínicas, analíticas y radiológicas de los pacientes con diagnóstico de ETEP y se analizaron las diferencias con los pacientes que no lo presentaban en el TCAP.
Análisis estadísticoEn el estudio descriptivo las variables cualitativas se expresaron mediante la distribución de sus frecuencias absolutas y relativas, mientras que las variables cuantitativas se mostraron a través de su media o mediana con su desviación estándar (DE) o rango intercuartílico (RIQ), con intervalos de confianza del 95% (IC 95%).
Para establecer las diferencias entre las características de los grupos de estudio, se utilizó el test de chi2 de Pearson o test de Fisher para las comparaciones entre variables cualitativas y la prueba t de Student o el test paramétrico U de Mann-Whitney para las variables cuantitativas según se ajustaran o no a la normalidad, respectivamente. Se estableció un IC 95%.
Las asociaciones entre las variables independientes y la variable principal se estimaron mediante odds ratios (OR) con sus correspondientes IC 95%.
El tratamiento de los valores perdidos se realizó por análisis de datos completos (listwise), por defecto en el paquete estadístico SPSS utilizado.
Una serie de variables continuas fueron dicotomizadas para su análisis con arreglo a diferentes criterios: frecuencia respiratoria ≥22rpm a la llegada del paciente al servicio de urgencias en función del punto de corte establecido en la escala qSOFA; cociente entre la saturación y la fracción inspirada de O2 (SpO2/FiO2) ≥420 en función de su valor mediano; LDH≥350UI/L en función de su límite superior de la normalidad; y dímero-D≥3.000ng/mL tras la determinación del punto óptimo para la predicción de ETEP mediante el estadístico J de Youden (J=sensibilidad+especificidad−1). Se estimó igualmente el área bajo la curva de características operativas del receptor (ABC-COR) como índice de capacidad discriminativa. Estudios previos muestran al dímero-D como predictor independiente de ETEP en el contexto de COVID-19, con un punto de corte óptimo de 5.000ng/mL5.
Se llevó a cabo un análisis multivariante mediante un modelo de regresión logística (pasos hacia atrás) para determinar el impacto de cada uno de los factores predictores sobre la variable primaria del estudio (presencia de ETEP), controlando a su vez el efecto de posibles factores de confusión, obteniéndose dos modelos (sin dímeros-D o introduciendo dicha variable con el punto de corte antes señalado de 3.000ng/mL). La capacidad predictiva de ambos modelos se analizó, siguiendo las recomendaciones de la guía TRIPOD, en función del ABC-COR obtenida.
El criterio de selección de las variables presentes en el modelo se realizó según su significación en el análisis univariante (p<0,05) y su plausibilidad biológica. Todos los análisis estadísticos fueron realizados mediante el programa SPSS versión 23.0 (SPSS, IBM Corp, Armonk, NY, EE.UU.).
ResultadosFueron incluidos un total de 274 pacientes (Figura S1), en 179 de los cuales (65,32%) se confirmó el diagnóstico de infección por SARS-CoV-2 mediante RT-PCR. En los restantes 95 pacientes (34,67%) el diagnóstico de presunción se realizó en base a una presentación clínico-radiológica altamente sugerente de COVID-19 en un contexto epidemiológico compatible.
En total, 70 pacientes presentaron hallazgos compatibles con ETEP en diferente grado de severidad en el TCAP, representando una incidencia acumulada del 25,54% (IC 95%: 20,49-31,14).
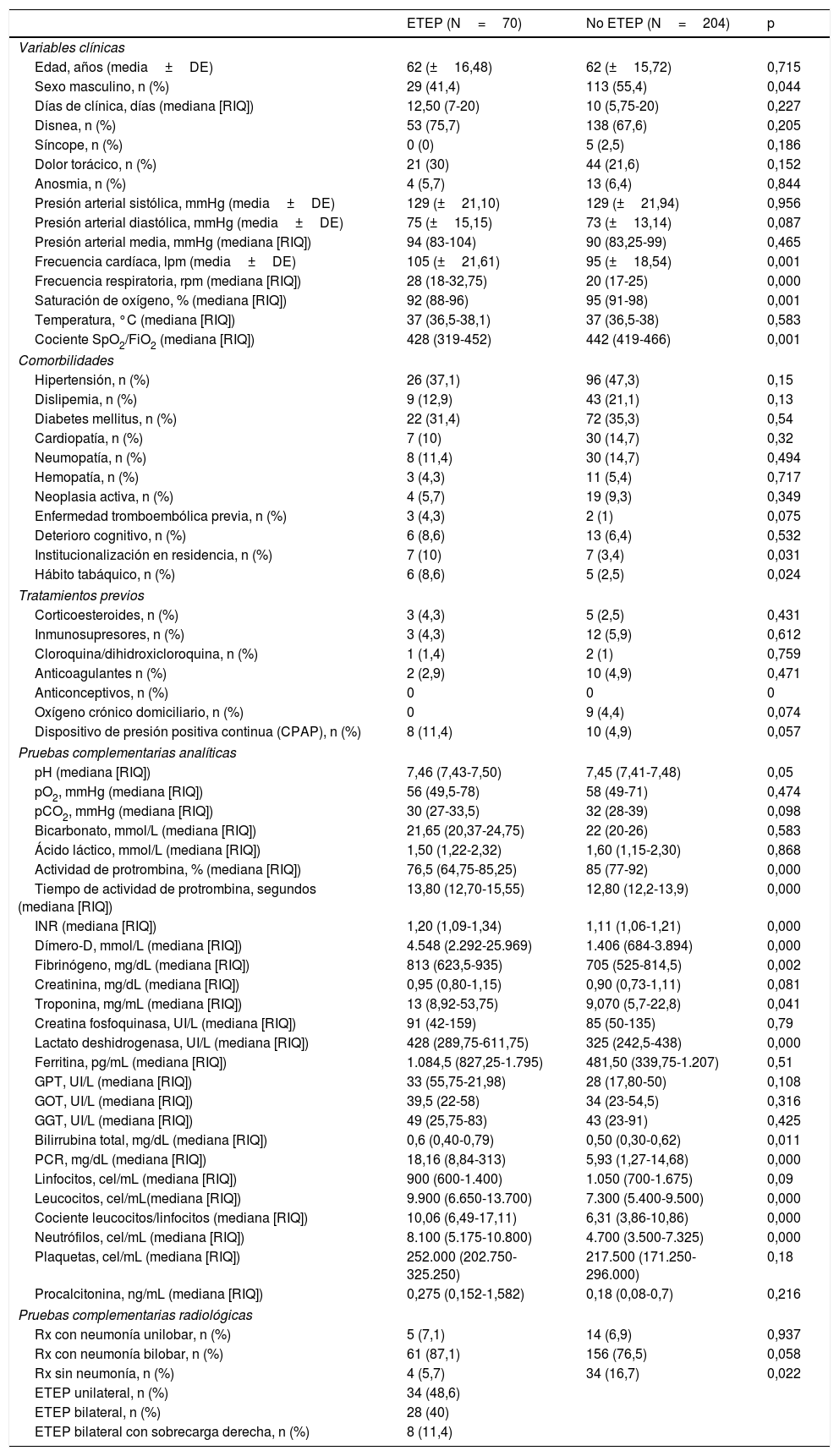
Para el análisis de los factores predictores de la presencia de ETEP se eligieron las variables en las que se habían observado diferencias estadísticamente significativas entre el grupo de pacientes con y sin ETEP (tabla 1). Los pacientes con ETEP presentaban las siguientes características clínicas: edad media de 62 años, con predominio de mujeres (41 pacientes [58,9%]). La duración mediana de los síntomas hasta su valoración en el servicio de urgencias fue de 12,50 días (RIQ: 7-20 días), y referían en la anamnesis la disnea como síntoma principal (53 pacientes [75,7%]). Otros síntomas menos frecuentes fueron el dolor torácico (21 [30,0%]) y la anosmia (4 [5,7%]).
Características basales de la muestra analizada con y sin ETEP
| ETEP (N=70) | No ETEP (N=204) | p | |
|---|---|---|---|
| Variables clínicas | |||
| Edad, años (media±DE) | 62 (±16,48) | 62 (±15,72) | 0,715 |
| Sexo masculino, n (%) | 29 (41,4) | 113 (55,4) | 0,044 |
| Días de clínica, días (mediana [RIQ]) | 12,50 (7-20) | 10 (5,75-20) | 0,227 |
| Disnea, n (%) | 53 (75,7) | 138 (67,6) | 0,205 |
| Síncope, n (%) | 0 (0) | 5 (2,5) | 0,186 |
| Dolor torácico, n (%) | 21 (30) | 44 (21,6) | 0,152 |
| Anosmia, n (%) | 4 (5,7) | 13 (6,4) | 0,844 |
| Presión arterial sistólica, mmHg (media±DE) | 129 (±21,10) | 129 (±21,94) | 0,956 |
| Presión arterial diastólica, mmHg (media±DE) | 75 (±15,15) | 73 (±13,14) | 0,087 |
| Presión arterial media, mmHg (mediana [RIQ]) | 94 (83-104) | 90 (83,25-99) | 0,465 |
| Frecuencia cardíaca, lpm (media±DE) | 105 (±21,61) | 95 (±18,54) | 0,001 |
| Frecuencia respiratoria, rpm (mediana [RIQ]) | 28 (18-32,75) | 20 (17-25) | 0,000 |
| Saturación de oxígeno, % (mediana [RIQ]) | 92 (88-96) | 95 (91-98) | 0,001 |
| Temperatura, °C (mediana [RIQ]) | 37 (36,5-38,1) | 37 (36,5-38) | 0,583 |
| Cociente SpO2/FiO2 (mediana [RIQ]) | 428 (319-452) | 442 (419-466) | 0,001 |
| Comorbilidades | |||
| Hipertensión, n (%) | 26 (37,1) | 96 (47,3) | 0,15 |
| Dislipemia, n (%) | 9 (12,9) | 43 (21,1) | 0,13 |
| Diabetes mellitus, n (%) | 22 (31,4) | 72 (35,3) | 0,54 |
| Cardiopatía, n (%) | 7 (10) | 30 (14,7) | 0,32 |
| Neumopatía, n (%) | 8 (11,4) | 30 (14,7) | 0,494 |
| Hemopatía, n (%) | 3 (4,3) | 11 (5,4) | 0,717 |
| Neoplasia activa, n (%) | 4 (5,7) | 19 (9,3) | 0,349 |
| Enfermedad tromboembólica previa, n (%) | 3 (4,3) | 2 (1) | 0,075 |
| Deterioro cognitivo, n (%) | 6 (8,6) | 13 (6,4) | 0,532 |
| Institucionalización en residencia, n (%) | 7 (10) | 7 (3,4) | 0,031 |
| Hábito tabáquico, n (%) | 6 (8,6) | 5 (2,5) | 0,024 |
| Tratamientos previos | |||
| Corticoesteroides, n (%) | 3 (4,3) | 5 (2,5) | 0,431 |
| Inmunosupresores, n (%) | 3 (4,3) | 12 (5,9) | 0,612 |
| Cloroquina/dihidroxicloroquina, n (%) | 1 (1,4) | 2 (1) | 0,759 |
| Anticoagulantes n (%) | 2 (2,9) | 10 (4,9) | 0,471 |
| Anticonceptivos, n (%) | 0 | 0 | 0 |
| Oxígeno crónico domiciliario, n (%) | 0 | 9 (4,4) | 0,074 |
| Dispositivo de presión positiva continua (CPAP), n (%) | 8 (11,4) | 10 (4,9) | 0,057 |
| Pruebas complementarias analíticas | |||
| pH (mediana [RIQ]) | 7,46 (7,43-7,50) | 7,45 (7,41-7,48) | 0,05 |
| pO2, mmHg (mediana [RIQ]) | 56 (49,5-78) | 58 (49-71) | 0,474 |
| pCO2, mmHg (mediana [RIQ]) | 30 (27-33,5) | 32 (28-39) | 0,098 |
| Bicarbonato, mmol/L (mediana [RIQ]) | 21,65 (20,37-24,75) | 22 (20-26) | 0,583 |
| Ácido láctico, mmol/L (mediana [RIQ]) | 1,50 (1,22-2,32) | 1,60 (1,15-2,30) | 0,868 |
| Actividad de protrombina, % (mediana [RIQ]) | 76,5 (64,75-85,25) | 85 (77-92) | 0,000 |
| Tiempo de actividad de protrombina, segundos (mediana [RIQ]) | 13,80 (12,70-15,55) | 12,80 (12,2-13,9) | 0,000 |
| INR (mediana [RIQ]) | 1,20 (1,09-1,34) | 1,11 (1,06-1,21) | 0,000 |
| Dímero-D, mmol/L (mediana [RIQ]) | 4.548 (2.292-25.969) | 1.406 (684-3.894) | 0,000 |
| Fibrinógeno, mg/dL (mediana [RIQ]) | 813 (623,5-935) | 705 (525-814,5) | 0,002 |
| Creatinina, mg/dL (mediana [RIQ]) | 0,95 (0,80-1,15) | 0,90 (0,73-1,11) | 0,081 |
| Troponina, mg/mL (mediana [RIQ]) | 13 (8,92-53,75) | 9,070 (5,7-22,8) | 0,041 |
| Creatina fosfoquinasa, UI/L (mediana [RIQ]) | 91 (42-159) | 85 (50-135) | 0,79 |
| Lactato deshidrogenasa, UI/L (mediana [RIQ]) | 428 (289,75-611,75) | 325 (242,5-438) | 0,000 |
| Ferritina, pg/mL (mediana [RIQ]) | 1.084,5 (827,25-1.795) | 481,50 (339,75-1.207) | 0,51 |
| GPT, UI/L (mediana [RIQ]) | 33 (55,75-21,98) | 28 (17,80-50) | 0,108 |
| GOT, UI/L (mediana [RIQ]) | 39,5 (22-58) | 34 (23-54,5) | 0,316 |
| GGT, UI/L (mediana [RIQ]) | 49 (25,75-83) | 43 (23-91) | 0,425 |
| Bilirrubina total, mg/dL (mediana [RIQ]) | 0,6 (0,40-0,79) | 0,50 (0,30-0,62) | 0,011 |
| PCR, mg/dL (mediana [RIQ]) | 18,16 (8,84-313) | 5,93 (1,27-14,68) | 0,000 |
| Linfocitos, cel/mL (mediana [RIQ]) | 900 (600-1.400) | 1.050 (700-1.675) | 0,09 |
| Leucocitos, cel/mL(mediana [RIQ]) | 9.900 (6.650-13.700) | 7.300 (5.400-9.500) | 0,000 |
| Cociente leucocitos/linfocitos (mediana [RIQ]) | 10,06 (6,49-17,11) | 6,31 (3,86-10,86) | 0,000 |
| Neutrófilos, cel/mL (mediana [RIQ]) | 8.100 (5.175-10.800) | 4.700 (3.500-7.325) | 0,000 |
| Plaquetas, cel/mL (mediana [RIQ]) | 252.000 (202.750-325.250) | 217.500 (171.250-296.000) | 0,18 |
| Procalcitonina, ng/mL (mediana [RIQ]) | 0,275 (0,152-1,582) | 0,18 (0,08-0,7) | 0,216 |
| Pruebas complementarias radiológicas | |||
| Rx con neumonía unilobar, n (%) | 5 (7,1) | 14 (6,9) | 0,937 |
| Rx con neumonía bilobar, n (%) | 61 (87,1) | 156 (76,5) | 0,058 |
| Rx sin neumonía, n (%) | 4 (5,7) | 34 (16,7) | 0,022 |
| ETEP unilateral, n (%) | 34 (48,6) | ||
| ETEP bilateral, n (%) | 28 (40) | ||
| ETEP bilateral con sobrecarga derecha, n (%) | 8 (11,4) | ||
DE: desviación estándar; ETEP: enfermedad tromboembólica pulmonar; RIQ: rango intercuartílico.
Respecto a las comorbilidades previas, se encontraron diferencias estadísticamente significativas entre los pacientes con y sin ETEP en la institucionalización en residencia (7 [10,0%] versus 7 [3,4%], respectivamente; p=0,031) y el hábito tabáquico (6 [8,6%] versus 5 [2,5%]; p=0,024). No hubo diferencias en relación con el uso de medicamentos que pudieran haber influido en el desarrollo de ETEP (esteroides orales, inmunosupresores, cloroquina o hidroxicloroquina, anticoagulación con indicación profiláctica o terapéutica, y anticonceptivos en cualquier presentación). Ninguno de los pacientes tenía indicación previa de oxígeno domiciliario o uso de CPAP nocturna.
En relación con los parámetros analíticos, los niveles de LDH (428UI/L [RIQ: 289,75-611,75] versus 325UI/L [RIQ: 242,5-438]; p<0,001) y de PCR (18,16mg/dL [RIQ: 8,84-313] versus 5,93mg/dL [RIQ: 1,27-14,68]; p<0,001) fueron mayores en pacientes con ETEP, así como el recuento de leucocitos y neutrófilos y la ratio leucocitos/linfocitos (tabla 1).
Encontramos diferencias en todos los parámetros relacionados con la coagulación, destacando el valor del dímero-D en cuanto a la relevancia que se ha dado a este parámetro asociado a la COVID-19, tanto como variable asociada a la fase inflamatoria como predictor de un evento tromboembólico (4.548ng/mL [RIQ: 2.292-25.969] versus 1.406ng/mL [IQR: 684-3.894] en pacientes con y sin ETEP; p<0,001).
Seis pacientes fallecieron en el grupo de ETEP (8,6%) frente a 22 pacientes (10,8%) en el grupo sin ETEP, sin observarse diferencias significativas.
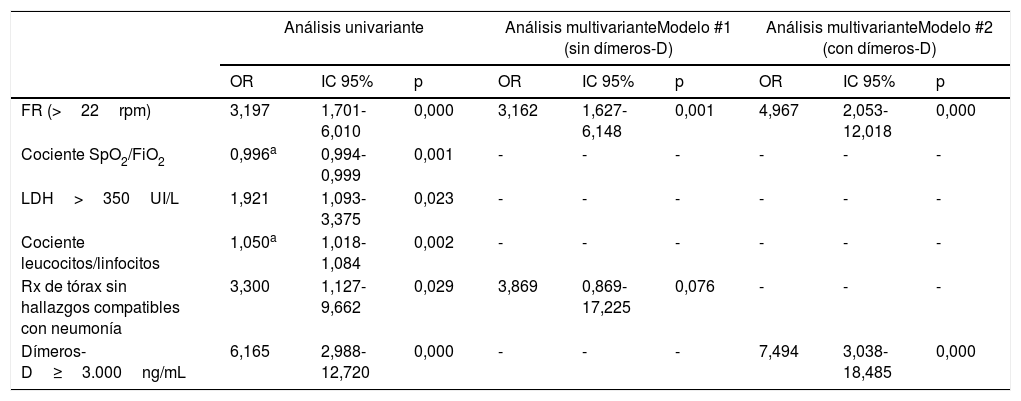
En el primer análisis multivariante (sin inclusión de los niveles de dímeros-D), la frecuencia respiratoria >22rpm a la llegada del paciente al servicio de urgencias (OR: 3,162; IC 95%: 1,627-6,148; p=0,001) y la ausencia de hallazgos compatibles con neumonía en la radiografía simple de tórax (OR: 3,869; IC 95%: 0,869-17,225; p=0,076) actuaron como predictores de ETEP. Al introducir el modelo la presencia de niveles de dímeros-D>3.000ng/mL (OR: 7,494; IC 95%: 3,038-18,485; p<0,001), solo la taquipnea >22rpm mantuvo su asociación estadísticamente significativa con la presencia de ETEP (OR: 4,967; IC 95%: 2,053-12,018; p<0,001) (tabla 2). La capacidad discriminativa de ambos modelos, estimada mediante las correspondientes ABC-COR, fue de 0,679 (IC 95%: 0,602-0,756) y 0,730 (IC 95%: 0,654-0,806), respectivamente.
Modelos uni- y multivariantes predictores de ETEP en pacientes con COVID-19
| Análisis univariante | Análisis multivarianteModelo #1 (sin dímeros-D) | Análisis multivarianteModelo #2 (con dímeros-D) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| OR | IC 95% | p | OR | IC 95% | p | OR | IC 95% | p | |
| FR (>22rpm) | 3,197 | 1,701-6,010 | 0,000 | 3,162 | 1,627-6,148 | 0,001 | 4,967 | 2,053-12,018 | 0,000 |
| Cociente SpO2/FiO2 | 0,996a | 0,994-0,999 | 0,001 | - | - | - | - | - | - |
| LDH>350UI/L | 1,921 | 1,093-3,375 | 0,023 | - | - | - | - | - | - |
| Cociente leucocitos/linfocitos | 1,050a | 1,018-1,084 | 0,002 | - | - | - | - | - | - |
| Rx de tórax sin hallazgos compatibles con neumonía | 3,300 | 1,127-9,662 | 0,029 | 3,869 | 0,869-17,225 | 0,076 | - | - | - |
| Dímeros-D≥3.000ng/mL | 6,165 | 2,988-12,720 | 0,000 | - | - | - | 7,494 | 3,038-18,485 | 0,000 |
ETEP: enfermedad tromboembólica pulmonar; FR: frecuencia respiratoria; IC: intervalo de confianza; LDH: lactato deshidrogenasa; OR: odds ratio.
Los pacientes con COVID-19 desarrollan eventos tromboembólicos potencialmente mortales asociados a la gravedad del sujeto. Objetivamos en nuestro estudio una incidencia acumulada de ETEP del 25,54%, en consonancia con otros estudios como el de Klok et al. o el multicéntrico de Helms et al. (31% y 11,7%, respectivamente), realizados en pacientes graves o críticos6,7. Middeldorp et al. comunicaron una incidencia acumulada de ETEP a los 7, 14 y 21 días del ingreso en la unidad de cuidados intensivos del 26%, 47% y 59%, respectivamente, mientras que en la hospitalización general las cifras fueron del 5,8%, 9,2% y 9,2%5,8, en tanto que en estudios de pacientes leves o moderados no llega al 7%. Aun así, mucho mayor que los datos presentados en la población general, que oscilan entre el 1,3% y el 2,5%9.
Todos los pacientes del estudio se encontraban en tratamiento con terapia anticoagulante, al menos con indicación profiláctica con HBPM desde su ingreso, generando la duda razonable de presentar la ETEP a su entrada en el servicio de urgencias o bien la posibilidad de haber desarrollado dichos eventos tromboembólicos a pesar de la profilaxis, como ya demuestran numerosos estudios, sobre todo los realizados en pacientes críticos7. En nuestro país se mantienen las recomendaciones de tromboprofilaxis y tratamiento antitrombótico en pacientes con COVID-19 editadas por las Sociedad Española de Trombosis y Hemostasia (SETH).
Hasta la fecha no se han identificado con claridad los factores de riesgo asociados al desarrollo de ETEP en estos pacientes10,11. No se ha demostrado evidencia científica de su relación con los factores protrombóticos clásicos; probablemente debido a que fisiopatológicamente un alto porcentaje de los eventos son secundarios al desarrollo de trombosis in situ y no a trombosis distales12,13. En el análisis multivariante (tabla 2) realizado solamente hemos encontrado, como factores asociados de forma independiente a ETEP, la presencia de taquipnea y la ausencia de infiltrados en la radiografía de tórax, además de la elevación del dímero-D≥3.000ng/mL, que per se ya se encuentra elevado en los pacientes con peor pronóstico. Tampoco parecen tener mucha utilidad el uso de escalas de predicción clínica de eventos tromboembólicos.
El resto de parámetros clínicos, analíticos y radiológicos analizados, si bien presentan diferencias estadísticamente significativas con respecto a los pacientes en los que no se ha objetivado ETEP en TCAP, se presentan en las fases más evolucionadas y graves de la COVID-19. Por lo que actualmente no disponemos de herramientas lo suficientemente eficaces que ayuden a predecir si un paciente con infección por SARS-CoV-2 presenta ETEP a su llegada al servicio de urgencias.
Hay que señalar algunas limitaciones en el presente estudio. Se ha realizado un segundo modelo incluyendo el valor dímero-D ante el número de estudios que avalan su relación con la ETEP, si bien en la recogida de datos obtuvimos hasta un 30% de valores perdidos en ambos grupos. Aunque se han analizado los valores gasométricos al ingreso, dadas las condiciones vividas durante esta etapa de la pandemia se han perdido numerosos estudios, además de no poder asegurar las condiciones en las que se extraía la muestra, pues la mayoría de los pacientes se encontraban con aporte de oxígeno, al menos con gafas nasales en el momento de la atención en el servicio de urgencias.
Concluimos que, a pesar de haber identificado determinados factores de riesgo que se asocian a la presencia de ETEP (como la taquipnea >22rpm, la ausencia de infiltrado en la radiografía de tórax o la elevación del dímero-D), el despistaje de esta complicación en pacientes con COVID-19 en los servicios de urgencias sigue constituyendo un reto.
FinanciaciónMario Fernández-Ruiz es beneficiario de un contrato «Miguel Servet» (CP18/00073) del Instituto de Salud Carlos III, Ministerio de Ciencia e Innovación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.