Los objetivos de este estudio fueron: determinar la prevalencia de la enfermedad renal crónica (ERC) en pacientes con diabetes mellitus tipo 2 (DM2) mediante la estimación del filtrado glomerular (FGe); comprobar los factores asociados a ERC; y en qué medida el filtrado glomerular se relaciona con un riesgo aumentado de enfermedad cardiovascular (ECV).
Pacientes y métodoEstudio observacional retrospectivo transversal. Revisión de una muestra representativa de 500 historias clínicas seleccionada aleatoriamente del listado de 2.950 pacientes con DM2 de nuestra área. Se registraron datos sociodemográficos, comorbilidades, factores de riesgo cardiovascular, tratamientos farmacológicos y datos analíticos. La ERC se definió como FGe<60ml/min/1,72m2 y se clasificó en estadios según la K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease.
ResultadosEl 51,6% eran mujeres y la media de edad era de 66,2 años. Se observó una prevalencia de ERC del 23,2%, con 108 casos (21,6%) en estadio 3 y 8 (1,6%) en estadio 4, sin ningún paciente en estadio 5. Un 70,4% eran hipertensos, un 67% tenían dislipidemia, el 17,6% eran fumadores y el 19% tenían antecedente de ECV (46% de ellos, cardiopatía isquémica). La presencia de ERC se relacionó con más edad, sexo femenino, creatinina plasmática elevada, presencia de microabuminuria y antecedentes de tabaquismo activo, HTA, dislipidemia y ECV. Al analizar los datos según las categorías de ERC, desaparecía la relación significativa con el tabaquismo. En el análisis multivariado existía relación positiva con edad, sexo femenino, dislipidemia y cardiopatía isquémica.
ConclusiónEn este estudio se confirma la elevada prevalencia de ERC en pacientes con DM2 y su relación con la presencia de enfermedad cardiovascular.
The aim of this study was: to estimate the prevalence of chronic renal insufficiency (CRI) in diabetic type 2 (DM2) patients treated in Primary Care based on the estimated glomerular filtration rate (GFe); to determine associated factors with CRI, and to evaluate the relationship of GF rate and risk of cardiovascular disease.
Patients and methodsThis was a descriptive cross-sectional study. We included 500 medical histories randomly selected in a total of 2,950 DM2 patients. We registered sociodemographic data, comorbidities, cardiovascular risk factors and laboratory data. CRI definition was based on GFe rate and classified according to the K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease.
ResultsThe prevalence of CRI was 23.2%. There were 51.6% females and the mean age was 66.2 years; 70,4% had hypertension and 67% dyslipidemia. The presence of CRI was related with older age, females, smoking habit, plasma creatinine value, microalbuminuria, and history of hypertension, dyslipidemia and cardiovascular disease. After analysing the data according to the category of GF rate, only the significant relationship with smoking habit disappeared. Multivariate statistic analysis supports a relation with older age, female gender, dyslipidemia and heart disease.
ConclusionsWe confirm a high prevalence of CRI in DM2 patients and their relationship with the presence of cardiovascular disease.
La diabetes mellitus (DM) es una enfermedad muy prevalente y la enfermedad renal crónica (ERC) es una de sus principales complicaciones. Según los recientes datos del estudio di@bet.es, la prevalencia de diabetes tipo 2 (DM2) en España se sitúa en el 13,8%1. Diversos estudios epidemiológicos han determinado la prevalencia de ERC en la población general2,3, pero existen pocos datos sobre su prevalencia en población con DM, la mayoría obtenidos con parámetros poco representativos, como la creatinina o la albuminuria. Por ello no es extraño hallar resultados dispares. Se calcula que entre el 25 y el 40% de pacientes con DM2 desarrollaran nefropatía diabética (NPD) a lo largo de su evolución3. En población general, algunos estudios determinan entre un 5 (Sociedad Española de Nefrología [SEN], estudio EPIRCE) y un 21% la prevalencia de ERC (EROCAP)3. La implementación de fórmulas estimativas del filtrado glomerular (FGe), como la MDRD 4-IDMS y la de Cockcroft-Gault (CG)4, ha mejorado el rendimiento diagnóstico de la ERC en pacientes con DM, habitualmente infravalorada. La fiabilidad y validez de estas fórmulas está ampliamente documentada3,5,6 y parecen idóneas tanto para estratificar el riesgo que supone la ERC como para la detección de la ERC oculta, motivo por el cual están actualmente recomendadas por la mayoría de sociedades científicas, incluida la SEN. Por otro lado, diversos estudios sugieren que la ERC es un marcador independiente del riesgo de muerte y de acontecimientos cardiovasculares en personas con y sin enfermedad cardiovascular (ECV) conocida7, relación bien documentada en la población general, pero escasamente en la población diagnosticada de diabetes. Hay que recordar que la ECV es la causa de muerte de al menos la mitad de los individuos con DM28 y que estos presentan un riesgo de ECV de 2 a 4 veces superior al de los no diabéticos9. La incidencia de ECV arteriosclerótica, y sobre todo de infarto agudo de miocardio, es 3 veces mayor en pacientes con ERC que en población general10,11. Hay que tener en cuenta factores como son la edad y el sexo, el control glucémico, la presencia de hipertensión, la dislipidemia, el tabaquismo, el sedentarismo y la obesidad abdominal al valorar el riesgo cardiovascular en los pacientes con DM para evitar confusión en la evaluación de la importancia de la ERC en dicho riesgo. También se debería valorar la participación de otros factores en la progresión de ERC, como son la raza, el síndrome metabólico y el uso de fármacos nefrotóxicos como antiinflamatorios no esteroideos (AINE) y biguanidas12. La finalidad del presente estudio fue estimar la prevalencia de la ERC basada en el cálculo del FGe, en una muestra representativa de la población diagnosticada de DM2 en nuestra área de influencia. En segundo término, comprobar qué factores de riesgo se asocian a la ERC y valorar la relación entre ERC y ECV.
Material y métodoDe enero a diciembre de 2008 se llevó a cabo el estudio observacional retrospectivo transversal. Asumiendo una prevalencia esperada del 33% de diabéticos con ERC, para una precisión del 4% en la estimación mediante un intervalo de confianza de 95%, y para una población finita de 2.950 individuos, se calculó como necesario incluir 452 sujetos, a lo que se añadió un 10% por posible falta de información o prueba de FGe no válida. La estimación final de la muestra necesaria fue de 500 pacientes con DM2. Las historias clínicas se seleccionaron aleatoriamente a partir de un listado informático de 2.950 pacientes con el diagnóstico de DM2 según criterios ADA 2008, y controlados en Atención Primaria, Centro Terrassa Sud, de Terrassa (provincia de Barcelona), con una población adscrita mayor de 18 años de unas 22.000 personas. Se solicitó el consentimiento oral de los pacientes para usar sus datos en nuestro trabajo. Este estudio no suponía ninguna intervención ni cambio en la asistencia sanitaria habitual de los pacientes. Posteriormente, la información se introdujo de forma anonimizada en la base de datos para su explotación. Se excluyeron los pacientes que no dieron su consentimiento y posteriormente las historias revisadas sin disponibilidad de datos analíticos en los últimos 6 meses. Los datos registrados fueron los siguientes: edad y sexo; años de evolución de la DM2 desde el momento del diagnóstico; etnia; tabaquismo (definido por el consumo activo de tabaco en el último año); antecedentes de hipertensión arterial (HTA), de dislipidemia (se consideró diagnóstico la existencia de tratamiento hipolipidemiante), y de ECV, incluyendo cardiopatía isquémica (CI), enfermedad vascular cerebral (EVC) y enfermedad vascular periférica (EVP). Se registró el antecedente de litiasis renal, y en los pacientes con este diagnóstico se confirmó con una segunda determinación el valor de FGe. Se registró si recibían tratamiento con los siguientes fármacos: metformina, inhibidores de la enzima conversiva de la angiotensina y/o antagonistas de los receptores de angiotensina II y AINE. Como parámetros antropométricos, se registraron el peso (kg), la talla (cm) y el índice de masa corporal (IMC, kg/m2). Se registraron las cifras más recientes de presión arterial sistólica y diastólica (mmHg). En cuanto a valores analíticos, se registraron la creatinina plasmática (mg/dl), la albúmina en orina primomatinal (mg/dl), el filtrado glomerular (fórmula MDRD-4, en ml/min/1,73m2), el colesterol total (mg/dl) y las fracciones unidas a lipoproteínas de alta densidad (HDL) y baja densidad (LDL), y la hemoglobina glucosilada (HbA1c, en %). El valor de FGe se determina actualmente dentro del perfil de seguimiento anual del paciente con DM. Se consideró válido siempre que el sedimento de orina no mostrara alteraciones. En caso contrario, se descartaba el paciente. La ERC se definió por presencia de FGe inferior a 60ml/min/1,73m2, y se clasifica, según la Clinical Practice Guidelines of Chronic Kidney Disease (K/DOQI)13 en:
- 1.
Estadio 1: FGe>90ml/min/1,73m2.
- 2.
Estadio 2: FGe=60-89ml/min/1,73m2.
- 3.
Estadio 3: FGe=30-59ml/min/1,73m2.
- 4.
Estadio 4: FGe=15-29ml/min/1,73m2.
- 5.
Estadio 5: FGe<15ml/min/1,73m2.
Hay que señalar que nuestro laboratorio no diferencia el valor del FGe superior a 60ml/min/1,73m2, por lo cual los estadios 1 y 2 se engloban en la misma categoría.
Análisis estadísticoLa descripción de variables se realizó mediante porcentajes e intervalos de confianza del 95% (IC 95%), o con medias y desviación estándar, según fueran variables cualitativas o cuantitativas, respectivamente. La comparación de las diferencias entre variables para la presencia de ERC y según los diferentes estadios de función renal medidos con el FGe (3 categorías: FGe>60ml/min/1,73m2, FGe=30-60ml/min/1,73m2, FGe<30ml/min/1,73m2, ya que no se observó ningún paciente con FGe<15ml/min/1,73m2) se realizó mediante las pruebas de la ji al cuadrado o el test exacto de Fisher para las cualitativas y U de Mann-Whitney o Kruskall Wallis para las cuantitativas. Se realizó un análisis multivariado mediante regresión logística múltiple por el método Enter, determinándose las odds ratio (OR) y los IC 95%. La variable dependiente fue la ERC, definida de forma dicotómica (0/1 si FGe<60ml/min/1,73m2). Como variables independientes se incluyeron: edad, sexo, IMC, tabaco, colesterol total, colesterol HDL y LDL, años de evolución de la DM2, dislipidemia, HTA, antecedentes de ECV y CI. Por otro lado, para determinar en qué medida el FGe se asociaba a la presencia de ECV y CI de forma independiente se determinaron las OR para la variable del FGe (3 categorías: FGe>60ml/min/1,73m2 –valor de referencia-; 60-30ml/min/1,73m2; <30ml/min/1,73m2) respecto a estas (ECV y CI como variables dependientes dicotómicas en modelos independientes) mediante análisis de regresión logística. Además de la variable categórica FGe (3 estadios), se incluyeron también en el modelo como covariables: edad, sexo, IMC, tabaco, colesterol total, colesterol HDL y LDL, Hb glucosilada, años de evolución de la DM, dislipidemia e HTA. El ajuste de la bondad de los modelos se realizó mediante el estadístico seudo-R2, escogiendo aquellos de mayor verosimilitud. Se consideró estadísticamente significativa una p<0,05 o un IC que no incluyera la unidad. Se utilizó el paquete estadístico Stata/SE® versión 9.0. (Stata Corporation, College Station, TX, EE.UU.).
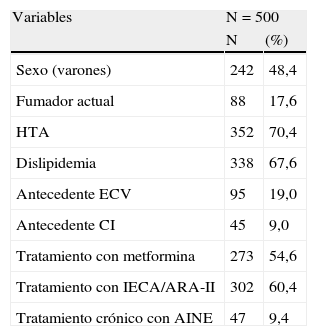
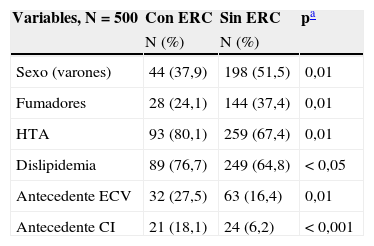
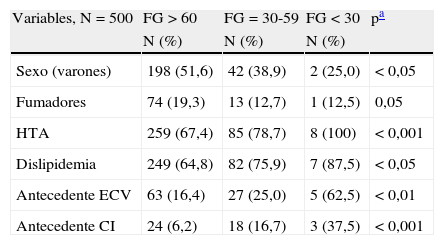
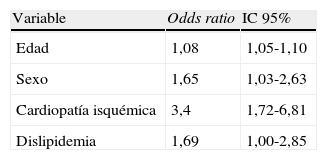
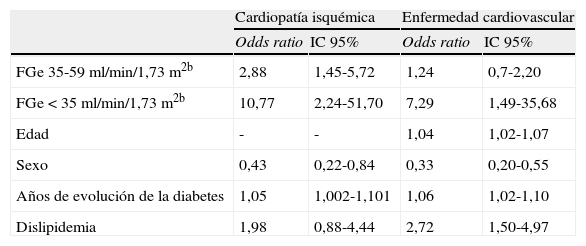
ResultadosLa tabla 1 muestra la descripción de las variables sociodemográficas, clínicas y analíticas de la población del estudio. Se incluyeron 500 pacientes, con un 51,6% de mujeres. La edad media fue de 66,2 años. El 94,8% eran de etnia caucásica (474 pacientes). Un 17,6% eran fumadores y un 16,1% ex fumadores. La media de años de evolución de la DM2 fue de 7,5. El 70,4% (352 pacientes) eran hipertensos, de los cuales el 85,5% (301) presentaban buen grado de control (presión arterial<130/80mmHg). Estaban diagnosticados de dislipidemia el 67,6%, y el 19% tenían antecedente de ECV, siendo el 46% de ellos CI, el 24% EVC, el 9,6% EVP y el resto presentaba más de una de ellas. La prevalencia de enfermedad renal en nuestra población diabética fue del 23,2% (116 pacientes), distribuidos 108 (21,6%) en el estadio 3 y 8 (1,6%) en el estadio 4, sin encontrar ningún paciente en estadio 5. En la tabla 2 se muestran las diferencias en las variables evaluadas entre pacientes diabéticos con y sin ERC. Los pacientes con ERC tuvieron una media de edad mayor (72,6 frente a 64,3 años; p<0,001) y predominaban las mujeres (62,1 frente a 48,5%; p<0,01). La ERC se asoció con HTA, dislipidemia, ECV y CI. La asociación con el tabaquismo fue significativa, pero a favor de los pacientes sin ERC, lo que podríamos explicar por el predominio de mujeres en el grupo con ERC, siendo estas menos fumadoras que los varones. Los pacientes con ERC tenían cifras más elevadas de creatinina plasmática (1,2 frente a 0,9mg/dl; p<0,001) y de microalbuminuria (4,3 frente a 2,6mg/dl; p<0,01). Aunque se observó una mayor duración de la DM2 (8,6 frente a 7,1 años) y valores menores de HbA1c (7,2 frente a 7,4%) en el grupo con ERC, las diferencias no alcanzaron la significación estadística (p=0,07). No se encontraron diferencias significativas respecto al IMC, el colesterol total y las fracciones HDL y LDL. En la tabla 3 se resumen las variables según las categorías de FGe, hallando diferencias significativas para las variables sexo, edad, antecedentes de ECV, presencia de HTA, dislipidemia, creatinina plasmática y microalbuminuria. Los resultados del análisis multivariado para la ERC se muestran en la tabla 4. En el modelo final de regresión persistió la asociación significativa con la edad (OR 1,08; IC 95% 1,06-1,11), el sexo femenino (OR 1,65; IC 95% 1,03-2,65), la dislipidemia (OR 1,69; IC 95% 1,00-2,85) y la CI (OR 3,45; IC 95% 1,72-6,81). En la tabla 5 se muestran los resultados de la asociación del FGe con la CI y la ECV mediante los análisis multivariados tras ajustar por las covariables a estudio. Un FGe<35ml/min/1,73m2 (respecto a un FGe>60ml/min/1,73m2) se asoció significativamente con CI (OR 10,8) y ECV (OR 7,3), mientras que la presencia de FGe entre 35-59ml/min/1,73m2se asoció solo con CI (OR 2,9).
Descripción de la población del estudio
| Variables | N=500 | |
| N | (%) | |
| Sexo (varones) | 242 | 48,4 |
| Fumador actual | 88 | 17,6 |
| HTA | 352 | 70,4 |
| Dislipidemia | 338 | 67,6 |
| Antecedente ECV | 95 | 19,0 |
| Antecedente CI | 45 | 9,0 |
| Tratamiento con metformina | 273 | 54,6 |
| Tratamiento con IECA/ARA-II | 302 | 60,4 |
| Tratamiento crónico con AINE | 47 | 9,4 |
| Media | DE | |
| Edad (años) | 66,2 | 11,1 |
| Evolución diabetes (años) | 7,5 | 5,6 |
| IMC (kg/m2) | 30,5 | 4,9 |
| HbA1c (%) | 7,38 | 1,46 |
| Filtrado glomerular (ml/min/1,73 m2) | 58,4 | 6,7 |
| Creatinina plasmática (mg/dl) | 1,0 | 0,3 |
| Microalbuminuria (mg/dl) | 3,1 | 5,9 |
| Colesterol total (mg/dl) | 187,6 | 35,0 |
| Colesterol LDL (mg/dl) | 115,5 | 34,0 |
| Colesterol HDL (mg/dl) | 43,7 | 20,8 |
AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas de los receptores de la angiotensina II; CI: cardiopatía isquémica; Colesterol HDL: colesterol unido a lipoproteínas de alta densidad; Colesterol LDL: colesterol unido a lipoproteínas de baja densidad; DE: desviación estándar; ECV: enfermedad cardiovascular; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IECA: inhibidores de la enzima conversiva de la angiotensina; IMC: índice de masa corporal.
Descripción de las variables según presencia o no de enfermedad renal
| Variables, N=500 | Con ERC | Sin ERC | pa |
| N (%) | N (%) | ||
| Sexo (varones) | 44 (37,9) | 198 (51,5) | 0,01 |
| Fumadores | 28 (24,1) | 144 (37,4) | 0,01 |
| HTA | 93 (80,1) | 259 (67,4) | 0,01 |
| Dislipidemia | 89 (76,7) | 249 (64,8) | <0,05 |
| Antecedente ECV | 32 (27,5) | 63 (16,4) | 0,01 |
| Antecedente CI | 21 (18,1) | 24 (6,2) | <0,001 |
| Media (DE) | Media (DE) | ||
| Edad (años) | 72,6 (10,3) | 64,3 (10,6) | <0,001 |
| Evolución diabetes (años) | 8,6 (6,9) | 7,1 (5,1) | 0,07 |
| IMC (kg/m2) | 30,4 (5,2) | 30,6 (4,7) | ns |
| HbA1c (%) | 7,2 (1,5) | 7,4 (1,4) | 0,07 |
| Creatinina plasmática (mg/dl) | 1,23 (0,32) | 0,9 (0,2) | <0,001 |
| Microalbuminuria (mg/dl) | 4,41 (8,1) | 2,7 (5,1) | <0,01 |
| Colesterol total (mg/dl) | 188,03 (34,6) | 187,5 (35,2) | ns |
| Colesterol LDL (mg/dl) | 113,8 (33,9) | 116,04 (34,1) | ns |
| Colesterol HDL (mg/dl) | 45,0 (24,9) | 43,4 (19,5) | ns |
Valor de p mediante el test exacto de Fisher o U de Mann Whitney.
CI: cardiopatía isquémica; Colesterol HDL: colesterol unido a lipoproteínas de alta densidad; Colesterol LDL: colesterol unido a lipoproteínas de baja densidad; DE: desviación estándar; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IMC: índice de masa corporal.
Diferencias de las variables del estudio según el estadio del filtrado glomerular (ml/min/1,73m2)
| Variables, N=500 | FG>60 | FG=30-59 | FG<30 | pa |
| N (%) | N (%) | N (%) | ||
| Sexo (varones) | 198 (51,6) | 42 (38,9) | 2 (25,0) | <0,05 |
| Fumadores | 74 (19,3) | 13 (12,7) | 1 (12,5) | 0,05 |
| HTA | 259 (67,4) | 85 (78,7) | 8 (100) | <0,001 |
| Dislipidemia | 249 (64,8) | 82 (75,9) | 7 (87,5) | <0,05 |
| Antecedente ECV | 63 (16,4) | 27 (25,0) | 5 (62,5) | <0,01 |
| Antecedente CI | 24 (6,2) | 18 (16,7) | 3 (37,5) | <0,001 |
| Media (DE) | Media (DE) | Media (DE) | ||
| Edad (años) | 64,3 (10,6) | 72,2 (10,4) | 78,2 (7,7) | <0,001 |
| Evolución DM (años) | 7,1 (5,08) | 8,8 (7,0) | 7 (3,2) | ns |
| IMC (kg/m2) | 30,6 (4,7) | 30,3 (5,0) | 31,01 (7,0) | ns |
| HbA1c (%) | 7,44 (1,4) | 7,23 (1,5) | 6,9 (1,52) | 0,09 |
| Creatinina plasmática (mg/dl) | 0,9 (0,2) | 1,2 (0,2) | 1,9 (0,6) | <0,001 |
| Microalbuminuria (mg/dl) | 2,7 (5,1) | 3,7 (7,7) | 13,0 (9,0) | <0,001 |
| Colesterol total (mg/dl) | 187,2 (35,2) | 187,7 (34,9) | 192,1 (31,9) | ns |
| Colesterol LDL (mg/dl) | 116,0 (34,1) | 113,5 (34,5) | 118,5 (26,3) | ns |
| Colesterol HDL (mg/dl) | 43,4 (19,5) | 45,6 (25,6) | 36,4 (5,2) | ns |
Valor de p mediante el test exacto de Kruskal Wallis.
CI: cardiopatía isquémica; Colesterol HDL: colesterol unido a lipoproteínas de alta densidad; Colesterol LDL: colesterol unido a lipoproteínas de baja densidad; DE: desviación estándar; DM: diabetes mellitus; ECV: enfermedad cardiovascular; FG: filtrado glomerular; HbA1c: hemoglobina glucosilada; HTA: hipertensión arterial; IMC: índice de masa corporal.
Análisis multivariado de regresión logística para enfermedad renal crónicaa
| Variable | Odds ratio | IC 95% |
| Edad | 1,08 | 1,05-1,10 |
| Sexo | 1,65 | 1,03-2,63 |
| Cardiopatía isquémica | 3,4 | 1,72-6,81 |
| Dislipidemia | 1,69 | 1,00-2,85 |
aModelo final tras ajustar por todas las covariables a estudio.
IC 95%: intervalo de confianza del 95%.
Asociación del filtrado glomerular con cardiopatía isquémica y enfermedad cardiovascular (análisis multivariado)a
| Cardiopatía isquémica | Enfermedad cardiovascular | |||
| Odds ratio | IC 95% | Odds ratio | IC 95% | |
| FGe 35-59ml/min/1,73 m2b | 2,88 | 1,45-5,72 | 1,24 | 0,7-2,20 |
| FGe<35 ml/min/1,73 m2b | 10,77 | 2,24-51,70 | 7,29 | 1,49-35,68 |
| Edad | - | - | 1,04 | 1,02-1,07 |
| Sexo | 0,43 | 0,22-0,84 | 0,33 | 0,20-0,55 |
| Años de evolución de la diabetes | 1,05 | 1,002-1,101 | 1,06 | 1,02-1,10 |
| Dislipidemia | 1,98 | 0,88-4,44 | 2,72 | 1,50-4,97 |
aModelo final de regresión logística tras ajustarlo por el resto de covariables a estudio.
bComparación respecto a filtrado glomerular estimado (FGe) >60ml/min/1,73 m2 como valor de referencia.
IC 95%: intervalo de confianza del 95%.
Este estudio aporta como novedad la determinación en nuestro medio de la prevalencia de ERC en pacientes con DM2 mediante las fórmulas de cálculo de FGe y la relación con factores de riesgo cardiovascular y ECV según los estadios de la ERC.
Los principales resultados fueron:
- 1.
El hallazgo de una prevalencia de ERC del 23,2% en diabéticos tipo 2 mediante el cálculo del FGe.
- 2.
La asociación independiente de la edad, el sexo femenino, la dislipidemia y la CI con la presencia de ERC en pacientes con DM2.
Por otro lado, existe un riesgo de 3 a 10 veces mayor en los diabéticos tipo 2 con un FGe<60ml/min/1,73m2 para la presencia de CI, independientemente de otros factores de riesgo ya conocidos, así como un mayor riesgo también (OR 7) para la presencia de cualquier otro evento cardiovascular en aquellos diabéticos con FGe<35ml/min/1,73m2. Creemos que es útil en este punto recordar que en la definición de NPD no se incluye la función renal propiamente dicha, sino solo la presencia de albuminuria en orina. La función renal se evaluaba hasta ahora principalmente con la creatinina plasmática y el aclaramiento de creatinina, siendo ambos estimadores poco exactos. Así pues, dado que un número importante de diabéticos (hasta un 30%) tienen ERC sin elevación de la excreción urinaria de albúmina, y la creatinina es poco representativa, se hacía necesaria la valoración de la función renal con parámetros más útiles como es el FGe14. Por este motivo, los estudios publicados hasta el momento reflejan datos de prevalencia de ERC muy variables. La prevalencia de NPD se estima entre el 25 y el 40% de la población diabética15. Marín et al.2 hallan un 15,5% de diabéticos tipo 2 con creatinina elevada y un 23,5% de proteinuria positiva. El estudio NHANES III determina un 12% de pacientes diabéticos tipo 2 con creatinina elevada16. Parving et al.15 detectan una prevalencia del 39% de afectación renal en una cohorte de 24.151 diabéticos de varios países mediante detección de microalbuminuria y el 22% de ERC mediante detección de FGe (<60ml/min/1,73m2). Estudios más recientes se basan en el FGe y encuentran prevalencias similares a las nuestras. Gimeno et al.4 confirman que en pacientes con DM 2 las fórmulas de CG y de MDRD son igualmente válidas para predecir la presencia de ECV clínica. De Pablos et al.17 detectan un 22,9% de ERC y Rodríguez-Poncelas et al.18 obtienen una prevalencia del 16,6%, siendo el 60,3% la ERC oculta, ambos con el cálculo del FGe mediante la fórmula MDRD. Tranche Iparraguirre et al.19 detectan con la fórmula CG una prevalencia de ERC del 40,5%. Estos 3 estudios tienen prevalencias similares a las nuestras de los otros factores de riesgo cardiovascular. Un estudio australiano que usó también la fórmula CG obtuvo una prevalencia de FGe reducido del 27,6% en población diabética, que triplicaba la de la población no diabética20. Recientemente, Lou et al.21 publican su estudio epidemiológico con casi 17.000 pacientes, en el que determinan una prevalencia de ERC del 34,6% con el FGe, detectando además un 16,1% de pacientes con micro-macroalbuminuria. Está bien definida la relación entre la ERC y la ECV y con los otros factores de riesgo cardiovascular. En nuestro caso, la ERC se asoció con HTA, dislipidemia, ECV y CI, y en cambio no hubo diferencias respecto a IMC, HbA1c, colesterol total y colesterol HDL y LDL.
En el análisis multivariado únicamente persistió la asociación significativa de la ERC con la edad, el sexo femenino, la dislipidemia y la CI. Varios estudios han hallado asociación con la edad y el sexo femenino, pero en cambio hay heterogeneidad en cuanto a la asociación con la dislipidemia y la HTA17,18. En cuanto a la asociación con CI, no hay muchos datos en diabéticos. Un reciente estudio publicado, prospectivo y de base poblacional, encuentra mayor riesgo en pacientes con ERC para presentar eventos coronarios, lo cual iría en consonancia con nuestros datos22. Respecto al riesgo de padecer ECV en pacientes con ERC, los resultados concuerdan también con los de la mayoría de la bibliografía, que demuestran un aumento de riesgo. Dos grandes estudios, como son el UKPDS23 y el Framingham24, ya determinaban mayor riesgo cardiovascular con mayor grado de afectación renal. Y estudios más recientes, como el ADVANCE, demuestran que hay un progresivo aumento de acontecimientos cardiovasculares con el incremento de albuminuria y el descenso del FGe. Gracia et al.5 aseguran que los diabéticos con nefropatía tienen más riesgo de infarto de miocardio y de muerte de causa cardiaca. Según Rodríguez Poncelas et al.18 y de Pablos-Velasco.17, el valor del FGe es capaz de predecir eventos cardiovasculares, y Shara et al.25 aseguran que la ERC es un marcador independiente de eventos cardiovasculares en personas con o sin ECV conocida. El estudio de Robles et al. publicado en 200826 determina que el riesgo de ECV aumenta con la presencia de microalbuminuria, principalmente en población con DM, y mucho más si se da esta e HTA. El estudio HOPE demostraba que los pacientes con insuficiencia renal tienen una incidencia significativamente aumentada de eventos cardiovasculares primarios y mortalidad cardiovascular y global11. Respecto a la relación entre la ECV y la ERC, al realizar el análisis multivariado ajustado por factores de riesgo cardiovascular (edad, sexo, IMC, tabaquismo, dislipidemia, HTA) y duración y control (Hb A1c) de la DM, confirmamos un mayor riesgo para presentar CI en los pacientes con ERC; en cambio, no se observó un mayor riesgo estadísticamente significativo para EVC. Este resultado coincide también con los estudios comentados que determinan más riesgo de infarto y de muerte de causa cardiaca.
Las limitaciones de este trabajo son las propias de un estudio observacional y de corte transversal, al no poder establecer relaciones de causalidad entre las variables. Por otra parte, los resultados son locales y pueden no ser extrapolables a otras zonas.
En conclusión, nuestro estudio confirma la elevada prevalencia de enfermedad renal en la población diabética, lo cual hace patente la necesidad de una detección precoz, especialmente desde la Atención Primaria, para poder realizar las acciones adecuadas. En segundo lugar, detectamos una asociación positiva entre la presencia de ERC y la ECV, valorada también según el estadio del filtrado glomerular. Este último hecho es importante cara a una mayor prevención cardiovascular de los pacientes diabéticos con ERC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.