La selectividad es la propiedad de un fármaco para unirse de forma preferente a una estructura biológica. La mayor parte de los fármacos pueden unirse y estimular o inhibir más de un sistema. Por ello es interesante que sean selectivos para la estructura sobre la que se pretende actuar y que con las dosis empleadas no ejerzan efectos sobre otras que pueden producir reacciones adversas. La selectividad se valora mediante experimentos in vitro sobre órganos o células aislados. Si se pretende comparar fármacos, el experimento debe realizarse sobre el mismo tejido y con el mismo diseño. Aun así, los datos obtenidos no se pueden extrapolar directamente a la clínica, por la influencia de las propiedades farmacocinéticas, que son las que permiten que el fármaco llegue en concentración adecuada al lugar de acción. En el caso de los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) se valora su capacidad para inhibir el SGLT2 renal sin modificar el SGLT1 intestinal, cuya inhibición podría producir reacciones adversas digestivas. Se calcula la concentración necesaria para inhibir cada uno de los transportadores y el cociente entre la que inhibe SGLT1 y la necesaria para inhibir SGLT2. Cuanto mayor sea el cociente, mayor será la selectividad y menor el riesgo de reacciones adversas digestivas. Los 3 iSGLT2 recientemente introducidos en terapéutica son suficientemente selectivos sobre SGLT2 como para que no sean esperables efectos sobre SGLT1 intestinal. Para diferenciar a los componentes de este grupo puede ser más interesante analizar sus propiedades farmacocinéticas que sus características farmacodinámicas, como la selectividad.
Selectivity is the property of a drug to preferentially bind to a biological structure. Most drugs can bind and stimulate or inhibit more than one system. Therefore, it is important that they are selective for the intended site and that the doses used do not have effects on other sites, which could provoke adverse reactions. Selectivity is assessed through in vitro experiments on organs or isolated cells. If the aim is to compare drugs, the experiment should be conducted in the same tissue and with the same design. Even so, the results cannot be directly extrapolated to clinical practice due to the influence of pharmacokinetic properties, which allow an adequate dose of the drug to reach the target site. Sodium-glucose cotransporter-2 inhibitors (SGLT2i) are able to inhibit renal SGLT2 without modifying intestinal SGLT1, whose inhibition could produce gastrointestinal adverse reactions. The concentration needed to inhibit each of the transporters is calculated, as well as the ratio between the concentration that inhibits SGLT1 and the concentration needed to inhibit SGLT2. The higher the ratio, the greater the selectivity and the lower the risk of gastrointestinal adverse reactions. The three SGLT2i recently introduced in the therapeutic arsenal are sufficiently selective for SGLT2 to make effects on intestinal SGLT1 unlikely. To differentiate the components of this therapeutic class, its pharmacokinetic properties should be analysed rather than its pharmacodynamic characteristics, such as selectivity.
La introducción en terapéutica del grupo de los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) ha puesto de actualidad el concepto farmacológico de la selectividad.
En una molécula biológicamente activa sobre 2 o más procesos, se entiende por selectividad su actividad preferente para uno de ellos. La selectividad depende de la afinidad de la molécula por el sistema biológico sobre el que actúa. Por ejemplo, una molécula que puede actuar sobre los sistemas A y B y tiene 100 veces más afinidad por el A que por el B se afirma que es selectiva para A1.
Un fármaco se caracteriza respecto de un determinado sistema biológico (al que se puede llamar diana y que será un receptor, un canal iónico, una enzima o un transportador) por 2 propiedades: afinidad y actividad intrínseca. La afinidad es la capacidad de unión al lugar donde ejercerá su acción y la actividad intrínseca es la capacidad para estimular el sistema biológico. Una y otra dependen de la complementariedad entre la estructura química del fármaco y la de la diana. Los fármacos que poseen afinidad y actividad intrínseca son agonistas, los que solo poseen afinidad, antagonistas. La afinidad define la potencia de un fármaco (potencia = 1/afinidad) y la actividad intrínseca, la eficacia2.
El diseño de nuevos fármacos se basa, cada vez más, en el conocimiento de la estructura molecular del sistema biológico sobre la que se pretende actuar. A partir del conocimiento de la estructura de un receptor se diseña una molécula capaz de unirse a este y estimularlo o inhibirlo. El objetivo del diseño es conseguir que el nuevo compuesto sea capaz de unirse a una única estructura biológica, es lo que se llama especificidad. Sin embargo, la mayoría de las veces, las posibles dianas son subtipos de estructuras biológicas con una gran similitud, lo que dificulta conseguir que un fármaco se una exclusivamente a uno de ellos. El resultado final es la obtención de un compuesto químico que tiene mayor apetencia por uno de los subtipos de receptor, pero que en determinadas condiciones también puede unirse a otros del grupo. Esa mayor facilidad para unirse a un receptor de entre varios que pertenecen al mismo grupo se debe a la selectividad3. Esta propiedad caracteriza a los fármacos capaces de estimular o bloquear distintos tipos de receptores como los histamínicos, los alfa o los betaadrenérgicos o los de la serotonina.
La selectividad puede utilizarse para comparar fármacos respecto de una misma diana biológica, en cuyo caso se clasifican los fármacos según su potencia. Si, como suele ser habitual, pueden unirse a más de una diana, se clasifican según la razón de afinidades para 2 sistemas biológicos distintos.
La selectividad por una diana se debe a que el fármaco es capaz de unirse a ella a una concentración mucho menor que la necesaria para actuar sobre otra del mismo grupo. Es decir, tiene mayor afinidad por una diana que por otra. La afinidad se puede medir mediante la utilización de moléculas marcadas radiactivamente o mediante ensayos biológicos. En el segundo caso se calcula la cantidad de sustancia necesaria para producir un determinado efecto, que por convención es el 50% del máximo que se puede producir. Por ello hablamos de concentración eficaz 50% (CE50) o concentración inhibitoria 50% (CI50). Estos cálculos se realizan mediante experimentos in vitro, en órganos o células aisladas. Cuando el mismo tipo de cálculo se realiza en animales íntegros o en humanos se habla de dosis en lugar de concentración1.
Diferencias entre SGLT1 y SGLT2Existen diferentes tipos de cotransportadores sodio-glucosa que se conocen como SGLT (sodium glucose linked transporter), y que están repartidos por diferentes órganos y sistemas. Los de tipo 1 y 2 son los mejor conocidos y existe similitud estructural entre ellos. No obstante, hay diferencias en su localización, su afinidad para la glucosa y su capacidad de transporte4.
El de tipo 2 se localiza de forma casi exclusiva en el riñón, en los segmentos 1 y 2 del túbulo contorneado proximal, mientras que el de tipo 1 se encuentra en el segmento 3 del túbulo, pero también, y en mayor concentración, en el intestino delgado, el corazón y el músculo estriado5.
El SGLT1 transporta 2 iones sodio por cada molécula de glucosa mientras que en el SGLT2 la razón es 1:1. La glucosa tiene alta afinidad por el SGLT1, cuya capacidad de transporte es baja, mientras que la afinidad por el SGLT2 es baja, pero la capacidad de transporte es elevada. Ello significa que una concentración de glucosa de 0,4 mM puede activar el de tipo 1, mientras que la que activa el de tipo 2 es 5 veces más alta, pero una vez activados, SGLT2 es más eficaz y transporta 10 nmol/min de glucosa, mientras que SGLT1 transporta 2 nmol/min. Debido a su localización anatómica y a sus características, el SGLT2 reabsorbe el 90% de la glucosa filtrada mientras que el SGLT1 solo transporta el 10%6,7.
Algunos individuos presentan una mutación del gen que regula SGLT1 y sufren el síndrome de malabsorción de glucosa-galactosa, que cursa con diarrea acuosa y deshidratación8. El cuadro remite con una dieta sin glucosa, lo que demuestra que este es el transportador de glucosa más importante en el intestino delgado. Sin embargo, estos pacientes tienen poca o nula glucosuria, lo que indica su escaso papel renal. En contraste, los humanos con mutación en el gen de SGLT2 presentan el síndrome de glucosuria renal familiar9, con intensa eliminación urinaria de glucosa que no se acompaña de otras alteraciones.
Selectividad de los inhibidores de SGLT2Un fármaco es útil desde el punto de vista terapéutico cuando su selectividad es tal que con la dosis utilizada es capaz de actuar solo sobre la estructura biológica deseada, sin hacerlo sobre otras que podrían dar lugar a reacciones adversas1. Cuando existen estructuras tan próximas como las de los distintos cotransportadores sodio-glucosa4 es importante valorar el grado de selectividad de los fármacos diseñados para la inhibición de uno de ellos. En este caso, el SGLT2 localizado en el túbulo renal proximal10.
Para valorar la selectividad de los diferentes inhibidores de SGLT2 (iSGLT2) se ha recurrido al cálculo de sus CI50 en diferentes diseños experimentales. La mayor parte de los estudios se han dirigido al cálculo de la selectividad de SGLT2 frente a SGLT1; para ello se ha dividido la concentración necesaria para inhibir en un 50% el SGLT1, por la que se precisa para inhibir al 50% el SGLT2.
Un aspecto importante para calcular la selectividad, y sobre todo para comparar la de diferentes sustancias para la misma diana, es que los datos deben proceder del mismo sustrato biológico y del mismo diseño experimental, ya que existen diferencias entre especies animales, y el método utilizado influye en el resultado3. Esto explica que cuando se acude a diferentes fuentes se encuentren distintos valores para la selectividad de los iSGLT2.
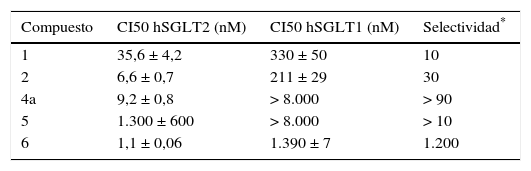
El descubrimiento de la dapagliflozina fue el resultado de una investigación con diferentes compuestos de estructura química muy similar en los que se evaluó, por un lado, su capacidad para inhibir SGLT1 y SGLT2, es decir su selectividad, y, por otro, su eficacia como glucosúricos11. La capacidad para inhibir SGLT2 se valoró in vitro en un cultivo de células de ovario de hámster que expresan SGLT1 y SGLT2 humanos. Los resultados obtenidos para algunos de los fármacos investigados se recogen en la tabla 1. El compuesto número 1 es la florizina, un fármaco glucosúrico obtenido en el siglo xix de la corteza del manzano12, y el 6 la dapagliflozina. Como puede observarse, la razón entre las CI50 para los 2 tipos de cotransportador, es decir, la selectividad para SGLT2 frente a SGLT1 fluctúa entre 10 para la florizina y 1.200 para la dapagliflozina, con valores intermedios para las otras moléculas investigadas. Cuando se comparó el efecto glucosúrico se observó que, tras la administración de la misma dosis de todos los compuestos, el 6 era el que producía mayor efecto; por ello se decidió su desarrollo clínico.
Selectividad de diferentes compuestos inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2)11
| Compuesto | CI50 hSGLT2 (nM) | CI50 hSGLT1 (nM) | Selectividad* |
|---|---|---|---|
| 1 | 35,6 ± 4,2 | 330 ± 50 | 10 |
| 2 | 6,6 ± 0,7 | 211 ± 29 | 30 |
| 4a | 9,2 ± 0,8 | > 8.000 | > 90 |
| 5 | 1.300 ± 600 | > 8.000 | > 10 |
| 6 | 1,1 ± 0,06 | 1.390 ± 7 | 1.200 |
CI50: concentración inhibitoria del 50%.
Compuesto 1: florizina; compuesto 6: dapagliflozina.
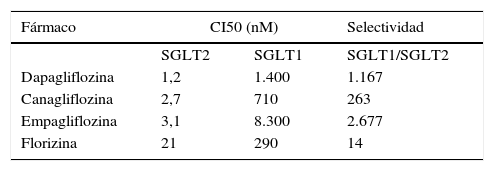
Durante el desarrollo de los otros fármacos iSGLT2 se realizaron experimentos similares13,14. En el caso concreto de la empagliflozina se utilizó un cultivo de células de riñón embrionario humano, conocidas como HEK 293, en las que mediante el manejo adecuado se pueden expresar distintos tipos de SGLT. En el estudio14 no solo se compararon moléculas próximas a empagliflozina, sino que se comparó también con dapagliflozina y canagliflozina. Ello ha permitido tener los valores de CI50 de los 3 fármacos comercializados en España en el mismo reactivo biológico, lo que facilita la comparación. La tabla 2 muestra los valores obtenidos.
Selectividad de los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) comercializados14
| Fármaco | CI50 (nM) | Selectividad | |
|---|---|---|---|
| SGLT2 | SGLT1 | SGLT1/SGLT2 | |
| Dapagliflozina | 1,2 | 1.400 | 1.167 |
| Canagliflozina | 2,7 | 710 | 263 |
| Empagliflozina | 3,1 | 8.300 | 2.677 |
| Florizina | 21 | 290 | 14 |
CI50: concentración inhibitoria del 50%.
Según los resultados de este estudio, la concentración de empagliflozina necesaria para inhibir el SGLT1 es 2.677 veces mayor que la que inhibe el SGLT2. En el caso de dapagliflozina es 1.167 veces mayor y en el de canagliflozina 263 veces. Por eso se puede afirmar que estos fármacos son selectivos para SGLT2. En cambio, para florizina el cociente entre la CI50 de SGLT1 y SGLT2 es 14, lo que significa que su selectividad para SGLT2 es baja, ya que si se eleva 14 veces la concentración de fármaco se inhibiría también SGLT1. Por ello se considera que la florizina es un iSGLT no selectivo14.
Si se compara la selectividad de los diferentes iSGLT2 respecto de este transportador utilizando los resultados del estudio se puede establecer el siguiente orden de potencias: dapagliflozina (CI50, 1,2 nM) > canagliflozina (2,7 nM) > empagliflozina (3,1 nM), que se debe interpretar como que dapagliflozina es el fármaco con mayor selectividad para SGLT2, seguido de canagliflozina y empagliflozina. Sin embargo, si se ordenan los fármacos teniendo en cuenta la razón de las selectividades por los 2 tipos de transportador, el orden es empagliflozina > dapagliflozina > canagliflozina.
Como se ha comentado anteriormente, el valor de la CI50 puede variar según el método utilizado para calcularlo. Si los datos proceden del mismo experimento puede haber diferencias cuantitativas, pero debe conservarse el orden, y si proceden de distintos experimentos podría también modificarse el orden. Las fichas técnicas de los fármacos comercializados en España dan valores de 0,55 nM para dapagliflozina15 y de 1,3 nM para empagliflozina16. El fabricante de canagliflozina no incluye este dato17.
Implicaciones clínicas de la inhibición de SGLT1 y SGLT2El desarrollo de fármacos iSGLT2 con mayor selectividad para este transportador que para otros SGLT, en especial el SGLT1, se debe a 3 razones: SGLT2 es responsable de la mayoría de la reabsorción tubular de glucosa, tanto en personas normoglucémicas como hiperglucémicas o con diabetes; la mutación de SGLT2 produce un incremento en la eliminación urinaria de glucosa que caracteriza a la glucosuria familiar renal y, por último, la inhibición o la mutación de SGLT1 produce alteraciones digestivas10.
El fármaco que se utiliza como patrón de comparación, la florizina, se obtuvo hace casi 2 siglos, su efecto glucosúrico es bien conocido y se intentó utilizar en el tratamiento de los procesos más variados12. Es un fármaco no selectivo que inhibe SGLT1 con concentraciones entre 10 y 20 veces superiores a las necesarias para inhibir SGLT2. Además produce efectos adversos digestivos y una duración de efecto muy breve cuando se administra por vía oral7,11,14.
Desde el punto de vista clínico, el grado de selectividad para SGLT2 es importante, ya que la inhibición del SGLT1 se asocia con reacciones adversas potencialmente graves. Aunque a nivel renal, SGLT1 juega un papel poco relevante, este transportador localizado fundamentalmente en el intestino delgado, facilita la absorción de la glucosa procedente de la alimentación y su inhibición da lugar a un incremento de la glucosa en la luz intestinal, con riesgo de aparición de diarrea osmótica. Como se ha comentado, SGLT1 se encuentra también en otros tejidos, pero su papel es peor conocido4,18. Además, si se minimiza el riesgo de inhibición de SGLT1, disminuirá también el riesgo de hipoglucemias vinculadas a mecanismos de contrarregulación, ya que un incremento de glucosa en el intestino distal podría incrementar la secreción de péptido similar al glucagón tipo 1 (GLP1).
El grado de selectividad de los iSGLT2 comercializados en España se recoge en la tabla 2. Según esos datos, para inhibir el SGLT1 intestinal con dapagliflozina sería necesaria una cantidad de fármaco 1.167 veces mayor que la que inhibe el SGLT2 renal, por lo que la posibilidad de inhibirlo con las dosis utilizadas en terapéutica es prácticamente inexistente. Algo semejante se puede decir para empagliflozina, fármaco con el que para inhibir SGLT1 habría que aumentar la concentración 2.677 veces. En el caso de canagliflozina habría que multiplicar por 26314. Si bien, desde un punto de vista teórico, el riesgo será menor cuando mayor sea la selectividad, las diferencias pierden valor clínico cuando los valores son superiores a 100. Por tanto, el riesgo de efectos adversos intestinales por inhibición de SGLT1 con cualquiera de los iSGLT2 recién introducidos en terapéutica es mucho menor que con la florizina y se puede considerar prácticamente inexistente, excepto en el caso de la dosis de 300 mg de canagliflozina, en que podría producirse una inhibición de SGLT1 intestinal de breve duración como consecuencia de una mayor disponibilidad de fármaco en ese lugar.
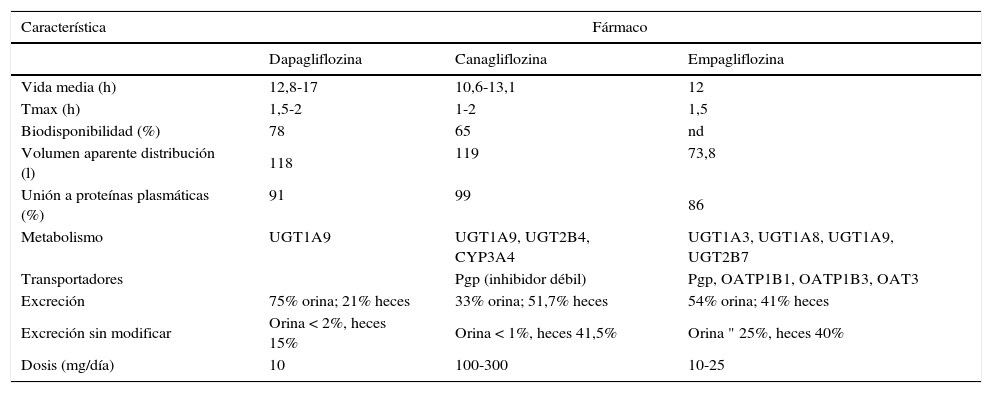
Debe aclararse que los datos procedentes de experimentos in vitro no son directamente extrapolables al comportamiento de los fármacos in vivo. Los efectos de un fármaco en un ser vivo dependen no solo de las características farmacodinámicas (afinidad y actividad intrínseca), sino de sus propiedades farmacocinéticas, que serán las que permitan que llegue a su lugar de acción. En el caso de los iSGLT2, una de las dificultades para su desarrollo ha sido precisamente conseguir moléculas que no se degradaran rápidamente en el intestino. Las diferencias farmacocinéticas explican también que 3 fármacos con afinidad semejante para SGLT2 se utilicen a dosis muy diferentes. Probablemente las diferencias en la farmacocinética tengan más importancia que las farmacodinámicas. La tabla 3 recoge algunas de las características farmacocinéticas de los 3 iSGLT2 comercializados15–17; como puede observarse, hay diferencias notables, sobre todo en la vía de metabolización y de excreción, que pueden explicar su diferente dosificación. En cuanto a la excreción, debe tenerse en cuenta la influencia del porcentaje eliminado por orina para fármacos que se ha demostrado que actúan de forma extracelular desde la luz tubular19.
Características farmacocinéticas de los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) disponibles en España15–17
| Característica | Fármaco | ||
|---|---|---|---|
| Dapagliflozina | Canagliflozina | Empagliflozina | |
| Vida media (h) | 12,8-17 | 10,6-13,1 | 12 |
| Tmax (h) | 1,5-2 | 1-2 | 1,5 |
| Biodisponibilidad (%) | 78 | 65 | nd |
| Volumen aparente distribución (l) | 118 | 119 | 73,8 |
| Unión a proteínas plasmáticas (%) | 91 | 99 | 86 |
| Metabolismo | UGT1A9 | UGT1A9, UGT2B4, CYP3A4 | UGT1A3, UGT1A8, UGT1A9, UGT2B7 |
| Transportadores | Pgp (inhibidor débil) | Pgp, OATP1B1, OATP1B3, OAT3 | |
| Excreción | 75% orina; 21% heces | 33% orina; 51,7% heces | 54% orina; 41% heces |
| Excreción sin modificar | Orina < 2%, heces 15% | Orina < 1%, heces 41,5% | Orina " 25%, heces 40% |
| Dosis (mg/día) | 10 | 100-300 | 10-25 |
CYP: citocromo P450; Pgp: pglucoproteína; Tmax: tiempo para alcanzar concentración plasmática máxima; UGT: glucuroniltransferasa.
El hecho de que cuando SGLT2 está inhibido aumente el papel de SGLT1 en la reabsorción tubular de glucosa20 ha llevado a plantear la búsqueda de fármacos que sean inhibidores de ambos tipos de transportador. Además, una moderada inhibición de SGLT1 podría mejorar la glucemia posprandial, incluso se ha postulado que un incremento de glucosa en la parte terminal del intestino podría favorecer la secreción de GLP121,22. El reto está en conseguir que se produzca la inhibición del transportador renal afectando mínimamente al intestinal para evitar efectos adversos digestivos. Otra cuestión a considerar es el posible efecto deletéreo sobre el miocardio de los iSGLT123. De momento hay un fármaco en desarrollo, la sotagliflozina, del cual no existe todavía información clínica suficiente21.
ConclusiónLa selectividad es la propiedad de un fármaco para unirse de forma preferente a una diana farmacológica. Dada la similitud de muchas de las estructuras biológicas es interesante que los fármacos sean selectivos para aquella sobre la que se pretende actuar, y que con las dosis empleadas en terapéutica no ejerzan efectos sobre otras que pueden producir reacciones no deseadas.
Los iSGLT2, como grupo farmacológico, suponen una nueva forma de abordar el tratamiento de la diabetes tipo 2 y tal vez la de tipo 1. Los 3 fármacos recientemente introducidos en terapéutica son suficientemente selectivos sobre el transportador de tipo 2 como para que no sean esperables efectos sobre SGLT1. Aunque todavía hay muchos aspectos sobre los que falta información precisa, entre ellos hay más similitudes que diferencias. Para diferenciar a los componentes de este grupo puede ser más interesante analizar sus propiedades farmacocinéticas que sus características farmacodinámicas, como la selectividad.
Conflicto de interesesEl autor declara haber recibido honorarios por ponencias de Amgen, Abbott, AstraZeneca y Esteve.