La familia Retroviridae incluye 7 subfamilias. Los miembros de 2 de ellas infectan a humanos y son patogénicos. Se trata de los deltarretrovirus, de los cuales el human T-cell lymphotropic virus (HTLV, «virus linfotrópico de linfocitos T humanos») tipo 1 (HTLV-1) es el más conocido, y los lentivirus, de los cuales el VIH tipo 1 (VIH-1) es el más importante.
El HTLV-1 fue el primer retrovirus identificado. Se aisló en 1980 a partir de una línea celular de un linfoma cutáneo de linfocitos T. Se trataba de una adult T-cell leukemia/lymphoma (ATLL, «leucemia/linfoma de células T del adulto»). Dos años más tarde se identificó un segundo retrovirus próximo al HTLV-1, que se denominó HTLV-2. Tras la descripción del sida, en 1983 se aisló el VIH-1 (originalmente denominado HTLV-III). Por último, en el año 1986 se aisló el VIH-2 a partir de pacientes con sida que presentaban serología negativa y/o indeterminada para el VIH-1.
HTLV-1La infección por HTLV-1 es una enfermedad desatendida a pesar de afectar a alrededor de 15 millones de personas en todo el mundo1. Al igual que en la infección por VIH, la cronicidad ocurre de manera uniforme después de la infección aguda por HTLV-1, sin episodios autolimitados. Sin embargo, menos del 10% de los portadores de HTLV-1 desarrolla manifestaciones clínicas, incluidas 2 enfermedades graves, una mielopatía subaguda invalidante conocida como tropical spastic paraparesis (TSP, «paraparesia espástica tropical»)2 y una ATLL3. Como otros retrovirus humanos, el HTLV-1 infecta a los linfocitos T CD4+. Sin embargo, en lugar de causar lisis celular e inmunodeficiencia (sida en fases avanzadas) como el VIH-1 y el VIH-2, el HTLV-1 causa disfunción y/o inmortalización de las células infectadas. La proliferación de linfocitos T CD4+ infectados puede progresar a ATLL, mientras que la TSP representa una respuesta inmunológica patológica frente a los antígenos del HTLV-1 en células de la médula espinal.
En contraste con el VIH-1 y el VIH-2, que pasaron de los primates a los humanos en el siglo pasado, el HTLV-1 ha infectado a los humanos durante miles de años, como demuestra su presencia en momias fósiles de América Latina4. En la infección aguda por HTLV-1, el genoma viral se integra dentro de los linfocitos T CD4+ y se expande principalmente a través de sinapsis virales y proliferación celular5, lo que explica la ausencia de viremia plasmática en los portadores. Se produce una fuerte respuesta de linfocitos T citotóxicos por parte del huésped, estableciéndose en unas pocas semanas una proporción estable de células T infectadas en cada sujeto. Este valor de carga proviral tiene valor pronóstico clínico6. La mediana de carga proviral HTLV-1 en pacientes con TSP es de 5 copias/100 células mononucleares de sangre periférica, mientras que en los portadores asintomáticos es inferior a 1 copia/100 células. Es de subrayar que la carga proviral HTLV-1 es mucho más alta que en la infección por VIH-1, en la que el provirus se reconoce integrado en menos de 1/1.000 células de sangre periférica. Otra diferencia importante entre ambos retrovirus se refiere a la variabilidad genética, que es mínima en las personas infectadas por HTLV-1, dado que la expansión viral ocurre mayoritariamente en forma de proliferación celular y solo ocasionalmente requiere de la transcriptasa inversa. En contraste, la infección por VIH-1 cursa con una elevada variabilidad genética intra- e interindividual, con una dinámica evolutiva que sigue el modelo de las cuasiespecies.
El HTLV-1 se transmite por vía perinatal (lactancia), sexual (más de varón a mujer) y parenteral (transfusiones, uso de drogas inyectables y trasplantes)1. El diagnóstico se basa en la demostración de anticuerpos específicos anti-HTLV-1 en el suero o plasma. Una carga proviral HTLV-1 elevada predice tanto el riesgo de desarrollar sintomatología6 como la infectividad por vía sexual7. Hasta la fecha no hay vacuna profiláctica ni terapia antiviral efectiva.
Hay regiones altamente endémicas para la infección por HTLV-1 en el sur del Japón, Irán, Papúa Nueva Guinea, África subsahariana, partes de América del Sur y en el Caribe1. La infección por HTLV-1 es bastante baja en europeos, con la excepción de Rumania1. Sin embargo, la tasa de infección por HTLV-1 en Europa ha ido en aumento durante las últimas décadas, principalmente entre inmigrantes de áreas endémicas, viajeros y sus contactos sexuales8.
VIH-2Esta variante del VIH se describió por primera vez en 1986 en 2 pacientes de África occidental que presentaban sida, con aislamiento de un virus con antigenicidad y genoma distinto (40% nucleótidos diferentes) del VIH-19. Tanto el VIH-1 como el VIH-2 pertenecen al género lentivirus, dentro de la familia Retroviridae. La infección viral de linfocitos T CD4+ produce disfunción y finalmente su pérdida, ocasionando una inmunodeficiencia secundaria. Sin embargo, los portadores del VIH-2 desarrollan sida después de un promedio de 20 años, un intervalo mayor que el de 10 años descrito para la infección por VIH-1 no tratada.
En la infección por VIH-2, la progresión más lenta a sida y el menor riesgo de transmisión, tanto por vía sexual como de madre a hijo, se correlacionan directamente con una menor carga de ARN de VIH-2 en plasma en comparación con la infección por VIH-110. La limitada transmisibilidad del VIH-2 junto con los esfuerzos preventivos, incluida la circuncisión en el África subsahariana, parecen conducir a la extinción de la epidemia del VIH-211.
El VIH-1 y el VIH-2 son el resultado de múltiples transmisiones entre especies de primates (simian immunodeficiency virus, SIV) a los humanos. La infección natural de SIV en monos no causa ninguna enfermedad. De los 18 lentivirus diferentes que infectan a primates, el origen del VIH-2 fue el SIV que infecta a los sooty mangabey (SIVsm)12. En algún momento, a finales del siglo xix, el SIVsm se introdujo en la especie humana, como resultado de una transmisión zoonótica, probablemente relacionada con actividades de caza en el bosque tropical de Costa de Marfil13. Fue necesaria una primera adaptación del virus a los humanos14 y la adquisición de poder transmitirse de modo eficiente entre humanos. De África occidental se expandió al resto del planeta en las décadas sucesivas15.
Se han producido al menos 8 transmisiones independientes a humanos del SIVsm en África occidental16. Los aislados virales se denominan VIH-2 grupos A al H. El grupo A es el más frecuente, seguido por el grupo B. Debido a su naturaleza esporádica, los grupos C a H se supone que representan transmisiones aisladas, a modo de «callejón sin salida». Los SIVsm continúan transmitiéndose a los humanos y pueden causar nuevos brotes zoonóticos. En contraste, el VIH-1 fue el resultado de al menos 4 transmisiones del SIV de especies cruzadas de chimpancés y gorilas en África central y occidental (Camerún), donde una de estas transmisiones (VIH-1 grupo M) ha sido la responsable mayoritaria de la epidemia mundial de sida17.
En la actualidad, se estima que 1-2 millones de personas están infectadas por el VIH-2, incluidas aquellas con infecciones duales por VIH-1/VIH-2. En contraste con la propagación mundial del VIH-1, el VIH-2 se ha mantenido en gran medida restringido a algunos países de África occidental, donde es endémico18. Los flujos migratorios desde el epicentro en Guinea-Bissau fueron favorecidos por la guerra de independencia de Portugal entre 1963 y 1974, extendiendo el VIH-2 a Portugal y a sus antiguas colonias18. Esto explica el reconocimiento del VIH-2 en áreas de Brasil, India, Angola y Mozambique. Una nueva expansión a otros países, incluido EE. UU.19, se ha producido directamente por inmigrantes procedentes de África occidental. En Europa, la infección por VIH-2 se ha encontrado en países distintos de Portugal con fuertes lazos coloniales y socioeconómicos con África occidental, como Francia y Bélgica.
Grupo Español de Estudio del HTLV y VIH-2Se fundó en 1989 tras la identificación de los primeros casos de infección de ambos virus en España. En la actualidad, forman parte de él más de 60 hospitales españoles y centros de diagnóstico microbiológico, ubicados a lo largo de toda la geografía española (fig. 1) en la que participan microbiólogos, infectólogos, hematólogos, neurólogos y especialistas en medicina interna.
De forma anual, en el mes de diciembre, el grupo celebra una reunión en la que se actualizan los datos de la infección por HTLV y VIH-2 en España. A lo largo de la reunión, se comunican los nuevos casos y se comparte la experiencia diagnóstica y clínica de los mismos. Entre los objetivos del grupo destacan conocer la epidemiología de la infección por HTLV y VIH-2 en España, analizar las características de los pacientes con infección por HTLV, y evaluar la respuesta al tratamiento antirretroviral de los pacientes y los patrones de resistencias característicos de la infección por VIH-2. Además, el grupo trabaja en la redacción de recomendaciones clínicas y diagnósticas basadas en su experiencia20,21.
Ante un nuevo diagnóstico de infección por HTLV o VIH-2, el médico o microbiólogo del hospital cumplimenta una hoja de registro de casos, que se remite al centro coordinador. Entre los datos cumplimentados en esta hoja figuran: 1) Datos demográficos: edad, sexo, país de origen y raza. 2) Datos epidemiológicos: posible ruta de infección, estancias o visitas a otros países, tiempo de residencia en España, relaciones con personas de áreas endémicas, etc. 3) Datos clínicos: infección por HTLV: clínica asociada al HTLV-1 y tratamiento recibido; Infección por VIH-2: número de linfocitos T CD4+, coinfección por VIH-1, clínica asociada a infección por VIH, tratamiento antirretroviral. Los estudios epidemiológicos propuestos cuentan con la aprobación de los comités éticos de investigación clínica de los centros correspondientes.
El registro de casos lleva asociada una colección de muestras que permite el análisis de la carga proviral HTLV y el subtipo del virus en el caso de infección por HTLV y el estudio de la carga viral VIH-2, el estudio de resistencias a los antirretrovirales cuando es necesario y el subtipo genético del virus en los casos de infección por VIH-2.
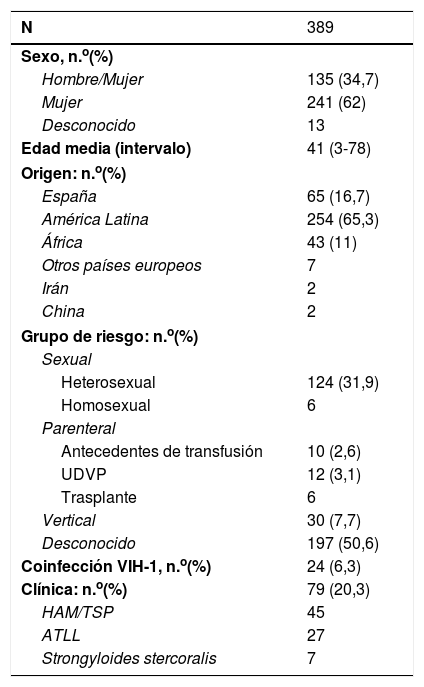
Infección por HTLV-1 en EspañaHasta diciembre de 2019 se ha diagnosticado un total de 389 casos de infección por HTLV-1. En general, el 65% son inmigrantes procedentes de América Latina y el 11% de África, siendo solo el 17% nativo español. Mayoritariamente los diagnósticos de HTLV-1 son en mujeres (62%) y la mediana de edad al momento del diagnóstico es de 41 años. En la tabla 1 se resumen las características principales de la población HTLV-1 informada hasta la fecha en el registro español.
Características generales de los pacientes con infección por HTLV-1 en España (1989-2019)
| N | 389 |
|---|---|
| Sexo, n.o(%) | |
| Hombre/Mujer | 135 (34,7) |
| Mujer | 241 (62) |
| Desconocido | 13 |
| Edad media (intervalo) | 41 (3-78) |
| Origen: n.o(%) | |
| España | 65 (16,7) |
| América Latina | 254 (65,3) |
| África | 43 (11) |
| Otros países europeos | 7 |
| Irán | 2 |
| China | 2 |
| Grupo de riesgo: n.o(%) | |
| Sexual | |
| Heterosexual | 124 (31,9) |
| Homosexual | 6 |
| Parenteral | |
| Antecedentes de transfusión | 10 (2,6) |
| UDVP | 12 (3,1) |
| Trasplante | 6 |
| Vertical | 30 (7,7) |
| Desconocido | 197 (50,6) |
| Coinfección VIH-1, n.o(%) | 24 (6,3) |
| Clínica: n.o(%) | 79 (20,3) |
| HAM/TSP | 45 |
| ATLL | 27 |
| Strongyloides stercoralis | 7 |
ATLL: adult T cell leukemia/lymphoma («leucemia/linfoma de células T del adulto»); HAM/TSP: HTLV-1 associated myelopathy/tropical spastic paraparesis («mielopatía asociada al HTLV-1/Paraparesia espástica tropical»)); UDVP: usuarios de drogas por vía parenteral.
Los casos de HTLV-1 en España se concentran en las áreas urbanas más grandes (Madrid y Barcelona) donde viven las mayores poblaciones de inmigrantes. Sin embargo, se han identificado personas infectadas con HTLV-1 en toda la geografía española. De los casi 47 millones de personas que viven actualmente en España, alrededor de 6 millones son extranjeros. Además, 75 millones de visitantes/turistas llegaron a España durante el año 2018, más del 10% de regiones endémicas de HTLV-1.
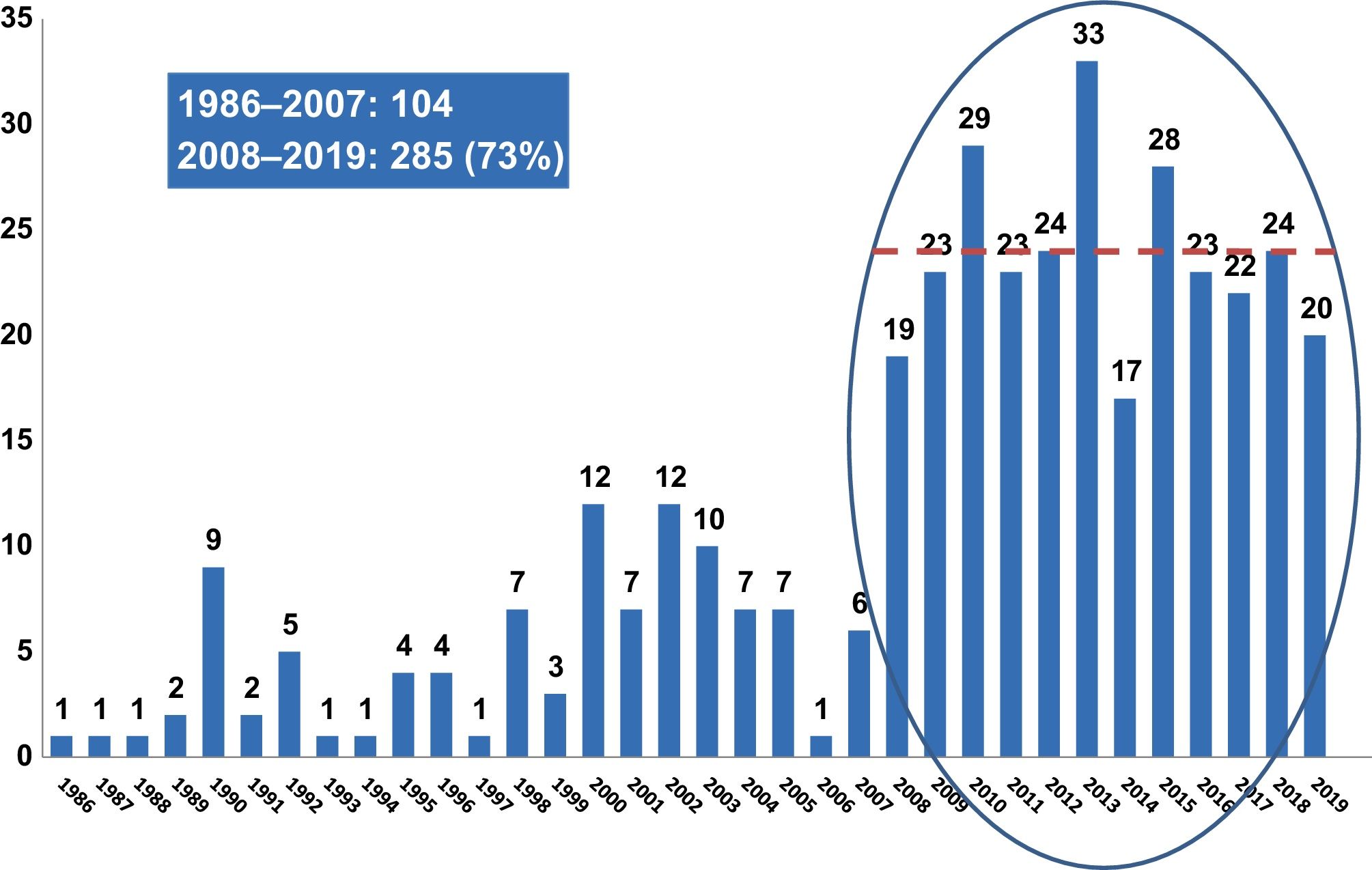
Se han diagnosticado infecciones sintomáticas por HTLV-1 en 79 (20,3%) de los portadores virales que viven en España, con 45 casos de TSP y 27 pacientes con ATLL. Los nuevos diagnósticos de infección por HTLV-1 han aumentado considerablemente en España desde 2008 (fig. 2), en gran parte como resultado de la introducción del cribado de HTLV en los bancos de sangre y la llegada cada vez mayor de inmigrantes y turistas de regiones endémicas. Sin embargo, la incidencia actual de nuevos diagnósticos de HTLV-1 en España se mantiene estable, alrededor de 20-25 casos al año.
En el año 2019, se diagnosticaron un total de 20 casos nuevos de HTLV-1 en España. Solo uno era español, 16 latinoamericanos, 2 africanos y uno de Irán. Seis (30%) presentaron enfermedad sintomática, incluidos 3 con TSP, 2 con sintomatología neurológica y uno con infección por Strongyloides stercoralis.
HTLV en bancos de sangre y trasplante de órgano sólidoDurante la última década, los bancos de sangre han contribuido anualmente con más de la mitad de los nuevos diagnósticos de HTLV-1 en España (fig. 2). De hecho, 9 de 20 nuevos casos reportados durante el año 2019 fueron identificados en personas que acuden para ser donantes de sangre. Cabe resaltar que de los casos diagnosticados en 2018, 3 fueron seroconversiones en donantes de sangre habituales (en donaciones previas eran HTLV negativos). Aun así, la seroprevalencia estimada actual del HTLV-1 es inferior a 1/100.000 donaciones en España, similar a la reportada en otros países occidentales.
España es el país líder mundial en trasplantes de órganos sólidos. La cifra anual está aumentando constantemente, siendo actualmente de más de 5.000 trasplantes por año. Hasta la fecha, más de 100.000 personas se han beneficiado de las donaciones de órganos. Más del 60% son trasplantes de riñón, siendo el hígado el segundo aloinjerto más frecuente. El corazón, el pulmón y el páncreas se trasplantan con menos frecuencia.
En España se identificaron los primeros casos de transmisión del HTLV en el contexto del trasplante de órganos en el año 2000. Dos receptores de riñón y un receptor hepático adquirieron infección por HTLV-1 como consecuencia del trasplante de un mismo donante, varón, joven español. Los 3 pacientes desarrollaron HTLV-1 associated myelopathy/tropical spastic paraparesis (HAM, «mielopatía asociada al HTLV-1»)/TSP 18 meses tras la cirugía del trasplante. Durante el año 2016, un receptor de trasplante de riñón en España desarrolló TSP dentro del primer año de cirugía. Curiosamente, un segundo receptor de trasplante de riñón del mismo donante infectado, un español nativo, también se infectó con HTLV-1, pero hasta la fecha no ha desarrollado ninguna enfermedad22. Sin embargo, este segundo aloinjerto se retiró después del rechazo 6 meses después del trasplante y, desde entonces, el paciente ya no está en tratamiento con inmunosupresores. En España, la legislación vigente únicamente recomienda el cribado para HTLV en aquellos individuos procedentes de área endémica, o que son hijos de personas procedentes de área endémica o que han mantenido relaciones sexuales con personas de estas zonas. Sin embargo, el conocimiento preciso de estos aspectos previos a la donación dificulta en muchos casos identificar de forma precisa los factores de riesgo. De hecho, los casos que han tenido lugar en España han sido a partir de donantes españoles en los que inicialmente no se sospechó riesgo de transmisión. Esta circunstancia junto con el mal pronóstico de los pacientes que adquieren HLTV en el contexto del trasplante pone de manifiesto la necesidad de incluir el cribado universal en todos los trasplantes de órganos22–24.
Estimación de infección por HTLV-1 en EspañaCasi 250 millones de los 7.500 millones de personas en todo el mundo son migrantes y actualmente viven en países donde no nacieron. Los flujos migratorios mundiales más importantes se producen en Asia, Europa y África, y de América Latina a América del Norte. Los mayores flujos de migración intercontinental son de Asia a Norteamérica y Europa, y de África a Europa.
Los flujos migratorios más frecuentes en Europa son desde regiones altamente endémicas del HTLV-1, de la siguiente manera: América Latina-Caribe>África>Japón>Irán>Rumania. En España, en el año 2017, había 5.852.953 residentes extranjeros, lo que supone un 12,7% del total de la población. En total, 2.293.711 personas eran originarias de países donde el HTLV-1 es endémico (1.567.034 latinoamericanos; 56.529 africanos; 658.132 rumanos; 6.128 japoneses; 5.888 iraníes). Teniendo en cuenta la estimación de infección por HTLV-1 en el país de origen2, entre 16.050 y 48.920 personas podrían presentar infección por HTLV-1 en España. En estos valores no se tiene en cuenta la transmisión horizontal en población nativa española por lo que la cifra del número de casos podría ser superior22.
Relevancia clínica de la infección por HTLV-1Como ya se ha comentado, las 2 entidades clínicas más frecuentes en los pacientes con infección por HTLV-1 son la TSP y la ATLL. Sin embargo, existe un amplio abanico de enfermedades (síndrome de Sjögren, eccema pediátrico, bronquiectasias, asma, fibromialgia, artritis, tuberculosis, etc.) que aunque si bien no son fatales, parecen ser frecuentes en individuos con infección por HTLV-1. Además, en un metaanálisis recientemente publicado25, se ha observado un aumento del riesgo prematuro de muerte en pacientes con infección por HTLV-1 que no se explica por la presencia de estas enfermedades, por lo que los autores indican que el impacto de esta infección no es bien conocido y podría ser relevante la relación del HTLV-1 con la enfermedad cardiovascular, cerebrovascular y síndrome metabólico.
A nivel nacional, el grupo español ha analizado el impacto clínico del HTLV-1 en los ingresos hospitalarios en los últimos 20 años26. Para ello se ha obtenido información de más de 66 millones de ingresos de los que únicamente 135 incluyen el diagnóstico del HTLV. Esto demuestra que la tasa de diagnóstico de infección por HTLV en pacientes hospitalizados en España es baja (2 casos por cada millón de ingresos) y estable en los últimos 20 años, aun a pesar del elevado flujo de inmigración procedente de zonas endémicas para HTLV-1. El infradiagnóstico de esta infección en España podría justificar en parte esta observación. Hasta 2 terceras partes de las complicaciones clínicas más frecuentes que llevan al ingreso hospitalario en nuestro país de pacientes con infección por HTLV-1 son la mielopatía (TSP) y la leucemia (ATLL). Sin embargo, otras enfermedades altamente prevalentes como episodios cardiovasculares, enfermedades neurodegenerativas, osteoporosis, síndrome metabólico, etc., están presentes en hasta casi un 25% de los pacientes HTLV-1 hospitalizados27.
Infección por VIH-2 en EspañaHasta diciembre de 2019 se han diagnosticado en España un total de 393 casos de infección por VIH-2. La edad media de los pacientes identificados es de 42 años (desde uno hasta 83 años). El 63% de ellos son varones, mayoritariamente procedentes de países de África subsahariana (76%). Sin embargo, el 14% de los pacientes identificados son nativos españoles (55 casos). A diferencia de lo que se observa en la infección por VIH-1 en nuestro país, los pacientes con infección por VIH-2 han adquirido la infección a través de contactos heterosexuales (64,6%) y únicamente el 3,8% por relaciones homosexuales. Un 10% de los casos presenta además infección por VIH-1 (tabla 2).
Características generales de los pacientes con infección por VIH-2 en España (1989-2019)
| N | 393 |
|---|---|
| Sexo: n.o(%) | |
| Hombre | 249 (63,3) |
| Mujer | 139 (35,3) |
| Desconocidos | 5 |
| Edad media (intervalo) | 42 (0-83) |
| Origen: n.o(%) | |
| España | 55 (14) |
| África | 302 (76,8) |
| Asía | 1 |
| América | 7 |
| Otros países europeos | 11 (2,8) |
| Desconocido | 17 (4,3) |
| Grupo de riesgo: n.o(%) | |
| Heterosexual | 254 (64,6) |
| Homosexual | 15 (3,8) |
| UDVP | 7 (1,8) |
| Vertical | 2 |
| Otros | 3 |
| Desconocido | 111 (28,2) |
| Sida: n.o(%) | 63 (16,1) |
| Coinfección VIH-1: n.o(%) | 38 (10) |
| Subtipo (*) | |
| A | 113 |
| B | 18 |
*El subtipo solamente está disponible en 131 pacientes VIH-2.
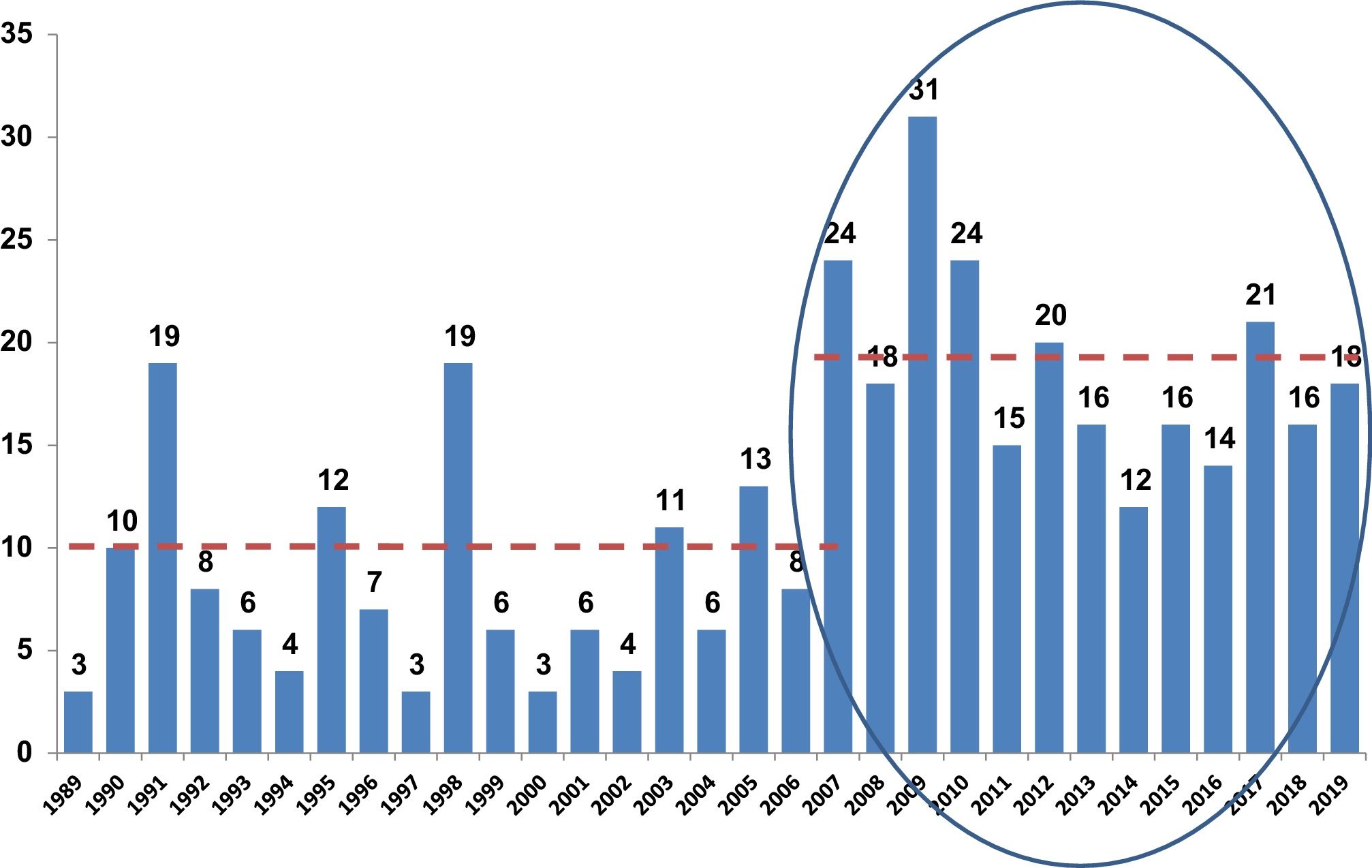
En todas las comunidades autónomas se han identificado casos de infección por VIH-2, oscilando desde un caso en el Principado de Asturias, La Rioja y Murcia hasta 117 casos en Cataluña. La incidencia de casos ha ido en aumento habiéndose identificado el 62% de los casos desde el año 2007. Esto supone que desde este año se identifican de media 19 casos/año en comparación con 7 casos/año en el período comprendido entre los años 1989 y 2006 (fig. 3).
En cuanto a la epidemiología molecular del VIH-2, la mayoría de los pacientes son subtipo A, subtipo mayoritario a nivel mundial. Sin embargo, 18 casos son portadores de infección por VIH-2 subtipo B. Los países de origen de estos casos son: 5 Guinea Ecuatorial, 6 España, 4 Senegal, 2 Costa de Marfil, uno Burkina Faso).
Coinfección VIH-1 y VIH-2Un total de 38 (10%) de los pacientes con infección por VIH-2 presentan además infección por VIH-1. El ARN de ambos virus ha podido detectarse en el plasma al menos una vez en solo 10 sujetos (31,2%) durante su seguimiento.
Los hombres representan el 67,6% de las personas con infección doble. Su mediana de edad es de 39 años, significativamente más joven que las personas monoinfectadas por VIH-2 (43 años; p=0,035). La mayoría de los pacientes coinfectados provienen de países de África occidental (70,6%), aunque 6 (17,6%) son españoles nativos. Las 8 personas restantes procedían de otros países africanos (6), Francia (1) y Brasil (1). Al momento del diagnóstico, 9 (26,5%) presentaron eventos relacionados con el sida.
Antes de iniciar el tratamiento antirretroviral, la mediana del recuento de CD4 en pacientes con infección doble fue de 204 (97-427) células/μL, significativamente menor que para los individuos monoinfectados con VIH-2 (445 [223-668] células/μL; p<0,001). Al inicio del estudio, la viremia plasmática era indetectable en un 5% para VIH-1 y en un 45% para VIH-2. La media de ARN del VIH en plasma en individuos virológicamente no suprimidos fue de 4,9 y 3,7 copias log/ml, respectivamente. En la coinfección VIH-1/VIH-2 adquiere especial relevancia la elección del tratamiento antirretroviral puesto que el régimen elegido debe ser activo frente a ambos virus28.
Respuesta al tratamiento antirretroviral y desarrollo en la infección por VIH-2La administración de un régimen antirretroviral óptimo, al igual que se demostró en pacientes infectados por VIH-1, suprime de forma eficaz la replicación viral del VIH-2, con el consecuente beneficio de la mejora inmunológica y clínica de los pacientes.
El tratamiento antirretroviral de gran actividad consiste en la administración de 3 fármacos distintos que inhiben varios procesos clave en la replicación del virus. Así, existen 5 familias actualmente aprobadas: inhibidores de la entrada, inhibidores de la transcriptasa inversa no análogos de nucleósidos, inhibidores de la transcriptasa inversa análogos de nucleós(t)idos, inhibidores de la integrasa e inhibidores de la proteasa. El VIH-2 presenta resistencia natural a los inhibidores de la transcriptasa inversa no análogos de nucleósidos y una menor actividad a ciertos inhibidores de la integrasa siendo los de mayor actividad, saquinavir, lopinavir y darunavir potenciados. Así, un paciente infectado por VIH-2 tendrá que lidiar con un menor número de fármacos eficaces y ello podría conducir a una futura administración de tratamientos subóptimos18,21.
A lo largo de estos años se ha evaluado la respuesta al tratamiento antirretroviral en los pacientes con infección por VIH-2 prestando especial interés últimamente en la respuesta a combinaciones que incluyen inhibidores de la integrasa. Hasta diciembre de 2017, 44 pacientes han recibido combinaciones de tratamiento que incluyen inhibidores de la integrasa, 18 de ellos como primera línea de tratamiento y 26 habiendo fracasado previamente con otras combinaciones de antirretrovirales. El 89% de los pacientes naive alcanzaron carga viral indetectable tras iniciar tratamiento mientras que esto solo fue posible en el 62% de los pacientes que recibían inhibidores de la integrasa como segunda o tercera línea de tratamiento. El desarrollo de mutaciones de resistencias tras fracaso virológico se objetivó en 15 pacientes. En total, 5 pacientes desarrollaron cambios en la posición 155H, 3 pacientes desarrollaron cambios en la posición 148H/R, 3 en la posición 143C/G y uno cambios en la posición 263K. En todos los casos las mutaciones primarias aparecieron acompañadas de mutaciones secundarias que incrementaban el grado de resistencia. Los 3 pacientes que no desarrollaron cambios en el gen de la integrasa presentaron cambios en otras regiones como la proteasa o la retrotranscriptasa con cambios que comprometían la respuesta a los fármacos acompañantes29–31.
ConclusionesLa infección por HTLV-1 es una enfermedad desatendida a pesar de infectar a 15 millones de personas en todo el mundo. Aunque España no es una región endémica, hasta la fecha se han notificado 389 portadores de HTLV-1, de los cuales 72 han sufrido una enfermedad potencialmente mortal. Las personas que provienen de regiones endémicas de HTLV-1, principalmente en América Latina, sus contactos sexuales o sus hijos están sobrerrepresentados en el registro español de HTLV-1. Dado que las madres infectadas con HTLV-1 pueden prevenir la transmisión a sus recién nacidos evitando la lactancia materna y las enfermedades graves por HTLV-1 pueden desarrollarse con mayor frecuencia y rapidez en los receptores de trasplantes, el cribado universal de HTLV de estas 2 poblaciones debería ser obligatorio en España, y del mismo modo en otros no países endémicos con flujos similares de inmigrantes de regiones endémicas.
El VIH-2 es un virus «neglected» (olvidado), a pesar de causar sida y estimaciones de 1-2 millones de portadores en todo el mundo. En España, un país no endémico, se han registrado un total de 393 casos hasta la fecha. Sin embargo, las encuestas serológicas indican que aproximadamente 5.000 personas infectadas por el VIH-2 viven actualmente en España.
El diagnóstico insuficiente es frecuente dada la falta de sospecha clínica por parte de los médicos y las dificultades de muchas personas infectadas por el VIH-2 para acceder al sistema de salud, dada su condición ilegal como inmigrantes de regiones endémicas, principalmente en África occidental.
Las características únicas del tratamiento antirretroviral y los problemas para controlar la respuesta al VIH-2 son desafíos importantes. El VIH-2, ya sea solo o como coinfección con VIH-1, debe excluirse en todas las personas con perfiles serológicos atípicos del VIH, desconexión inmunovirológica (pérdida del recuento de CD4 a pesar de la viremia indetectable) y/o altos vínculos epidemiológicos (nacimiento o parejas sexuales de regiones endémicas). Los regímenes antirretrovirales, incluidos los inhibidores de la integrasa, deberían ser la opción preferida a la hora de iniciar tratamiento antirretroviral en estos pacientes.
FinanciaciónEste trabajo ha sido parcialmente financiado por la Fundación de Investigación y Educación en SIDA (F-IES) y con Fondos de Investigación Sanitaria (FIS-ISCIII Fondos Feder. Proyectos; CES12/003, PI13/01574; FI14/0264; CD14/0243).
Conflicto de interesesLos autores declaran no tener conflicto de intereses.
C. Rodríguez, M. Vera, O. Ayerdi y J. del Romero (Centro Sanitario Sandoval, Madrid); G. Marcaida y M.D. Ocete (Hospital General Universitario, Valencia); E. Caballero (Hospital Vall d’Hebrón, Barcelona); A. Aguilera, J.J. Rodríguez-Calviño, D. Navarro, C. Rivero y M.D. Vilariño (Hospital Conxo-CHUS, Santiago); R. Benito y J. Sahagún (Hospital Clínico Universitario Lozano Blesa, Zaragoza); R. Ortiz de Lejarazu y S. Rojo (Hospital Clínico Universitario, Valladolid); J.M. Eirós, M. Domíngez-Gil (Hospital Rio Hortega, Valladolid); C. Manzardo y J.M. Miró (Hospital Clínic-IDIBAPS, Barcelona); J. García (Hospital Cristal-Piñor, Orense); E. Calderón (Hospital Virgen del Rocío y CIBERESP, Sevilla); D. Escudero (Hospital Germans Trias i Pujol, Barcelona); M. Trigo, J. Diz y M. García-Campello (Complejo Hospitalario, Pontevedra); M. Rodríguez-Iglesias (Hospital Universitario, Puerto Real); A. Hernández-Betancor y A.M. Martín (Hospital Insular Hospital Universitario, Las Palmas de Gran Canaria); J.M. Ramos y A. Gimeno (Hospital Universitario, Alicante); C. Gómez-Hernando (Complejo Hospitalario Virgen de la Salud, Toledo); G. Cilla y E. Pérez-Trallero (Hospital Donostia, San Sebastián); L. Fernández-Pereira (Hospital San Pedro de Alcántara, Cáceres); M. Hernández, A.M. López-Lirola y J.L. Gómez-Sirvent (Hospital Universitario La Laguna, Tenerife); L. Force (Hospital General, Mataró); C. Cifuentes (Hospital Son Llátzer, Palma de Mallorca); S. Pérez y L. Morano (Hospital do Meixoeiro, Vigo); C. Raya (Hospital del Bierzo, Ponferrada); A. González-Praetorius (Hospital Universitario, Guadalajara); M. Peñaranda (Hospital Son Espases, Mallorca); L. Roc (Hospital Miguel Servet, Zaragoza); I. Viciana (Hospital Virgen de la Victoria, Málaga); T. Cabezas (Hospital Torredecárdenas, Almeria); A. Lozano, E. Fernández-Fuertes y J.M. Fernández (Hospital de Poniente, Almería); I. García-Bermejo y G. Gaspar (Hospital Universitario, Getafe); M. Valeiro, L. Pérez y T. Aldamiz (Hospital Gregorio Marañón, Madrid); N. Margall (Hospital Santa Creu i Sant Pau, Barcelona); S. Sauleda y M. Pirón (Banco de Sangre y Tejidos, Barcelona); R. González, A. Richart y L. Barea (Centro de Transfusiones, Madrid); A. Jiménez y L. Blanco (Centro de Hemoterapia y Hemodonación de Castilla y León, Valladolid); A. Suárez y I. Rodríguez-Avial (Hospital Clínico San Carlos, Madrid); P. Parra y M. Fernández (Hospital Universitario 12 de Octubre, Madrid); M. Fernández-Alonso y G. Reina (Clínica Universitaria Navarra, Pamplona); MJ. Echeverría (Hospital Universitario de Donosti); E. Ugalde, MC. Nieto, P. Liendo (Hospital Universitario de Basurto); L. Benítez-Gutiérrez, A. Arias, V. Moreno-Torres, V. Cuervas-Mons y C. de Mendoza (IIS Hospital Universitario Puerta de Hierro, Majadahonda); P. Barreiro (La Paz University Hospital, Madrid); V. Soriano, O. Corral y F. Gómez-Gallego (UNIR Health Sciences School, Madrid).