El riesgo cardiovascular asociado a la diabetes mellitus (DM) es evidente, ya que aproximadamente en el 60–65% de los pacientes la causa de muerte es de origen cardiovascular1, lo que implica que uno de los objetivos básicos en el tratamiento de los pacientes con DM es el control de los factores de riesgo cardiovascular. Por otra parte, más del 66% de los pacientes de cardiología presenta algún grado de alteración del metabolismo de la glucosa: DM, intolerancia a la glucosa o glucemia basal alterada. La DM tipo 2, al igual que la DM tipo 1, se asocia a un mayor riesgo de cardiopatía isquémica (CI), como indican varios estudios epidemiológicos que muestran la existencia de una correlación entre la glucemia y la incidencia de CI2,3. En el diabético, las manifestaciones principales, como angina, insuficiencia cardiaca (IC) e infarto agudo de miocardio, suelen, por lo general, aparecer a una edad más temprana, y parece, además, que la DM se asocia a una mayor prevalencia de isquemia asintomática. La mortalidad por CI en diabéticos, comparada con pacientes no diabéticos ajustados por la edad y el sexo, es 3 y 2 a 5 veces mayor en varones y mujeres, respectivamente4, de lo que se deduce la gran importancia del diagnóstico precoz y de un control metabólico adecuado en la fase aguda de la complicación cardiovascular.
El correcto control glucémico disminuye las complicaciones microvasculares (retinopatía, nefropatía y la polineuropatía) tanto en la DM tipo 15 como en la DM tipo 26. En cuanto a las complicaciones macrovasculares (cardiaca, cerebrovascular y vascular periférica), en diabéticos tipo 17 y en diabéticos tipo 28 con buen control desde el diagnóstico de la enfermedad se ha demostrado una menor incidencia de enfermedad vascular con respecto a los pacientes en que se había alcanzado un peor control glucémico. Especialmente en los pacientes con inicio de la DM o pocos años de evolución se ha demostrado el beneficio del control glucémico más estricto y precoz8, destinado a la normalización del control metabólico inicial, que ejercería una influencia a largo plazo sobre la evolución clínica posterior (fenómeno conocido como «memoria metabólica»)7. Sin embargo, en estudios recientes en diabéticos tipo 2 de larga evolución, con enfermedad cardiovascular previa o múltiples factores de riesgo y con mal control, no se ha podido demostrar una disminución de episodios clínicos en aquéllos en tratamiento intensivo9–13. Por tanto, resulta de especial trascendencia optimizar el control glucémico «precoz y estricto», y evitar las hipoglucemias en pacientes de alto riesgo vascular, que se han propuesto como causa del aumento de la mortalidad en los estudios ACCORD9 y VADT11.
Pautas generales de tratamientoExisten numerosos consensos y recomendaciones para el abordaje del tratamiento de la hiperglucemia en el paciente con DM tipo 2, pero no desde la perspectiva del paciente con 2 entidades clínicas bien definidas: la CI y la IC en su fase estable, es decir, una vez que los enfermos están controlados del episodio coronario agudo o de la descompensación de la IC. El Grupo de Trabajo de Corazón y Diabetes de la Sociedad Española de Cardiología propuso la realización de un documento conjunto multidisciplinario de cardiólogos, endocrinólogos, internistas y médicos de familia, que resultó en la elaboración de 2 algoritmos terapéuticos con objeto de intentar facilitar a los cardiólogos, y a todos aquellos médicos que se encuentren con estas 2 situaciones en la práctica clínica, la elección del tratamiento antidiabético más adecuado. Tanto el tratamiento insulínico de la DM en la fase aguda de la cardiopatía como las estrategias destinadas al control de los factores de riesgo (obesidad, tabaquismo, dislipidemia o hipertensión), necesarias para la optimización del tratamiento de la DM, están fuera de los objetivos de los algoritmos terapéuticos propuestos en este documento, cuyas recomendaciones se centran únicamente en el abordaje del control estricto de la glucemia.
La individualización del tratamiento en cada paciente es la esencia de la actuación médica. Sin embargo, el paciente con cardiopatía estable presenta unas características específicas que hay que tener en cuenta en el momento de seleccionar el hipoglucemiante más adecuado. En este sentido, hay que considerar no sólo la eficacia de los diferentes antidiabéticos orales (ADO), sino, lo que es igualmente importante, la seguridad de éstos en el contexto de la cardiopatía estable. La elección de un ADO concreto (o de una combinación) se fundamenta en las recomendaciones generales de las guías de práctica clínica14, las revisiones sistemáticas15–19 y el análisis de los datos de ensayos clínicos recientes7–13 y estudios observacionales20; aunque cabe resaltar que en algunas situaciones resulta particularmente difícil recomendar el uso de una determinada clase de ADO frente a otra, dada la falta de evidencia procedente de ensayos clínicos controlados aleatorizados que comparen directamente las diferentes clases de medicamentos.
En líneas generales, se recomienda iniciar las modificaciones en el estilo de vida y el tratamiento farmacológico con ADO desde el momento del diagnóstico. Para seleccionar un ADO adecuado para el paciente con DM tipo 2 y cardiopatía estable se debe valorar una serie de características del medicamento (mecanismo de acción, efectividad, perfil de seguridad, contraindicaciones, interacciones) y del paciente (glucemia, índice de masa corporal [IMC], comorbilidad, descompensación de la diabetes, factores que contraindiquen o aumenten el riesgo del uso de determinados fármacos). En la determinación de la estrategia terapéutica general (especialmente en la fijación del objetivo de control metabólico en términos de hemoglobina glucosilada [HB1C]) se debe tener en cuenta la expectativa de vida del paciente evaluando la posibilidad de utilizar estrategias de control glucémico menos estrictas con objetivos de HB1C no intensivos en pacientes ancianos, polimedicados, con diabetes de larga evolución (>10 años) y complicaciones avanzadas, con comorbilidad significativa (con especial atención a la insuficiencia renal) o con especial riesgo de desarrollar hipoglucemias. En este sentido, en pacientes con edad avanzada, alta comorbilidad y expectativa de vida reducida, los objetivos de control glucémico deben ser menos estrictos, y es aceptable un intervalo de HB1C del 7,5–8,5% como parámetro de referencia para realizar progresión o cambios del tratamiento hipoglucemiante. Las características más relevantes de los diferentes ADO pueden consultarse en revisiones recientes15,16 y guías clínicas generales14.
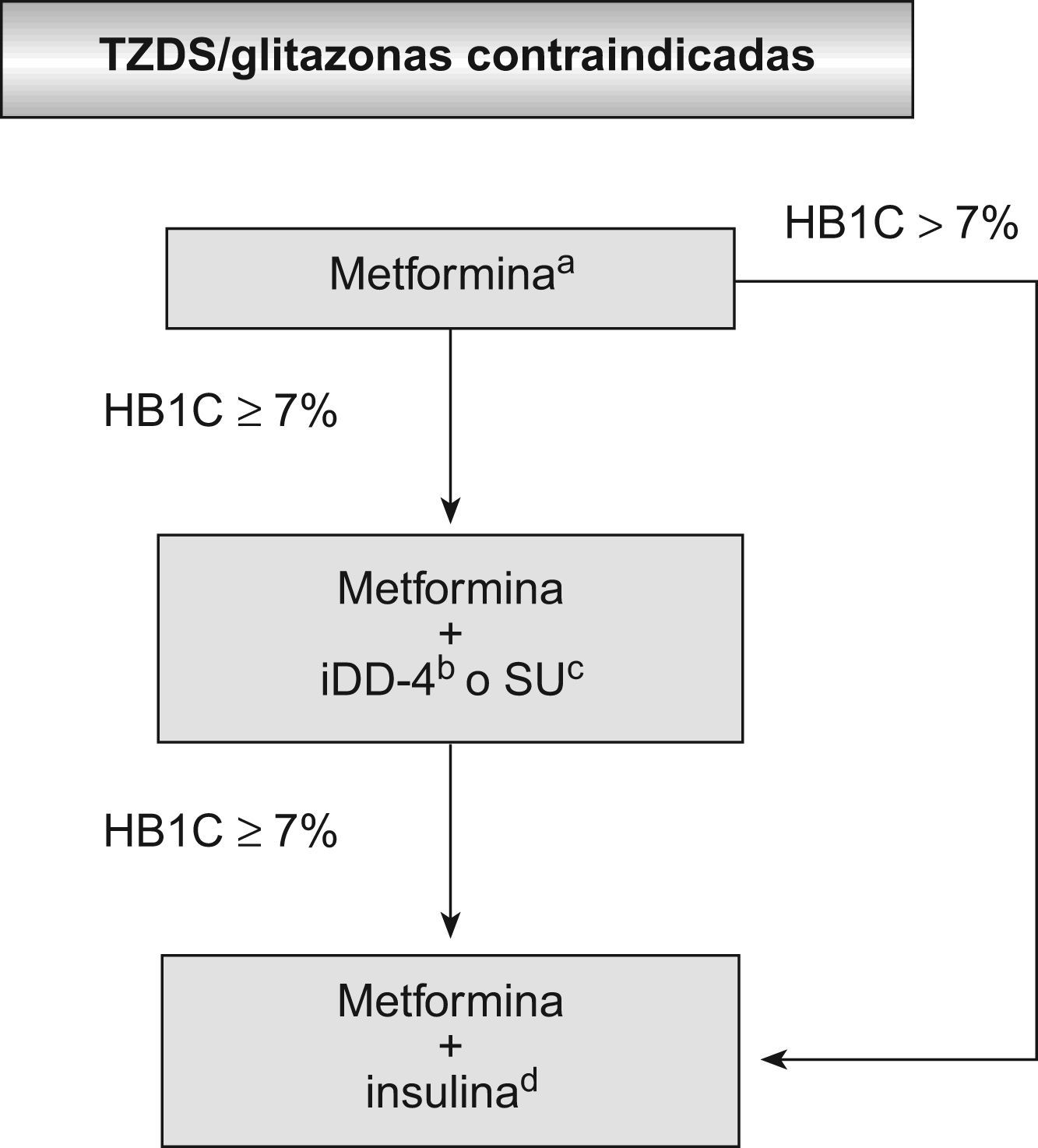
Tratamiento farmacológico de la diabetes mellitus tipo 2 en pacientes con insuficiencia cardiaca estableLa metformina se debe considerar como el ADO de primera línea en todos los pacientes con DM tipo 2 (recomendación A). Diversos autores21–23 proponen la retirada de algunas contraindicaciones actualmente reflejadas en la ficha técnica de la metformina (IC crónica, interrupción del tratamiento 2 días antes de la cirugía o administración de contrastes radiológicos) o su modificación (límite de aclaramiento de creatinina <40ml/min en pacientes con insuficiencia renal crónica en lugar de <60ml/min), relacionadas con el riesgo de acidosis láctica identificado inicialmente y consideradas obsoletas a la luz de la revisión sistemática de la evidencia acumulada que avala la seguridad de la metformina. En este sentido, la guía de práctica clínica de la Sociedad Europea de Cardiología para el diagnóstico y el tratamiento de la IC aguda y crónica24 establece que la metformina se considerará el fármaco de primera elección en pacientes con sobrepeso y DM tipo 2 sin disfunción renal significativa (tasa de filtración glomerular >39ml/min). En caso de intolerancia o contraindicación relevante a la metformina, se puede considerar el uso de una sulfonilurea (SU) de segunda generación como ADO alternativo de primera línea (recomendación A), bien la gliclazida de larga liberación (estudio ADVANCE10), la glimepirida o la glipizida, pero evitar la glibenclamida por su mayor riesgo de provocar hipoglucemias. Recientemente, se ha aprobado la indicación de sitagliptina en monoterapia en pacientes con intolerancia o contraindicación a la metformina. Es importante señalar que el uso de las tiazolidindionas (TZD) o las glitazonas está contraindicado en pacientes con IC (o historial) de grado i a iv de la New York Heart Association25–27.
El cambio de monoterapia a una combinación de 2 fármacos debe considerarse cuando no se alcanza un control metabólico adecuado (HB1C≥7%) con un solo fármaco en un plazo de 3 meses (recomendación D), teniendo en cuenta que la combinación suele ser más efectiva y segura que alcanzar las dosis máximas toleradas del fármaco inicial. Con valores de HB1C superiores o iguales al 7%, se recomienda añadir bien un inhibidor de la dipeptidil-peptidasa-4 (iDPP-4), con muy bajo riesgo de hipoglucemia y un efecto neutro sobre el peso corporal, aunque su beneficio a largo plazo y su seguridad cardiovascular no están establecidos, o bien una SU (alternativamente considerar repaglinida por su bajo riesgo de hipoglucemia, similar al de las SU de segunda generación). En pacientes con IMC superior a 35kg/m2, puede considerarse el uso de un incretín-mimético28,29 (análogos de péptido 1 similar al glucagón [GLP-1], como la exenatida o la liraglutida), de administración subcutánea.
Cuando no se consiga un buen control (HB1C>7%) con la combinación de 2 ADO, debería introducirse una dosis de insulina basal (preferiblemente análogos de insulina de acción lenta por su menor riesgo de hipoglucemias frente a la insulina humana), al igual que en aquellos pacientes en que persistan valores de HB1C superiores al 9% a pesar de utilizar la dosis máxima de metformina. La insulina puede añadirse o sustituir a los ADO en cualquier momento evolutivo de la enfermedad. En los regímenes avanzados de insulinoterapia, habitualmente se suspenden los secretagogos (SU y glinidas). Dado el riesgo de retención de sodio y el aumento de la volemia con el uso de insulina, especialmente con dosis altas, en pacientes con IC se recomienda utilizar la mínima dosis efectiva y ajustarla cuidadosamente. Por último, en caso de que persista un mal control, podría intensificarse el tratamiento al añadir un análogo de acción rápida o insulina humana regular antes de las comidas o al sustituir la insulina basal por análogos premezclados al 25, al 30, al 50 o al 70%. Alternativamente, puede optarse, en casos seleccionados, por el triple tratamiento oral con metformina, una SU y un iDPP-4 (fig. 1).
Algoritmo terapéutico en pacientes con diabetes mellitus tipo 2 e insuficiencia cardíaca estable. En caso de a) contraindicación o intolerancia a la metformina, considerar una sulfonilurea (SU) de segunda generación, como la gliclazida de larga liberación, la glimepirida o la glipizida por su menor riesgo de hipoglucemia (y evitar la glibenclamida por mayor riesgo), o bien la sitagliptina; b) muy bajo riesgo de hipoglucemia, efecto neutro sobre el peso corporal y similar potencia que una SU, considerar un incretín-mimético (análogo de GLP-1) como la exenatida o la liraglutida si el índice de masa corporal es superior a 35kg/m2; c) considerar alternativamente repaglinida (por su bajo riesgo de hipoglucemia, similar al de las SU de segunda generación); d) preferiblemente análogos de insulina de acción lenta (menor riesgo de hipoglucemias que insulina humana), o alternativamente considerar triple tratamiento oral en casos seleccionados (metformina más inhibidor de la dipeptidil-peptidasa-4 más SU). HB1C: hemoglobina glucosilada; iDPP-4: inhibidor de la dipeptidil-peptidasa-4; SU: sulfonilurea; TZD: tiazolidindiona.
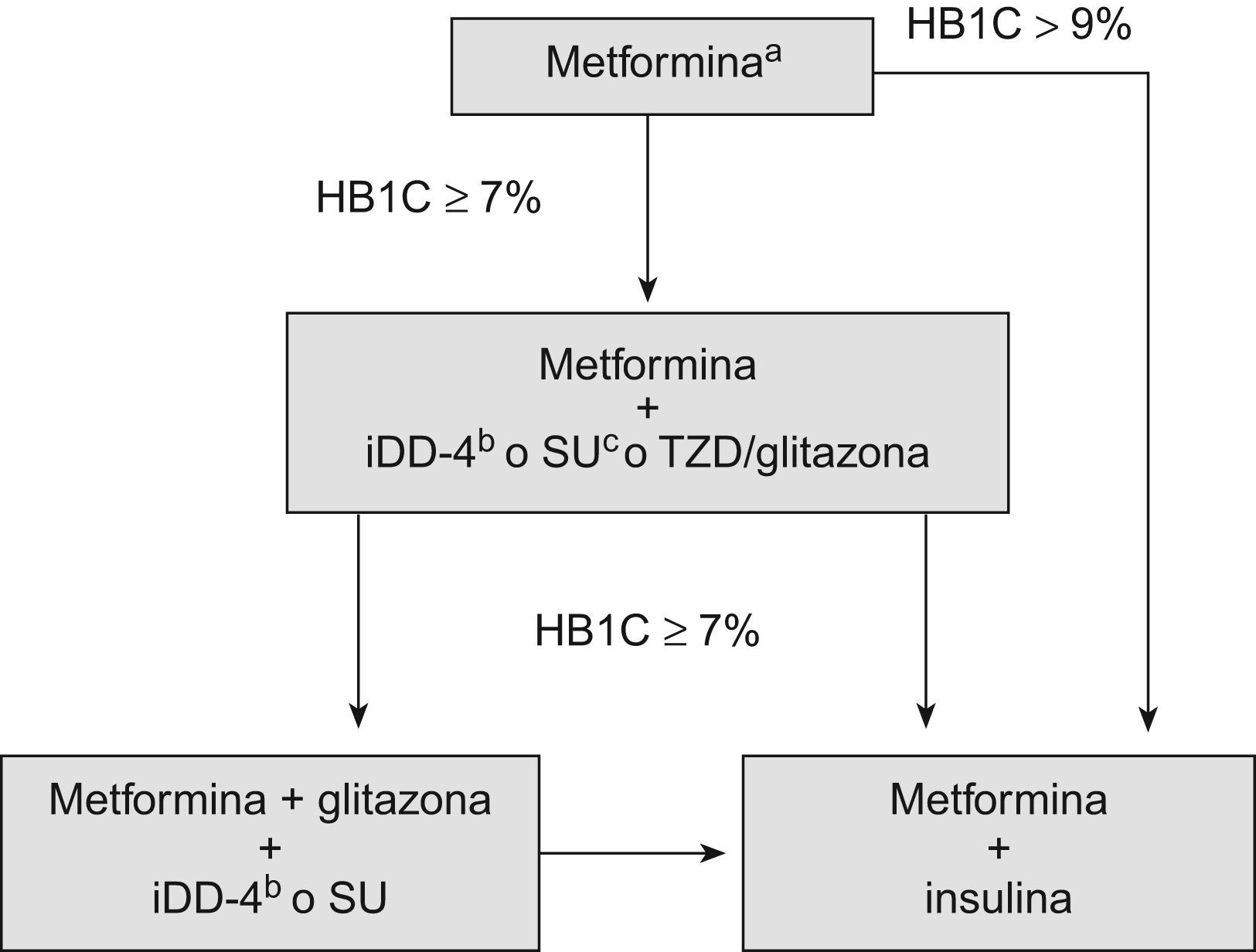
Al igual que en el caso anterior, la metformina se debe considerar como el ADO de primera línea en todos los pacientes con DM tipo 2 y únicamente en caso de intolerancia o contraindicación se debería considerar como ADO alternativo de primera línea una SU de segunda generación, como la gliclazida de larga liberación, la glipizida o la glimepirida, o bien el iDPP-4 sitagliptina. Debe evitarse el uso de la glibenclamida por su mayor riesgo de provocar hipoglucemias y precondicionamiento isquémico en pacientes con CI.
El cambio de monoterapia a una combinación de 2 fármacos debe considerarse cuando no se alcanza un control metabólico adecuado (HB1C≥7%) con un solo ADO en un plazo de 3 meses (recomendación D). Con valores de HB1C superiores o iguales al 7%, se puede considerar la combinación dual de metformina con los siguientes fármacos:
- •
SU (considerar alternativamente repaglinida por su bajo riesgo de hipoglucemia).
- •
iDPP-4, con muy bajo riesgo de hipoglucemia y un efecto neutro sobre el peso corporal.
- •
TZD/glitazonas, por su bajo riesgo de hipoglucemia y seguridad en la CI (estudios PROactive25, RECORD30, BARI 2D31), aunque estén contraindicadas en la IC.
- •
Incretín-mimético (análogo de GLP-1)28,29, como la exenatida o la liraglutida (en pacientes con un IMC>35kg/m2).
En casos seleccionados, el triple tratamiento oral metformina más TZD/glitazona más iDPP-4 o SU puede ser necesario para alcanzar el control de HB1C inferior al 7%.
Si con la monoterapia con metformina la HB1C sigue siendo superior al 9%, o con el doble o triple tratamiento con ADO no se consigue un control adecuado (valores de HB1C≥7%), puede considerarse la combinación con insulina (preferiblemente análogos de acción lenta, por su menor riesgo de hipoglucemias frente a la insulina humana). En caso de persistir los valores elevados de HB1C, se procederá a intensificar la insulina con un análogo de insulina de acción rápida o insulina humana regular en las comidas o con insulina basal por análogos premezclados al 25, al 30, al 50 o al 70% en 2 o 3 dosis diarias (fig. 2).
Algoritmo terapéutico en pacientes con diabetes tipo 2 y cardiopatía isquémica (sin insuficiencia cardíaca). En caso de a) contraindicación o intolerancia a la metformina, considerar una sulfonilurea de segunda generación, como la gliclazida de larga liberación, la glimepirida o la glipizida, por su menor riesgo de hipoglucemia (y evitar la glibenclamida por mayor riesgo), o bien el inhibidor de la dipeptidil-peptidasa-4 sitagliptina; b) muy bajo riesgo de hipoglucemia, efecto neutro sobre el peso corporal y similar potencia que con una sulfonilurea, considerar un incretín-mimético (análogo de GLP-1), como la exenatida o la liraglutida, si el índice de masa corporal es superior a 35kg/m2; c) considerar alternativamente repaglinida (por su bajo riesgo de hipoglucemia); d) bajo riesgo de hipoglucemia y seguridad en la cardiopatía isquémica25,30,31 y contraindicado en la insuficiencia cardíaca; e) preferiblemente análogos de acción lenta. HB1C: hemoglobina glucosilada; iDPP-4: inhibidor de la dipeptidil-peptidasa-4; SU: sulfonilurea; TZD: tiazolidindiona.
En conclusión, el control glucémico de los pacientes con IC estable o con CI sin IC tiene unas características especiales que merecen una consideración específica. Resulta beneficioso, desde el punto de vista del riesgo cardiovascular, el control glucémico estricto lo más temprano posible desde el diagnóstico de la diabetes. Sin embargo, en aquellos diabéticos con cardiopatía establecida, tanto CI como IC, el control glucémico más estrecho se asocia a un incremento de la mortalidad. Hoy en día se desconocen las causas que originan esa mayor mortalidad, pero las sospechas recaen sobre las hipoglucemias graves y sobre determinados fármacos o sus combinaciones. De este modo, la elección de un ADO o de un tipo o pauta de insulina debe fundamentarse en su menor riesgo de producir hipoglucemias y en su mejor perfil de riesgo cardiovascular, según los estudios disponibles en el momento actual. Por otro lado, para los objetivos de control es necesario valorar la situación clínica del paciente, sus comorbilidades y su expectativa de vida, pues de esto va a depender lo estricto del control glucémico por conseguir. En pacientes ancianos, con una reducida expectativa de vida, el control ha de ser menos estricto —resultan aceptables las concentraciones de HB1C más modestas—, y debe procurarse mantenerlos con un grado de control que comporte el menor riesgo posible de presentar hipoglucemias, descompensaciones hiperglucémicas o síntomas cardinales de diabetes. El futuro del tratamiento del diabético con cardiopatía pasa por aclarar de forma definitiva cuál es la estrategia farmacológica más segura en estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses
Los autores expresan su más sincero agradecimiento a la Dra. Sara Artola (Centro de Salud Hereza, Madrid), a la Dra. Mar Moreno (Servicio de Cardiología, Hospital Universitario La Paz, Madrid) y al Dr. Pedro Conthe (Servicio de Medicina Interna, Hospital Universitario Gregorio Marañón, Madrid), sin cuya estrecha colaboración no habría sido posible la realización de este manuscrito.