La pulsioximetría se ha propuesto como método de cribado de la vasculopatía periférica. Dado que la arteriosclerosis afecta a todo el territorio vascular, estudiamos su eficacia para detectar pacientes con diabetes mellitus tipo 2 (DM2) con arteriosclerosis carotídea.
Pacientes y métodoSe incluyeron 105 pacientes con DM2 sin historia previa de vasculopatía periférica. Se realizó historia clínica, exploración física, medición del índice tobillo-brazo (ITB) y de la saturación de oxígeno en el pie y la mano mediante pulsioximetría, análisis sanguineo y ecografía carotídea (medición del grosor íntima-media carotídeo y de placas carotídeas [PC]). Se consideraron patológicos los valores de ITB inferiores a 0,9 y un descenso en la pulsioximetría de la saturación de oxígeno superior al 2% en los pies respecto de la mano o tras la elevación de la extremidad inferior respecto del decúbito supino.
ResultadosSesenta pacientes eran varones (edad media de 62,1 años [desviación estándar de 7,1] y hemoglobina glucosilada media del 6,9% [1,0]). Un 58,1% presentaba PC. Los datos antropométricos y analíticos fueron homogéneos entre los pacientes con y sin PC. El ITB fue inferior a 0,9 en el 49% y en el 25% de los pacientes con y sin PC, respectivamente. No hubo diferencias en la pulsioximetría en función de la presencia de PC ni del ITB patológico. Tampoco el grosor íntima-media fue diferente en función de la pulsioximetría, aunque fue mayor en los pacientes con PC y con ITB inferior a 0,9 que en aquéllos sin alteraciones. Estos resultados fueron independientes de la historia de macroangiopatía clínica.
ConclusionesLa pulsioximetría no es útil en el cribado de la aterosclerosis carotídea en pacientes con DM2.
Pulse oximetry of the toes has been suggested in the screening of peripheral arterial disease. We studied the uselfuness of pulse oximetry in detection of type 2 diabetic patients with carotid atherosclerosis.
Subjects and methods105 patients with type 2 diabetes mellitus (DM) without previous clinical peripheral arterial disease were enrolled. All patients had (1) ankle-brachial index (ABI) measurement, (2) pulse oximetry to measure SaO2 of their index fingers and big toes in the supine position and at elevated 30cm and (3) a carotid ultrasound [carotid artery intima-media thickness (IMT) and carotid plaques (CP) measurements]. The ABI was considered abnormal when it was <0.9 and when the pulse oximetry showed a decrease in SaO2 of >2% of the finger compared to foot or to 30cm foot elevation.
Results60 patients were men (age of 62±7 years, HbA1c of 6.9±1.0); 58.1% had CP. There were no differences in anthropometric and biochemical results between patients with or without CP. The ABI was <0.9 in 49% and 25% of patients with and without CP, respectively. Neither were there differences in pulse oximetry in patients with CP or in those with ABI <0.9. The IMT did not change in relation to pulse oximetry, but it was higher in patients with CP and with ABI <0.9 than in patients without alterations. These results were independent of the presence of previous clinical macroangiopathy.
ConclusionPulse oximetry is not a useful screening method of carotid atherosclerosis in type 2 DM.
La principal causa de morbimortalidad de los pacientes afectados de diabetes mellitus es la enfermedad cardiovascular, estimándose una prevalencia de hasta un 80% en los pacientes con diabetes mellitus tipo 2 (DM2)1. Por este motivo, es de gran interés la búsqueda de herramientas diagnósticas reproducibles y sencillas de aplicar en las consultas, que permitan identificar a los pacientes diabéticos en fases subclínicas de la enfermedad arteriosclerótica con el fin de poder intensificar el tratamiento de los factores de riesgo cardiovascular y así mejorar su pronóstico. La ecografía en modo B de la arteria carótida extracraneal ha demostrado ser un método incruento, relativamente económico y fiable en la detección de la aterosclerosis carotídea2. Debido a que la enfermedad aterosclerótica es sistémica y afecta a la mayor parte de las arterias de mediano y gran calibre del organismo, se ha propuesto esta exploración como un marcador adecuado de la carga aterosclerótica de un individuo y de su riesgo cardiovascular2–4. Varios estudios prospectivos han demostrado que el grosor íntima-media (GIM) carotídeo es un factor de riesgo independiente de la enfermedad macrovascular (EMV) en la población general y diabética5–8. Asimismo, se ha descrito que la presencia de placas carotídeas (PC) se asocia a un mayor GIM y predice episodios cardiovasculares independientemente de otros factores de riesgo cardiovascular9. Dado que la detección de PC es más sencilla que la medición del GIM, se ha propuesto su identificación como marcador alternativo de arteriosclerosis subclínica9,10. Sin embargo, la ecografía carotídea no es una técnica habitualmente accesible en las consultas externas, por lo que se utilizan otras exploraciones para el cribado de la enfermedad arterial periférica asintomática11,12, como la medición del índice tobillo-brazo (ITB), dado que es una prueba incruenta, sencilla, de escaso coste y de una gran reproducibilidad. Estudios prospectivos han demostrado que un ITB inferior a 0,9 se asocia a una elevada prevalencia de enfermedad coronaria e ictus y a una elevada mortalidad total y cardiovascular13–16. Sin embargo, existen trabajos en los que el ITB no detectó pacientes con aterosclerosis subclínica17,18 y se ha señalado que su sensibilidad para diagnosticar arteriopatía periférica en pacientes diabéticos asintomáticos es baja (28,4%) y que presenta una elevada tasa de falsos positivos por la coexistencia de calcificación arterial19,20. La pulsioximetría mide la saturación de oxígeno (SaO2) en sangre periférica, por lo que se ha demostrado que refleja la perfusión tisular. Dado que los pulsioxímetros son accesibles y fáciles de utilizar en la consulta, se ha sugerido que la pulsioximetría podría emplearse como una técnica de cribado de la enfermedad arterial periférica alternativa al ITB21,22 al haberse observado una buena concordancia entre ambas técnicas en algunos estudios21,22.
El objetivo de este trabajo fue determinar la eficacia de la pulsioximetría para identificar pacientes con DM2 con aterosclerosis subclínica evaluada mediante ecografía carotídea.
Pacientes y métodoDiseño del estudio y pacientesSe trata de un estudio transversal, descriptivo y observacional sin intervención terapéutica en pacientes con DM2 procedentes de 2 centros hospitalarios (Hospital Universitari Germans Trias i Pujol y Hospital de Mataró) del área sanitaria del Barcelonés Nord y Maresme, que se llevó a cabo entre febrero y junio de 2007. Se seleccionaron 105 pacientes con DM2 (el 56,2% eran varones) que acudieron de forma consecutiva a control en las consultas externas de Endocrinología. El diagnóstico de DM2 se realizó de acuerdo a los criterios de la American Diabetes Association23. Los criterios de inclusión fueron pacientes diabéticos en tratamiento con dieta o antidiabéticos orales desde el diagnóstico de la diabetes y con ausencia de anticuerpos contra la descarboxilasa del ácido glutámico, ausencia de vasculopatía periférica sintomática (historia de claudicación intermitente o amputación), ausencia de clínica de agudización de enfermedad cardiovascular en los 6 meses previos a la inclusión, ausencia de enfermedad inflamatoria sistémica crónica y de historia activa o previa de neoplasia y ausencia de gestación. Se consideró criterio de exclusión una hemoglobina glucosilada (HbA1c) superior al 7,5% en alguna determinación de los últimos 12 meses. El Comité Ético del hospital aprobó el protocolo de estudio.
Tras obtener el consentimiento informado, se efectuó una historia clínica completa y una exploración física con medición de la talla, el peso y el perímetro de la cintura en centímetros, y la presión arterial sistólica (PAS) y la presión arterial diastólica en milímetros de mercurio (media de 2 determinaciones con un intervalo de 5min, con el sujeto en sedestación, mediante monitor automático Omron®). El índice de masa corporal se calculó como el peso expresado en kilogramos dividido por el cuadrado de la talla expresada en metros. El perímetro de la cintura se expresó como la media de 3 mediciones realizadas por el mismo explorador a la altura de la parte superior de la cresta ilíaca en un plano paralelo al suelo que pasaba por el ombligo.
La presencia de EMV se consideró si el paciente tenía historia de cualquier episodio de infarto agudo de miocardio, angina de pecho, ictus o arteriopatía periférica. La nefropatía diabética se evaluó en función de la excreción urinaria de albúmina en orina de 24h en al menos 2 de 3 muestras consecutivas. Se consideró normoalbuminuria si la excreción urinaria de albúmina era inferior a 30mg/24h, oligoalbuminuria si era de 30 a 300mg/24h y proteinuria si era superior a 300mg/24h. La retinopatía diabética se evaluó mediante cámara de retinografía no midriática por parte de un oftalmólogo especializado. La hipertensión arterial se definió como una PAS superior a 140mmHg o una presión arterial diastólica superior a 90mmHg o cuando el paciente seguía tratamiento con fármacos antihipertensivos. La hipercolesterolemia se definió como un colesterol total (CT) superior a 5,13mmol/l o cuando el paciente seguía tratamiento con hipolipidemiantes.
Determinaciones bioquímicasLas muestras de sangre se extrajeron por venopunción entre las 07.00 y 08.00 después de un ayuno de 12h. Se determinaron en el plasma la glucosa, el CT, el colesterol unido a lipoproteínas de alta densidad (HDL), los triglicéridos y el ácido úrico por técnicas sistemáticas de bioquímica inmediatamente después de la extracción. El colesterol no unido a HDL se calculó como la diferencia entre el CT y el colesterol unido a HDL. La HbA1c se midió en muestras sanguíneas con EDTA por cromatografía líquida de alta presión usando el analizador automatizado Adams HA-8160® (Arkray, Kyoto, Japón), con un coeficiente de variación interensayo del 1,8% y del 1,5% para una HbA1c del 4,8 y del 9,0%, respectivamente (intervalo de referencia del 4,0–6,0%).
Las muestras séricas para la medición de los restantes parámetros bioquímicos estudiados se congelaron y almacenaron inmediatamente a −80°C hasta su determinación. La proteína C reactiva ultrasensible (PCR-us) se determinó en el suero por nefelometría utilizando BN-ProSpect® (Dade Behring®, GMBH, Marburg, Alemania) con un coeficiente de variación interensayo del 3,7 y del 3,5% para concentraciones de PCR-us de 2,38mg/l y de 52,2mg/l, respectivamente. La medición de la proteína plasmática asociada a la gestación-A (PAPP-A) ultrasensible se realizó en el suero mediante un enzimoinmunoanálisis (DSL, Active US PAPP-A ELISA Diagnostic Systems Laboratories INC, Webster, TX, EE. UU.), con un coeficiente de variación interensayo del 8,5% y del 5,3% para concentraciones de PAPP-A de 2,5mU/l y de 10mU/l, respectivamente. Las concentraciones séricas del factor de necrosis tumoral alfa (TNF-α) y de la inteleucina-6 (IL-6) se determinaron mediante análisis inmunométrico quimioluminiscente (Immulite One®, DPC, Los Ángeles, CA, EE.UU.). El coeficiente de variación interensayo para el TNF-α fue del 2,5% y del 4,8% para concentraciones de TNF-α de 96pg/ml y de 567pg/ml, respectivamente. El coeficiente de variación interensayo para la IL-6 fue del 3,7% y del 5,9% para concentraciones de IL-6 de 78pg/ml y de 459pg/ml, respectivamente. Las concentraciones séricas de adiponectina se midieron utilizando un radioinmunoanálisis comercial de doble anticuerpo (Linco Research, Inc., St. Louis, MO, EE. UU.). Los coeficientes de variación intraensayo e interensayo fueron inferiores al 6,2% y al 9,2%, respectivamente, a concentraciones medias de adiponectina de 3μg/ml, 6μg/ml y 15μg/ml. La sensibilidad del análisis fue de 1μg/ml. Todas las muestras de plasma se diluyeron a 1:250 para obtener un intervalo efectivo de 0,2–50μg/ml.
Índice tobillo-brazoEl ITB se determinó tras un reposo de media hora mediante un ecógrafo Doppler portátil (Mini-Doppler®, model ES-100X, Hadeco Inc, Kawasaki, Japón) con una frecuencia de emisión de 8MHz y un esfigmógrafo de mercurio calibrado. Se midió la PAS en la arteria tibial posterior y pedia de ambos miembros inferiores, y en la arteria braquial de ambos miembros superiores. El valor del ITB para cada uno de los miembros inferiores fue el resultado de dividir la mayor PAS obtenida en cada miembro inferior, tibial posterior o pedia, entre la PAS mayor en cualquiera de los miembros superiores. El valor del miembro con un menor ITB fue el utilizado para cada paciente. Se consideró patológico cuando el ITB era inferior a 0,9. Los pacientes con un ITB superior a 1,3 se excluyeron para evitar falsas elevaciones por calcificación arterial.
Ecografía carotídeaLa exploración ecográfica se realizó con un ecógrafo de alta resolución en modo B (Acuson Sequoia C-256®) con un transductor eléctrico lineal (Multifrequency 8L5). Se examinaron 3 segmentos predeterminados de las arterias de ambos lados: carótida primitiva (1cm proximal al bulbo carotídeo), bifurcación/bulbo (1–2cm) y carótida interna (1cm distal a la bifurcación). Los vasos se estudiaron con ecografía en tiempo real y Doppler color mediante secciones longitudinales y transversales con rotación de la cabeza de 45° hacia el lado contralateral al explorado y con el cuello en situación neutra y en dirección anteroposterior. En cada estudio se evaluaron el GIM y las PC de ateroma, y se tomó la presencia de PC como criterio de aterosclerosis carotídea. El GIM, definido como la distancia existente entre la interfaz luz carotídea-íntima y la interfaz media-adventicia de la pared distal, se determinó en la zona libre de placas de la pared posterior de la arteria carótida común 1cm prebifurcación de acuerdo con el Consenso de Mannheim (2004–2006)24. Los resultados se expresan como la media de 8 determinaciones, 4 en cada lado. Las PC se definieron como un estrechamiento de la luz arterial de al menos 0,5mm o un engrosamiento focal del GIM con una altura superior o igual a 1,5mm o superior al 50% del GIM adyacente. El análisis de las PC incluyó su localización, número, altura máxima y características ecoestructurales. El grosor de las PC se midió perpendicularmente a la pared arterial en el lugar del máximo estrechamiento como la distancia entre la media-adventicia y la superficie de la lesión en la luz arterial. El número de PC se calculó desde 1 a 4 o más de 4 en todos los segmentos arteriales. La morfología de las PC se expresó en función del grado de ecogenicidad como hiperecogénica, hipoecogénica o anecoica. La luz arterial se utilizó como estructura de referencia para definir la hipoecogenicidad y el eco producido por la media-adventicia en la pared distal como la de la hiperecogenicidad. Cuando varias PC se detectaban en el mismo segmento arterial, sólo se utilizaba la ecogenicidad de la asociada a un mayor estrechamiento de la luz arterial.
PulsioximetríaTodas las mediciones se realizaron durante la visita en la consulta externa. Se utilizó un pulsioxímetro automatizado (Onyx® 9500, Nonin Medical Inc, Plymouth, EE. UU.) para medir la SaO2. La SaO2 se determinó en el segundo dedo de ambas manos y en el primer dedo de ambos pies en decúbito supino y con una elevación del pie de unos 30cm. Se consideró patológico si la SaO2 medida en los pies era más de un 2% menor que en las manos o si la SaO2 medida en los dedos de los pies disminuía más de un 2% con la elevación de la extremidad inferior respecto del valor en posición supina, de acuerdo a un estudio previo realizado que evaluó el uso de esta técnica en el cribado de la vasculopatía periférica diabética21.
Análisis estadísticoLas variables continuas se expresaron como media (desviación estándar) o mediana (intervalo intercuartílico) y las variables categóricas como frecuencias y porcentajes en función de si seguían una distribución normal. La distribución normal de las variables se evaluó mediante el test de distribución de Kolmogorov-Smirnov. Las diferencias entre grupos se analizaron con la t de Student o el test de la U de Mann-Whitney cuando la variable no seguía una distribución normal. Las diferencias en las proporciones se analizaron mediante el test de la chi cuadrado. La relación entre las variables cuantitativas se analizó mediante el cálculo de los coeficientes de correlación de Pearson (r) o Spearman. La significación estadística se consideró como riesgo alfa del 5% (p<0,05). Los cálculos se efectuaron mediante el paquete estadístico SPSS, versión 12.0 (SPSS®, Chicago, IL, EE. UU.).
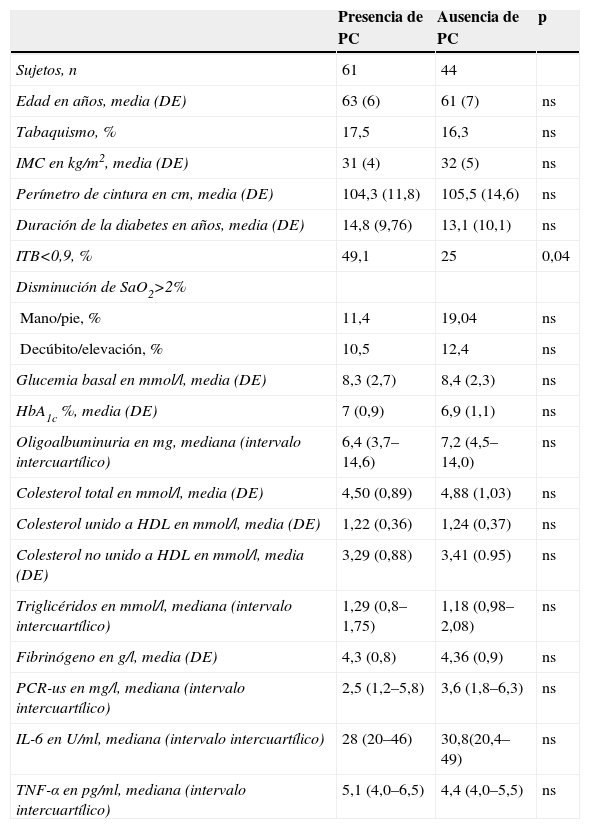
ResultadosSe incluyeron 105 pacientes (60 varones). La edad media fue de 62 años (desviación estándar de 7) y la duración media de la diabetes fue de 14,2 años (10,4). En el grupo total, la HbA1c media fue del 6,9% (1,0). El ITB fue patológico en un 35% de la muestra total. Un 58,1% tenía PC. En la tabla 1 se recogen los datos clínicos y bioquímicos de todos los pacientes divididos en 2 grupos en función de la presencia o ausencia de PC en la ecografía. Los datos antropométricos y el tiempo de evolución de la diabetes fueron comparables entre ambos grupos de pacientes. Tampoco hubo diferencias entre los pacientes con y sin PC respecto a la prevalencia de tabaquismo (el 17,5 frente al 16,3%; p=0,9), de hipertensión arterial (el 84 frente al 80%; p=0,7), de dislipidemia (el 86 frente al 83%; p=0,9) ni de historia de macroangiopatía (el 34 frente al 21%; p=0,2). No existieron diferencias en la prevalencia de nefropatía (el 19,6 frente al 23,8%; p=0,8) ni de neuropatía diabética (el 34 frente al 30%; p=0,7). Sin embargo, los pacientes con PC presentaban con más frecuencia retinopatía diabética (el 49 frente al 25%; p=0,02). La proporción de pacientes en tratamiento con hipoglucemiantes orales (el 75 frente al 69%; p=0,6), insulina (el 66 frente al 55%; p=0,3), estatinas (el 76 frente al 71%; p=0,70), fibratos (el 13 frente al 12%; p=0,8) y antihipertensivos (el 81 frente al 80%; p=0,9) fue similar entre los pacientes con y sin PC. Los pacientes presentaban un control glucémico y lipídico similar. Las concentraciones de la PCR-us, del TNF-α, la IL-6, la adiponectina y la PAPP-A fueron similares entre ambos grupos (tabla 1).
Características clínicas y bioquímicas de los pacientes con diabetes mellitus tipo 2 en función de la presencia de placas carotídeas
| Presencia de PC | Ausencia de PC | p | |
| Sujetos, n | 61 | 44 | |
| Edad en años, media (DE) | 63 (6) | 61 (7) | ns |
| Tabaquismo, % | 17,5 | 16,3 | ns |
| IMC en kg/m2, media (DE) | 31 (4) | 32 (5) | ns |
| Perímetro de cintura en cm, media (DE) | 104,3 (11,8) | 105,5 (14,6) | ns |
| Duración de la diabetes en años, media (DE) | 14,8 (9,76) | 13,1 (10,1) | ns |
| ITB<0,9, % | 49,1 | 25 | 0,04 |
| Disminución de SaO2>2% | |||
| Mano/pie, % | 11,4 | 19,04 | ns |
| Decúbito/elevación, % | 10,5 | 12,4 | ns |
| Glucemia basal en mmol/l, media (DE) | 8,3 (2,7) | 8,4 (2,3) | ns |
| HbA1c %, media (DE) | 7 (0,9) | 6,9 (1,1) | ns |
| Oligoalbuminuria en mg, mediana (intervalo intercuartílico) | 6,4 (3,7–14,6) | 7,2 (4,5–14,0) | ns |
| Colesterol total en mmol/l, media (DE) | 4,50 (0,89) | 4,88 (1,03) | ns |
| Colesterol unido a HDL en mmol/l, media (DE) | 1,22 (0,36) | 1,24 (0,37) | ns |
| Colesterol no unido a HDL en mmol/l, media (DE) | 3,29 (0,88) | 3,41 (0.95) | ns |
| Triglicéridos en mmol/l, mediana (intervalo intercuartílico) | 1,29 (0,8–1,75) | 1,18 (0,98–2,08) | ns |
| Fibrinógeno en g/l, media (DE) | 4,3 (0,8) | 4,36 (0,9) | ns |
| PCR-us en mg/l, mediana (intervalo intercuartílico) | 2,5 (1,2–5,8) | 3,6 (1,8–6,3) | ns |
| IL-6 en U/ml, mediana (intervalo intercuartílico) | 28 (20–46) | 30,8(20,4–49) | ns |
| TNF-α en pg/ml, mediana (intervalo intercuartílico) | 5,1 (4,0–6,5) | 4,4 (4,0–5,5) | ns |
DE: desviación estándar; HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; IL-6: interleucina-6; IMC: índice de masa corporal; ITB: índice tobillo-brazo; ns: no significativo; PC: placas carotídeas; PCR-us: proteína C reactiva ultrasensible; SaO2: saturación de oxígeno; TNF-α: factor de necrosis tumoral alfa.
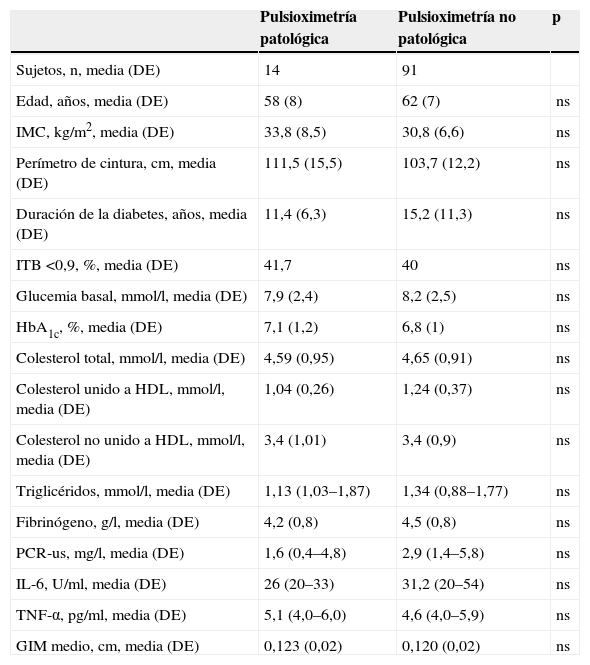
Un 49,1% de los pacientes con PC presentaba un ITB patológico frente a un 25% de los pacientes sin PC, siendo esta diferencia significativa (p=0,02). Sin embargo, no se observaron diferencias significativas en la proporción de pacientes con pulsioximetría alterada en función de la evaluación mano-pie (el 11,8 frente al 18,8%; p=0,5) o decúbito-elevación (el 10,9 frente al 12,5%; p=0,9) entre los pacientes con y sin PC (tabla 1). Estos resultados no se modificaron tras excluir a los pacientes con EMV previa (datos no mostrados). No se observaron diferencias significativas en los datos clínicos y analíticos entre los pacientes con y sin ITB patológico (datos no mostrados). Los datos clínicos, bioquímicos y ecográficos fueron similares entre los pacientes con pulsioximetría normal y patológica (tabla 2).
Características clínicas, analíticas y ecográficas de los pacientes en función de la presencia de pulsioximetría patológica (relación mano-pie o decúbito-elevación)
| Pulsioximetría patológica | Pulsioximetría no patológica | p | |
| Sujetos, n, media (DE) | 14 | 91 | |
| Edad, años, media (DE) | 58 (8) | 62 (7) | ns |
| IMC, kg/m2, media (DE) | 33,8 (8,5) | 30,8 (6,6) | ns |
| Perímetro de cintura, cm, media (DE) | 111,5 (15,5) | 103,7 (12,2) | ns |
| Duración de la diabetes, años, media (DE) | 11,4 (6,3) | 15,2 (11,3) | ns |
| ITB <0,9, %, media (DE) | 41,7 | 40 | ns |
| Glucemia basal, mmol/l, media (DE) | 7,9 (2,4) | 8,2 (2,5) | ns |
| HbA1c, %, media (DE) | 7,1 (1,2) | 6,8 (1) | ns |
| Colesterol total, mmol/l, media (DE) | 4,59 (0,95) | 4,65 (0,91) | ns |
| Colesterol unido a HDL, mmol/l, media (DE) | 1,04 (0,26) | 1,24 (0,37) | ns |
| Colesterol no unido a HDL, mmol/l, media (DE) | 3,4 (1,01) | 3,4 (0,9) | ns |
| Triglicéridos, mmol/l, media (DE) | 1,13 (1,03–1,87) | 1,34 (0,88–1,77) | ns |
| Fibrinógeno, g/l, media (DE) | 4,2 (0,8) | 4,5 (0,8) | ns |
| PCR-us, mg/l, media (DE) | 1,6 (0,4–4,8) | 2,9 (1,4–5,8) | ns |
| IL-6, U/ml, media (DE) | 26 (20–33) | 31,2 (20–54) | ns |
| TNF-α, pg/ml, media (DE) | 5,1 (4,0–6,0) | 4,6 (4,0–5,9) | ns |
| GIM medio, cm, media (DE) | 0,123 (0,02) | 0,120 (0,02) | ns |
HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; IL-6: interleucina-6; IMC: índice de masa corporal; ITB: índice tobillo-brazo; ns: no significativo; PC: placas carotídeas; PCR-us: proteína C reactiva ultrasensible; SaO2: saturación de oxígeno; TNF-α: factor de necrosis tumoral alfa.
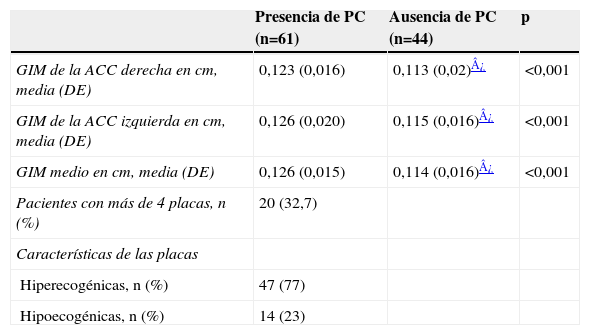
La tabla 3 muestra las características ecográficas carotídeas de los pacientes incluidos en el estudio según la presencia o no de PC. Los pacientes con PC presentaban un GIM mayor en todas las determinaciones respecto de los pacientes sin ellas (p<0,001). También el GIM en todas sus medidas fue significativamente mayor en los pacientes con ITB patológico respecto de los que tenían un ITB normal (p<0,005), incluso cuando se excluyó a los pacientes con historia de EMV. Por el contrario, no se observaron diferencias en el GIM en función de la pulsioximetría alterada al comparar ambos subgrupos de pacientes en conjunto, ni tras la exclusión de los pacientes con historia conocida de EMV (tabla 3). No hubo diferencias respecto a la ecogenicidad de las PC entre los pacientes con un ITB o una pulsioximetría patológicos o normales.
Características ecográficas de los pacientes con y sin placas carotídeas
| Presencia de PC (n=61) | Ausencia de PC (n=44) | p | |
| GIM de la ACC derecha en cm, media (DE) | 0,123 (0,016) | 0,113 (0,02)¿ | <0,001 |
| GIM de la ACC izquierda en cm, media (DE) | 0,126 (0,020) | 0,115 (0,016)¿ | <0,001 |
| GIM medio en cm, media (DE) | 0,126 (0,015) | 0,114 (0,016)¿ | <0,001 |
| Pacientes con más de 4 placas, n (%) | 20 (32,7) | ||
| Características de las placas | |||
| Hiperecogénicas, n (%) | 47 (77) | ||
| Hipoecogénicas, n (%) | 14 (23) |
ACC: arteria carótida común; DE: desviación estándar; GIM: grosor íntima-media; PC: placas carotídeas.
En el estudio de correlaciones se observó que el TNF-α se correlacionaba con la IL-6 (r=0,3; p=0,002) y con el número total de PC (r=0,28; p=0,004). La IL-6 se correlacionó significativamente con la PCR-us (r=0,4; p<0,0001). El ITB se correlacionó negativa y significativamente con el GIM en todas sus medidas (r=−0,4; p<0,05 para GIM medio carotídeo) y con el número total de PC (r=−0,2; p=0,04). Asimismo, el GIM en todas sus medidas mostró correlación significativa y positiva con el número de PC (r=0,4; p<0,0001 para el GIM medio carotídeo) y con la edad (r=0,2; p<0,02 para el GIM medio carotídeo).
La sensibilidad de la pulsioximetría y del ITB para detectar pacientes con arteriosclerosis carotídea subclínica fue de un 12,7 y de un 49,9% y la especificidad de un 41,7 y de un 75%, respectivamente. El valor predictivo positivo para la pulsioximetría fue de un 58,3% y para el ITB de un 77%. El valor predictivo negativo de la pulsioximetría fue de un 40,0% y el del ITB de un 46,2%.
DiscusiónPara nuestro conocimiento, estos resultados demuestran por primera vez que la pulsioximetría tiene una baja sensibilidad y una baja especificidad para identificar pacientes con DM2 con PC, independientemente de la historia de macroangiopatía clínica previa. Tampoco se observó que los pacientes con SaO2 disminuida en las extremidades inferiores presentaran un GIM carotídeo mayor que los pacientes con pulsioximetría normal.
La pulsioximetría mide la SaO2 de la sangre periférica y, por lo tanto, se ha propuesto como un indicador indirecto de la perfusión de los tejidos y se utiliza en el tratamiento clínico de lesiones isquémicas en las extremidades inferiores22,25. No obstante, un estudio experimental reciente demuestra que la medición de la SaO2 no siempre refleja la perfusión tisular, ya que podría estar disminuida como consecuencia de una respuesta adrenérgica26. Dada su facilidad de uso en la consulta, se ha estudiado su papel en la evaluación de la vasculopatía periférica en varios trabajos, y se han obtenido diferentes resultados. Así, se ha propuesto como una técnica alternativa al ITB en el tratamiento del paciente con arteriopatía periférica sintomática22 y, recientemente21, como técnica diagnóstica en el cribado de la arteriopatía periférica en pacientes diabéticos asintomáticos. En un estudio reciente realizado por Jawahar et al27 que comparaba la pulsioximetría con el ITB en un grupo de enfermos con clínica de vasculopatía periférica, la pulsioximetría no detectó al 84% con un ITB patológico de 0,5 a 0,9, ni al 46% de aquéllos con un ITB inferior a 0,5. No conocemos estudios previos que evalúen el uso de la pulsioximetría respecto al de la ecografía carotídea, que está considerada una técnica de detección de la aterosclerosis subclínica. Nuestros resultados apoyan la ineficacia de la pulsioximetría como técnica de cribado de la macroangiopatía central en pacientes diabéticos, por lo que su utilización no sería aconsejable de forma sistemática.
En lo que respecta a la medición del ITB, la correlación significativa entre el ITB y el GIM observada en el presente estudio concuerda con datos anteriores en los que se observó que los pacientes con ITB patológico tenían un GIM carotídeo significativamente mayor que los que presentaban un ITB normal12. Además, en nuestro caso, los pacientes con PC presentaban con mayor frecuencia un ITB patológico que los pacientes sin ellas, incluso tras la exclusión de aquéllos con EMV previa. A la vista de estos resultados, el ITB se confirma como un método útil en la exploración de la macroangiopatía, como se ha propuesto en numerosos trabajos prospectivos12–16. Sin embargo, y a pesar de que el ITB se correlacionó de manera significativa con el GIM carotídeo y con el número de PC, el ITB presentó una baja sensibilidad para detectar pacientes con PC, de acuerdo a otros estudios en que esta técnica no detectó pacientes con aterosclerosis carotídea subclínica16,17. Por otro lado, la prevalencia de ITB patológico en el presente estudio fue más elevada que la referida en otros previos28,29, lo que podría explicarse por la inclusión de pacientes con DM2 más evolucionada y complicada que estaban en control en las consultas externas especializadas hospitalarias.
Las correlaciones observadas entre el TNF-α, la IL-6 y la PCR-us en el presente estudio están en concordancia con el estado proinflamatorio de los pacientes con diabetes. La correlación significativa entre el TNF-α, el GIM carotídeo y el número de PC confirmaría la asociación descrita en la bibliografía entre los marcadores inflamatorios y la aterosclerosis30. Asimismo, la observación de que el GIM carotídeo se asocia de manera significativa al número de PC totales apoya la utilización de la determinación de las PC como alternativa a la medición del GIM carotídeo en el estudio de la aterosclerosis carotídea, como ya se ha demostrado en estudios previos9,10. En el presente estudio se confirma la asociación significativa del GIM carotídeo a la edad descrita en otros estudios4,30,31, pero no a los parámetros lipídicos, probablemente por el pequeño tamaño muestral y la inclusión de pacientes en tratamiento con estatinas.
Cabe señalar que, tomando como referencia los valores de GIM del estudio de Junyent et al31 realizado en personas sanas no diabéticas de nuestro ámbito sanitario, se observa que los pacientes diabéticos de nuestra muestra, a pesar del buen control glucémico promedio, tenían un mayor GIM que los sujetos sanos de más de 65 años, lo que confirma el riesgo arteriosclerótico de la diabetes per se y la importancia de buscar herramientas diagnósticas sencillas de utilizar en nuestras consultas que permitan intensificar el tratamiento en fases precoces.
Creemos que estos resultados son valorables porque los pacientes con y sin PC, evaluados mediante pulsioximetría, fueron homogéneos en cuanto a edad, tiempo de evolución de la DM2, dislipidemia, hipertensión arterial, historia previa de macroangiopatía y control glucémico, que son factores de riesgo bien conocidos del desarrollo de PC y de ITB patológico. Además, el análisis de pacientes diabéticos con y sin historia de EMV y, por lo tanto en diferentes fases evolutivas del proceso aterosclerótico, reafirma el escaso papel de la pulsioximetría en el proceso diagnóstico de la arteriosclerosis. Dada la complejidad de la enfermedad aterosclerótica, es de gran interés la búsqueda de una técnica de cribado fiable, reproducible y de bajo coste, y son necesarios más estudios con una mayor muestra de pacientes para confirmar estos resultados.
FinanciaciónLa beca «Ajut a la recerca en diabetis Gonçal Lloveras i Vallès» de la Sociedad Catalana de Diabetes ha financiado en parte este trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.