El 31 de enero de 2020 se declaró el primer caso de infección por enfermedad por coronavirus de 2019 (COVID-19) en España. El 23 de marzo se habían detectado 14.000 casos y más de 5.000 en la Comunidad de Madrid.
La Dirección Asistencial de Atención Primaria del área noroeste de Madrid, dada la situación de urgencia en la que se hallaban los centros sociosanitarios, organizó unas unidades de apoyo a residencias (UAR) constituidas por un médico, una enfermera y un conductor, cuyo cometido sería la atención sanitaria de los residentes, el apoyo para la sectorización del centro y el aislamiento de los pacientes infectados y sus contactos estrechos.
El 27 de diciembre de 2020 empezó la campaña de vacunación frente a coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) en todos los países de la Unión Europea. Las personas que viven en centros sociosanitarios son particularmente vulnerables a las infecciones graves por SARS-CoV-2 y experimentan altas tasas de enfermedad grave y mortalidad, por lo que en el programa de vacunación fueron los primeros en ser atendidos.
La UAR vacunó a un total de 4.512 pacientes (residentes y trabajadores) de centros sociosanitarios con la vacuna BNT162b2 de Pfizer, entre el 28 de diciembre de 2020 y el 18 de febrero de 2021.
Nuestro objetivo es comunicar el hallazgo de eritema palpebral observado en una serie de 10 casos tras la administración de la vacuna.
Se incluyó en el programa de vacunación a todos los pacientes ≥16años, institucionalizados en centros sociosanitarios para discapacitados o residencias de ancianos, y a sus trabajadores, que firmaron el consentimiento informado. Quedaron excluidos aquellos pacientes con historia previa de reacción adversa grave o anafilaxia a alguno de los componentes de la vacuna, infección aguda por SARS-CoV-2, ingreso hospitalario o periodo de convalecencia de cualquier enfermedad.
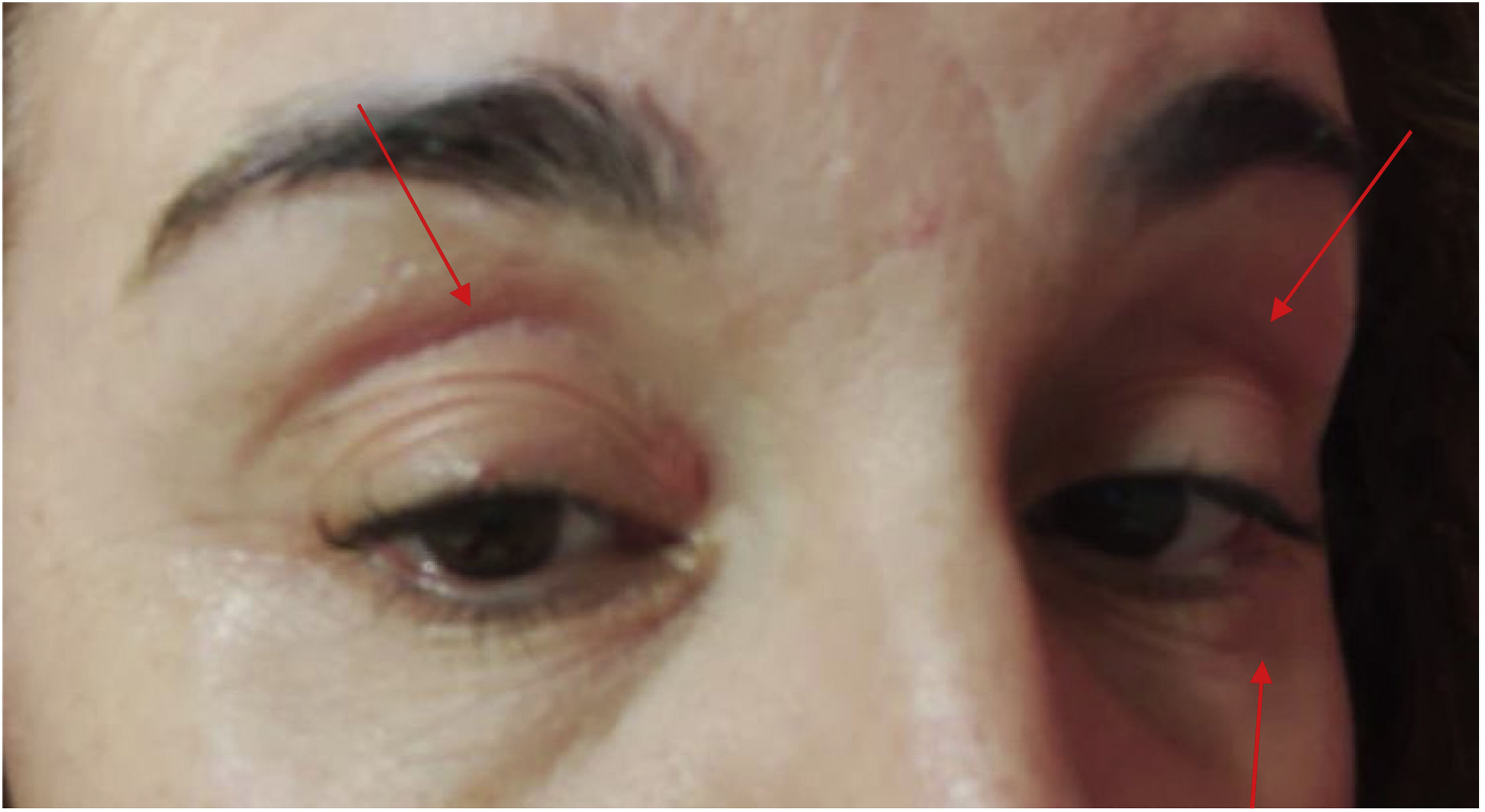
Diez pacientes (0,22%) entre 47 y 99 años de los 4.512 vacunados presentaron eritema palpebral rojo-violáceo (fig. 1), en los párpados superior e inferior, no descamativo, no pruriginoso, irritativo, con sensación de quemazón, tras la administración de la vacuna.
Seis de ellos habían padecido una infección por COVID-19 previa a la vacunación. Ninguno de ellos había padecido con anterioridad un cuadro similar, no tenían antecedentes de enfermedad dermatológica ni de cirugía de párpados.
En un paciente el cuadro se desarrolló a las 24horas de la primera dosis, en 7 de ellos a las 24 de la segunda y solo en 2 de ellos se repitió tras la primera y la segunda dosis, a las 24 y a las 8horas respectivamente. No se asoció a ningún otro efecto secundario.
En todos los casos la duración fue de 4 días, en 4 pacientes mejoró con corticoide tópico en pomada y en los otros 6 desapareció espontáneamente.
Los efectos secundarios declarados hasta el momento se refieren a síntomas generales (los más frecuentes fiebre, cefalea, escalofríos, cansancio, mialgias y dolores articulares), o locales en el lugar de la punción (dolor, hinchazón y enrojecimiento) y fueron más frecuentes después de recibir la segunda dosis de vacuna1–4. Hasta la fecha no hemos encontrado ningún caso en la literatura de eritema palpebral secundario a la vacunación con BNT162b2 de Pfizer, ni está recogido en su ficha técnica.
En todos los casos observados el patrón de aparición y curación respecto al día en que se administró la vacuna y el tipo de lesión cutánea sugiere una relación causa-efecto. Sería necesario valorar la aparición de este signo clínico tras la administración de la vacuna de BNT162b2 de Pfizer o de cualquier otra en series con mayor número de pacientes y su relación temporal y fisiopatológica con la administración de la misma.
Todos los pacientes dieron su consentimiento para la publicación de los casos y de las imágenes.
FinanciaciónEste trabajo no ha recibido financiación.