El alcohol y sus metabolitos tienen un papel importante en la carcinogénesis, pudiendo estar este efecto modulado por polimorfismos en genes que codifican enzimas participantes en el metabolismo de alcohol y folato. Por ello, analizamos el efecto que podría tener el consumo de alcohol y los polimorfismos ADH1B Arg48His, ADH1B Arg370Cys, ADH1C Ile349Val, ALDH2 Glu540Lys, CYP2E1 RsaI, CYP2E1 DraI, CYP2E1 TaqI y MTHFR C677T en el riesgo de cáncer de pulmón.
Pacientes y métodoSe incluyeron 876 casos de cáncer de pulmón y 840 controles del estudio caso-control de base hospitalaria CAPUA. El genotipado de los SNP se realizó mediante la tecnología Sequenom MassArray (iPLEX GOLD).
ResultadosUn consumo de alcohol de 0,1-9,9g/día disminuye el riesgo de cáncer de pulmón (ORajustada=0,71; IC 95% 0,48-1,05), aunque no se alcanza la significación estadística. Un consumo de alcohol≥30g/día y de tabaco≥36paquetes/año aumenta el riesgo de cáncer de pulmón (ORajustada=26,68; IC 95% 12,69-56,10). Por otro lado, un consumo elevado de verduras (≥116,65g/día) o de frutas (≥233,13g/día) disminuye el riesgo de cáncer de pulmón con un consumo de alcohol de 0,1-9,9g/día (ORajustada=0,52; IC 95% 0,30-0,89; ORajustada=0,58; IC 95% 0,33-1,03, respectivamente). Un consumo de alcohol de 10-29,9g/día en individuos portadores del alelo ADH1B 48His aumenta el riesgo de cáncer de pulmón (ORajustada=3,32; IC 95% 1,03-10,70).
ConclusionesEl alcohol y polimorfismos en genes que participan en el metabolismo del alcohol y del folato están relacionados con el cáncer de pulmón.
Alcohol and its metabolites play an important role in carcinogenesis. This effect could be modulated by polymorphisms in genes encoding enzymes involved in the metabolism of alcohol and folate. Therefore, we analyzed the effect of alcohol consumption and ADH1B Arg48His, ADH1B Arg370Cys, ADH1C Ile349Val, ALDH2 Glu540Lys, CYP2E1 RsaI, CYP2E1 DraI, CYP2E1 TaqI and MTHFR C677T polymorphisms on the risk of developing lung cancer.
Patients and methodsWe included 876 lung cancer cases and 840 controls of the CAPUA hospital-based case-control study. Genotyping was performed using the Sequenom MassArray (iPLEX GOLD) technology.
ResultsAn alcohol consumption of 0.1-9.9g/day decreased lung cancer risk (ORadjusted=0.71; 95% CI 0.48-1.05), although statistical significance was not achieved. A consumption≥30g/day of alcohol and≥36PY of tobacco increases lung cancer risk (ORadjusted=26.68; 95% CI 12.69-56.10). On the other hand, a high consumption of vegetables (≥116.65g/day) and fruits (≥233.13g/day) decreases lung cancer risk with an alcohol consumption of 0.1-9.9g/day (ORadjusted=0.52; 95% CI 0.30-0.89; ORadjusted=0.58; 95% CI 0.33-1.03, respectively). An alcohol consumption of 10-29.9g/day in ADH1B 48His allele-carriers increases lung cancer risk (ORadjusted=3.32; 95% CI 1.03-10.70).
ConclusionsAlcohol and polymorphisms in genes involved in the metabolism of alcohol and folate are related to the onset of lung cancer.
Aproximadamente un total de 770.000 casos de cáncer a nivel mundial, que representan el 5,5% de todos los cánceres, derivan del consumo crónico de alcohol, y 480.000 muertes, que suponen el 5,8% del total de muertes por cáncer a nivel mundial, son atribuibles al consumo de alcohol1. Actualmente, la International Agency for Research on Cancer (IARC, «Agencia Internacional para la Investigación del Cáncer») ha clasificado los cánceres de cavidad oral, faringe, laringe, esófago, hígado, colorrectal y el de mama en mujeres como los cánceres de mayor riesgo (Grupo 1) asociados al consumo de alcohol2. Sin embargo, la relación entre consumo de alcohol y cáncer de pulmón continúa siendo controvertida porque la evidencia epidemiológica actual no ha constatado una asociación clara de riesgo o protección a desarrollar este tipo de neoplasia3,4.
Uno de los principales mecanismos que pueden contribuir a la carcinogénesis mediada por el alcohol incluye el efecto tóxico del acetaldehído, primer metabolito de la oxidación del etanol, dado que el acetaldehído presente en las bebidas alcohólicas está clasificado como «carcinógeno en humanos»5. Experimentos en animales y cultivos celulares muestran claramente que el acetaldehído es carcinogénico porque tiene un efecto mutagénico y puede afectar al ciclo celular, la apoptosis y la reparación del ADN6.
El hecho de que el alcohol pueda actuar como un agente carcinógeno también puede ser debido, en parte, a la existencia de variaciones o alteraciones genéticas, entre las que destacamos los polimorfismos de un único nucleótido (SNPs) en los genes que participan en el metabolismo del etanol y del acetaldehído, como son ADH, ALDH y CYP2E1. Polimorfismos funcionales presentes en estos genes actúan alterando la velocidad de síntesis del metabolito tóxico acetaldehído o disminuyendo su posterior oxidación a acetato, dando lugar a diferencias en la exposición a acetaldehído entre los bebedores7. Está demostrado que individuos que acumulan acetaldehído debido a estos polimorfismos tienen un mayor riesgo de cáncer8. Es más, el consumo de alcohol podría interaccionar con otros genes, como el MTHFR, que codifica una enzima implicada en el metabolismo del folato, compuesto que participa en la metilación, la síntesis y la reparación del ADN. El alcohol es un antagonista del folato, afectando a la biodisponibilidad de este último, lo que podría dar lugar a la alteración de la expresión genética y de la integridad genómica.
Las alcohol deshidrogenasas (ADH) son enzimas que oxidan el etanol en acetaldehído. Cuando el consumo de alcohol es elevado, la citocromo P4502E1 (CYP2E1) es inducida y oxida el etanol a acetaldehído, al tiempo que produce reactive oxygen species (ROS, «especies reactivas de oxígeno»). Posteriormente, el acetaldehído es oxidado a acetato por la aldehído deshidrogenasa (ALDH). Por otro lado, un consumo elevado de alcohol parece interferir con la utilización del folato, ya que provoca la escisión de este compuesto. La enzima MTHFR desempeña un papel central en el metabolismo del folato, regulando el flujo de este entre 2 importantes vías: la producción de timidilato y purinas para la síntesis de ADN y el suministro de grupos metilo para la síntesis de metionina y la metilación del ADN.
En este trabajo se analizan los polimorfismos Arg48His y Arg370Cys en el gen ADH1B y el polimorfismo Ile349Val en el gen ADH1C. Los alelos variantes 48His y 370Cys codifican una subunidad superactiva, con una Vmáx 40 veces superior y 90 veces superior, respectivamente3. En el caso del polimorfismo Ile349Val, el alelo variante 349Val da lugar a una reducción de 2,5 veces en la oxidación del alcohol a acetaldehído3; en el gen CYP2E1 estudiamos los polimorfismos TaqI, RsaI y DraI. Los alelos variantes de los polimorfismos RsaI y DraI se asocian con una mayor actividad transcripcional, niveles elevados de proteína y una mayor actividad enzimática. La posible implicación funcional del polimorfismo TaqI aún no está establecida3. En el caso del gen ALDH2, seleccionamos el polimorfismo Glu504Lys. El alelo variante Lys da lugar a una subunidad inactiva de la enzima; y por último, para el gen MTHFR, el polimorfismo C677T. En este caso, el alelo variante T es comúnmente llamado «termolábil», porque la actividad de la enzima codificada se reduce a 37°C o más3.
Material y métodosEl estudio Cáncer de Pulmón en Asturias (CAPUA) es un análisis caso-control de base hospitalaria. Los detalles del método de selección de los participantes para este estudio ya han sido descritos9–13. Brevemente, se seleccionaron un total de 969 casos incidentes en los hospitales de Gijón (Hospital de Cabueñes), Avilés (Hospital de San Agustín), Mieres (Hospital Álvarez Buylla) y Oviedo (Hospital Universitario Central de Asturias), siguiendo un protocolo idéntico desde octubre de 2000 a diciembre de 2010. Los sujetos elegibles fueron casos incidentes de cáncer de pulmón, con una edad comprendida entre los 30 y los 85 años y residentes, durante al menos 6 meses antes del diagnóstico, en las áreas de influencia de los hospitales participantes. Todos los casos fueron confirmados histológicamente, a excepción de aquellos en estadio iv avanzado, para los cuales la cirugía no era apropiada, y, por lo tanto, no tienen confirmación histológica. El diagnóstico de estos casos fue confirmado por el oncólogo y fueron definidos como diagnóstico clínico. Un total de 870 controles fueron seleccionados entre pacientes que ingresaron en los mismos hospitales de los casos para cirugía, con enfermedades no relacionadas con ningún factor de riesgo conocido de cáncer de pulmón, y emparejados por frecuencia por hospital, sexo y edad (±5 años). Las principales enfermedades específicas de los controles seleccionados fueron las siguientes: hernias abdominales e inguinales (International Classification of Diseases, tenth revision [ICD-10, «Clasificación Internacional de Enfermedades, décima revisión»]: K40-K46); lesiones (ICD-10: S00-S99); apendicitis (ICD-10: K35); y obstrucciones intestinales (ICD-10: K56, K57, K60). El estudio fue aprobado por el comité ético regional del Principado de Asturias, y cada participante firmó un consentimiento informado. Desde 2010, el estudio CAPUA ha sido incluido en el International Lung Cancer Consortium (http://ilcco.iarc.fr) y en el grupo SYNERGY (http://SYNERGY.iarc.fr) de la IARC14,15.
Un 93,31% de los individuos elegibles aceptaron participar en el estudio y fueron entrevistados (876 casos y 840 controles). De estos individuos se recogieron muestras biológicas de un total de 1.695 (98,78%), de los cuales 871 son casos (51,39%) y 825, controles (48,61%).
Recolección de datosPara la obtención de los datos referentes a los factores de riesgo conocidos o potenciales para el cáncer de pulmón, un entrevistador entrenado realizó una entrevista personal al caso o control durante la primera estancia hospitalaria del sujeto. Para ello se utilizó un cuestionario estructurado e informatizado, en el que se recogen datos sobre variables sociodemográficas básicas, antecedentes familiares y personales de cáncer, posibles factores de riesgo (endógenos, medioambientales, estilos de vida y ocupacionales) y datos clínicos (histología, grado y diferenciación del tumor).
La sección de dieta del cuestionario valoraba la frecuencia de consumo y el tamaño habitual de la porción o ración de 127 ítems de alimentos (incluidas las bebidas alcohólicas), y se usó para estimar el consumo diario de alcohol y de calorías. Las raciones estándar de vino tinto (125ml), vino blanco (125ml), cerveza (200ml), jerez (50ml), sidra (125ml), licores dulces (30ml), y coñac, ginebra, ron, whisky y vodka (40ml) fueron calculadas a partir de las tablas de composición de los alimentos y contienen 13,25; 13,25; 6,15; 3,06; 7,80; 7,40; y 14,25g de etanol, respectivamente. Se recogió el consumo medio de alcohol durante los 5 años anteriores a la entrevista y los sujetos participantes se agruparon en 4 categorías basadas en los terciles del consumo de alcohol (ajustado por energía) entre los controles: no bebedores,<0,1 (categoría de referencia en el análisis); 0,1-9,9; 10-29,9; y≥30g/día.
Para evaluar la ingesta diaria habitual de alimentos y nutrientes se utilizó un food frequency questionnaire (FFQ, «cuestionario de frecuencia de alimento») semicuantitativo de 101 ítems. El FFQ fue una versión modificada de un FFQ previo basado en el cuestionario de Harvard16, y que se desarrolló y validó usando 4 registros de una semana de la dieta en población adulta en Valencia. Los coeficientes de correlación de validez y reproducibilidad (ajustados por consumo de energía) oscilaron entre 0,38 para la reproducibilidad de los carotenoides y 0,44 para la validez de la vitamina C17,18. A los sujetos participantes en este estudio se les preguntó por la frecuencia media habitual con que habían consumido cada alimento durante los 5 años anteriores. Los valores de los nutrientes se obtuvieron, principalmente, de las tablas de composición de los alimentos de las publicaciones del Departamento de Agricultura de los EE. UU.19, así como de otras fuentes publicadas para la comida española y los tamaños de las porciones (tablas del CESNID)20. Para obtener la ingesta diaria de nutrientes para cada individuo, se multiplicó la frecuencia de ingesta de cada alimento por la composición de nutrientes de la ración o porción especificada en el FFQ y se sumaron las de todos los alimentos para obtener la ingesta total de cada nutriente.
Los sujetos participantes fueron definidos como fumadores si habían fumado alguna vez de forma habitual, es decir, al menos un cigarrillo por día durante 6 meses o más; el resto fueron definidos como no fumadores. Los fumadores se clasificaron a su vez en fumadores actuales, si durante el año previo a la entrevista o más, habían estado fumado al menos un cigarrillo al día durante 6 meses o más; los individuos que habían fumado regularmente, pero que habían dejado de fumar al menos un año antes de la entrevista fueron definidos como exfumadores; aquellos individuos que habían dejado de fumar menos de un año antes de la entrevista fueron incluidos, por tanto, en fumadores actuales. A los fumadores se les preguntó el tiempo, en años, que habían estado fumando al menos un cigarrillo al día y cuántos cigarrillos solían fumar diariamente. La intensidad del hábito tabáquico se definió posteriormente en paquetes/año (PY), calculados multiplicando el número de paquetes de cigarrillos fumados al día por el número de años que el sujeto ha estado fumando esa cantidad de tabaco. Los sujetos se clasificaron como fumadores leves (<36PY) o grandes fumadores (≥36PY), basándose en la media del consumo de la distribución de los PY del grupo control.
Genotipado de polimorfismos de un único nucleótido (SNPs)El ADN genómico utilizado para el genotipado se extrajo a partir de muestras de sangre periférica o a partir de células procedentes de enjuague bucal, mediante técnicas ya descritas21.
El genotipado de los SNP estudiados se ha realizado mediante la tecnología Sequenom MassArray (iPLEX GOLD), llevada a cabo en el Centro Nacional de Genotipado, Nodo Santiago22.
Análisis estadísticoTodas las ingestas de nutrientes y grupos de alimentos fueron transformados logarítmicamente (base natural) para mejorar su normalidad. Posteriormente se estimaron las ingestas de nutrientes ajustadas por ingesta calórica total. Para ello se utilizó el método de los residuos, denominado también de Willett, donde cada nutriente se ajusta en un modelo de regresión lineal con las calorías totales y los residuos se añaden a la ingesta media del nutriente en la población de estudio16. Se calcularon también cuartiles de ingesta para alimentos y nutrientes ajustados por calorías totales. De acuerdo con esto, las categorías para frutas y verduras se basan en los cuartiles del grupo control.
Se comprobó que la población estuviera en equilibrio Hardy-Weinberg. Para la comparación de variables continuas entre distintos grupos de individuos se utilizó el test no paramétrico de Mann-Whitney. Para las variables categóricas se empleó el test Chi-cuadrado.
En el análisis multivariante se empleó el método de regresión logística no condicionada. Se utilizaron los test LR y Wald para estudiar las variables que entraban o salían del modelo, valorando confusión y estudiando si existía interacción entre distintos factores. Por último, se estudió –a través de test de bondad de ajuste (test de Hosmer-Lemeshow)– cómo de efectivo es el modelo.
Todos los análisis estadísticos se llevaron a cabo utilizando el programa estadístico Stata 12.1.
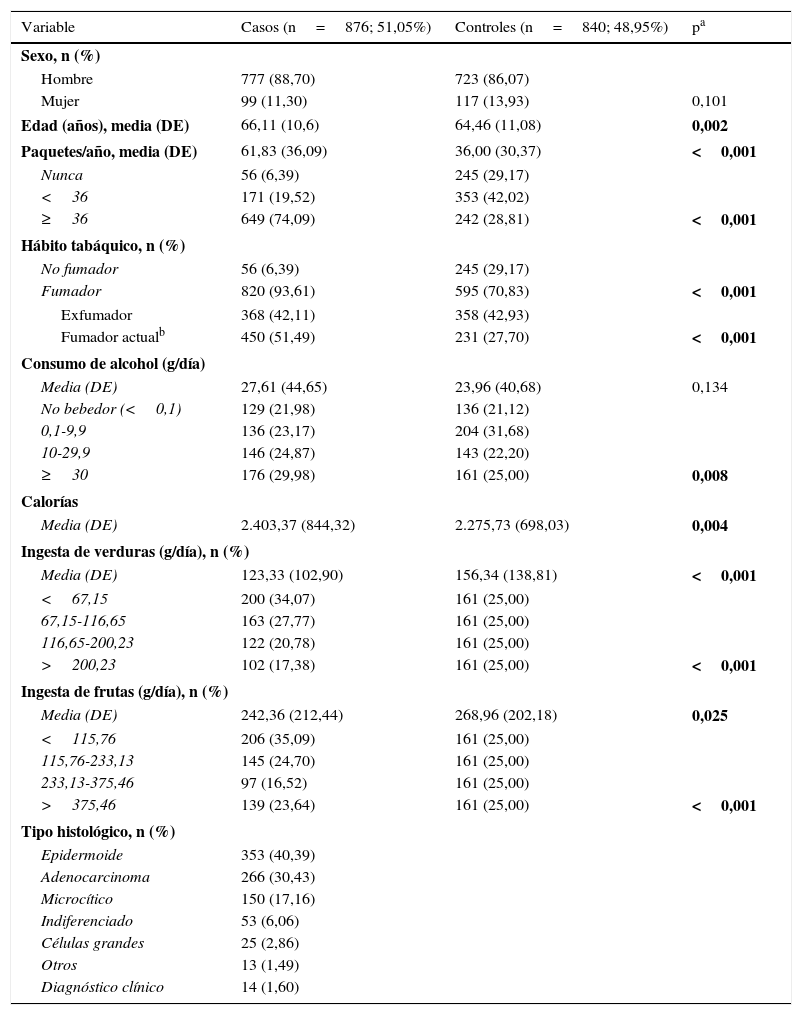
ResultadosLas características de los individuos participantes en el estudio se recogen en la tabla 1. Existen diferencias estadísticamente significativas entre casos y controles en cuanto a la media de edad (66,11 frente a 64,46 años), el consumo de tabaco (61,83 frente a 36,00PY), el consumo medio de verduras (123,33 frente a 156,34g/día), el consumo medio de frutas (242,36 frente a 268,96g/día) y el consumo medio de calorías (2.403,37 frente a 2.275,73Kcal/día). Histológicamente, el carcinoma epidermoide (40,39%) es el principal tipo de cáncer de pulmón.
Distribución de los casos de cáncer de pulmón y los controles del estudio
| Variable | Casos (n=876; 51,05%) | Controles (n=840; 48,95%) | pa |
|---|---|---|---|
| Sexo, n (%) | |||
| Hombre | 777 (88,70) | 723 (86,07) | |
| Mujer | 99 (11,30) | 117 (13,93) | 0,101 |
| Edad (años), media (DE) | 66,11 (10,6) | 64,46 (11,08) | 0,002 |
| Paquetes/año, media (DE) | 61,83 (36,09) | 36,00 (30,37) | <0,001 |
| Nunca | 56 (6,39) | 245 (29,17) | |
| <36 | 171 (19,52) | 353 (42,02) | |
| ≥36 | 649 (74,09) | 242 (28,81) | <0,001 |
| Hábito tabáquico, n (%) | |||
| No fumador | 56 (6,39) | 245 (29,17) | |
| Fumador | 820 (93,61) | 595 (70,83) | <0,001 |
| Exfumador | 368 (42,11) | 358 (42,93) | |
| Fumador actualb | 450 (51,49) | 231 (27,70) | <0,001 |
| Consumo de alcohol (g/día) | |||
| Media (DE) | 27,61 (44,65) | 23,96 (40,68) | 0,134 |
| No bebedor (<0,1) | 129 (21,98) | 136 (21,12) | |
| 0,1-9,9 | 136 (23,17) | 204 (31,68) | |
| 10-29,9 | 146 (24,87) | 143 (22,20) | |
| ≥30 | 176 (29,98) | 161 (25,00) | 0,008 |
| Calorías | |||
| Media (DE) | 2.403,37 (844,32) | 2.275,73 (698,03) | 0,004 |
| Ingesta de verduras (g/día), n (%) | |||
| Media (DE) | 123,33 (102,90) | 156,34 (138,81) | <0,001 |
| <67,15 | 200 (34,07) | 161 (25,00) | |
| 67,15-116,65 | 163 (27,77) | 161 (25,00) | |
| 116,65-200,23 | 122 (20,78) | 161 (25,00) | |
| >200,23 | 102 (17,38) | 161 (25,00) | <0,001 |
| Ingesta de frutas (g/día), n (%) | |||
| Media (DE) | 242,36 (212,44) | 268,96 (202,18) | 0,025 |
| <115,76 | 206 (35,09) | 161 (25,00) | |
| 115,76-233,13 | 145 (24,70) | 161 (25,00) | |
| 233,13-375,46 | 97 (16,52) | 161 (25,00) | |
| >375,46 | 139 (23,64) | 161 (25,00) | <0,001 |
| Tipo histológico, n (%) | |||
| Epidermoide | 353 (40,39) | ||
| Adenocarcinoma | 266 (30,43) | ||
| Microcítico | 150 (17,16) | ||
| Indiferenciado | 53 (6,06) | ||
| Células grandes | 25 (2,86) | ||
| Otros | 13 (1,49) | ||
| Diagnóstico clínico | 14 (1,60) | ||
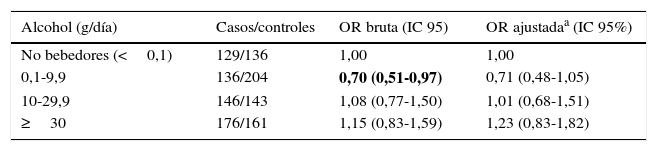
En la tabla 2 se analiza el riesgo de cáncer de pulmón en función del consumo de alcohol. Se observa una tendencia no estadísticamente significativa hacia un efecto protector frente al desarrollo de cáncer de pulmón con un consumo de alcohol de 0,1-9,9g/día (ORajustada=0,71; IC 95% 0,48-1,05).
Consumo de alcohol y riesgo de cáncer de pulmón
| Alcohol (g/día) | Casos/controles | OR bruta (IC 95) | OR ajustadaa (IC 95%) |
|---|---|---|---|
| No bebedores (<0,1) | 129/136 | 1,00 | 1,00 |
| 0,1-9,9 | 136/204 | 0,70 (0,51-0,97) | 0,71 (0,48-1,05) |
| 10-29,9 | 146/143 | 1,08 (0,77-1,50) | 1,01 (0,68-1,51) |
| ≥30 | 176/161 | 1,15 (0,83-1,59) | 1,23 (0,83-1,82) |
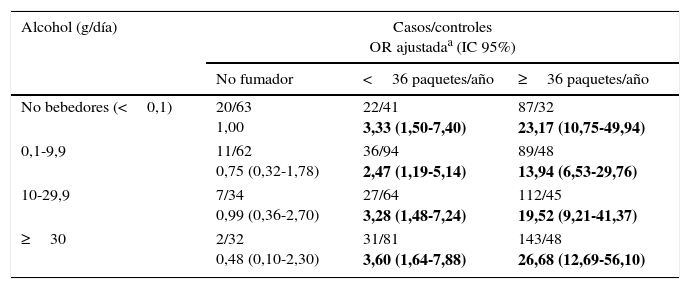
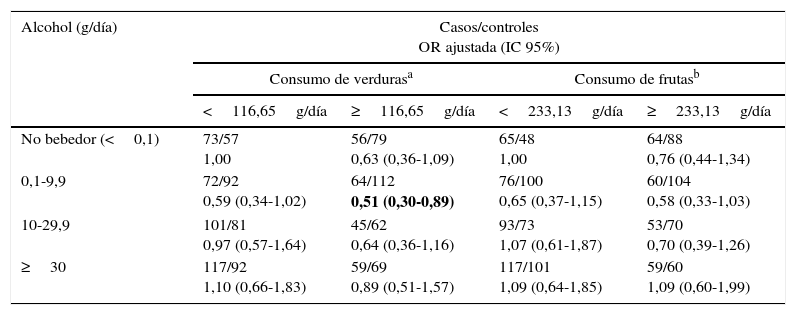
Al analizar el consumo de alcohol y según el consumo de tabaco, se observa una clara modificación de efecto, observando el mayor aumento de riesgo de cáncer de pulmón en individuos en las categorías de mayor consumo de alcohol (≥30g/día) y tabaco (≥36PY), siendo este incremento del riesgo de más de 26 veces (ORajustada=26,68; IC 95% 12,69-56,10) (tabla 3). Por otro lado, al examinar la modificación del efecto del alcohol en el riesgo de cáncer de pulmón según el consumo de verduras y frutas, encontramos que tanto un consumo elevado de verduras (≥116,65g/día) como de frutas (≥233,13g/día) reducen a la mitad el riesgo de cáncer de pulmón para un consumo de alcohol de 0,1-9,9g/día (ORajustada=0,51; IC 95% 0,30-0,89; ORajustada=0,58; IC 95% 0,33-1,03, respectivamente) (tabla 4).
Consumo de alcohol y riesgo de cáncer de pulmón estratificado por tabaco
| Alcohol (g/día) | Casos/controles OR ajustadaa (IC 95%) | ||
|---|---|---|---|
| No fumador | <36 paquetes/año | ≥36 paquetes/año | |
| No bebedores (<0,1) | 20/63 1,00 | 22/41 3,33 (1,50-7,40) | 87/32 23,17 (10,75-49,94) |
| 0,1-9,9 | 11/62 0,75 (0,32-1,78) | 36/94 2,47 (1,19-5,14) | 89/48 13,94 (6,53-29,76) |
| 10-29,9 | 7/34 0,99 (0,36-2,70) | 27/64 3,28 (1,48-7,24) | 112/45 19,52 (9,21-41,37) |
| ≥30 | 2/32 0,48 (0,10-2,30) | 31/81 3,60 (1,64-7,88) | 143/48 26,68 (12,69-56,10) |
Consumo de alcohol y riesgo de cáncer de pulmón estratificado por consumo de verduras y frutas
| Alcohol (g/día) | Casos/controles OR ajustada (IC 95%) | |||
|---|---|---|---|---|
| Consumo de verdurasa | Consumo de frutasb | |||
| <116,65g/día | ≥116,65g/día | <233,13g/día | ≥233,13g/día | |
| No bebedor (<0,1) | 73/57 1,00 | 56/79 0,63 (0,36-1,09) | 65/48 1,00 | 64/88 0,76 (0,44-1,34) |
| 0,1-9,9 | 72/92 0,59 (0,34-1,02) | 64/112 0,51 (0,30-0,89) | 76/100 0,65 (0,37-1,15) | 60/104 0,58 (0,33-1,03) |
| 10-29,9 | 101/81 0,97 (0,57-1,64) | 45/62 0,64 (0,36-1,16) | 93/73 1,07 (0,61-1,87) | 53/70 0,70 (0,39-1,26) |
| ≥30 | 117/92 1,10 (0,66-1,83) | 59/69 0,89 (0,51-1,57) | 117/101 1,09 (0,64-1,85) | 59/60 1,09 (0,60-1,99) |
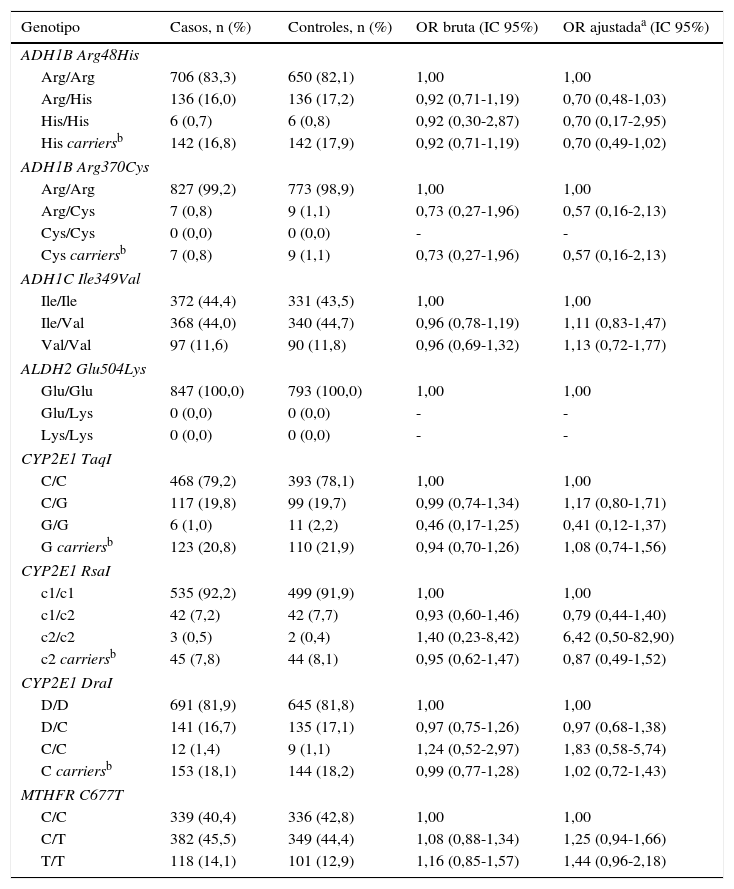
Se determinó la frecuencia de los polimorfismos Arg48His y Arg370Cys en el gen ADH1B, Ile349Val en el gen ADH1C, Glu504Lys en el gen ALDH2, TaqI, RsaI y DraI en el gen CYP2E1 y C677T en el gen MTHFR en los pacientes con cáncer de pulmón y en los controles para evaluar su posible asociación con el riesgo de cáncer de pulmón. La distribución de los genotipos de todos los SNP estudiados fueron consistentes con el equilibrio Hardy-Weinberg, excepto en el caso del polimorfismo Glu504Lys en el gen ALDH2. No se encontró ninguna asociación entre los polimorfismos analizados y el riesgo de cáncer de pulmón. En el caso del polimorfismo Glu504Lys en el gen ALDH2, todos los individuos son homocigotos salvajes Glu/Glu y, por ello, no se han podido hacer más análisis para este polimorfismo (tabla 5).
Genotipos de ADH/ALDH/CYP2E1/MTHFR y riesgo de cáncer de pulmón
| Genotipo | Casos, n (%) | Controles, n (%) | OR bruta (IC 95%) | OR ajustadaa (IC 95%) |
|---|---|---|---|---|
| ADH1B Arg48His | ||||
| Arg/Arg | 706 (83,3) | 650 (82,1) | 1,00 | 1,00 |
| Arg/His | 136 (16,0) | 136 (17,2) | 0,92 (0,71-1,19) | 0,70 (0,48-1,03) |
| His/His | 6 (0,7) | 6 (0,8) | 0,92 (0,30-2,87) | 0,70 (0,17-2,95) |
| His carriersb | 142 (16,8) | 142 (17,9) | 0,92 (0,71-1,19) | 0,70 (0,49-1,02) |
| ADH1B Arg370Cys | ||||
| Arg/Arg | 827 (99,2) | 773 (98,9) | 1,00 | 1,00 |
| Arg/Cys | 7 (0,8) | 9 (1,1) | 0,73 (0,27-1,96) | 0,57 (0,16-2,13) |
| Cys/Cys | 0 (0,0) | 0 (0,0) | - | - |
| Cys carriersb | 7 (0,8) | 9 (1,1) | 0,73 (0,27-1,96) | 0,57 (0,16-2,13) |
| ADH1C Ile349Val | ||||
| Ile/Ile | 372 (44,4) | 331 (43,5) | 1,00 | 1,00 |
| Ile/Val | 368 (44,0) | 340 (44,7) | 0,96 (0,78-1,19) | 1,11 (0,83-1,47) |
| Val/Val | 97 (11,6) | 90 (11,8) | 0,96 (0,69-1,32) | 1,13 (0,72-1,77) |
| ALDH2 Glu504Lys | ||||
| Glu/Glu | 847 (100,0) | 793 (100,0) | 1,00 | 1,00 |
| Glu/Lys | 0 (0,0) | 0 (0,0) | - | - |
| Lys/Lys | 0 (0,0) | 0 (0,0) | - | - |
| CYP2E1 TaqI | ||||
| C/C | 468 (79,2) | 393 (78,1) | 1,00 | 1,00 |
| C/G | 117 (19,8) | 99 (19,7) | 0,99 (0,74-1,34) | 1,17 (0,80-1,71) |
| G/G | 6 (1,0) | 11 (2,2) | 0,46 (0,17-1,25) | 0,41 (0,12-1,37) |
| G carriersb | 123 (20,8) | 110 (21,9) | 0,94 (0,70-1,26) | 1,08 (0,74-1,56) |
| CYP2E1 RsaI | ||||
| c1/c1 | 535 (92,2) | 499 (91,9) | 1,00 | 1,00 |
| c1/c2 | 42 (7,2) | 42 (7,7) | 0,93 (0,60-1,46) | 0,79 (0,44-1,40) |
| c2/c2 | 3 (0,5) | 2 (0,4) | 1,40 (0,23-8,42) | 6,42 (0,50-82,90) |
| c2 carriersb | 45 (7,8) | 44 (8,1) | 0,95 (0,62-1,47) | 0,87 (0,49-1,52) |
| CYP2E1 DraI | ||||
| D/D | 691 (81,9) | 645 (81,8) | 1,00 | 1,00 |
| D/C | 141 (16,7) | 135 (17,1) | 0,97 (0,75-1,26) | 0,97 (0,68-1,38) |
| C/C | 12 (1,4) | 9 (1,1) | 1,24 (0,52-2,97) | 1,83 (0,58-5,74) |
| C carriersb | 153 (18,1) | 144 (18,2) | 0,99 (0,77-1,28) | 1,02 (0,72-1,43) |
| MTHFR C677T | ||||
| C/C | 339 (40,4) | 336 (42,8) | 1,00 | 1,00 |
| C/T | 382 (45,5) | 349 (44,4) | 1,08 (0,88-1,34) | 1,25 (0,94-1,66) |
| T/T | 118 (14,1) | 101 (12,9) | 1,16 (0,85-1,57) | 1,44 (0,96-2,18) |
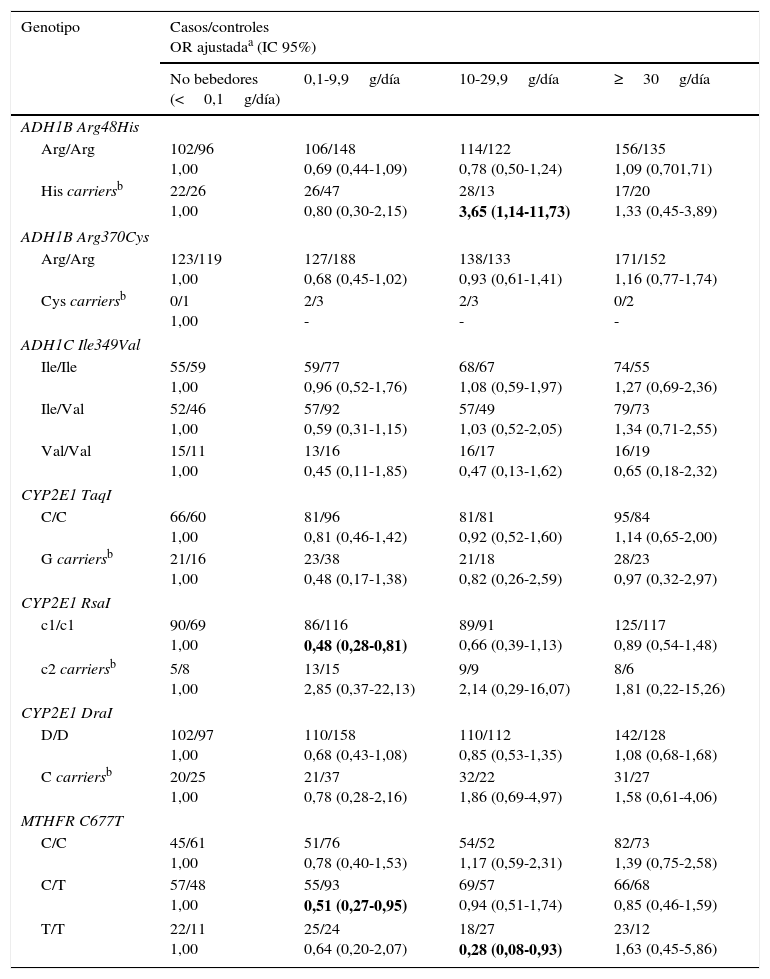
A continuación se analizó la posible modificación que pueden ejercer los polimorfismos estudiados en la asociación del consumo de alcohol y el riesgo de cáncer de pulmón (tabla 6). En el caso del polimorfismo Arg48His en el gen ADH1B, se observa que un consumo de alcohol entre 10-29,9g/día, en individuos portadores del alelo variante His, aumenta el riesgo de cáncer de pulmón en más de 3 veces (ORajustada=3,65; IC 95% 1,14-11,73). Para el polimorfismo RsaI en el gen CYP2E1, se observa que un consumo de alcohol entre 0,1 y 9,9g/día disminuye el riesgo de cáncer de pulmón en individuos con genotipo homocigoto salvaje c1/c1 (ORajustada=0,48; IC 95% 0,28-0,81). Por último, en el polimorfismo C677T en el gen MTHFR se observa que, con un consumo de alcohol de 0,1-9,9g/día, en individuos con genotipo heterocigoto C/T, el riesgo de cáncer de pulmón disminuye (ORajustada=0,51; IC 95% 0,27-0,95); el mismo efecto se observa en individuos con genotipo homocigoto variante T/T con un consumo de alcohol de 10-29,9g/día (ORajustada=0,28; IC 95% 0,08-0,93). Para el resto de los polimorfismos estudiados no se encontró ninguna asociación estadísticamente significativa.
Consumo de alcohol y riesgo de cáncer de pulmón estratificado por genotipos de ADH/ALDH/CYP2E1/MTHFR
| Genotipo | Casos/controles OR ajustadaa (IC 95%) | |||
|---|---|---|---|---|
| No bebedores (<0,1g/día) | 0,1-9,9g/día | 10-29,9g/día | ≥30g/día | |
| ADH1B Arg48His | ||||
| Arg/Arg | 102/96 1,00 | 106/148 0,69 (0,44-1,09) | 114/122 0,78 (0,50-1,24) | 156/135 1,09 (0,701,71) |
| His carriersb | 22/26 1,00 | 26/47 0,80 (0,30-2,15) | 28/13 3,65 (1,14-11,73) | 17/20 1,33 (0,45-3,89) |
| ADH1B Arg370Cys | ||||
| Arg/Arg | 123/119 1,00 | 127/188 0,68 (0,45-1,02) | 138/133 0,93 (0,61-1,41) | 171/152 1,16 (0,77-1,74) |
| Cys carriersb | 0/1 1,00 | 2/3 - | 2/3 - | 0/2 - |
| ADH1C Ile349Val | ||||
| Ile/Ile | 55/59 1,00 | 59/77 0,96 (0,52-1,76) | 68/67 1,08 (0,59-1,97) | 74/55 1,27 (0,69-2,36) |
| Ile/Val | 52/46 1,00 | 57/92 0,59 (0,31-1,15) | 57/49 1,03 (0,52-2,05) | 79/73 1,34 (0,71-2,55) |
| Val/Val | 15/11 1,00 | 13/16 0,45 (0,11-1,85) | 16/17 0,47 (0,13-1,62) | 16/19 0,65 (0,18-2,32) |
| CYP2E1 TaqI | ||||
| C/C | 66/60 1,00 | 81/96 0,81 (0,46-1,42) | 81/81 0,92 (0,52-1,60) | 95/84 1,14 (0,65-2,00) |
| G carriersb | 21/16 1,00 | 23/38 0,48 (0,17-1,38) | 21/18 0,82 (0,26-2,59) | 28/23 0,97 (0,32-2,97) |
| CYP2E1 RsaI | ||||
| c1/c1 | 90/69 1,00 | 86/116 0,48 (0,28-0,81) | 89/91 0,66 (0,39-1,13) | 125/117 0,89 (0,54-1,48) |
| c2 carriersb | 5/8 1,00 | 13/15 2,85 (0,37-22,13) | 9/9 2,14 (0,29-16,07) | 8/6 1,81 (0,22-15,26) |
| CYP2E1 DraI | ||||
| D/D | 102/97 1,00 | 110/158 0,68 (0,43-1,08) | 110/112 0,85 (0,53-1,35) | 142/128 1,08 (0,68-1,68) |
| C carriersb | 20/25 1,00 | 21/37 0,78 (0,28-2,16) | 32/22 1,86 (0,69-4,97) | 31/27 1,58 (0,61-4,06) |
| MTHFR C677T | ||||
| C/C | 45/61 1,00 | 51/76 0,78 (0,40-1,53) | 54/52 1,17 (0,59-2,31) | 82/73 1,39 (0,75-2,58) |
| C/T | 57/48 1,00 | 55/93 0,51 (0,27-0,95) | 69/57 0,94 (0,51-1,74) | 66/68 0,85 (0,46-1,59) |
| T/T | 22/11 1,00 | 25/24 0,64 (0,20-2,07) | 18/27 0,28 (0,08-0,93) | 23/12 1,63 (0,45-5,86) |
Los resultados obtenidos indican un efecto protector a desarrollar cáncer de pulmón en individuos con un consumo de alcohol de 0,1-9,9g/día. Esta misma asociación ha sido observada en otros estudios realizados en poblaciones europeas23,24. Los efectos antiinflamatorios del consumo moderado de alcohol podrían contribuir a este efecto, dado que se ha demostrado que la ingesta moderada de alcohol está relacionada con concentraciones plasmáticas más bajas de distintos marcadores sistémicos de inflamación en comparación con un consumo elevado o no consumo, así como con un daño oxidativo reducido25, y se ha comprobado el papel de los componentes antioxidantes de las bebidas alcohólicas en la promoción y progresión tumoral26. Además, pequeñas cantidades de alcohol podrían ser necesarias para la inducción de las enzimas de protección, tales como las reparadoras de ADN o las detoxificantes de carcinógenos. Por tanto, es posible que los efectos beneficiosos del consumo bajo o moderado de alcohol contrarresten la función de promoción del cáncer del etanol y sus metabolitos.
El tabaco modifica claramente el efecto del alcohol, de forma que los individuos que son grandes fumadores y grandes bebedores tienen un aumento del riesgo de cáncer de pulmón de más de 26 veces. Este efecto podría ser debido a que el alcohol actúa como solvente para los carcinógenos presentes en el tabaco, facilitando su penetración3. Además, el alcohol podría aumentar los efectos carcinogénicos del humo del tabaco en los tejidos a través de la inducción de la actividad de las enzimas citocromo P450, las cuales, a su vez, pueden activar procarcinógenos presentes en las bebidas alcohólicas. La presencia de inductores y de substratos precarcinógenos de la CYP2E1 en el humo del tabaco podría explicar el hecho de que el abuso del alcohol y el tabaquismo interactúan sinérgicamente como factores etiológicos para el cáncer. El aumento del riesgo que observamos en no bebedores refleja el efecto del tabaco en el desarrollo de cáncer de pulmón.
Por otra parte, el consumo de frutas y verduras está relacionado con un menor riesgo de cáncer de pulmón, próstata, vejiga, esófago y estómago. Esto se debe a que son una fuente de sustancias fitoquímicas que tienen muchas propiedades beneficiosas, como su acción antiinflamatoria y antioxidante, la reducción de la toxicidad de las sustancias químicas dañinas, el control de los niveles hormonales y el crecimiento celular27. En este trabajo observamos que un consumo elevado tanto de frutas como de verduras ejerce un efecto protector frente al desarrollo de cáncer de pulmón, evidenciando que un consumo elevado de frutas y verduras podría neutralizar parte del efecto dañino producido por la ingesta de alcohol, poniendo de manifiesto el efecto beneficioso de consumir muchas frutas y verduras en el riesgo de cáncer de pulmón.
La eficiencia en la conversión de etanol a acetaldehído y la posterior oxidación a acetato está determinada principalmente por la actividad de la ADH y ALDH. Además, el consumo crónico de alcohol conduce a la inducción de la CYP2E1 microsomal. El acetaldehído y las ROS producidas por la actividad CYP2E1 producen lesiones en el ADN, que si no son reparadas iniciarían el proceso de la carcinogénesis. Por todo ello, la etiología del cáncer entre los bebedores se ve afectada por diferencias en el metabolismo del etanol derivadas de la existencia de polimorfismos genéticos en estas enzimas.
No encontramos ninguna asociación entre los polimorfismos estudiados y el riesgo de cáncer de pulmón en la población general. Sin embargo, cuando analizamos conjuntamente la asociación de estos polimorfismos junto con el consumo de alcohol y su posible efecto en el desarrollo de cáncer de pulmón, observamos que el alelo variante His, asociado con una mayor velocidad de oxidación del alcohol, del polimorfismo Arg48His ADH1B, aumenta el riesgo de cáncer de pulmón en más de 3 veces cuando el consumo de alcohol es elevado. Esto podría deberse a que al metabolizar el etanol a acetaldehído más rápidamente, estos individuos acumulan una mayor cantidad de acetaldehído en el organismo, por lo que estarían más tiempo expuestos a sus efectos cancerígenos3. En el caso del polimorfismo RsaI en el gen CYP2E1, el efecto protector del alelo c1 observado en individuos con un consumo de alcohol entre 0,1 y 9,9g/día podría deberse al hecho de que este alelo está asociado a una menor actividad transcripcional, menores niveles de proteína y una menor actividad enzimática con respecto al alelo variante c228, por lo que habría una menor activación metabólica de procarcinógenos, una menor producción de ROS, así como de acetaldehído, lo que daría lugar a una menor exposición a compuestos cancerígenos y una menor acumulación de daños en el ADN. Por otra parte, para el polimorfismo C677T en el gen MTHFR, no encontramos una explicación plausible para el menor riesgo observado en individuos con un consumo de alcohol de 10-29,9g/día y con genotipo heterocigoto C/T, así como en individuos con un consumo de alcohol de 10-29,9g/día y con genotipo homocigoto variante T/T, ya que la menor actividad de la enzima MTHFR atribuida al alelo variante T ha sido asociada con una reducción de los niveles de folato en plasma29 y, debido al papel fundamental que desempeña el folato en el suministro de grupos metilo para la síntesis de novo de desoxinucleósidos y para las reacciones de metilación intracelulares30, una menor actividad de la enzima MTHFR conduciría a un desequilibrio en el flujo del metabolismo del folato que podría llevar a daños en el ADN, a una reparación alterada del ADN y a una hipometilación del ADN. Más aún, en este caso se sumaría el efecto antagonista que ejerce el alcohol sobre el folato, por lo que el resultado observado no concuerda con lo esperado desde el punto de vista biológico.
Este estudio tiene varios puntos fuertes, incluyendo la alta participación de los sujetos elegibles (93,31%), un tamaño de muestra razonablemente grande de una población homogénea con ascendencia similar (876 casos y 840 controles), y el hecho de que todos los controles estaban en equilibrio Hardy-Weinberg, excepto para el polimorfismo Glu504Lys en el gen ALDH2. Además, la mayoría de los casos (98%) fueron confirmados histopatológicamente, con la excepción de 15 casos clasificados como cáncer de pulmón en estadio avanzado, sin la necesidad de confirmación patológica. Las principales limitaciones de este estudio son el uso de sujetos hospitalarios, el sesgo de memoria debido a que la información sobre la exposición al tabaco se obtuvo retrospectivamente, y, especialmente, asociaciones que pueden ser falsos positivos. Debido a las múltiples comparaciones hechas, no podemos excluir la posibilidad de que algunas de estas asociaciones puedan deberse al azar. Para minimizar los sesgos de selección, los controles fueron seleccionados cuidadosamente entre pacientes que ingresaron en el mismo hospital de cada caso con diagnósticos no relacionados con las exposiciones de interés. Otra posible limitación es que no podemos excluir la posibilidad de que alguien que ha bebido alcohol previamente se declare a sí mismo como no bebedor. En cualquier caso, estaríamos subestimando el efecto del alcohol y los resultados no estarían invalidados.
Este trabajo representa el primer estudio en España donde los polimorfismos Arg48His y Arg370Cys en el gen ADH2, Ile349Val en el gen ADH3, RsaI, DraI y TaqI en el gen CYP2E1, Glu504Lys en el gen ALDH2 y el polimorfismo C677T en el gen MTHFR, el tabaco, la dieta y el consumo de alcohol se analizan conjuntamente en un esfuerzo para determinar su posible contribución al desarrollo de cáncer de pulmón.
Los resultados muestran un efecto beneficioso de un consumo bajo de alcohol, así como de un consumo elevado de frutas y verduras en el riesgo de cáncer de pulmón. Existe una clara modificación del efecto del alcohol por el tabaco, aumentando el riesgo de esta neoplasia más de 26 veces en individuos que son grandes fumadores y grandes bebedores.
Por otro lado, el alelo variante ADH1B 48His aumenta el riesgo de cáncer de pulmón cuando el consumo de alcohol es elevado. Sin embargo, con un consumo bajo-moderado de alcohol, tanto el alelo variante MTFHR 677T como el alelo salvaje CYP2E1 c1 disminuyen el riesgo. Todo ello indica que el consumo de alcohol está implicado en la susceptibilidad a desarrollar cáncer de pulmón.
FinanciaciónEste trabajo ha sido financiado por el Ministerio de Educación del Gobierno de España (AP2008-04284), Instituto de Salud Carlos III (FISS-PI060604), Fundación para el Fomento en Asturias de la Investigación Científica Aplicada y la Tecnología (FICYT IB09-133), CIBERESP, Obra Social Cajastur/Fundación Liberbank y la Universidad de Oviedo.
AutoríaSara M. Álvarez-Avellón fue responsable de la redacción del borrador inicial del artículo, de la realización de los análisis de laboratorio, la adquisición de datos, la interpretación de los datos, la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta; Ana Fernández-Somoano fue responsable de la adquisición de datos, el análisis estadístico, la redacción del borrador final, la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta; Eva M. Navarrete-Muñoz fue responsable de la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta; Jesús Vioque fue responsable de la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta; Adonina Tardón fue responsable de la concepción y diseño del estudio, de la revisión crítica del contenido intelectual y la aprobación definitiva de la versión que se presenta.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Estamos en deuda con todos los pacientes que han participado en el estudio. Estamos también muy agradecidos al Instituto Universitario de Oncología del Principado de Asturias y al Nodo de Santiago del Centro Nacional de Genotipado.