Actualmente no hay ningún fármaco aprobado para el tratamiento de la COVID-19. Se emplean fármacos de manera empírica según experiencia y disponibilidad, pero no existen estudios controlados que demuestren su eficacia y seguridad. En este contexto, es importante que los médicos dispongan de información de los posibles efectos adversos tanto inmunológicos como no inmunológicos de estos medicamentos. En esta revisión se repasa el fundamento para su uso en la infección por SARS-Cov-2, así como las reacciones adversas más frecuentes; no se trata de una revisión sistemática sino narrativa.
Se han incluido aquellos fármacos que se utilizan con el fin de abordar adecuadamente las dos fases clínicas que parece tener la enfermedad en su manifestación más grave: una primera fase con predominio de infección viral y una segunda fase con predominio de una respuesta inflamatoria. También se han repasado los casos de reacciones a dichos fármacos recogidas en el Programa de Farmacovigilancia del hospital antes del inicio de la pandemia.
Currently, there is no treatment approved for COVID-19. Numerous drugs are being used in an empirical manner according to experience and availability. Studies demonstrating their efficacy and safety are still to be published. Thus, it is of vital importance for healthcare workers to be well informed and updated regarding possible immunological and non-immunological adverse effects regarding such treatments. In this narrative revision, the rationale use of these treatments in the SARS-CoV-2 infection is emphasized as well as their most frequently described adverse drug reactions.
Drugs that are being essayed to counteract both clinical phases that are thought to take place in the severe stage of this disease are included; an initial phase where a viral infection prevails and a second phase where an inflammatory response takes over. Adverse reactions registered in the Pharmacovigilance Program of our hospital before the onset of this pandemic have also been included.
La enfermedad causada por el nuevo Severe Acute Respiratory Syndrome Coronavirus-2 (SARS-CoV-2), Coronavirus Disease 2019 (COVID-19), que se inició en Wuhan (China) en diciembre de 2019, se ha expandido en forma de pandemia global. A fecha 15 de junio 2020, la Organización Mundial de la Salud (OMS) había confirmado 7.823.289 casos y 431.541 defunciones en todo el mundo1. Para la comunidad médica, esta nueva enfermedad representa un reto a la hora de identificar opciones terapéuticas efectivas para su tratamiento y prevención. En el momento actual se usan fármacos de forma empírica según experiencia y disponibilidad, por lo que aún no hay ningún fármaco aprobado para el tratamiento de la COVID-19.
Actualmente hay múltiples ensayos clínicos aleatorizados en marcha y en la práctica clínica se están administrando fármacos muy diversos con el fin de abordar adecuadamente las dos fases clínicas que parece tener la enfermedad en su manifestación más grave: una primera fase con predominio de la infección viral y una segunda fase con predominio de una respuesta inflamatoria que puede producir un síndrome de distrés respiratorio agudo del adulto2.
Es de prever que aunque se aplane la curva de contagios estos seguirán produciéndose en los próximos meses, por lo que el número de pacientes expuestos a todo este arsenal terapéutico seguirá incrementándose y, con ello, aumentará también el número de potenciales reacciones adversas a los medicamentos (RAM) relacionadas con estos tratamientos.
Desde la Unitat d’Al.lergologia y el Servei de Farmacologia Clínica del Hospital Universitari de Bellvitge nos propusimos revisar los principales efectos adversos, tanto de mecanismo inmunológico como no inmunológico, descritos con los fármacos utilizados para el tratamiento específico de la COVID-19, con el objeto de identificarlos tempranamente y abordar su manejo de manera integral. No se han incluido otros fármacos empleados para tratar las posibles comorbilidades derivadas de esta enfermedad (como por ejemplo, los antitrombóticos para tratar la coagulopatía). Para llevar a cabo esta revisión se utilizó una selección de la bibliografía identificada a través de las bases de datos y buscadores PubMed-Medline, que incluye referencias bibliográficas desde 1966 hasta la actualidad, SIETES (www.sietes.org), un sistema de información sobre novedades en farmacología clínica y terapéutica, el recurso clínico UptoDate (https://www.uptodate.com), y la base de datos sobre interacciones farmacológicas Medinteract (https://www.medinteract.net/). Se incluyeron casos o series de casos, estudios observacionales o ensayos clínicos, así como revisiones sistemáticas o narrativas con alguno de los fármacos evaluados. También se recogió información de las fichas técnicas de cada uno de los productos. El resultado de dicha revisión es el objeto del presente trabajo.
A continuación se revisan los principales fármacos propuestos para tratar la COVID-19. Se han considerado los fármacos con actividad antivírica y antiinflamatoria más usados en el standard of care (protocolo establecido) de los distintos hospitales.
Lopinavir/ritonavirAmbos son antirretrovirales de la familia de los inhibidores de la proteasa del Virus de la Inmunodeficiencia Humana (VIH) que se metabolizan a través de la isoforma CYP3A del citocromo P450. Esta inhibición previene la escisión de la poliproteína gag-pol, dando lugar a la producción de un virus inmaduro no infeccioso. El lopinavir proporciona la actividad antiviral mientras que el ritonavir actúa como un potenciador farmacocinético, aumentando la vida media en plasma del primero. Para el lopinavir se ha demostrado actividad inhibitoria in vitro contra el SARS-CoV, el virus que causa Síndrome Agudo Respiratorio Severo (SARS) en humanos3. Aunque algunos estudios con pacientes hospitalizados por neumonía grave por COVID-19 no hayan podido demostrar mejoría clínica significativa con este medicamento4, la combinación de este con otros agentes antivirales, como se ha hecho para SARS3, podría abrir nuevos horizontes terapéuticos.
Se han descrito efectos adversos gastrointestinales hasta en un 28% de los pacientes tratados (diarrea, náuseas y vómitos), dislipemias y alteraciones hepáticas (entre un 2% y un 20%) y pancreáticas4. Con menor frecuencia se han descrito prolongación del segmento QT del electrocardiograma (ECG). Por otra parte, su actividad sobre el citocromo CYP3A comporta un riesgo elevado de interacciones con fármacos que también utilizan esta vía de metabolización. Se recomienda revisar la medicación concomitante y los riesgos asociados a dichas interacciones.
Son conocidos casos de hipersensibilidad por excipientes del fármaco5 y por el fármaco antirretroviral en cuestión. Cabe destacar que la mayoría son pacientes infectados por VIH (más propensos que la población general a sufrir exantemas relacionados con medicamentos) y que las reacciones de hipersensibilidad por inhibidores de las proteasas son anecdóticas, siendo mucho más frecuentes en otras familias dentro de los antirretrovirales, como son los inhibidores de la transcriptasa inversa6. Se han descrito erupciones cutáneas leves, en forma de exantema maculopapular, así como reacciones cutáneas graves.
RemdesivirEs un análogo de nucleótido no autorizado que interfiere con la polimerización del ARN del virus. Se desarrolló inicialmente como tratamiento para la enfermedad del virus del Ébola pero presenta también actividad in vitro frente a otros virus, incluyendo el coronavirus. Algunos estudios demuestran mayor actividad antivírica in vitro combinándolo con interferón-β frente a la combinación de lopinavir/ritonavir7. Se ha publicado un estudio abierto con los primeros pacientes críticos que recibieron el tratamiento por uso compasivo, evidenciándose una mejoría clínica del 68%8. Sin embargo, recientemente, otros estudios no han confirmado esta mejoría pero sí una tendencia a acortar el tiempo en alcanzar una respuesta clínica9. Remdesivir se está evaluando en diversos ensayos clínicos10.
Es un medicamento con un perfil de seguridad aún pendiente de caracterizar. El principal efecto adverso es la hipotensión secundaria a la infusión. Otros posibles efectos adversos afectan al tracto gastrointestinal (náuseas, vómitos, diarrea, estreñimiento, dolor abdominal, etc.)11.
HidroxicloroquinaEs una 4-aminoquinolina similar a la cloroquina. Posee acción antimalárica e inmunosupresora. Como inmunosupresor inhibe la quimiotaxis de eosinófilos, la migración de neutrófilos y disminuye las reacciones antígeno-anticuerpo dependientes del complemento. Se trata de un medicamento inicialmente utilizado como antimalárico que posteriormente se ha empleado para enfermedades autoinmunitarias. Diversos estudios han demostrado la eficacia in vitro de las 4-aminoquinolinas frente a virus, atribuida a diferentes mecanismos, entre ellos el cese de la replicación viral mediante el aumento de pH endosomal que inactiva enzimas indispensables para la misma12. Entre ellas destaca la enzima convertidora de angiotensina-2, utilizada por el SARS-CoV-2 para su entrada en la célula. No obstante, estos efectos han sido muy variables12,13 debido, en parte, a la difícil extrapolación de las concentraciones de cultivo a dosis en humanos14.
La Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)11,15,16 alerta sobre la posibilidad que la hidroxicloroquina pueda prolongar el intervalo QT. Se consideran grupos de riesgo pacientes con síndrome congénito de QT largo, desequilibrio hidroelectrolítico no corregido, cardiopatía o tratamiento simultáneo con medicamentos (como azitromicina) que pueden alargar dicho intervalo. Este riesgo aumenta a dosis altas. Durante el tratamiento, son frecuentes los trastornos digestivos (náuseas, vómitos y diarrea). También se han descrito hipoglucemia, discrasias sanguíneas, cefalea, sordera, acúfenos, alteración de la función hepática y fotosensibilidad. El tratamiento podría exacerbar los cuadros de porfiria, psoriasis y miastenia gravis.
Existen casos de reacciones leves en forma de exantema morbiliforme17, reacciones cutáneas graves como pustulosis exantemática aguda generalizada y síndrome de hipersensibilidad sistémico inducido por fármacos o síndrome DRESS (Drug Rash with Eosinophilia and Systemic Symptoms)18,19 y anafilaxia20.
IvermectinaEs una avermectina, un tipo de antiparasitario semisintético de amplio espectro aislada por fermentación de Streptomyces avermitilis. Las avermectinas se unen a canales de cloro de las células nerviosas y musculares (en microorganismos invertebrados) provocando una parálisis y muerte del parásito.
Originalmente identificada como inhibidor de la interacción entre proteína integrasa (IN) del VIH-1 y el heterodímero importina (IMP) α/β1 responsable de la importación nuclear de IN, también se ha encontrado actividad antiviral in vitro sobre diversos virus21. Estudios sobre el SARS-CoV revelan el papel potencial de IMPα/β1 durante la infección. En definitiva, sugieren que la actividad inhibitoria en el transporte nuclear de ivermectina puede ser efectiva contra el SARS-CoV-2, demostrando in vitro la pérdida del material viral en 48 h con una dosis única21. Estos resultados no han sido trasladados por el momento a la clínica.
Los efectos adversos más frecuentes son fiebre, mialgias, cefalea, prurito y exantema cutáneo, que aparecen habitualmente los primeros días de tratamiento. También se han descrito efectos adversos oculares (uveítis anterior, edema palpebral, conjuntivitis o queratitis), síntomas gastrointestinales, artralgias, somnolencia, o elevaciones transitorias de las transaminasas22. Con menor frecuencia hipotensión ortostática, alteraciones del ECG, taquicardia, etc.
Muy excepcionalmente se han publicado casos de necrólisis epidérmica tóxica23 y síndrome de Stevens-Johnson24 debidos a ivermectina por vía oral.
AzitromicinaEs un azálido, una subclase de los antibióticos macrólidos. Actúa inhibiendo la síntesis de las proteínas bacterianas ARN-dependientes (en organismos sensibles) por unión a la subunidad 50s del ribosoma e inhibiendo la translocación de los péptidos. Los macrólidos tienen actividad antibacterial conocida pero, además, presentan efectos inmunomoduladores, incluyendo potencial antiinflamatorio. Recientemente, su poder antivírico ha cobrado gran interés25. Con respecto a la COVID-19, distintos estudios evalúan el uso de azitromicina sola o en combinación con hidroxicloroquina26,27.
La azitromicina puede provocar efectos adversos gastrointestinales (entre ellos la colitis por Clostridioides difficile es la más grave) y hepatotoxicidad en forma de ictericia colestásica. Debido a su asociación con la prolongación del intervalo QT, se recomienda monitorizar y evitar el uso simultáneo de otros fármacos que puedan prolongar dicho intervalo. Otros efectos adversos descritos son cefaleas, alteraciones auditivas y del equilibrio, trastornos psiquiátricos (agitación y ansiedad), artralgias, nefritis intersticial y erupciones cutáneas11,16.
Las reacciones alérgicas son poco frecuentes en los macrólidos. Los casos de alergia ocurren entre un 0,4 y un 3%28. Sin embargo, sí existen casos tanto de hipersensibilidad inmediata (urticaria, angioedema y anafilaxia), como de hipersensibilidad retardada, con aparición de sintomatología cutánea de gravedad variable29,30.
TocilizumabEs un anticuerpo monoclonal humanizado dirigido contra el receptor de la interleucina 6 (IL-6). La IL-6 es una citocina proinflamatoria que participa en diversos procesos fisiológicos como la activación de los linfocitos T, la inducción de secreción de inmunoglobulina, la inducción de síntesis hepática de proteínas de la fase aguda y la estimulación de la hemopoyesis. Aparece también en la patogenia de enfermedades inflamatorias, osteoporosis y neoplasias. Tocilizumab se une específicamente a los receptores de IL-6, tanto solubles como unidos a membranas (IL-6Rs e IL-6Rm), inhibiendo la activación de los mismos.
Estudios realizados en pacientes fallecidos por SARS y Middle East Respiratory Syndrome (MERS) sugieren que la mortalidad se asocia con una respuesta aberrante del sistema inmunológico, favoreciendo una tormenta de citocinas31. Fu et al.32 evidenciaron un aumento de células Th1 patogénicas, junto con monocitos inflamatorios con sobreexpresión de IL-6, en pacientes con neumonía grave por COVID-19. De esta manera, además del tratamiento estándar propuesto de lopinavir, metilprednisolona, oxigenoterapia y tratamientos sintomáticos, trataron a pacientes críticos con tocilizumab observando una reducción en la mortalidad.
Se han notificado como efectos adversos, infecciones del tracto respiratorio superior, cefalea, hipertensión, neutropenia, trombocitopenia y elevación de la alanina aminotransferasa. Las RAM más graves fueron infecciones graves, complicaciones de diverticulitis y neumonías11,16.
Las reacciones de hipersensibilidad son raras y suelen abarcar desde urticaria retardada generalizada33 hasta anafilaxia34. También hay publicados casos de hipersensibilidad por excipientes del fármaco6.
SarilumabEs un agente inmunosupresor que, al igual que el tocilizumab, actúa inhibiendo los receptores de la IL-6. Además de su uso conocido para artritis reumatoide, se están realizando ensayos clínicos (en fase II/III) para evaluar su eficacia en pacientes con infección grave por COVID-1935, al haberse evidenciado un papel importante de la IL-6 en pacientes con SARS y MERS36.
Las RAM más frecuentes observadas en estudios clínicos fueron neutropenia, trombocitopenia, elevación de las transaminasas, eritema en el lugar de inyección, infecciones del tracto respiratorio superior e infecciones del tracto urinario. Las infecciones graves más frecuentes incluyen la neumonía y la celulitis. También se han notificado casos de infecciones oportunistas16.
BaricitinibEs un inhibidor reversible y selectivo de las cinasas janus tipos 1 y 2 (JAK1 y 2). Estas enzimas transducen señales intracelulares involucradas en la hematopoyesis, inflamación y en la función inmunitaria. Como se ha mencionado anteriormente, el SARS-CoV-2 utiliza a la enzima convertidora de angiotensina para infectar a las células pulmonares12. Por ese motivo, baricitinib se ha propuesto como posible pilar terapéutico de pacientes afectados por SARS-CoV-237, dado que inhibe a la proteína cinasa 1 (AAK1) y a la ciclina cinasa-G (GAK), conocidas como reguladoras de la endocitosis38,39.
Entre los efectos adversos40 destacan infecciones que pueden ser graves, incluidas tuberculosis y herpes zoster. Otros efectos adversos clínicamente relevantes incluyen acontecimientos tromboembólicos, o procesos neoplásicos. También se han descrito alteraciones analíticas como elevación de transaminasas, creatina-cinasa (CK), lípidos, neutropenia, linfopenia o anemia. Las náuseas son frecuentes con el uso de este fármaco.
AnakinraEs un antagonista del receptor humano para la IL-1 producido en células de Escherichia coli por tecnología del ADN recombinante41. La familia de la IL-1 es un grupo de citocinas proinflamatorias, siendo IL-1α e IL-1β las de mayor efecto inflamatorio. Mediante la expresión de integrinas en leucocitos y células endoteliales regulan e inician la respuesta inflamatoria42. Anakinra neutraliza la actividad biológica de IL-1α e IL-1β al inhibir competitivamente su unión al receptor de tipo I.
En combinación con el metotrexato, está indicada para tratar adultos con artritis reumatoide en los que este último, por sí solo, ha sido ineficaz. También está indicada (desde lactantes a partir de los ocho meses), para tratar tanto síndromes periódicos asociados a criopirina como enfermedad de Still, incluida la artritis idiopática juvenil sistémica. Se ha empleado como alternativa a la colchicina en pacientes afectados por la fiebre mediterránea familiar, una enfermedad inflamatoria autosómica recesiva43.
Entre los efectos adversos relevantes destacan las infecciones graves, el daño hepático, la trombocitopenia y la neutropenia (se recomienda no iniciar el tratamiento con recuentos inferiores a < 1,5 × 109/L)44. Debido a su actividad inmunosupresora no se recomienda su uso en pacientes con enfermedad maligna.
Las reacciones en la zona de punción, que consisten en inflamación, eritema, prurito y dolor, suelen ser muy frecuentes en tratamientos biológicos y, en el caso de anakinra, es debido a la gran cantidad de solución proteínica que produce una degranulación mastocitaria local41.
Las reacciones sistémicas suelen ser poco frecuentes con agentes anti-IL-1, pero sí hay casos descritos de hipersensibilidad inmediata45-47.
TacrólimusEs un macrólido aislado de una muestra con bacteria Streptomyces tsukubaensis (Tsukuba macrolide immunosuppressant). Inhibe las vías de transducción de señal en linfocitos T mediante la inhibición de la calcineurina, impidiendo así la transcripción de múltiples genes relacionados con citocinas proinflamatorias, entre ellas la IL-2, así como interferones de tipo 1, disminuyendo la actividad de los linfocitos T48.
Actualmente se están realizando ensayos clínicos en la neumonía grave por SARS-CoV-2. Su posible eficacia se basa en la capacidad de contrarrestar la inflamación excesiva provocada por la tormenta de citocinas proinflamatorias49,50.
Se trata de un fármaco que requiere vigilancia de sus concentraciones en sangre. Los efectos adversos más frecuentes son de neuro y nefrotoxicidad48. La nefrotoxicidad puede presentarse de forma aguda por un mecanismo prerrenal, con alteración del filtrado glomerular, o bien en su forma crónica, con lesiones arteriolares y fibrosis intersticial. Los efectos neurológicos incluyen temblor, parestesias, cefaleas, depresión, confusión o insomnio. También se han descrito hipertensión arterial, complicaciones dermatológicas, hiperplasia gingival, cuadros gastrointestinales o intolerancia a la glucosa51. Por su efecto inmunosupresor se puede asociar con infecciones por gérmenes oportunistas o a la reactivación de infecciones latentes. También se le ha atribuido efectos metabólicos, como diabetes, y hematológicos como anemia y leucopenia.
Son conocidos los casos de hipersensibilidad por excipientes del fármaco6 y por el fármaco en cuestión. Aunque se ha sugerido una posible reactividad cruzada entre macrólidos y tacrólimus, los casos publicados son aislados52.
CiclosporinaEs un péptido producido por el hongo Tolypocladium inflatum con actividad inmunosupresora. Impide la transcripción de genes relacionados con citocinas proinflamatorias al inhibir la actividad de la calcineurina. También actúa sobre las mitocondrias, inhibiendo su apoptosis. Por los mismos motivos que el tacrólimus, este medicamento podría ser de utilidad para la infección por SARS-CoV-2. Al mismo tiempo, algunos artículos sugieren que la combinación del mismo con interferon-α-1 podría suponer una actividad sinérgica antiviral efectiva53.
Se trata de un fármaco que requiere vigilancia de sus concentraciones en sangre. Entre sus efectos adversos la nefrotoxicidad es frecuente y dependiente de dosis. También se han descrito hipertensión arterial (asociada a un aumento de las resistencias vasculares periféricas) y alteraciones lipídicas54. Por su efecto inmunosupresor se puede asociar con infecciones sistémicas o localizadas, sobre todo por gérmenes oportunistas o a la reactivación de infecciones latentes51. Debido a que la ciclosporina se elimina en parte a través de las glándulas sebáceas, se han descrito lesiones pilosebáceas en forma de hipertricosis. Otros efectos adversos incluyen hipertrofia gingival, hipomagnesemia, hiperpotasemia o hiperuricemia. Se recomienda, además, tener precaución con productos que contienen Hypericum perforatum (hierba de San Juan) al poder disminuir las concentraciones en sangre de la ciclosporina. Se han publicado casos de hipersensibilidad por excipientes del fármaco6.
GlucocorticoidesSon sustancias químicas producidas en el córtex suprarrenal que derivan del colesterol. La indicación en COVID-19 vendría determinada por su capacidad para disminuir la respuesta inflamatoria en el pulmón. Aunque, según la OMS, por el momento no estarían indicados de rutina salvo que existiera concomitantemente una exacerbación de EPOC o shock refractario55, diferentes estudios apuntan a que pueden ser una buena estrategia en forma de pulsos y durante el menor tiempo posible. Recientemente, los investigadores del ensayo clínico Randomised Evaluation of COVid-19 thERapY (RECOVERY), que incluye a más de 11.500 pacientes infectados por COVID-19 en el Reino Unido, han comunicado que la dexametasona ha disminuido las muertes en un tercio de los pacientes con ventilación mecánica asistida y en un quinto en los pacientes con uso de oxígeno únicamente56. Estos resultados, afirman, se publicarán próximamente.
Los ampliamente conocidos efectos secundarios de los glucocorticoides son básicamente efectos no deseados de su propia acción glucocorticoide o de la inhibición del eje hipotálamo-hipófisis-suprarrenal.
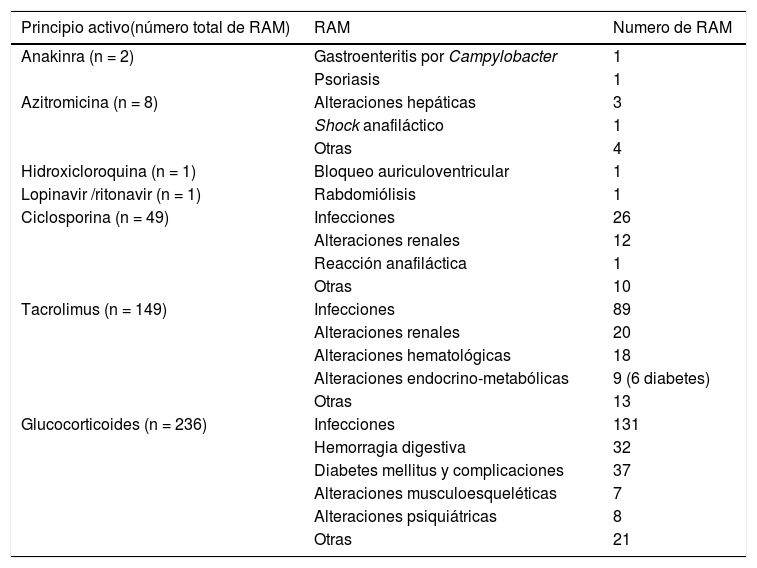
Principales reacciones adversas medicamentosas atribuibles a estos fármacosEn la tabla 1 se detallan las sospechas de RAM registradas en el Programa de Farmacovigilancia (PFV) del Hospital Universitari de Bellvitge57. Se han revisado las sospechas de RAM causantes de ingreso entre los pacientes atendidos en urgencias y las notificaciones espontáneas realizadas por el personal sanitario del hospital desde 2007 hasta 2020. Los glucocorticoides son los fármacos con más RAM notificadas, seguidos de tacrólimus, ciclosporina y azitromicina, mientras que para anakinra, hidroxicloroquina y lopinavir/ritonavir son escasas. De otros fármacos que se están empleando en la COVID-19, como ivermectina, sarilumab, remdesivir, baricitinib o tocilizumab, todavía no hay ninguna sospecha notificada de RAM.
Principales reacciones adversas según el Programa de Farmacovigilancia del Hospital Universitari de Bellvitge57
| Principio activo(número total de RAM) | RAM | Numero de RAM |
|---|---|---|
| Anakinra (n = 2) | Gastroenteritis por Campylobacter | 1 |
| Psoriasis | 1 | |
| Azitromicina (n = 8) | Alteraciones hepáticas | 3 |
| Shock anafiláctico | 1 | |
| Otras | 4 | |
| Hidroxicloroquina (n = 1) | Bloqueo auriculoventricular | 1 |
| Lopinavir /ritonavir (n = 1) | Rabdomiólisis | 1 |
| Ciclosporina (n = 49) | Infecciones | 26 |
| Alteraciones renales | 12 | |
| Reacción anafiláctica | 1 | |
| Otras | 10 | |
| Tacrolimus (n = 149) | Infecciones | 89 |
| Alteraciones renales | 20 | |
| Alteraciones hematológicas | 18 | |
| Alteraciones endocrino-metabólicas | 9 (6 diabetes) | |
| Otras | 13 | |
| Glucocorticoides (n = 236) | Infecciones | 131 |
| Hemorragia digestiva | 32 | |
| Diabetes mellitus y complicaciones | 37 | |
| Alteraciones musculoesqueléticas | 7 | |
| Alteraciones psiquiátricas | 8 | |
| Otras | 21 |
Esta revisión tiene algunas limitaciones. El número de artículos publicados en las últimas semanas y la velocidad con que se publican implica que las recomendaciones, e incluso fármacos ensayados, vayan modificándose constantemente, por lo que es probable que algunos no aparezcan en esta revisión. Los efectos adversos descritos aparecen en las bases de datos revisadas, pero es posible que ciertas reacciones adversas no hayan sido comunicadas o publicadas.
ConclusionesHasta la fecha, ningún tratamiento ha demostrado de manera concluyente que mejore el pronóstico de los pacientes con COVID-19. Por el momento, la mayor parte de los trabajos publicados son estudios observacionales pequeños o series de casos, sin aleatorización ni grupo control. Algunos fármacos han mostrado actividad in vitro, pero no están claros sus potenciales beneficios clínicos. En la actualidad se están llevando a cabo múltiples ensayos clínicos aleatorizados controlados que se espera que aporten próximamente mayor evidencia terapéutica, es de prever que un mejor conocimiento de los mecanismos de acción del virus sugiera nuevas líneas de tratamiento.
En cualquier caso, estas estrategias de tratamiento deberían basarse en la consideración de que el beneficio supere los riesgos asociados de posibles reacciones adversas, por lo que es preciso una individualización terapéutica que tenga en cuenta el riesgo de toxicidad y la relación beneficio-riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
En representación del Grup de Treball Al.lergologia-Farmacologia Clínica Hospital Universitari de Bellvitge. El Grupo está integrado por: Valeria Herrera-Lasso Regás, María Teresa Dordal Culla, Ramón Lleonart Bellfill, Jaume Martí-Garrido, Dolors Rodríguez Cumplido, Paula Vázquez Revuelta, Roser Llop Rius.