El objetivo de este proyecto fue adaptar la primera guía de práctica clínica en la hipofosfatemia ligada al cromosoma X (XLH) aparecida en 2019 a nuestro medio siguiendo un proceso sistemático basado en el método ADAPTE.
Materiales y métodosLa adaptación de las guías a nuestro ámbito de aplicación e implementación se llevó a cabo en 3 fases —puesta en marcha, adaptación y finalización— mediante un grupo de expertos implicados en el manejo de los pacientes con XLH.
ResultadosSiguiendo la guía original, se presentan las recomendaciones acordadas por el grupo elaborador de las guías para el diagnóstico, la frecuencia y el ámbito de las visitas y el seguimiento específico en niños y adultos. Por otro lado, se establecen las recomendaciones para ambas franjas de edad con tratamiento convencional, así como con burosumab en niños o adultos y las relacionadas al controvertido uso de hormona de crecimiento en niños. También se proponen sugerencias en cuanto al seguimiento y al manejo de las alteraciones del aparato locomotor y tratamiento ortopédico en niños, la salud dental y la audición y las complicaciones neuroquirúrgicas. Por último, se plantean una serie de cuestiones y áreas en las que profundizar en una posible investigación futura.
ConclusionesEstas recomendaciones constituyen la adaptación sistemática a nuestro medio de la primera guía de práctica clínica basada en la evidencia para el diagnóstico y el manejo de la XLH, y esperamos que pueda contribuir al manejo adecuado de la enfermedad.
The objective of this project was to adapt to our setting following a systematic process based on the ADAPTE method the first clinical practice guidelines on X-linked hypophosphatemia (XLH) that were published in 2019.
Materials and methodsThe adaptation of the guidelines to our application and implementation setting was carried out in three phases —start-up, adaptation, and finalization— by a group of experts involved in the management of patients with XLH.
ResultsFollowing the original guide, the recommendations agreed by the group that elaborated the guidelines for diagnosis, frequency and scope of visits and specific follow-up in children and adults are presented. On the other hand, recommendations are established for both age groups with conventional treatment, as well as with burosumab in children or adults and those related to the controversial use of growth hormone in children. Suggestions are also proposed regarding the monitoring and management of musculoskeletal disorders and orthopedic treatment in children, dental health and hearing, and neurosurgical complications. Finally, a series of questions and areas are raised in order to deepen the possible future investigation.
ConclusionsThese recommendations constitute the systematic adaptation to our setting of the first evidence-based clinical practice guide for the diagnosis and management of XLH and we hope that they can contribute to the adequate management of the disease.
La hipofosfatemia ligada al cromosoma X (XLH) o raquitismo hipofosfatémico es una enfermedad hereditaria dominante del metabolismo del fosfato caracterizada por una mutación en el gen de la endopeptidasa neutra reguladora de fosfato (PHEX) que se expresa predominantemente en osteoblastos, osteocitos y odontoblastos1. Aunque son infrecuentes, existen casos de XLH sin antecedentes familiares que se producen por una mutación de novo del gen responsable de la enfermedad1. Las mutaciones en el gen PHEX dan lugar a un aumento de la concentración del factor de crecimiento de fibroblastos 23 (FGF-23), que regula la reabsorción de fosfato en los riñones y se considera potencialmente implicado en muchas de las manifestaciones de la XLH2.
La XLH tiene una incidencia de 3,9 casos por cada 100.000 nacidos vivos y una prevalencia que varía entre 1,7 por 100.000 niños y 4,8 por 100.000 en niños y adultos3. Un estudio reciente realizado en el Reino Unido muestra que, en ese país, entre 1995 y 2016, la prevalencia ha ido en aumento, posiblemente como consecuencia de una mejoría en la práctica clínica y el diagnóstico4. Las manifestaciones clínicas de la enfermedad varían mucho, desde casos donde no existe más que una hipofosfatemia sin síntomas óseos asociados, a casos con sintomatología grave1. Las manifestaciones clínicas más habituales son retraso del crecimiento y alteraciones de la marcha, la denominada marcha de pato, deformidades de la rodilla como el genu varum, raquitismo, dolor óseo, desarrollo dental anormal y aparición de abscesos dentales espontáneos, pérdida auditiva, entesopatía y artrosis asociadas a deformidades de extremidades inferiores y columna1,5,6. El diagnóstico se realiza en función del examen físico, las pruebas de laboratorio, las pruebas de imagen y los antecedentes familiares; el análisis genético puede confirmar el diagnóstico si se identifica la mutación, pero no es estrictamente necesario para el diagnóstico1.
El tratamiento convencional, no curativo, consiste en la administración oral de fosfato en combinación con calcitriol o alfacalcidol, siendo en muchos casos necesaria la cirugía correctiva de las deformidades óseas, tratamientos dentales o incluso la administración de hormona del crecimiento7,8. La enfermedad se asocia a un importante deterioro de la calidad de vida tanto en niños como en adultos, en el que juegan un papel primordial las alteraciones estructurales9, asociadas a dolor y limitación funcional que persiste a pesar del tratamiento10. Aunque los estudios al respecto son escasos, los pacientes con XLH parecen mostrar un aumento de la mortalidad11. Muy recientemente se ha incorporado al arsenal terapéutico para el manejo de esta enfermedad el burosumab, un anticuerpo monoclonal humano que tiene como diana el FGF-23 y que ha demostrado su eficacia en esta enfermedad, mejorando la clínica del raquitismo evaluada mediante la puntuación de gravedad del raquitismo (RSS) o la impresión global del cambio radiográfico, el crecimiento y las alteraciones bioquímicas respecto al tratamiento convencional12–17.
Desde hace bastante tiempo tanto clínicos como pacientes han expresado su preocupación por la falta de información sobre esta enfermedad, y la ausencia de guías de práctica clínica, situación que ha dado lugar a problemas en el diagnóstico y en el tratamiento de la misma18. A pesar de intentos individuales de algunos autores por sistematizar el manejo de la enfermedad8,18, no ha sido hasta el año 2019 en el que se publica la primera guía de práctica clínica basada en la evidencia para el diagnóstico y el manejo de la XLH3. En nuestro medio, no existe ninguna recomendación publicada al respecto. Por este motivo, se estableció un comité de expertos con experiencia en el diagnóstico y el tratamiento de esta entidad para adaptar esta primera guía del 2019 a nuestro medio siguiendo un proceso sistemático basado en el método ADAPTE. El proyecto ha sido avalado por la Asociación Española de Nefrología Pediátrica (AENP), por la Asociación Española para el Estudio de los Errores Congénitos del Metabolismo (AECOM), por la Sociedad Española de Endocrinología Pediátrica (SEEP) y por la Sociedad Española de Investigación Ósea y Metabolismo Mineral (SEIOMM).
MétodosEl método ADAPTE fue propuesto como una alternativa para mejorar la eficiencia en el desarrollo de guías de práctica clínica, evitando la inversión de grandes recursos en la realización de nuevas guías cuando ya existen guías desarrolladas adecuadamente en otros medios por diferentes organizaciones para un mismo problema de salud19.
El proceso de adaptación sigue una sistemática bien establecida que tiene como objetivo refrendar las recomendaciones ya existentes de otras guías o modificarlas para adaptarlas a un ámbito de aplicación e implementación diferente al original donde se desarrollaron las guías fuente. La adaptación se lleva a cabo en 3 fases19: 1) fase de puesta en marcha, consistente en la identificación de las habilidades y recursos necesarios para llevar a cabo el proceso, con objeto de determinar si la adaptación es factible; 2) fase de adaptación, en la que se identifican las cuestiones específicas, se buscan y recuperan las guías, se valora la calidad de las guías, su grado de actualización, contenido y aplicabilidad, se toman las decisiones sobre la adaptación y se prepara un borrador de la guía adaptada, y 3) fase de finalización, en la que se puede obtener la opinión de los decisores sobre los que impactará la guía, se establece un proceso de revisión y actualización de las guía adaptada, y se crea el documento final. El procedimiento completo de desarrollo de guías siguiendo el proceso ADAPTE puede consultarse en otros sitios19.
Fase de puesta en marchaEl proyecto fue llevado a cabo por un grupo de expertos implicados en el manejo de los pacientes con XLH e incluyeron una experta en endocrinología pediátrica (SMB), un endocrinólogo experto en metabolismo óseo (GM), 2 expertos en nefrología pediátrica (DG-L y MIY), una reumatóloga experta en enfermedad metabólica ósea (PP) y una experta en odontología pediátrica (AL). Estos profesionales se constituyeron como grupo elaborador de la guía (GEG) y en una primera reunión establecieron el plan de trabajo para la elaboración de la guía con la ayuda de un colaborador externo experto en metodología de la investigación (FR-V, ver agradecimientos).
Fase de adaptaciónBúsqueda, cribado y evaluación de las guíasDada la existencia de una sola guía basada en la evidencia, las «Clinical practice recommendations for the diagnosis and management of X- linked hypophosphataemia», esta fase se limitó a una evaluación inicial del interés de estas guías para los profesionales de nuestro medio que fue discutida en la primera reunión anteriormente mencionada.
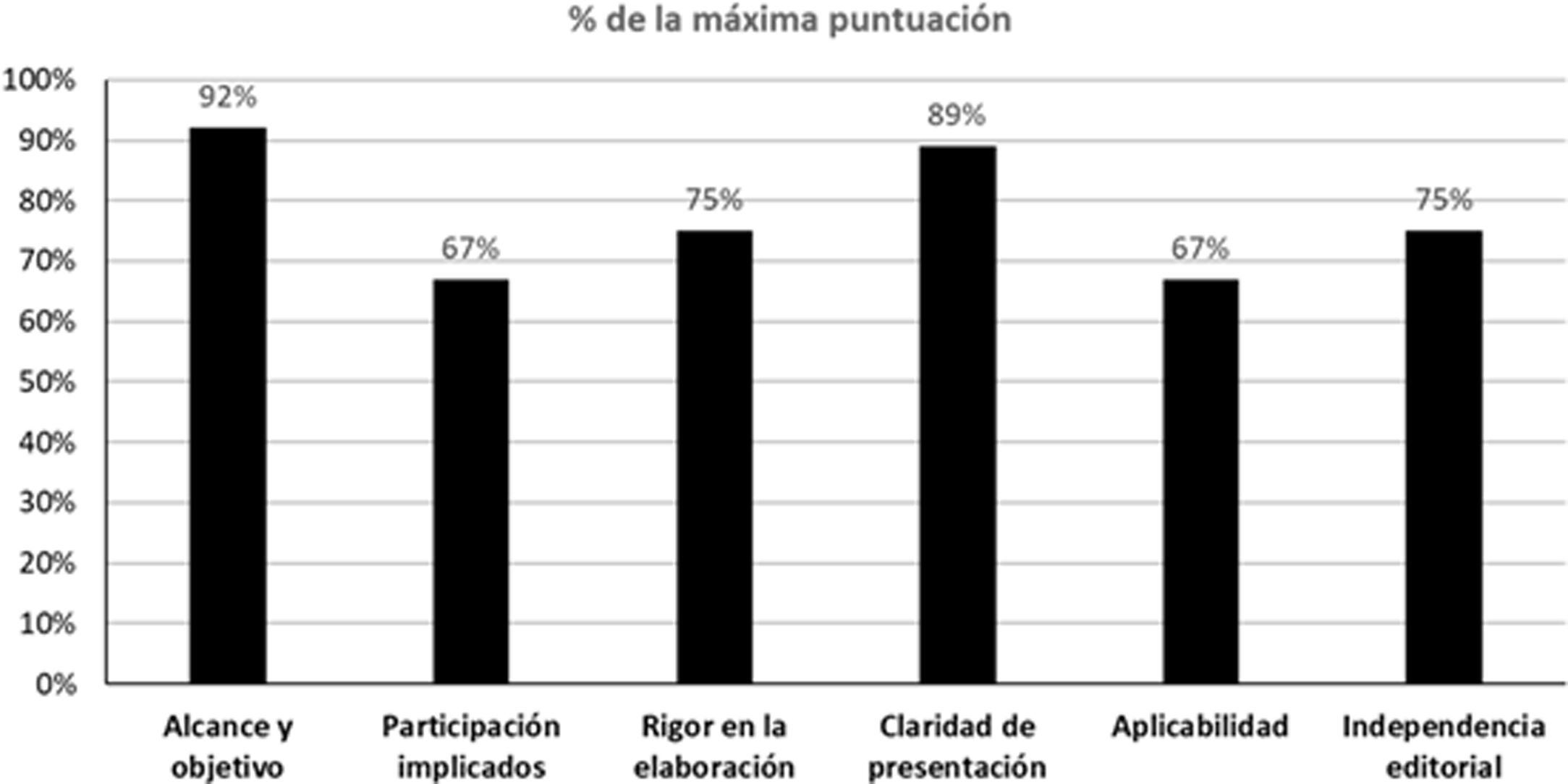
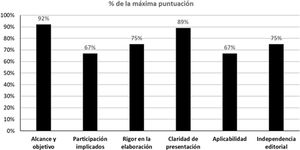
Además, 2 miembros del GEG realizaron una evaluación de la calidad de esta guía utilizando la herramienta denominada Appraisal of Guidelines for Research and Evaluation II (AGREE II)20. El AGREE II es una herramienta que evalúa el proceso de desarrollo y comunicación de la guía. Consta de 23 ítems que evalúan el grado de acuerdo en una escala de tipo likert de 7 puntos, de uno muy en desacuerdo a 7 muy de acuerdo. El instrumento evalúa 6 dimensiones: alcance y objetivo, participación de los implicados, rigor en la elaboración, claridad en la presentación, aplicabilidad e independencia editorial. Además, se incluye una evaluación global de la calidad de la guía que también se responde en una escala likert de 7 puntos (de uno «la calidad más baja posible» a 7 «la calidad más alta posible»), y los evaluadores tienen que responder a la siguiente pregunta «¿Recomendaría esta guía para su uso?» con 3 alternativas de respuesta (esto es, sí, sí con modificaciones o no). Para el entrenamiento previo a la evaluación, los evaluadores utilizaron los videos de entrenamiento y el manual explicativo del instrumento disponibles en el AGREE II (Disponible en: https://www.agreetrust.org/). El cálculo de la puntuación agregada de los 2 evaluadores se realizó de acuerdo a las instrucciones que acompañan al instrumento. Los resultados globales de la evaluación de la guía se presentan en la figura 1. La concordancia entre evaluadores no fue elevada, con un coeficiente de correlación intraclase de 0,42 (tabla suplementaria 1). Sin embargo, ambos evaluadores coincidieron en evaluar la calidad global de la guía con una puntuación de 6 en la escala Likert de 7 puntos, y ambos coincidieron en recomendar la guía para su uso.
Selección y elaboración de las recomendacionesCon objeto de disponer de información actualizada sobre el manejo de la XLH, se realizó una actualización de la búsqueda bibliográfica de la guía original. Para ello, al igual que la guía original, se realizó una búsqueda en PubMed desde el 26 de junio de 2018 al 24 de julio de 2019 utilizando una estrategia de búsqueda algo más amplia en sus términos que la del artículo original (cuadro suplementario 1). La nueva búsqueda arrojó 82 registros que fueron distribuidos entre todos los miembros del GEG.
Todas las recomendaciones de la guía original fueron recogidas en inglés en una tabla siguiendo la misma estructura de temas que la guía. Esta tabla fue distribuida entre todos los miembros del GEG para que revisaran las recomendaciones y señalaran individualmente si estaban de acuerdo con las mismas tal cual estaban formuladas, si requerían alguna modificación y, en caso afirmativo, el motivo de dicha modificación; si consideraban que por su experiencia o especialidad no podían valorar una determinada recomendación, la señalaban como no evaluable. Las evaluaciones individuales de todos los evaluadores se recogieron en una única tabla que fue revisada y discutida por todos los evaluadores en 2 teleconferencias para alcanzar un acuerdo global del GEG sobre cada una de las recomendaciones en las que alguno de los evaluadores había indicado que requería alguna modificación o había incluido algún comentario sobre alguna recomendación; las recomendaciones en las que existía consenso de todos los evaluadores en aceptarlas sin modificación no fueron discutidas y se consideraron aceptadas. Una vez acordadas las modificaciones o comentarios a añadir respecto a aquellas recomendaciones que así lo requirieron, se realizó una traducción al español de las recomendaciones. Esta traducción fue revisada por todos los miembros del GEG y discutida en una nueva teleconferencia. Por último, se produjo un documento final que incluyó la recomendación original en inglés, la traducción al español, si requirió o no modificación, la recomendación modificada y la razón de ser de la modificación (tabla suplementaria 2).
Fase de finalizaciónTras la publicación de la guía cualquier lector interesado en el tema puede enviar sus comentarios al autor para correspondencia para ser tenidas en cuenta en futuras actualizaciones de la misma.
Niveles de evidenciaLos niveles de evidencia que se incluyen con las recomendaciones son los comunicados en la guía original y que se basan en los utilizados por la American Academy of Pediatrics en sus guías21 (cuadro suplementario 2).
ResultadosRecomendaciones para el diagnóstico (tabla 1)De acuerdo con la guía, el diagnóstico se establece mediante la evaluación clínica, radiológica y bioquímica, aunque se recomienda su confirmación mediante un análisis genético del gen PHEX en niños y adultos si es posible. La determinación de FGF-23 puede ser útil para apoyar el diagnóstico, pero se debe tener en cuenta que unos niveles normales no excluyen el diagnóstico23, y que el tratamiento convencional con fosfato y vitamina D puede alterar los niveles de FGF-2323,24.
Recomendaciones para el diagnóstico
| - En niños, se debe plantear un diagnóstico de XLH en presencia de signos clínicos y/o radiológicos de raquitismo, disminución de la velocidad de crecimiento y niveles séricos de fosfato por debajo de los valores de referencia ajustados a la edad, asociado con una pérdida renal de fosfato y sin deficiencia de vitamina D o de calcio (grado B, recomendación moderada) |
| - En adultos, se debe plantear el diagnóstico de XLH en presencia o con antecedentes de deformidades en las extremidades inferiores, y/o signos clínicos y/o radiológicos de osteomalacia (incluyendo pseudofracturas, artrosis precoz y entesopatías) en el contexto de unos niveles séricos de fosfato por debajo de los valores de referencia ajustados a la edad asociado con una pérdida renal de fosfato (grado B, recomendación moderada) |
| - Recomendamos que se investigue la presencia de XLH en cualquier miembro de la familia de primera generación de un paciente con XLH (grado D, recomendación débil); los hijos varones de hombres afectos por XLH no están en riesgo |
| - Recomendamos llevar a cabo los siguientes procedimientos diagnósticos iniciales (grado B, recomendación moderada): |
| • Una evaluación clínica detallada, incluyendo evidencia de raquitismo, retraso del crecimiento, anomalías dentales y signos de craneosinostosis y/o hipertensión intracraneal mediante fondo de ojoa |
| • Una evaluación radiológica para diagnosticar y evaluar el grado de raquitismo (puntuación de gravedad del raquitismo [RSS]) y las lesiones por osteomalaciaa |
| • Pruebas bioquímicas que incluyan los niveles séricos de fosfato, calcio, fosfatasa alcalina, hormona paratiroidea, 25(OH) vitamina D, 1,25(OH)2 vitamina D, FGF-23 intacto, y creatinina, así como los niveles urinarios de calcio, fosfato y creatinina a partir de una muestra puntual de orina para el cálculo de la reabsorción tubular de fosfato (TRP)by de los índices urinarios de calcio:creatinina y fosfato:creatininaa |
| - Recomendamos que se excluya la pérdida tubular renal de fosfato no selectiva (lo que sugiere un síndrome de Fanconi renal) buscando pérdidas anómalas de bicarbonato, aminoácidos, glucosa y/o ácido úrico en las muestras de orina y proteinuria de bajo peso molecular (grado B, recomendación moderada) |
| - Recomendamos confirmar el diagnóstico clínico de XLH mediante un análisis genético del gen PHEX en niños y adultos si es posible (grado B, recomendación moderada) |
| - Si no se dispone de análisis genético, unos niveles plasmáticos elevados del FGF-23 intacto y/o antecedentes familiares positivos de XLH apoyan el diagnóstico (grado C, recomendación moderada) |
| - Recomendamos tener en cuenta otras causas de hipofosfatemia hereditaria o adquirida si el análisis del gen PHEX produce un resultado negativo para XLH (grado B, recomendación moderada) |
| - Recomendamos que se ofrezca asesoramiento genético a los pacientes con XLH, especialmente en la transición de la atención infantil a la adulta, así como a las familias que estén planeando un embarazo (grado C, recomendación moderada) |
| - Los métodos para detectar las mutaciones de PHEX se pueden aplicar al diagnóstico genético preimplantacional o al diagnóstico prenatal.Sin embargo, las recomendaciones deben adaptarse a las normas éticas y jurídicas específicas de cada país y comunicarse utilizando el asesoramiento genético adecuado (grado D, recomendación débil) |
| - Recomendamos realizar otras pruebas después del diagnóstico, incluidas las investigaciones destinadas a diagnosticar la presencia y la gravedad de complicaciones comunes y poco frecuentes resumidas en latabla 2(grado C, recomendación moderada) |
| - Antes de la transición a la atención adulta sugerimos realizar un ecocardiograma para evaluar el estado cardiovasculara |
Recomendaciones que han sufrido alguna modificación respecto a la original. La modificación, cuando se trata de una modificación del texto, aparece subrayada; la eliminación del texto no aparece reflejada en la tabla y se comenta en el texto explicativo.
La reabsorción tubular de fosfato se calcula como TRP=1-[PO4 (U)×Cr (S)]/[PO4 (S)×Cr (U)]; donde Cr, creatinina; S, suero; O, orina; PO4, fosfato1,22.
Entre las pruebas bioquímicas hemos incluido la razón fosfato:creatinina en orina aislada. La excreción de fosfato en orina de 24h (24h UPE) es considerado el estándar para valorar la ingesta de fosfato. En niños pequeños la razón fosfato:creatinina en orina aislada es potencialmente intercambiable con la muestra de orina de 24h25. Y en niños pequeños cualquier índice urinario obtenido de una orina aislada tiene más valor clínico que la orina de 24h26.
Además de las evaluaciones previamente recomendadas por parte de la guía original, el GEG sugiere la realización de un ecocardiograma en el momento de la transición a la atención adulta, dadas las posibles alteraciones cardiovasculares que pueden presentar estos pacientes. Entre las morbilidades asociadas a la XLH y las relacionadas de algún modo con el FGF-23 se ha señalado la posible presencia de calcificación cardiovascular e hipertensión2. Además, algunos estudios indican que cerca de un 20% de los sujetos con XLH presentan resultados ecocardiográficos sugerentes de una hipertrofia ventricular izquierda27. Otros autores, en series de casos, han encontrado también hipertrofia ventricular izquierda y alteraciones de la presión arterial, y sugieren que se debe realizar un seguimiento estrecho de estos pacientes para valorar el desarrollo de estas dos alteraciones28. De forma más general, también se ha señalado que al cribado de las alteraciones renales, reumatológicas, dentales y neuroquirúrgicas, debe añadirse el de las alteraciones cardiovasculares29.
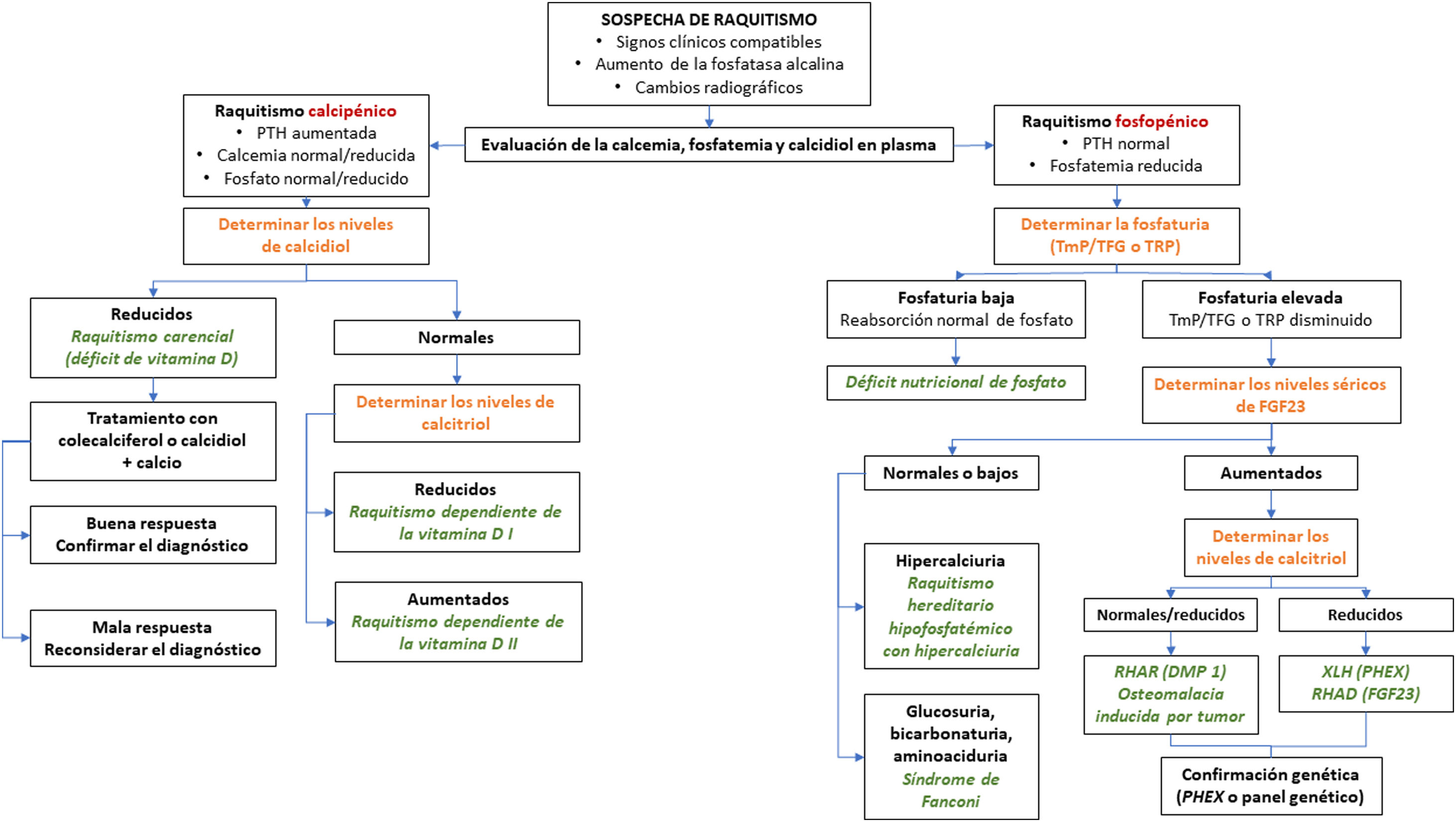
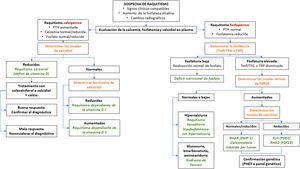
En el algoritmo de la figura 2 se resume el manejo diagnóstico de la XLH.
Algoritmo diagnóstico del raquitismo.
FGF-23: factor de crecimiento de fibroblasto 23; PTH: hormona parotiroidea; RHAD: raquitismo hipofosfatémico autosómico dominante; RHAR: raquitismo hipofosfatémico autosómico recesivo; TFG: tasa de filtrado glomerular; TmP: reabsorción tubular máxima de fosfato; XLH: raquitismo hipofosfatémico ligado al cromosoma X.
Fuente: Traducido y adaptado con permiso de Springer Nature Customer Service Centre GmbH: Adis, Advances in Therapy. González-Lamuño D45. ©Springer Healthcare Ltd., part of Springer Nature 2020.
A continuación, se hacen recomendaciones generales para el seguimiento tanto de niños como de pacientes adultos (tablas 3–5). No obstante, se debe tener en cuenta que las manifestaciones y las complicaciones de la enfermedad varían mucho de un paciente a otro, por lo que el seguimiento debe individualizarse en función de sus antecedentes médicos, sus manifestaciones clínicas, el estadio de desarrollo y el juicio del médico.
Evaluación inicial de las complicaciones frecuentes y raras de la XLH
| Evaluaciones clínicas |
| - Gráfica de crecimiento |
| - Signos de raquitismo y/o deformidad en las piernas |
| - Medir distancia intermaleolar e intercondílea |
| - Perímetro craneal y forma del cráneob |
| - Examen neurológico (por consecuencias de craneosinostosis y estenosis espinal) |
| - Evaluación auditivaa |
| - Examen bucodental |
| - Función musculoesquelética (marcha)a,b |
| Evaluaciones bioquímicas |
| - Sangre: calcio, fosfato y creatinina |
| - Orina (muestra aislada): calcio, fosfato y creatinina |
| - TmP/TFG |
| - Tasa de filtrado glomerular estimado |
| - 25(OH) vitamina D |
| - 1,25(OH)2 vitamina D |
| - PTH |
| - Fosfatasa alcalina (niños y adultos) y fosfatasa alcalina ósea (adultos) |
| - FGF-23 intacto (en caso de antecedentes familiares negativos) |
| Evaluaciones por la imagen |
| - Radiografías de muñeca y/o rodilla y/o tobillo (raquitismo)b |
| - Radiografía anteroposterior estandarizada y bien posicionada de alineación de las extremidades en bipedestación (con técnicas de dosis bajas, si es posible) |
| - Ortopantomografía dentala |
| - Resonancia magnética cerebral |
| - Ecografía renal (nefrocalcinosis) |
FGF-23: factor de crecimiento de fibroblastos 23; PTH: hormona paratiroidea; TmP/TFG: reabsorción tubular máxima de fosfato para la tasa de filtración glomerular; XLH: hipofosfatemia ligada al cromosoma X.
Todas las evaluaciones son aplicables a niños <de 5 años, niños de 5-18 años y adultos excepto que se especifique lo contrario.
Frecuencia y ámbito de las vistas
| - Sugerimos que equipos multidisciplinares sean los que proporcionen la atención al paciente (grado D, recomendación débil)a |
| - Sugerimos revisiones de los niños con XLH al menos cada 3 meses durante las fases de crecimiento rápido (primera infancia [0-2 años] y pubertad [10-16 años]) o después del inicio del tratamiento (grado C, recomendación débil)a |
| - Sugerimos revisiones de los pacientes adultos cada 6 meses si reciben tratamiento, o una vez al año si no reciben tratamiento farmacológico (grado C, recomendación débil) |
Seguimiento de los niños con XLH (grado C, recomendación moderada)
| - Recomendamos medir la estatura, el peso, el perímetro craneal (hasta los 5 años de edad), las distancias intercondílea e intermaleolar y la presión arterial |
| - Recomendamos calcular el índice de masa corporal (IMC) y la velocidad de crecimiento anual. |
| - Recomendamos documentar la forma de la cabeza y los antecedentes de cefaleas, abscesos dentales o celulitis maxilofacial, dolor óseo, fatiga y nivel de actividad física |
| - Recomendamos que en presencia de deformidad en las extremidades inferiores (varo, valgo o anteroposterior) se realice una evaluación ortopédica del aparato locomotor |
| - Recomendamos buscar pruebas de pérdida de audición, deformidad de la columna vertebral y escoliosis, manifestaciones relacionadas con craneosinostosis, malformación de Chiari 1 y/o hipertensión intracraneal y dismorfosis maxilar |
| - Recomendamos valorar la edad ósea (preferiblemente mediante radiografía de los huesos del carpo y el Atlas de Greulich y Pyle) para evaluar el potencial de crecimiento en niños >5 años con retraso del crecimientoa |
Seguimiento de los adultos con XLH (grado C, recomendación moderada)
| - Recomendamos medir la estatura, el peso y la presión arterial y calcular el IMC |
| - Recomendamos registrar los antecedentes de cefaleas, manifestaciones orales (incluyendo enfermedad periodontal, absceso dental o celulitis maxilofacial), dolor osteomuscular, pseudofracturas, fatiga y nivel de actividad física |
| - Recomendamos buscar pruebas de pérdida de audición, entesopatías, artrosis, deformidad de la columna vertebral y escoliosis, deficiencia muscular, rango de movimiento, manifestaciones relacionadas con la malformación de Chiari 1 y/o hipertensión intracraneal |
La guía original recomienda que los equipos multidisciplinares estén coordinados por un experto en enfermedades del metabolismo óseo. El GEG considera que esta recomendación, aunque sea adecuada, no se adapta totalmente a la realidad de nuestro medio, donde dependiendo de la zona pueden no existir dichos expertos. Creemos que cada centro debe decidir quién será el coordinador del equipo multidisciplinar.
Además, la guía original sugiere espaciar el seguimiento en aquellos pacientes que presentan una respuesta positiva al tratamiento. El GEG considera que el seguimiento depende más de la edad del paciente o de situaciones concretas, como estar en el periodo de transición a la atención del adulto, que del tratamiento que reciben.
Entre las recomendaciones de seguimiento de los niños se encuentra la valoración de la edad ósea. El GEG considera importante resaltar que esta evaluación se debe realizar con métodos fiables, y recomienda la realización de radiografía de los huesos del carpo y la utilización del Atlas de Greulich y Pyle. Una revisión sistemática reciente de 17 estudios ha mostrado un buen grado de acuerdo entre la edad cronológica y la ósea determinada mediante el Atlas de Greulich y Pyle30. Así, las diferencias entre ambas edades fueron por lo general menor de un año en todos los grupos de edad30.
En la medida de lo posible estas pruebas que se recomiendan para el seguimiento deben acompañarse de una cuantificación de la gravedad; por ejemplo, con la utilización de escalas visuales analógicas para valorar la intensidad del dolor o la fatiga, o la prueba de la marcha de 6min (6MWT) para valorar la capacidad funcional y de la cual se disponen de manuales de utilización en otras enfermedades crónicas31 que pueden adaptarse a este ámbito, dado que no existen recomendaciones específicas para pacientes con XLH. No obstante, existen valores de referencia del 6MWT para niños y adolescentes entre 4-19 años32; por debajo de esa edad no es factible su realización.
Seguimiento de todos los pacientes (niños y adultos) (tabla 6)En pacientes tratados con burosumab, recomendamos un seguimiento de los niveles de fosfato sérico en ayunas junto con la TRP y la reabsorción tubular máxima de fosfato para la TmP/TFG. El motivo de esta recomendación es que en el estudio inicial de la hipofosfatemia se recomienda calcular primero el TRP, pero en caso de TRP normal-bajo, el TmP/TFG es más preciso para detectar la pérdida urinaria de fosfato33.
Seguimiento de todos los pacientes (niños y adultos)
| - Recomendamos revisiones por el dentista dos veces al año después de la erupción dental o del primer año de vida para prevenir y tratar infecciones dentales y periodontitis (grado C, recomendación moderada)a |
| - Recomendamos controlar los niveles sanguíneos de fosfatasa alcalina (FA) (niveles séricos de FA total en niños y adultos y, de forma opcional, FA específica del hueso en adultos), calcio, fosfato, creatinina, PTH y 25(OH) vitamina D (grado B, recomendación moderada)a. Recomendamos medir los niveles de calcio y creatinina en la orina para calcular el cociente de calcio:creatinina en pacientes que reciben un tratamiento convencional o burosumab (grado B, recomendación moderada) |
| - En pacientes tratados con burosumab, recomendamos un seguimiento de los niveles de fosfato sérico en ayunas (grado B, recomendación moderada) junto con la TRP y la reabsorción tubular máxima de fosfato para la tasa de filtración glomerular (TmP/TFG) (grado B, recomendación débil) cada 2 semanas durante el primer mes de tratamiento, y cada 4 semanas durante los siguientes 2 meses y posteriormente cada 3-6 meses; también recomendamos medir el nivel de fosfato sérico en ayunas 4 semanas después del ajuste de la dosis (grado B, recomendación moderada) y sugerimos medir los niveles séricos de 1,25(OH)2 vitamina D cada 6 meses analizados junto con la excreción urinaria de calcio como parámetros de seguridad (grado B, recomendación débil) |
| - Recomendamos evaluar la gravedad de la enfermedad mediante radiografías de muñecas y rodillas en niños (utilizando la RSS) que no respondan bien al tratamiento o cuyas deformidades óseas empeoren a pesar del tratamiento médico, en niños que puedan necesitar cirugía ortopédica, en aquellos que se quejen de dolor óseo inexplicable o en adolescentes con deformidades persistentes en las extremidades inferiores cuando están en transición a la atención de adultos. Las radiografías deben ser en proyección anteroposterior estándar de miembros inferiores en bipedestación (utilizando radiación de dosis baja cuando sea posible) para evaluar las deformidades de las extremidades, la alineación de las articulaciones y la calidad ósea (grado B, recomendación moderada)a |
| - En pacientes que reciben tratamiento convencional o con burosumab, recomendamos una ecografía renal al menos cada 2 años en pacientes sin nefrocalcinosis, y anualmente en pacientes con nefrocalcinosis y/o hipercalciuria persistente (grado C, recomendación moderada)b |
| - Recomendamos una RMN craneal (si es posible incluyendo una secuencia hipointensa para hueso [«secuencia ósea negra»] para tomar imágenes del cráneo) si la morfología del cráneo sugiere craneosinostosis o signos clínicos de hipertensión intracraneal (grado C, recomendación moderada) |
| - Aconsejamos realizar una ortopantomografía (radiografía de maxilares superior e inferior y dientes) a los 5 años de edad y en adultos con manifestaciones orales recientes. Las radiografías deben repetirse según las necesidades individuales; se pueden usar radiografías retrocoronales y periapicales, y tomografía computarizada de haz cónico para detectar y hacer seguimiento de infecciones endodónticas, periodontales o periimplantes (grado D, recomendación débil) |
| - Para evaluar la salud ósea en pacientes con XLH, no recomendamos el uso sistemático de la absorciometría de rayos X de doble energía (DXA) ni la tomografía computarizada cuantitativa periférica (pQCT) (grado C, recomendación moderada) |
| - Sugerimos proporcionar a los pacientes los datos de contacto de asociaciones de pacientes, informarles de los descubrimientos científicos (incluyendo nuevos tratamientos), apoyar la aportación escolar y profesional y proporcionar apoyo social (grado D, recomendación débil) |
| - Sugerimos plantear la prueba de la marcha de 6MWT y evaluar la calidad de vida con la versión apropiada para la edad del EuroQol-5D en pacientes a partir de los 5 años de edad a intervalos anuales o cada 2 años siempre que haya instalaciones disponibles (grado D, recomendación débil)a |
Entre las recomendaciones para todos los pacientes está la determinación del calcio y la creatinina urinaria para el cálculo del cociente de calcio:creatinina, que es importante para el seguimiento de los pacientes que reciben tratamientos convencionales (por ejemplo, vitamina D) o burosumab. El GEG considera que esa determinación se debe realizar preferiblemente en orina de 24h, al menos en adultos, ya que en orina aislada, en ayunas el cociente calcio:creatinina infraestima la calciuria y en orina postprandial puede sobreestimarla. También se puede realizar en dos muestras de orina aisladas.
Al igual que se ha comentado para otras evaluaciones, el GEG considera que siempre que sea posible se debe recomendar la utilización de instrumentos específicos de evaluación como la RSS para la evaluación de la gravedad, o la utilización de cuestionarios de calidad de vida como la familia de instrumentos EQ-5D que han sido desarrollados tanto para adultos (EQ-5D-5L) como para niños (EQ-5D-Y). El EQ-5D evalúa 5 dimensiones (movilidad, autocuidados, actividades habituales, dolor/malestar y ansiedad/depresión) en 5 niveles (EQ-5D-5L) o en 3 niveles (EQ-5D-Y)34. Son fáciles de utilizar, fiables y sensibles al cambio, y se encuentran disponibles en español para su utilización gratuita siempre que no existan fines comerciales34.
Recomendaciones terapéuticas en niños (tabla 7)El GEG está de acuerdo globalmente con las recomendaciones de manejo terapéutico para el niño con XLH. No obstante, considera importante realizar algunas modificaciones que se comentan a continuación, en especial respecto a la dosificación de algunas intervenciones:
- -
Consideramos que la frecuencia de administración de suplementos fosfato no debe determinarse exclusivamente en función de la FA, ya que no es el factor más importante para el seguimiento de los efectos del tratamiento; la FA podría no haberse normalizado y ser necesario una reducción de la administración de suplementos de fosfato35.
- -
La recomendación de utilizar dosis bajas de fosfato nos parece adecuada, pero creemos que es importante recalcar que sean dosis terapéuticas para evitar la infradosificación.
- -
Aunque no se especifica en las recomendaciones, el exceso de calcio urinario se puede tratar de evitar ajustando la dosis de vitamina D y fosfato e introduciendo tiazidas si fuera necesario36,37.
- -
La dosis de vitamina D activa creemos que se debe establecer siempre en función del peso del paciente
Recomendaciones terapéuticas en niños
| - Recomendamos tratar a los niños que tengan un fenotipo manifiesto de XLH con una combinación de fósforo oral (sales de fosfato) y vitamina D activa (calcitriol o alfacalcidol) tan pronto como se establezca el diagnóstico (grado B, recomendación moderada) |
| - Recomendamos una dosis inicial de 20-60mg/kg de peso corporal al día (0,7-2,0mmol/kg al día) de fósforo elemental en lactantes y niños en edad preescolar, que deberá ajustarse a medida que mejoren el raquitismo, el crecimiento, y los niveles de FA y hormona paratiroidea (PTH) (grado C, recomendación moderada) |
| - Recomendamos administrar los suplementos de fosfato con la mayor frecuencia posible, por ejemplo, 4-6 veces al día en pacientes jóvenes con niveles altos de FA (grado B, recomendación moderada)a |
| - Recomendamos un aumento progresivo de la dosis de suplementos de fosfato en caso de respuesta clínica insuficiente, si bien se deben evitar dosis superiores a 80mg/kg al día (en función del fósforo elemental) para prevenir molestias gastrointestinales e hiperparatiroidismo. Si se presentan estos efectos adversos, el tratamiento debe ajustarse disminuyendo la dosis y/o aumentando la frecuencia (grado C, recomendación moderada) |
| - Recomendamos el uso de dosis bajas dentro del intervalo de dosis eficaz (esto es, 20-60mg/kg) en pacientes con fenotipos leves, por ejemplo, lactantes diagnosticados por cribado familiar (grado C, recomendación moderada)a |
| - Recomendamos una dosis inicial de calcitriol de 20-30ng/kg de peso corporal al día o de alfacalcidol de 30–50ng/kg de peso corporal al día (grado C, recomendación moderada)a |
| - Para prevenir la nefrocalcinosis, recomendamos mantener los niveles de calciuria dentro del intervalo de normalidad (evitar que exceda de más de 4mg/kg de peso en orina de 24 h en niños mayores de 2 años que sean continentes) y evitar dosis altas de suplementos de fosfato; sugerimos medidas que disminuyan la concentración, la excreción y/o la cristalización del calcio urinario si fuera necesario, incluida la ingesta regular de agua, la administración de citrato de potasio y la ingesta limitada de sodio (grado C, recomendación moderada)a |
| - Con respecto al hiperparatiroidismo secundario, recomendamos lo siguiente: |
| • A los pacientes que reciban un tratamiento convencional con niveles elevados de PTH se les aumentará la dosis de vitamina D activa y/o se disminuirá la dosis de suplementos de fosfato oral (grado C, recomendación moderada) |
| • Se podría contemplar un tratamiento con calcimiméticos en los pacientes con hiperparatiroidismo secundario persistente a pesar de las medidas mencionadas anteriormente (grado D, recomendación débil)a,b. Cinacalcet se debe utilizar con precaución en XLH, ya que se ha asociado con efectos adversos graves, a saber, hipocalcemia y aumento del intervalo QT (grado X, recomendación fuerte) |
| • Se debe contemplar la paratiroidectomía en caso de hiperparatiroidismo terciario (hiperparatiroidismo hipercalcémico persistente) a pesar del tratamiento optimizado con vitamina D activa y cinacalcet (grado C, recomendación moderada) |
| - Sugerimos que los pacientes con deficiencia de vitamina D reciban suplementos de vitamina D nativa (colecalciferol) (grado C, recomendación débil)a |
| - No recomendamos la administración sistemática de suplementos de calcio a niños con XLH, aunque sí se deberá realizar una evaluación dietética de la ingesta diaria de calcio (grado D, recomendación débil) |
| - Recomendamos que la planificación del tratamiento se lleve a cabo en el entorno de un equipo multidisciplinario antes de la cirugía; también sugerimos reducir o interrumpir la suplementación de vitamina D activa si los pacientes están inmovilizados durante un largo período y reiniciarla pronto como el paciente reanude la deambulación (grado D, recomendación débil)a |
Además, tanto para las recomendaciones en niños como en adultos, se ha eliminado como suplementos de vitamina D nativa el ergocalciferol, ya que no se utiliza habitualmente en nuestro medio.
Finalmente, para el manejo del hiperparatiroidismo secundario, dado que las guías originales sugieren una posible utilización de Cinacalcet, se ha especificado que esa utilización no está incluida entre las indicaciones del producto; en nuestro medio este fármaco está indicado para el tratamiento del hiperparatiroidismo (HPT) secundario en niños de 3 años de edad o mayores, con insuficiencia renal crónica en diálisis en los que el HPT secundario no está adecuadamente controlado con el tratamiento habitual.
Recomendaciones para la administración de burosumab en niños con XLH (tabla 8)Tras la reciente decisión final de la Comisión Europea (el 30 de septiembre de 2020), burosumab ha obtenido la autorización de la extensión de su indicación al tratamiento de la XLH en niños y adolescentes de 1 a 17 años con signos radiográficos de enfermedad ósea, y en adultos38. Las recomendaciones de la guía original se ajustan a esta indicación en el presente documento, tras la también reciente obtención de acuerdo para el reembolso nacional al momento de envío a publicación del mismo. Se ha modificado la dosis de inicio recomendada de burosumab de 0,4 a 0,8mg/kg/cada 2 semanas para la población pediátrica en base a los resultados de los últimos ensayos clínicos con este fármaco12,16. No obstante, cuando se prescriba burosumab deberán tenerse en cuenta las recomendaciones incluidas en la ficha técnica del producto39.
Recomendaciones para la administración de burosumab en niños con XLH
| - Si está disponible, recomendamos contemplar el tratamiento con burosumab en niños con XLH≥1 año y en adolescentes en las siguientes situaciones: evidencia radiográfica de enfermedad ósea manifiesta y enfermedad refractaria a la terapia convencional; o complicaciones relacionadas con la terapia convencional; o la imposibilidad del paciente para adherirse a la terapia convencional, asumiendo que es factible realizar un seguimiento adecuado (grado B, recomendación moderada)a |
| - En niños, recomendamos una dosis inicial de burosumab de 0,8mg/kg de peso corporal (redondeando la dosis a los 10mg más próximos), que se administre por vía subcutánea cada 2 semanas (grado B, recomendación moderada)a |
| - Recomendamos aumentar gradualmente la dosis de burosumab en incrementos de 0,4mg/kg para elevar los niveles de fosfato sérico en ayunas en torno al límite inferior del intervalo de referencia normal ajustado a la edad hasta una dosis máxima de 2,0mg/kg de peso corporal (dosis máxima 90mg) (grado B, recomendación moderada) |
| - Burosumab no se debe ajustar con una frecuencia superior a cada 4 semanas (grado B, recomendación moderada) |
| - Durante el periodo de titulación de la dosis, sugerimos realizar un control de los niveles de fosfato sérico en ayunas entre inyecciones, idealmente 7-11 días después de la última inyección, para detectar la presencia de hiperfosfatemia; después de alcanzar un estado de equilibrio, que se puede asumir que será después de 3 meses de recibir una dosis estable, se deberán evaluar los niveles de fosfato sérico en ayunas preferiblemente justo antes de las inyecciones para detectar infradosificación (grado B, recomendación débil) |
| - La dosis debe interrumpirse si el nivel de fosfato sérico en ayunas está por encima del límite superior del intervalo normal. Burosumab se puede reiniciar a la mitad de la dosis anterior cuando la concentración de fosfato sérico esté por debajo del intervalo normal (grado B, recomendación moderada) |
| - Recomendamos que burosumab no se administre junto con el tratamiento convencional, cuando los niveles de fosfato en ayunas antes del inicio del tratamiento estén dentro del intervalo normal de referencia ajustado a la edad o en presencia de insuficiencia renal grave (grado X, recomendación moderada) |
La hormona del crecimiento se ha utilizado en estos pacientes como terapia adyuvante. Sin embargo, la respuesta al tratamiento ha sido variable y no se ha podido demostrar adecuadamente que los beneficios superen los riesgos, de ahí la limitación de su uso a poblaciones muy restringidas18.
Recomendaciones relacionadas con la hormona del crecimiento
| - No recomendamos la administración sistemática de la hormona de crecimiento humana recombinante (rhGH) en pacientes con XLH (grado C, recomendación débil) |
| - Se podría contemplar el tratamiento con rhGH en los niños con talla baja, siempre que los niveles de FA y hormona paratiroidea estuvieran bien controlados (grado C, recomendación débil) |
El GEG está de acuerdo con las recomendaciones de la guía a este respecto. No obstante, no considera que sea estrictamente necesario recomendar la reducción de la dosis de vitamina D en todos los pacientes en los que se prevea una inmovilización a largo plazo, sino que dicha decisión se debe tomar de acuerdo a la situación clínica de cada paciente y, por tanto, se incluye como sugerencia.
Recomendaciones para el tratamiento convencional en adultos
| - Recomendamos que los adultos sintomáticos con XLH reciban tratamiento con vitamina D activa junto con fósforo oral (sales de fosfato) para reducir la osteomalacia y sus consecuencias y mejorar la salud bucal (grado B, recomendación moderada) |
| - Sugerimos tratar a las mujeres embarazadas y en periodo de lactancia con vitamina D activa en combinación con suplementos de fosfato si fuera necesario (grado D, recomendación débil) |
| - No recomendamos el tratamiento sistemático de adultos con XLH que estén asintomáticos (grado C, recomendación moderada) |
| - Recomendamos el uso de dosis sustancialmente más bajas de vitamina D activa y fosfato oral de las que se utilizan en los niños (grado C, recomendación moderada). Recomendamos un intervalo de dosis de 750-1.600mg diarios (basado en fósforo elemental) para fosfato y de 0,50-0,75 y 0,75-1,5μg diarios para calcitriol y alfacalcidol, respectivamente (grado C, recomendación débil) |
| - Sugerimos la reducción de la dosis de vitamina D activa en pacientes en los que se prevea una inmovilización a largo plazo, para prevenir la hipercalciuria y la hipercalcemia (grado D, recomendación débil)a |
| - Recomendamos suspender los suplementos de fosfato en pacientes con niveles notablemente aumentados de la PTH (grado C, recomendación moderada) |
| - Sugerimos que en pacientes adultos con hiperparatiroidismo secundario la vitamina D activa podría administrarse sin suplementos de fosfato si se realiza un seguimiento cuidadoso (grado D, recomendación débil) |
| - Sugerimos administrar suplementos de vitamina D nativa (colecalciferol) en caso de deficiencia de vitamina D; también sugerimos garantizar una ingesta normal de calcio (grado C, recomendación débil)a |
Como se comentaba previamente, burosumab está en la actualidad indicado para el tratamiento de la XLH en niños y adolescentes de uno a 17 años con signos radiográficos de enfermedad ósea, y en adultos38. En adultos, consideramos importante que, cuando su utilización se deba a dolor óseo y/o articular persistente, se haya descartado que el dolor no sea debido a patología degenerativa no relacionada con la XLH, ya que este no responde a burosumab40. El manejo de esta sintomatología derivada de cambios degenerativos se aborda en el siguiente punto.
Recomendaciones para el tratamiento con burosumab en adultos
| - Si estuviera disponible para esta indicación, recomendamos contemplar el tratamiento con burosumab en adultos con XLH que tengan las siguientes características: dolor óseo y/o articular persistente debido a XLH y/u osteomalacia que limite las actividades diarias (descartando que el dolor esté asociado con otras patologías comunes como artrosis, espondiloartrosis o estenosis de canal, entre otras); pseudofracturas o fracturas relacionadas con la osteomalacia; y respuesta insuficiente o refractaria a la terapia convencional (grado B, recomendación moderada)a |
| - También recomendamos contemplar el tratamiento con burosumab si los pacientes experimentan complicaciones relacionadas con el tratamiento convencional (grado D, recomendación débil) |
| - Recomendamos una dosis inicial de burosumab de 1,0mg/kg de peso corporal (dosis máxima de 90mg) administrada por vía subcutánea cada 4 semanas (grado B, recomendación moderada) |
| - Sugerimos el control inicial de los niveles de fosfato sérico en ayunas entre inyecciones, idealmente 7-11 días después de la última inyección para detectar la presencia de hiperfosfatemia; después de alcanzar un estado de equilibrio, que se asume se conseguirá después de 3 meses de recibir una dosis estable, los niveles séricos de fosfato deben evaluarse durante la última semana antes de la siguiente inyección para detectar infradosificación (grado B, recomendación débil) |
| - La dosis debe interrumpirse si el nivel de fosfato sérico en ayunas está por encima del límite superior del intervalo normal. Burosumab se puede reiniciar a la mitad de la dosis anterior cuando la concentración de fosfato sérico esté por debajo del intervalo de normalidad (grado C, recomendación moderada) |
| - Burosumab no debe administrarse junto con el tratamiento convencional, en pacientes cuyos niveles de fosfato antes del inicio del tratamiento estén dentro del intervalo normal de referencia ajustado a la edad o en presencia de insuficiencia renal grave (grado X, recomendación moderada) |
Recomendaciones para el tratamiento de las alteraciones del aparato locomotor
| - Recomendamos intervenciones dirigidas a reducir el dolor óseo y articular, la deformidad, la rigidez, la debilidad muscular y a mejorar la distancia de paseo y la actividad física. Estas intervenciones incluyen medidas generales tales como el uso de analgésicos (p, ej., el uso de antiinflamatorios no esteroideos [AINE] durante cortos periodos de tiempo), las infiltraciones intrarticulares (en presencia de cambios degenerativos), la fisioterapia, la rehabilitación, la actividad física y el tratamiento no farmacológico del dolor y la valoración de cirugía ortopédica según la evolución y limitación funcional (grado D, recomendación débil)a |
Recomendaciones para el tratamiento ortopédico en niños XLH
| - No recomendamos el uso de férulas o plantillas para el tratamiento de la deformidad de las extremidades inferiores en niños con XLH (grado C, recomendación moderada) |
| - Sugerimos insistir en la importancia del ejercicio de resistencia supervisados por personal cualificado, del mantenimiento del rango articular y de maximizar la fuerza y la resistencia (grado D, recomendación débil)a |
| - Recomendamos fisioterapia después de la cirugía o en caso de disminución del rango de movimiento, debilidad muscular, fatiga, inestabilidad o si existe un descondicionado físico (grado D, recomendación débil) |
| - Recomendamos que el tratamiento quirúrgico programado se realice solo en niños en los que se haya maximizado el tratamiento médico durante al menos 12 meses (grado C, recomendación moderada) |
| - Sugerimos que la cirugía la lleve a cabo un cirujano con experiencia en enfermedades óseas metabólicas (grado B, recomendación moderada) |
| - Se debe contemplar tratamiento quirúrgico ante una deformidad persistente (desviación del eje mecánico Zona 2 o superior) a pesar del tratamiento médico optimizado y/o la presencia de síntomas con interferencia funcional (grado C, recomendación débil) |
| - Recomendamos que la edad del niño se considere como un factor importante en el proceso de toma de decisiones: las técnicas de crecimiento guiadas dependen del potencial de crecimiento restante del niño y, por lo tanto, deben llevarse a cabo al menos 2-3 años antes de la madurez esquelética (14 años en niñas y 16 años en niños), mientras que las complicaciones asociadas con la osteotomía se reducen cuando la cirugía se realiza en la infancia tardía o después de la madurez esquelética (grado C, recomendación moderada) |
| - Recomendamos que el tratamiento quirúrgico de urgencia, como la fijación de fracturas, se lleve a cabo cuando sea necesario (grado B, recomendación moderada) |
| - Sugerimos que, después de la cirugía, se hagan evaluaciones clínicas y funcionales regulares, incluyendo radiografía, a los 12 meses después de la cirugía, o antes si la deformidad ósea empeora y/o hay preocupación clínica. Se deberán realizar evaluaciones adicionales intermitentemente hasta la madurez esquelética (grado C, recomendación moderada) |
Recomendaciones para el manejo de la salud dental
| - En niños y adultos con manifestaciones orales en curso, recomendamos el tratamiento con suplementos de vitamina D activa y fosfato para mejorar la mineralización de la dentina y reducir el número de abscesos dentales y la gravedad de la periodontitis (grado B, recomendación moderada) |
| - En los niños, además de la atención profiláctica estándar, recomendamos revisiones dentales cada 6 meses y sugerimos sellar fosas y fisuras con compuesto de resina líquida en dientes temporales y permanentes tan pronto y con tanta frecuencia como sea necesaria (grado C, débil recomendación). Si el paciente pediátrico ya ha tenido un absceso se recomienda hacer pulpotomías profilácticas y coronasa |
| - Sugerimos una investigación clínica exhaustiva en busca de necrosis pulpar (cambios de color, fístula, hinchazón, absceso, celulitis o dolor) y realizar radiografías retrocoronales y/o periapicales u ortopantomografía para buscar cámaras pulpares agrandadas y pérdida ósea periapical dependiendo de los hallazgos de un examen clínico (grado B, recomendación débil) |
| - Sugerimos optimizar el tratamiento médico convencional de la XLH antes de iniciar el tratamiento de ortodoncia (grado C, recomendación moderada) |
| - En adultos, recomendamos visitas 2 veces al año para realizar una terapia periodontal convencional de apoyo, que debe incluir la evaluación del riesgo periodontal y el desbridamiento supragingival y subgingival si fuera necesario (grado B, recomendación moderada) |
| - En adultos, sugerimos que la cirugía de implante dental se lleve a cabo después de 3-6 meses de tratamiento médico, que deberá continuar durante 6 meses después de la cirugía de implante; el tiempo de curación debe extenderse hasta los 6 meses (grado D, recomendación débil) |
Recomendaciones para el manejo de la audición
| - Sugerimos informar a los pacientes y a las familias de que pueden aparecer problemas auditivos y que cualquier sospecha de hipoacusia debe evaluarse meticulosamente (grado D, recomendación débil) |
| - Sugerimos tratar la hipoacusia de forma similar a otras causas de pérdida auditiva periférica, con audífonos, prevención de la exposición al ruido y evitación de medicamentos ototóxicos (grado D, recomendación débil) |
Recomendaciones para el manejo de complicaciones neuroquirúrgicas
| - Sugerimos una evaluación neurológica básica anual, pero no recomendamos más investigaciones en pacientes con XLH que estén asintomáticos (grado C, recomendación débil) |
| - Sugerimos que se informe a los pacientes y a las familias de que pueden aparecer complicaciones neuroquirúrgicas y que cualquier preocupación sobre la función del sistema nervioso central debe ser comunicada y tratada precozmente (grado C, recomendación débil) |
| - Recomendamos una evaluación completa con oftalmoscopia e imágenes cerebrales o craneales en cualquier paciente con XLH que presente una morfología craneal que indique craneosinostosis o síntomas clínicos de hipertensión intracraneal, compresión del tronco encefálico inferior o compresión del cordón cervical superior (sugiriendo una malformación de Chiari 1) (grado C, recomendación moderada) |
Recomendaciones relacionadas con el estilo de vida
| - Recomendamos que se apoye la actividad física de los pacientes con XLH y se adapte a la capacidad del paciente. Todos los deportes están permitidos a menos que existan contraindicaciones individuales; se prefieren las actividades aeróbicas porque las actividades anaeróbicas pueden causar demasiada tensión en el esqueleto (grado D, recomendación débil) |
| - Apoyamos las mismas pautas para la prevención y el tratamiento de la obesidad que se dan a la población general (grado D, recomendación débil) |
Temas para una investigación futura
| - Desarrollar un registro amplio de niños y adultos con XLH para evaluar la historia natural de la enfermedad, incluyendo complicaciones raras y la mortalidada |
| - Evaluar el impacto de la XLH en la escolarización, la vida social y la actividad profesional |
| - Desarrollar índices clínicos y/o biológicos y/o radiológicos para apoyar la evaluación de la eficacia y la seguridad del tratamiento |
| - Definir el grado de deformidad esquelética que es compatible con una buena calidad de vida |
| - Definir el cociente de riesgo-beneficio de las intervenciones quirúrgicas (osteotomía frente a técnicas guiadas) |
| - Evaluar el cociente de riesgo-beneficio del tratamiento convencional en adultos antes y después de las intervenciones quirúrgicas |
| - Evaluar el cociente de riesgo-beneficio del tratamiento convencional en mujeres con XLH embarazadas o en periodo de lactancia |
| - Evaluar el intervalo objetivo óptimo de las variables bioquímicas sustitutas (como los niveles de fosfato sérico en ayunas y la reabsorción tubular máxima de fosfato para la tasa de filtración glomerular) en pacientes en tratamiento con burosumab |
| - Evaluar la eficacia y la seguridad de burosumab en lactantes y adolescentes |
| - Evaluar la eficacia y la seguridad a largo plazo de burosumab en pacientes con XLH en cuanto a los resultados críticos tales como crecimiento, forma ósea, actividad física, mineralización dental, función auditiva, complicaciones neuroquirúrgicas y prevención de seudofracturas, entesopatías, absceso dental y artrosis |
| - Definir los pacientes que se beneficiarán más del tratamiento con burosumab y, por lo tanto, que deberían preferentemente iniciarlo o cambiarse a este tratamiento. Para ello se deben estudiar los predictores de respuestaa |
| - Definir la dosis y la frecuencia óptima del tratamiento con burosumab para su uso una vez que los pacientes hayan alcanzado una estabilidad de la enfermedad |
| - Evaluar la relación coste-efectividad de burosumab y del tratamiento convencional en pacientes pediátricos y adultos con XLH |
| - Realizar estudios de calidad del hueso con burosumab, evaluando la posible utilidad de los marcadores de recambio óseoa |
Además de los aspectos que requieren de investigación señalados por la guía, este grupo de expertos considera importante una mayor investigación sobre el impacto de esta enfermedad en términos de mortalidad. Existen estudios sobre la carga de enfermedad que muestran un importante impacto en especial por la persistencia del dolor y la alteración funcional y de calidad de vida de estos pacientes en la edad adulta6,9,10,41, pero es poco lo que se conoce sobre la mortalidad asociada a esta condición. Un estudio reciente realizado en el Reino Unido de 122 casos posibles de XLH, 9 (7,4%) habían fallecido con una mediana de edad de 64 años11.
Aunque, como señala la guía original, se requieren más datos acerca del tratamiento a largo plazo con burosumab, recientemente se han publicado los resultados de estudios de al menos 48 semanas de seguimiento, tanto en adultos como en niños. En adultos los resultados muestran que burosumab continúa siendo bien tolerado hasta un periodo de 48 semanas y consigue corregir de forma sostenida los niveles de fosfato, consolidando las fracturas y pseudofracturas y mejorando de forma sostenida algunas alteraciones musculoesqueléticas17. En niños, los resultados de los ensayos clínicos de 64 semanas de duración muestran una mejoría de la gravedad del raquitismo, el crecimiento y las alteraciones bioquímicas, con un perfil favorable de seguridad12,16; en alguna serie de casos en niños con XLH tratados con burosumab en la práctica clínica se han observado resultados consistentes con los descritos42.
Creemos que otro aspecto no señalado por la guía y que se debe investigar más extensamente15 es el impacto de burosumab en la calidad del hueso, evaluando la posible utilidad de los marcadores de recambio óseo y técnicas que estudian de forma no invasiva otros aspectos de la microarquitectura y resistencia ósea, como el Trabecular Bone Score (TBS) y, especialmente, la high-resolution peripheral quantitative computed tomography (HR-pQCT)43. Recientemente un estudio realizado en pacientes adultos con XLH mostró un aumento importante en los marcadores de resorción y formación ósea después de 48 semanas de tratamiento (un 77% de incremento en el propéptido amino-terminal del procolágeno tipo 1 [P1NP] y de un 36% del telopéptido carboxiterminal del colágeno tipo I [CTX])15.
Finalmente, consideramos necesario más investigación sobre las anomalías vasculares de estos pacientes, como la hipertensión, la hipertrófica ventricular y la calcificación vascular28,44, así como la afectación osteoarticular residual en la edad adulta relacionada con la enfermedad6.
ConclusionesLa XLH es una enfermedad genética rara del metabolismo del fosfato que debe sospecharse en las siguientes situaciones:
- 1.
Signos clínicos y/o radiológicos de raquitismo/osteomalacia asociados a valores bajos de fósforo sérico ajustado a la edad con evidencia de una pérdida renal de fosfato (TRP o TmP/TFG disminuidos)
- 2.
Deformidad angular (desaxación) en miembros inferiores, talla baja y/o alteraciones dentales asociadas al punto anterior
- 3.
Familiares de primer grado con XLH
Otros datos bioquímicos que pueden observarse incluyen: aumento de fosfatasa alcalina, aumento de FGF-23 (o niveles inapropiadamente normales), niveles levemente aumentados de PTH o en el límite superior de la normalidad, y niveles bajos de 1,25(OH)2 vitamina D (o inapropiadamente normales).
Si está disponible, es aconsejable el estudio de las mutaciones del gen PHEX, así como el consejo genético en caso positivo.
En niños, hasta el momento, el tratamiento convencional (con suplementos de fosfato y vitamina D activa ajustados según edad y respuesta clínica) era imprescindible para optimizar el crecimiento y prevenir en la medida de lo posible deformidades óseas y mejorar la salud dental. El tratamiento en adultos sintomáticos (dolor osteomuscular, pseudofracturas, problemas dentales), hasta el momento, debía hacerse con suplementos orales de fosfato en dosis fraccionadas y vitamina D activa. El objetivo del tratamiento es mejorar la osteomalacia y los síntomas relacionados, así como prevenir complicaciones dentales (periodontitis, abscesos dentales). El seguimiento multidisciplinar es muy importante en estos pacientes para asegurar la atención global de sus diferentes necesidades. La disponibilidad de nuevas terapias farmacológicas dirigidas a FGF-23, como burosumab, supone un gran avance para el manejo de estos pacientes. Los ensayos y estudios realizados con burosumab hasta el momento demuestran una mejoría tanto clínica, analítica como radiológica, con menos efectos secundarios y mejor tolerancia.
FinanciaciónEste proyecto fue financiado por Kyowa Kirin Farmacéutica, SLU. Kyowa Kirin Farmacéutica no ha tenido ningún papel en la evaluación de las guías, en la elaboración de las recomendaciones, ni en la preparación de este manuscrito.
AutoríasTodos los autores han contribuido por igual en la realización de este proyecto y en la preparación de este manuscrito; por tanto, han sido listados alfabéticamente.
Conflicto de interesesDomingo González-Lamuño ha recibido honorarios como ponente por parte de Kyowa Kirin Farmacéutica. Ana Lorente Rodriguez ha recibido honorarios por consultoría de Kyowa Kirin Farmacéutica. Silvia Marín-del Barrio ha actuado como consultora, ha recibido honorarios como ponente y ha recibido ayudas para formación y asistencia a congresos científicos de Kyowa Kirin Farmacéutica. Guillermo Martínez Diaz-Guerra, ha recibido honorarios por ponencias y consultoría de Kyowa Kirin Farmacéutica. Pilar Peris, ha recibido honorarios como ponente de Amgen, Lilly, UCB y Kyowa Kirin Farmacéutica.
Agradecemos a Fernando Rico-Villademoros (APICES, Madrid, España) su ayuda editorial en la preparación de este manuscrito. Esta ayuda ha sido financiada por Kyowa Kirin Farmacéutica, S.L.U.