La cistatina C se utiliza cada vez más como marcador de la función renal como complemento de la creatinina sérica y la tasa de filtración glomerular (TFG). Hemos evaluado su eficacia como predictor de mortalidad en un grupo de pacientes con cistatina C aumentada, pero con TFG >60mL/min.
Diseño y métodosSe incluyeron 608 pacientes, 65,9% varones, 34,6% tenían diabetes mellitus. La edad media era de 58,5±14,5 años y el TFG medio de 64,1±33,5mL/min. Los pacientes se dividieron en tres grupos CONTROL (cistatina C normal y TFG> 60mL/min, edad 53,3±12,8años, TFG 96,6±22,4mL/min, n=193), CISTATINA AUMENTADA (cistatina C>1,03mg/L y TFG>60mL/min, edad 58, 9±13,1años, TFG 72,2±10,4mL/min, n=40) y enfermedad renal crónica (ERC) (cistatina C aumentada y TFG <60mL/min, edad 61,4±14,8años, TFG 36,0±12,7mL/min, n=160). La relación con la mortalidad global se analizó mediante el método de Kaplan-Meier.
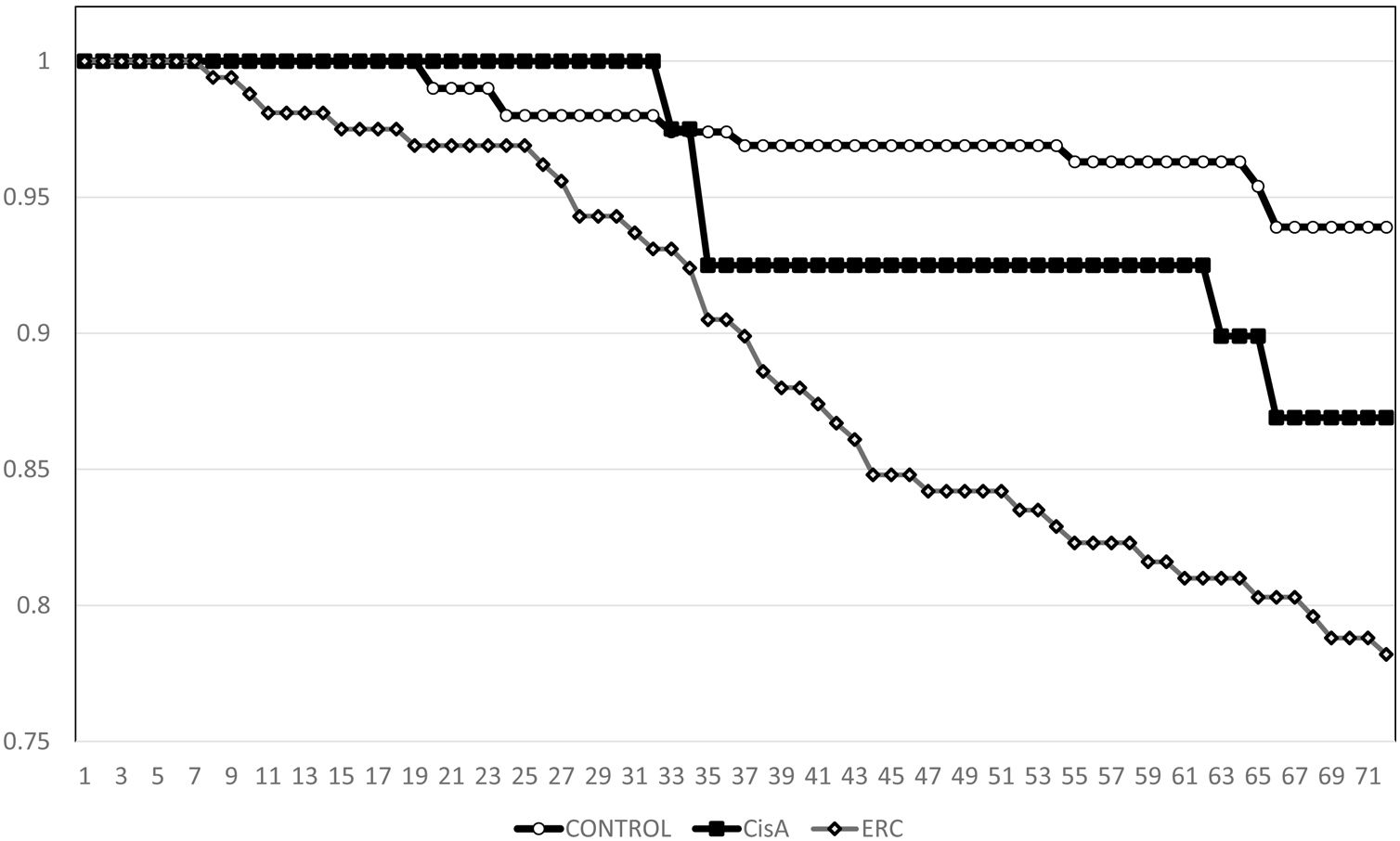
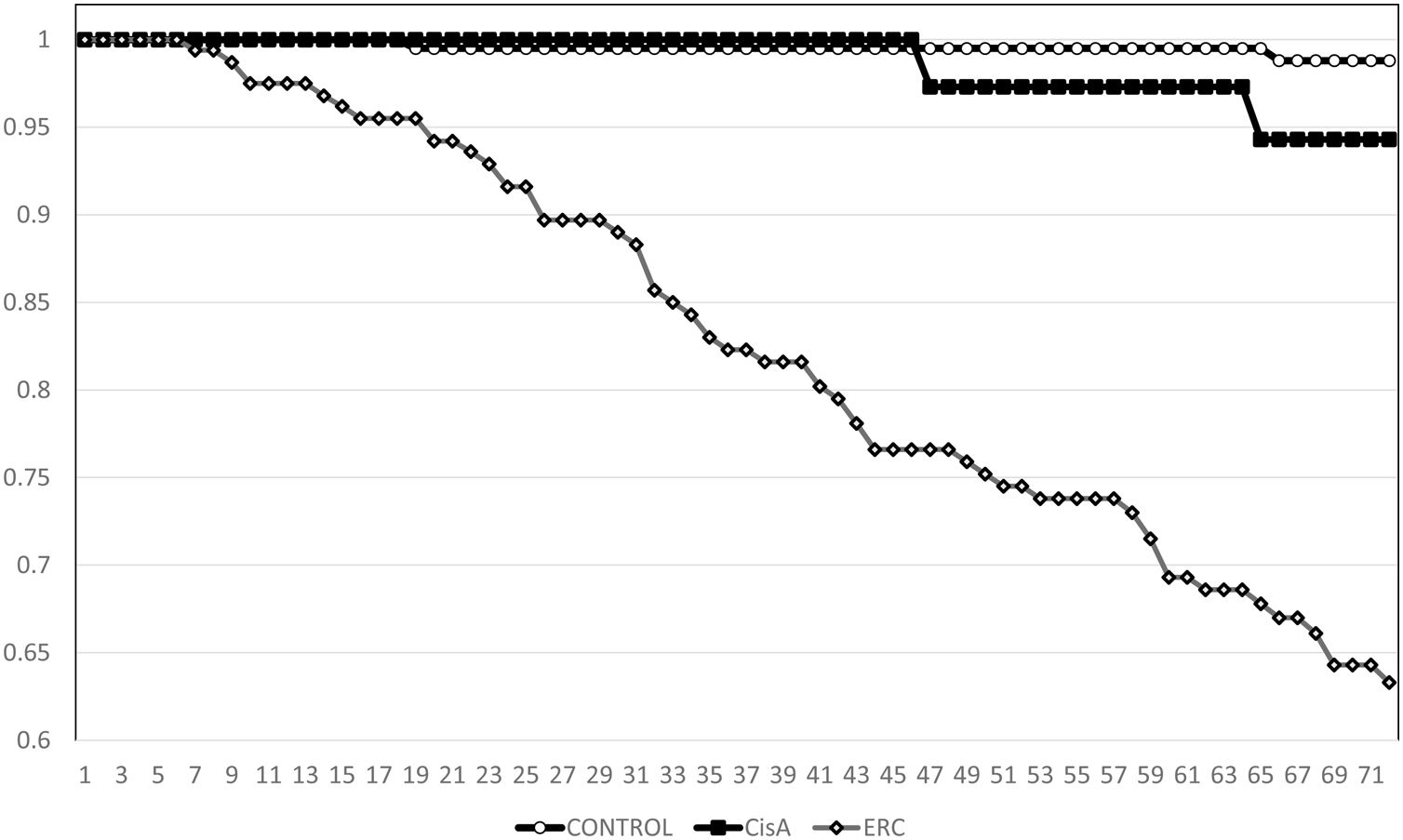
ResultadosLa cistatina C media fue de 0,75±0,13 vs. 1,79±0,54 en el grupo ERC y 1,14±0,14mg/L, p <0,001). En el grupo CONTROL la supervivencia fue de 93,9% a los cinco años, vs. 78,8% en el grupo ERC y 82,3% en el grupo CISTATINA AUMENTADA (p <0,001). La supervivencia a los cinco años antes del tratamiento renal sustitutivo también fue diferente para el grupo ERC (73%, p <0,001 Log Rank) pero no entre los otros dos grupos (CONTROL 99,0%, CISTATINA AUMENTADA 94,3% p=0,08).
ConclusionesEl aumento de los niveles plasmáticos de cistatina C en pacientes con TFG> 60mL/min fue un factor predictivo de mayor mortalidad, pero no de progresión a insuficiencia renal terminal. Estos resultados confirman el interés de medir sistemáticamente la cistatina C.
Cystatin C is increasingly used as a marker of renal function as a complement to serum creatinine and glomerular filtration rate (GFR). We have assessed its efficacy as a predictor of mortality in a group of patients with increased cystatin C but GFR> 60mL/min.
Design and methodsWe included 608 patients, 65.9% male, 34.6% had diabetes mellitus. The mean age was 58.5±14.5 years and a mean GFR of 64.1±33.5mL/min. Patients were divided into 3 groups: CONTROL (normal cystatin C and GFR> 60mL/min, age 53.3±12.8years, GFR 96.6±22.4mL/min,n=193), INCREASED CYSTATIN (cystatin C>1.03mg/l and GFR>60mL/min, age 58.9±13,1years, GFR 72.2±10.4mL/min, n=40) and CKD (chronic kidney disease, increased cystatin C and GFR <60mL/min, age 61.4±14.8years, GFR 36.0±12.7mL/min, n=160). The relationship with overall mortality was analyzed using the Kaplan-Meier method.
ResultsMean cystatin C was 0.75±0.13 versus 1.79±0.54 in CKD group and 1.14±0.14mg/l, p <0.001). In CONTROL group survival was 93.9% at 5y, compared to 78.8% in the ERC group and 82.3% in the INCREASED CYSTATIN group (p <0.001) Five-year survival before renal replacement therapy was also different for the ERC group (73%, p <0.001 Log Rank) but not between the other two groups (CONTROL 99.0%, INCREASED CYSTATIN 94.3% p=0.08).
ConclusionsIncreased plasmatic levels of cystatin C in patients with GFR> 60mL/min was a predictor of increased mortality but not of progression to end-stage renal failure. These results confirm the interest of routinely measuring cystatin C.
La enfermedad renal crónica (ERC) afecta al 10% de la población mundial y figura entre las 10 principales enfermedades no transmisibles que contribuyen a la morbilidad y la discapacidad1. Su incidencia está aumentando en todo el mundo, y la mortalidad debida a la ERC se incrementó entre 2005 y 2017 de 0,9 millones a 1,2 millones de muertes anuales2.
La creatinina sérica y el aclaramiento de creatinina fueron utilizados por primera vez para evaluar la función renal por los fisiólogos daneses Rehberg y Holten a mediados de la década de 1920. La creatinina sérica es el único biomarcador plasmático renal que se utiliza actualmente en la práctica clínica diaria para estimar la tasa de filtración glomerular (TFG). Sin embargo, la interpretación adecuada del resultado de la creatinina sérica sigue siendo a veces problemática. El aclaramiento de creatinina es un método relativamente fácil para estimar la TFG, pero tiene algunas limitaciones importantes en esta medición (es decir, la secreción tubular de creatinina, que es variable de un sujeto a otro). El aclaramiento de creatinina sobreestima sistemáticamente el FG medido y esta sobreestimación es mayor a niveles bajos de FG3. En la actualidad, las ecuaciones basadas en la creatinina, especialmente la ecuación del estudio Modification of Diet in Renal Disease (MDRD) y la del Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI), se utilizan en todo el mundo para estimar la TFG4.
La cistatina C es un nuevo marcador interesante para la estimación de la TFG. Ofrece varias ventajas sobre la creatinina u otras proteínas de peso molecular similar. La cistatina C es producida por todas las células nucleadas del cuerpo humano y, dado que la proteína está codificada por un gen de mantenimiento de la casa (es decir, un gen que se expresa tanto de forma constitutiva como no regulada), se considera que la cistatina C se produce constantemente5. Tras ser filtrada sin restricción por los glomérulos debido a su baja masa molecular y a la ausencia de unión a proteínas, la cistatina C es reabsorbida en su totalidad por los túbulos proximales, donde es catabolizada casi en su totalidad6. Las actuales directrices del Kidney Disease: Improving Global Outcomes (KDIGO) para la ERC sugieren medir la cistatina C en adultos con un FG de 45-59mL/min/1,73 m2 que no presenten marcadores de daño renal si se requiere la confirmación de la ERC7.
La proporción de pacientes con ERC definida por el FG que evolucionan a enfermedad renal terminal es extremadamente pequeña. Las directrices KDIGO reconocieron la importancia de la albuminuria y del diagnóstico etiológico, así como del FG. Se diseñó una tabla para categorizar el riesgo en poblaciones con ERC utilizando el grupo de TFG y la gravedad de la albuminuria, aunque no se calificó la evidencia5. Hemos intentado evaluar el valor de los niveles plasmáticos elevados aislados de cistatina C en pacientes con un nivel de creatinina plasmática normal y un FG estimado superior a 60mL/min como marcador de riesgo renal.
Diseño y métodosSe estudió a un grupo de 608 pacientes: 401 varones y 207 mujeres; la edad media era de 53,3±12,8 años; 34,6% padecía diabetes mellitus. La cistatina C sérica se midió con un nefelómetro BNII (Dade Behring Inc., Deerfield, IL, EE. UU.) que utilizaba un ensayo inmunonefelométrico mejorado por partículas (N Latex Cystatin-C). El intervalo del ensayo es de 0,195-7,330mg/L, siendo el intervalo de referencia para individuos jóvenes sanos de 0,53-0,95mg/L. La albuminuria se midió en la recogida de orina de 24 horas y 18,5% mostró un aumento de la excreción de albúmina en orina (≥ 30mg/día). La TFG se estimó a partir de la creatinina sérica utilizando la ecuación CKD-EPI para cada sexo. Solo se incluyeron en el estudio pacientes caucásicos, por lo que la raza no se incluyó en el cálculo.
Los pacientes se clasificaron según los estadios KDIGO de la ERC: 13,6% se encontraba en estadio IV o V, 30,9% en estadio III, y el resto de pacientes presentaba un FG superior a 60mL/min (39,1%). El punto de corte para el cuartil más alto de la distribución sérica de la cistatina C fue de 1,03mg/L. El FG se estimó a partir de la cistatina C utilizando la formulación CKD-EPI para la cistatina C. La microalbuminuria se definió como una excreción urinaria de albúmina>30 y <300mg/día; la macroalbuminuria se diagnosticó cuando la albuminuria era igual o superior a 300mg/día.
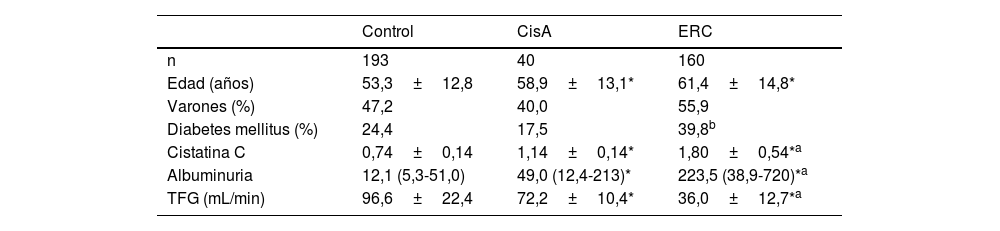
Los pacientes se dividieron en tres grupos CONTROL (niveles normales de cistatina C y FG> 60mL/min, n=193), CISTATINA AUMENTADA (CisA) (cistatina C superior a 1,03mg/l, pero FG>60mL/min, n=40) y ERC (cistatina C superior a 1,03mg/g y FG <60mL/min, n=160). La tabla 1 muestra las características de cada grupo. La mayor parte de los pacientes del grupo CONTROL procedían de pacientes sin patología detectada o seguidos por hipertensión arterial o litiasis sin deterioro de la función renal.
Características demográficas y clínicas de los Grupos
Todos los procedimientos realizados en los estudios con participantes humanos se ajustaron a las normas éticas del comité de investigación institucional y/o nacional y a la declaración de Helsinki de 1964 y sus modificaciones posteriores o normas éticas comparables. La aprobación ética fue proporcionada por el Comité de Ética de la Universidad de Extremadura (#21/2014).
EstadísticaLos resultados se expresan como media±1 desviación estándar. Todas las pruebas estadísticas fueron de dos caras. Los valores de p inferiores a 0,05 se consideraron significativos. Para las comparaciones entre grupos, se utilizó la prueba ANOVA y el análisis post hoc de Bonferroni para las variables continuas y la prueba de X2 para las variables categóricas. Dado que la prueba Z de Kolmogorov-Smirnov determinó que la albuminuria no seguía una distribución normal, se utilizó la prueba de Kruskall-Wallis para comparar los valores. Estos parámetros se han expresado como mediana (rango intercuartílico [RI]).
Se utilizó el análisis de supervivencia de Kaplan-Meier para calcular la supervivencia antes de la muerte y de alcanzar el estadio V de la ERC según KDIGO o del tratamiento renal sustitutivo. Las asociaciones entre los tres subgrupos de pacientes y el riesgo de muerte o de alcanzar el tratamiento renal sustitutivo se evaluaron mediante el modelo de supervivencia de riesgos proporcionales de Cox. Se calcularon los cocientes de riesgos (CR) y los correspondientes intervalos de confianza (IC) de 95%, y se consideró que un valor p <0,05 era estadísticamente significativo. Todas las variables que alcanzaron un nivel de significación de p <0,1 en el análisis univariante se tuvieron en cuenta para su inclusión en la construcción del modelo de Cox. Los datos se analizaron con el programa estadístico IBM® SPSS ® Statistics V.21 (IBM Corporation, Armonk, NY, EE. UU.).
ResultadosLa mediana del tiempo de seguimiento fue de 72 meses (IQR 60-76). La cistatina plasmática media en el grupo CONTROL fue de 0,74±0,14mg/l, vs. 1,80±0,54 (grupo ERC) y 1,14±0,14mg/l (grupo CisA) (p <0,001 ANOVA). El grupo de control era más joven que los otros grupos (p <0,001, ANOVA). La excreción urinaria de albúmina fue mayor en el grupo con ERC que en los demás (véanse los valores y las significaciones en la tabla 1). La TFG media de la cistatina C fue de 67,0±7,8mL/min para el grupo CisA, 107,1±22,6 para el grupo control (p <0,001 vs. otros grupos, ANOVA) y 44,1±13,2 para el de ERC (p <0,001 vs. otros grupos, ANOVA); 18,1% de los enfermos en el grupo CONTROL vs. 20% de los pacientes en el grupo CisA padecían una enfermedad inflamatoria (tipo glomerulonefritis o vasculitis), la diferencia no es significativa (prueba de X2).
En el grupo ERC, 63,1% (IC 95%: 55,4-70,2) de los pacientes se encontraban en el estadio 3 KDIGO, 35,6% (IC 95%: 28,6-43,3) en el estadio 4, y solo dos en estadio 5 (1,25, IC 95%: 0,03-4,44). En el grupo CONTROL, 21,8% (IC 95%: 16,5-28,4) de los pacientes presentaban microalbuminuria y 12,8% (IC 95%: 8,7-18,3) macroalbuminuria; en el de ERC, 36,2% (IC 95%: 29,0-44,1) de los pacientes presentaban microalbuminuria y 40,8% (IC 95%: 33,3-48,8) macroalbuminuria; 8% (IC 95%: 33,3-48,7); y en el grupo CisA 42,1% (IC 95%: 27,9-57,8) de los pacientes tenían microalbuminuria y 18,4% (IC 95%: 9,2-33,4) macroalbuminuria (p <0,001, prueba de X2).
La supervivencia de Kaplan-Meier para la mortalidad general a los cinco años fue de 93,9% para el grupo CONTROL, de 78,8% para el grupo ERC y 82,3% en el grupo CisA (p <0,001, Log Rank test para la diferencia entre el grupo CONTROL y el CisA) (fig. 1). En cuanto a la supervivencia antes de iniciar el tratamiento renal sustitutivo o alcanzar el estadio V KDIGO, el método de Kaplan-Meier muestra una supervivencia a cinco años de 99,0% para el grupo CONTROL, de 73,0% para el grupo ERC y 94,3% en el grupo CisA (p <0,001 Log Rank para el grupo ERC, no hay diferencia entre CisA y CONTROL, p=0,08) (fig. 2). Cuando se realizó un análisis separado incluyendo en el grupo control solamente los pacientes que no presentaran albuminuria, la supervivencia a cinco años se incrementó hasta 97,0% (p<0.01, Log Rank).
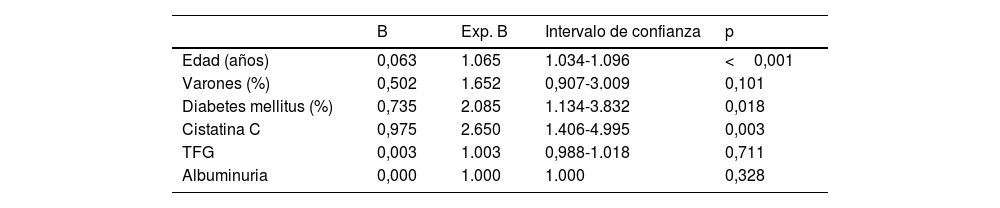
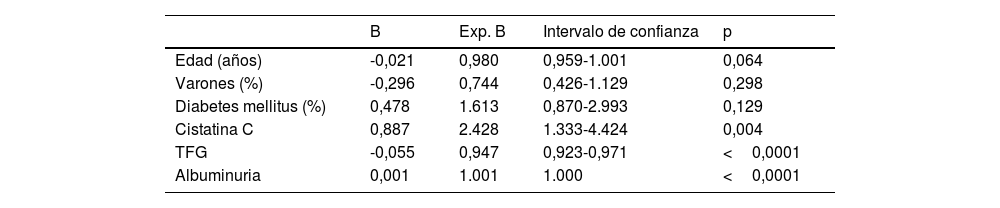
En la muestra global, tras ajustar por posibles factores de confusión, el análisis de Cox mostró una relación significativa de los niveles elevados de cistatina C con la mortalidad (p<0,001), solo la edad y la diabetes mellitus mostraron también una relación significativa (tabla 2). Por el contrario, tras ajustar por posibles factores de confusión, la supervivencia antes de llegar al tratamiento renal sustitutivo se asoció significativamente con los niveles de cistatina C (p=0,008), el FG medido por la ecuación CKD-EPI y la excreción urinaria de albúmina (véanse las significaciones en la tabla 3).
Análisis de Cox de la supervivencia vital
| B | Exp. B | Intervalo de confianza | p | |
|---|---|---|---|---|
| Edad (años) | 0,063 | 1.065 | 1.034-1.096 | <0,001 |
| Varones (%) | 0,502 | 1.652 | 0,907-3.009 | 0,101 |
| Diabetes mellitus (%) | 0,735 | 2.085 | 1.134-3.832 | 0,018 |
| Cistatina C | 0,975 | 2.650 | 1.406-4.995 | 0,003 |
| TFG | 0,003 | 1.003 | 0,988-1.018 | 0,711 |
| Albuminuria | 0,000 | 1.000 | 1.000 | 0,328 |
Análisis de Cox para supervivencia antes de tratamiento renal sustitutivo
| B | Exp. B | Intervalo de confianza | p | |
|---|---|---|---|---|
| Edad (años) | -0,021 | 0,980 | 0,959-1.001 | 0,064 |
| Varones (%) | -0,296 | 0,744 | 0,426-1.129 | 0,298 |
| Diabetes mellitus (%) | 0,478 | 1.613 | 0,870-2.993 | 0,129 |
| Cistatina C | 0,887 | 2.428 | 1.333-4.424 | 0,004 |
| TFG | -0,055 | 0,947 | 0,923-0,971 | <0,0001 |
| Albuminuria | 0,001 | 1.001 | 1.000 | <0,0001 |
Hemos observado que en un grupo de pacientes con niveles elevados de cistatina C en plasma y TFG superior a 60mL/min la mortalidad era mayor que en los pacientes con niveles normales de cistatina C y TFG> 60mL/min. Por el contrario, el riesgo de progresión de la ERC no fue mayor en el grupo CisA. Aquellos pacientes con niveles elevados de cistatina C y TFG reducida tienen el mayor riesgo de mortalidad y progresión a estadio V KDIGO de ERC o inicio de terapia renal sustitutiva.
El sistema renal desempeña varias funciones fisiológicas, pero la TFG se considera el mejor parámetro de la función renal global y, por este motivo, su evaluación se ha convertido en una herramienta importante en la práctica clínica. La TFG no puede medirse directamente, sino que debe estimarse mediante el aclaramiento de los marcadores de filtración8. En cualquier caso, la evaluación clínica de la TFG puede ayudar al clínico a estimar el grado de disfunción renal y/o la progresión de la enfermedad renal establecida. Se han desarrollado varias ecuaciones basadas en la creatinina en un intento de mejorar la estimación de la TFG a partir de la creatinina sérica. Las actuales directrices KDIGO recomiendan la ecuación CKD-EPI7, que es la que hemos seleccionado. A este respecto, la definición actual de ERC es un FG <60mL/min durante más de tres meses y éste es el umbral que se seleccionó para dividir los grupos de estudio9. También se aconseja el uso de la ecuación CKD-EPI combinada creatinina-cistatina C7, sin embargo, hemos creído conveniente evitarla en este estudio puesto que podría introducir cierto grado de confusión cuando precisamente intentábamos diferenciar el valor pronóstico de la TFG medida por creatinina y los niveles plasmáticos de cistatina C.
Los pacientes con ERC presentan un riesgo pronunciado de eventos cardiovasculares: 50% de todos los pacientes con ERC en estadios 4 a 5 presentan enfermedad cardiovascular y la mortalidad cardiovascular representa entre 40 y 50% de todas las muertes en pacientes con ERC avanzada (estadio 4), así como con enfermedad renal terminal (estadio 5), en comparación con 26% en controles con función renal normal. Las proporciones de muertes por insuficiencia cardiaca y valvulopatía aumentan con el descenso de la TFG, junto con las proporciones de muertes por causas infecciosas y de otro tipo, mientras que la proporción de muertes por cáncer disminuyó. El punto de corte utilizado fue, como en nuestro estudio, una TFG <60mL/min, pero la mortalidad aumenta especialmente cuando la TFG desciende de 45mL/min10. Por lo tanto, podría explicar por qué la mortalidad es mayor en el grupo con ERC, pero no puede arrojar luz sobre la relación entre los niveles plasmáticos más elevados de cistatina (y con un FG superior a 60mL/min) y la mortalidad.
La cistatina C es un marcador interesante para la estimación de la TFG. Ofrece varias ventajas sobre la creatinina u otras proteínas de peso molecular similar. Es producida por todas las células nucleadas del cuerpo humano y se considera que se produce constantemente. Tras ser filtrada sin restricciones por los glomérulos debido a su baja masa molecular y a la ausencia de unión a proteínas, la cistatina C es reabsorbida en su totalidad por los túbulos proximales, donde es catabolizada casi en su totalidad6. Las actuales directrices KDIGO para la ERC sugieren medir la cistatina C en adultos con un FG de 45-59mL/min/1,73 m2 que no presenten marcadores de daño renal si es necesario confirmar la ERC7. La cistatina C también es un marcardor del riesgo cardiovascular. Esta asociación persiste incluso con la exclusión adicional de personas con ERC o con microalbuminuria11.
Sin embargo, estas dos capacidades de la cistatina C no parecen estar correlacionadas en nuestro estudio. De hecho, la mortalidad se asoció de forma independiente con los niveles de cistatina C, pero esta relación no se encontró con la TFG o la albuminuria. Estos resultados pueden interpretarse de varias maneras. En primer lugar, las personas con niveles elevados de cistatina C, pero sin ERC pueden tener ERC preclínica y una elevada carga de factores de riesgo asociada similar a la de las personas con ERC. Debido al error de medición que conlleva la cuantificación de la TFG, también es posible que las personas con niveles elevados de cistatina C, pero con una TFG que no se encuentra en el intervalo de ERC se clasifiquen con mayor exactitud como pacientes renales utilizando los niveles de cistatina C12. No obstante, esta hipótesis parece poco probable, ya que la TFG calculada a partir de la cistatina C o de la creatinina arrojó resultados muy próximos. Además, la cistatina C -sin disminución de la TFG- no está asociada a la progresión de la ERC. Otra posibilidad es que la cistatina C elevada en personas sin ERC sea el resultado de fuentes extrarrenales de variabilidad de la cistatina C y que, por tanto, no estén relacionadas con la función renal. Existen algunas pruebas de que el nivel sérico de cistatina C es hereditario y los niveles séricos elevados de cistatina C se asociaron con la mayoría de los principales factores de riesgo de cardiovascular11.
El aumento de la excreción urinaria de albúmina en pacientes diabéticos es un factor predictivo de la progresión de la nefropatía diabética y también un potente factor de riesgo independiente de morbilidad y mortalidad cardiovascular13–15. En pacientes hipertensos no diabéticos, se ha demostrado que la excreción urinaria de albúmina predice eventos cardiovasculares, y en un estudio de población general se ha demostrado una relación continua entre la excreción urinaria de albúmina y la mortalidad cardiovascular, así como la mortalidad general16–20. Por lo tanto, actualmente se recomienda la búsqueda de microalbuminuria, debido a la evidencia de que puede ser un marcador sensible de daño en órganos diana, no solo en la diabetes sino también en la hipertensión21,22. Por lo tanto, la actual Guía de Práctica Clínica KDIGO para la Evaluación y el Tratamiento de la Insuficiencia Renal Crónica establece que se evalúen la TFG y la albuminuria al menos una vez al año en personas con Insuficiencia Renal Crónica. Además, la TFG y la albuminuria deben evaluarse con mayor frecuencia en los individuos con mayor riesgo de progresión y/o en aquellos casos en los que la medición influya en las decisiones terapéuticas5. En nuestro estudio, aunque una proporción significativa de sujetos en CONTROL y CisA presentaba un aumento de la excreción urinaria de albúmina, no se asoció al riesgo de mortalidad, pero sí se relacionó significativamente con la progresión de la ERC.
Existen aspectos biológicos y clínicos que limitan el uso de la cistatina C como la obesidad, la disfunción tiroidea, la inflamación sistémica y el tratamiento con corticosteroides11. Como hemos señalado más arriba, el porcentaje de pacientes con enfermedades inflamatorias, y por tanto de tratamiento con corticoides, era similar entre los grupos CONTROL y con Cistatina elevada sin reducción de FG. Existen pruebas contradictorias respecto al posible efecto de la diabetes mellitus sobre los valores séricos de cistatina C sérica. Aunque se relacionó positivamente con una mayor prevalencia de diabetes en adultos de mediana y avanzada edad, Magnusson et al.23,24 hallaron una asociación de la cistatina C en suero con el síndrome metabólico, pero no con la diabetes tipo 2. No obstante, las asociaciones causales con resultados adversos no pudieron demostrarse en estudios de asociación genómica, lo que indica que las concentraciones séricas elevadas de cistatina C principalmente reflejan daño renal25. Por otra parte, no había diferencias en el porcentaje de diabéticos entre grupo CONTROL y grupo con citatina C elevada aislada.
La limitación media de este estudio es el pequeño tamaño de la muestra con valores elevados de cistatina C y FG inferior a 60mL/min. No obstante, este tipo de pacientes son poco frecuentes en la práctica clínica y, por tanto, la información resultante para nuestros resultados cobra mayor importancia. De hecho, se han comunicado pocos datos sobre esta cuestión. Shlipak et al.12 utilizaron datos del Cardiovascular Health Study en el que, al inicio del estudio, 78% de los participantes tenían una TFG estimada> o=60mL/min. Las concentraciones de cistatina C mostraron fuertes asociaciones con la muerte, la muerte cardiovascular y los eventos cardiovasculares mayores entre estos participantes. Las concentraciones séricas de creatinina presentaron asociaciones mucho más débiles con cada resultado y solo predijeron la muerte cardiovascular. Este estudio no midió la albuminuria, por lo que el nuestro, que incluyó este parámetro, ofrece datos valiosos sobre la relación de la cistatina C y la mortalidad. Desgraciadamente, no hemos podido incluir en el estudio índices de comorbilidad, que hubieran podido ayudar a dilucidar el valor de la cistatina C aislada como factor de riesgo, aunque probablemente esta fuera ligeramente superior puesto que hay una diferencia de edad respecto al grupo control, pero no frente al grupo con TFG reducida.
El hecho de haber utilizado pacientes con hipertensión como controles, a pesar de su mayor riesgo cardiovascular, da mayor fortaleza a nuestros resultados.
ConclusionesLa cistatina C es un buen marcador de mortalidad en pacientes sin enfermedad renal definida como un FG inferior a 60mL/min. En este grupo de pacientes, ni el FG ni la albuminuria mostraron un efecto independiente. Por el contrario, la albuminuria y la TFG basal, así como la cistatina C, fueron marcadores pronósticos de la progresión de la enfermedad renal en pacientes con ERC. Los niveles plasmáticos aislados de cistatina C son un buen marcador de mortalidad, pero no se asocian a un mayor riesgo de ERC.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
FinanciaciónEste trabajo ha sido financiado en parte por las becas PI18/00745, PI22/00181 y RD21/0005/0031 del Instituto de Salud Carlos III, Madrid (España), financiadas por la Unión Europea-NextGeneration UE, Recovery and Resilience Mechanism; la subvención GR21026 de la Junta de Extremadura, Mérida (España) y el Fondo Europeo de Desarrollo Regional (FEDER) «Una manera de hacer Europa».