Diversas investigaciones relacionan la progresión del deterioro cognitivo leve (DCL) a demencia con factores de riesgo como la edad avanzada, trastornos vasculares y déficits cognitivos y funcionales, destacando que el subtipo amnésico es más propenso a la conversión. Las tasas anuales de progresión a demencia oscilan entre el 10% y 25%.
ObjetivoEste estudio examina los predictores clínicos y neuropsicológicos de la progresión del DCL a demencia, diferenciando entre los subtipos amnésico y multidominio.
Sujetos y métodoSe incluyó a 170 pacientes mayores de 60 años con quejas cognitivas, evaluados con pruebas neuropsicológicas que abarcaron memoria, atención, funciones ejecutivas, lenguaje, habilidades visuoespaciales y escalas de reserva funcional y cognitiva. Se realizaron resonancias magnéticas a 92 pacientes para evaluar el daño vascular.
ResultadosLa muestra tenía una edad promedio de 77,94 años e instrucción de 11,20 años. De los 170 pacientes, 140 (82,35%) fueron diagnosticados con DCL. En 24 meses, el 44,28% de los pacientes con DCL progresaron a demencia, siendo el subtipo amnésico el de mayor progresión. Los predictores significativos fueron el rendimiento en pruebas de memoria y funcionalidad compleja, así como la presencia de factores de riesgo vascular. Los principales factores de riesgo fueron hipertensión (60,89%), dislipemia (51,98%), y tabaquismo (49,29%).
ConclusionesSe identificaron predictores cognitivos específicos para cada subtipo de DCL, subrayando la relevancia del déficit en la funcionalidad compleja como posible indicador de progresión a demencia. Se enfatiza la necesidad de evaluaciones neuropsicológicas sistematizadas de seguimiento y la importancia de orientar a los pacientes sobre medidas preventivas.
Several studies relate the progression of mild cognitive impairment (MCI) to dementia with risk factors such as advanced age, vascular disorders, and cognitive and functional deficits, highlighting that the amnesic subtype is more prone to conversion. Annual rates of progression to dementia range from 10% to 25%.
ObjectiveThis study examines the clinical and neuropsychological predictors of the progression of MCI to dementia, differentiating between the amnesic and multidomain subtypes.
Subjects and method170 patients over 60 years of age with cognitive complaints were included, evaluated with neuropsychological tests that included memory, attention, executive functions, language, visuospatial skills and functional and cognitive reserve scales. MRI scans were performed on 92 patients to assess vascular damage.
ResultsThe sample had a mean age of 77.94 years and an education of 11.20 years. Of the 170 patients, 140 (82.35%) were diagnosed with MCI. In 24 months, 44.28% of patients with MCI progressed to dementia, with the amnesic subtype being the one with the greatest progression. Significant predictors were performance on memory tests and complex functionality, as well as the presence of vascular risk factors. The main risk factors were hypertension (60.89%), dyslipidemia (51.98%), and smoking (49.29%).
ConclusionsSpecific cognitive predictors were identified for each subtype of MCI, underlining the relevance of deficit in complex functionality as a possible indicator of progression to dementia. The need for systematized follow-up neuropsychological evaluations and the importance of guiding patients on preventive measures are emphasized.
Múltiples estudios han mostrado evidencia clínica de la progresión del deterioro cognitivo leve (DCL) a enfermedad demencial, asociada a diversos factores como mayor edad, compromiso vascular, trastornos cognitivos, funcionales, psiquiátricos y asimismo factores genéticos y la presencia de biomarcadores tempranos1–3.
La prevalencia de DCL es variable, abarca desde un 3% a un 42% y aumenta con la edad, con una tasa de progresión anual a demencia del 10% al 25% en la población mayor de 65 años4–6. Estudios anteriores de metaanálisis verifican una tasa de progresión del 28,9% en 41 estudios de cohortes y del 33,6% en estudios poblacionales y ensayos clínicos7.
Otras investigaciones clínicas muestran diferencias en la probabilidad de progresión a demencia en relación con los subtipos de DCL: DCL amnésico (DCLa) y DCL multidominio (DCLm), con una mayor conversión a demencia en el subtipo amnésico con un perfil neuropsicológico hipocampal8–12. En un estudio reciente sobre un total de 462 pacientes adultos mayores con DCL, en un seguimiento de 33 meses, 190 sujetos progresaron a demencia, el 49% de los DCLa y el 28% de los DCL no amnésico13.
A su vez, investigaciones actuales corroboran una diferencia de progresión del DCL, referido al grado de déficit mnésico en tareas de memoria episódica. Se caracterizan dos grupos clínicos, DCL temprano y DCL tardío, siendo este último en el que se registró mayor progresión a demencia14,15.
Del mismo modo, es de marcado interés el estudio de aquellos pacientes que revirtieron su cuadro inicial de DCL a un estado normal. Un metaanálisis sobre 25 estudios mostró que un 25% de los pacientes revirtieron de DCL a una cognición normal. Se asociaron con la reversión del cuadro variables significativas como la edad más joven, ausencia del alelo APOE ɛ4, puntuación CDR-SOB más baja y puntuaciones más altas en las pruebas de memoria/lenguaje16,17.
Asimismo, existe evidencia sobre el daño vascular asociado al DCL, y su posible incidencia en la progresión del deterioro cognitivo. Se señala a la patología cerebrovascular como uno de los mayores factores de riesgo de demencia que se presenta con frecuencia asociada a patologías neurodegenerativas. Los factores de riesgo como la hipertensión, la hipercolesterolemia, la diabetes y el tabaquismo en la mediana edad están asociados a un aumento del riesgo de demencia entre un 20% y un 40%18.
Entre las variables que anticipan la progresión del deterioro cognitivo a demencia se han estudiado los marcadores predictivos, tanto cognitivos como conductuales. Un interesante estudio asoció el DCL con trastornos del comportamiento. Concluye que la presencia de trastornos neuropsiquiátricos en el cuadro de DCL se asocia con un mayor riesgo de progresión a demencia y una probabilidad significativamente reducida de revertir a cognición normal6.
Otros trabajos destacan el valor de las pruebas cognitivas como variables predictivas de progresión19. Un estudio de metaanálisis realizado por Belleville et al. en 2017 muestra valores predictivos de 61 pruebas neuropsicológicas con un seguimiento medio de 31 meses, sobre 2365 participantes20. Las medidas de memoria verbal (67,6% de sensibilidad y 84,7% de especificidad) y lenguaje (denominación y fluencia verbal) arrojaron una precisión predictiva muy alta. La escala Free and Cued Selective Reminding Test (FCSRT) creada por Buschke en 198421, que mide memoria episódica verbal, mostró un alto valor predictivo para detectar Alzheimer prodrómico. Otros dominios como funciones ejecutivas y memoria visual mostraron mejor especificidad que sensibilidad. La precisión predictiva fue mayor cuando se combinaron medidas de memoria con otros dominios o cuando se administraron baterías cognitivas amplias.
En un trabajo previo de nuestro equipo, mostramos los resultados de un estudio de seguimiento de 518 pacientes con queja cognitiva, de los cuales el 29,9% progresaron a demencia22. Se identificaron al menos 3 variables predictoras de progresión: la edad, el nivel de instrucción y el perfil cognitivo, que mostró fallas en las escalas de memoria, especialmente en su fase diferida, en las pruebas de fluidez verbal y en la habilidad visomotora.
Como vimos se han estudiado factores múltiples asociados a la progresión de DCL a demencia. Sin embargo, hay escasos trabajos en nuestro medio que identifiquen las fallas específicas del sistema cognitivo y funcional y sus correlaciones con otros factores y variables clínicas. Considerando las limitaciones de acceder a estudios de neuroimágenes y/o biomarcadores destacamos el valor clínico de identificar marcadores cognitivo-funcionales que tengan un valor predictor de progresión a demencia.
Teniendo en cuenta la revisión bibliográfica antes mencionada, donde se sugiere por un lado la utilización de baterías neuropsicológicas amplias, con la administración de escalas con alta especificidad de predicción, especialmente en el dominio mnésico, y asimismo lo reportado sobre el daño vascular como uno de los marcadores de progresión, realizamos este nuevo estudio de seguimiento que tiene en cuenta estas variables así como las medidas de reserva cognitiva y el estudio específico de la funcionalidad compleja.
En este estudio de seguimiento de una población de pacientes con diagnóstico de DCL nuestros objetivos fueron detectar los factores clínicos y de reserva cognitiva, la presencia de daño vascular y las variables neuropsicológicas asociadas a la progresión a demencia, discriminando los subtipos amnésico y multidominio de DCL.
MetodologíaSe incluyeron 170 pacientes mayores de 60 años que consultaron por queja cognitiva en la Unidad de Evaluación Funcional del Adulto Mayor del Hospital Italiano de Buenos Aires, entre los años 2019 y 2021. Se excluyeron aquellos pacientes con diagnóstico de depresión mayor, déficits sensoriales no compensados, epilepsia y tumores del sistema nervioso central. Todas las evaluaciones contaron con el consentimiento oral de todos los pacientes.
Se administró una evaluación geriátrica integral al total de la muestra que incluye el relevamiento del desempeño cognitivo funcional y estado anímico. La evaluación cognitiva recabó información sobre el dominio mnésico con el Free and Cued Selective Reminding Test en la versión para el español rioplatense: Prueba de recuerdo libre/facilitado de palabras con recuerdo inmediato23; Tareas atencionales: Dígitos directos e inversos, Trail Making A (TMA); Función ejecutiva: test del Reloj, Trail Making B (TMB); Lenguaje: Fluencia semántica y fonológica, Denominación de Boston y visuoespaciales: Copia de la figura compleja de Rey. Las escalas funcionales fueron: AVDI, DAD y Estudio funcional extendido (EFE). Asimismo, se administraron las escalas de depresión geriátrica de Yesavaye y una escala de reserva cognitiva (CRI). Se relevaron las comorbilidades: hipertensión arterial, diabetes, dislipemia, ACV, alcoholismo, tabaquismo y caídas. Un total de 92 pacientes contaron con estudio de resonancia magnética (RM) con valoración del grado de daño vascular según la escala de Fazekas.
Sobre los pacientes que fueron diagnosticados con DCL utilizando los criterios de Petersen4 se realizó un seguimiento de 24 meses y se identificó a los pacientes que evolucionaron a demencia.
Considerando los criterios de Alzheimer's Disease Neuroimaging Initiative (ADNI) se clasificó a los pacientes según el grado de deterioro en las pruebas de memoria episódica en: DCL temprano: rendimiento entre 1 y 1,5 DE por debajo de la media normativa y DCL tardío: rendimiento de 1,5 DE por debajo la media normativa24.
Para el análisis de datos se utilizó el test ANOVA, análisis de regresión lineal múltiple (RLM) y análisis de componentes principales (PCA). El RLM tuvo como variable objetivo predecir demencia vs. no demencia. Luego se analizaron las variables de mayor correlación con el resultado, en especial aquellas debajo del umbral de significación estadística. El análisis de componentes principales se realizó a fin de evaluar la estructura de relaciones entre las variables, principalmente de aquellas que correlacionen con el target demencia vs. no demencia.
ResultadosCaracterísticas del total de la muestra: edad, M 77,94 años (DE 6,05); instrucción: M 11,20 años (DE 4,54), el 64% fueron mujeres. Factores de riesgo: hipertensión arterial 60,89%, dislipemia 51,98%, antecedentes de tabaquismo 49,29%.
Del total inicial de la muestra, 30 pacientes (17,64%) no presentaron deterioro cognitivo, 140 pacientes (82,35%) fueron diagnosticados con DCL. Según el subtipo se diagnosticaron 96 DCLm (68,57%) y 44 DCLa (31,42%). Según el grado de compromiso mnésico, 89 DCL temprano (63,57%) y 51 DCL tardío (36,43%).
En el seguimiento de los 140 pacientes con DCL a los 24 meses, 71 (50,71%) se mantuvieron estables en cuanto al diagnóstico, 62 pacientes (44,28%) evolucionaron a demencia (IC 95% 36-53) y 7 pacientes revirtieron a cognición normal (5%).
En la evaluación basal el grupo que progresó a demencia mostró puntajes más bajos en las medidas cognitivas y funcionales que los que se mantuvieron estables.
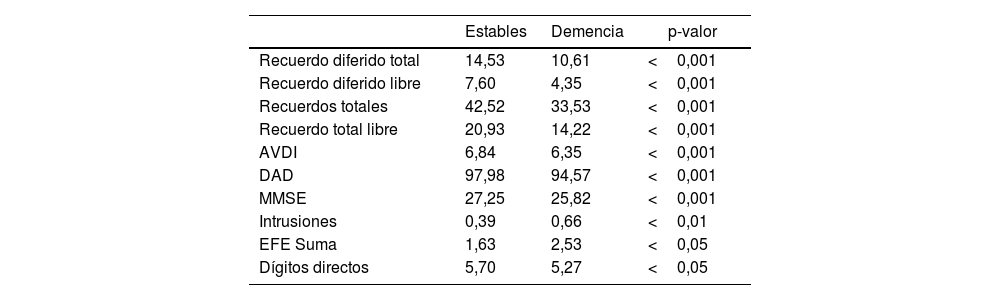
Las tareas en las que se registraron diferencias significativas entre las medias se correspondieron en un primer lugar con el rendimiento mnésico (recuerdo diferido y otras medidas de recuerdo de la Prueba de recuerdo libre/facilitado de palabras), con la presencia de intrusiones en la fase de recuerdo libre en aquellos que progresaron. Asimismo, se registraron diferencias en el desempeño funcional complejo (AVDI, DAD, y EFE), el puntaje total del MMSE y la tarea atencional de dígitos directos (tabla 1).
Diferencias entre medias de pacientes estables y que progresaron a demencia ordenados por grado de significación
| Estables | Demencia | p-valor | |
|---|---|---|---|
| Recuerdo diferido total | 14,53 | 10,61 | <0,001 |
| Recuerdo diferido libre | 7,60 | 4,35 | <0,001 |
| Recuerdos totales | 42,52 | 33,53 | <0,001 |
| Recuerdo total libre | 20,93 | 14,22 | <0,001 |
| AVDI | 6,84 | 6,35 | <0,001 |
| DAD | 97,98 | 94,57 | <0,001 |
| MMSE | 27,25 | 25,82 | <0,001 |
| Intrusiones | 0,39 | 0,66 | <0,01 |
| EFE Suma | 1,63 | 2,53 | <0,05 |
| Dígitos directos | 5,70 | 5,27 | <0,05 |
En relación con los subtipos de DCL encontramos que de los 96 DCLm, 30 progresaron a demencia (31,25%,), y de los 44 DCLa, evolucionaron 32 (72,73%).
Según el grado de severidad del déficit mnésico medido por la prueba de recuerdo libre/facilitado, de los 89 DCL temprano 25 progresaron a demencia (28%) y de los 51 DCL tardíos, progresaron 37 (72,54%).
Resultados teniendo en cuenta el daño vascularSe realizó un análisis teniendo en cuenta a los 92 pacientes que contaban con RM, con valoración del daño vascular según grado de Fazekas, clasificándolos en: Sin daño vascular (SDV, Fazekas 0-1) y con daño vascular (DV, Fazekas 2-3). Del total de dicha muestra 30 tenían DV (32,6%), de los cuales 14 progresaron a demencia (7 DCLa y 7 DCLm).
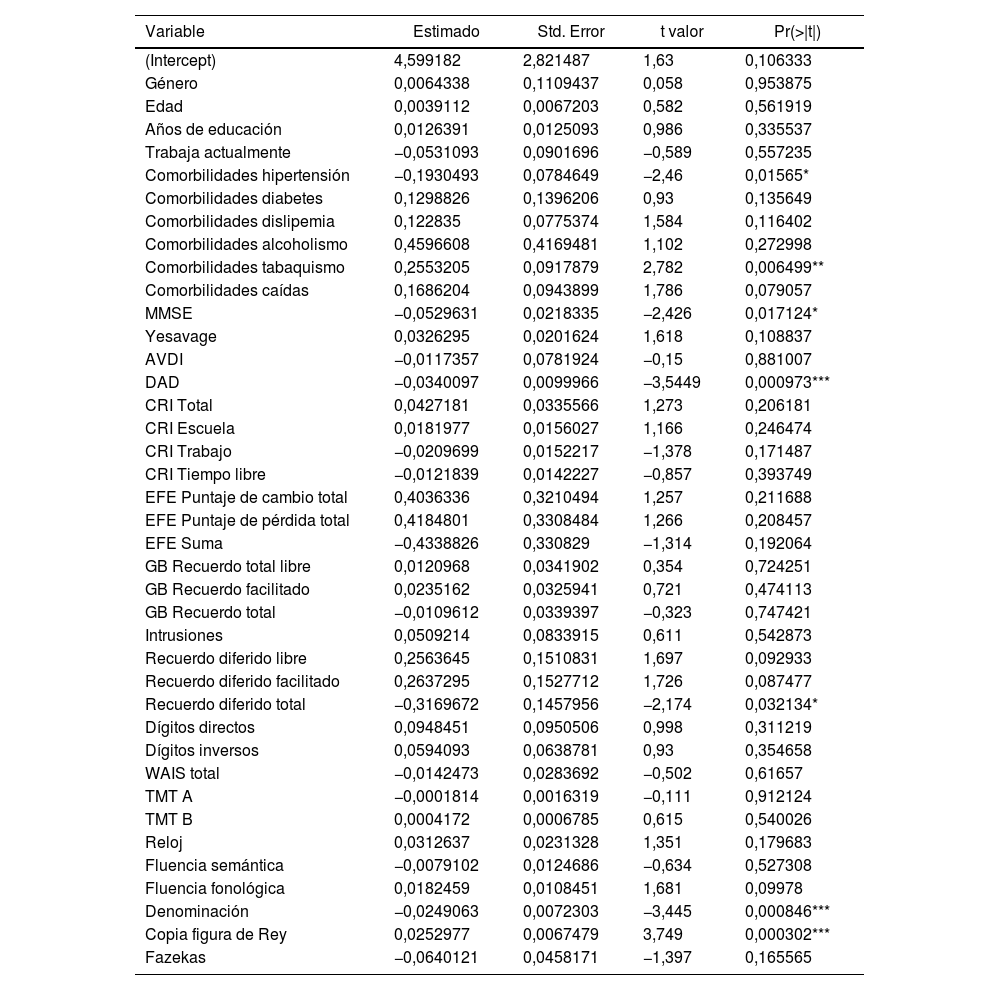
Regresión lineal múltiple del total de la muestra (tabla 2)Las variables que predicen mejor el pasaje a demencia tanto en amnésicos como en multidominio son: DAD, denominación, copia de Figura del Rey, en primer lugar, con un p-valor inferior a 0,001; comorbilidad de tabaquismo, en segundo lugar, con un p-valor inferior a 0,01, y por último, el MMSE, el recuerdo diferido total y comorbilidad hipertensión arterial con un p-valor inferior a 0,05.
RLM del total de la muestra
| Variable | Estimado | Std. Error | t valor | Pr(>|t|) |
|---|---|---|---|---|
| (Intercept) | 4,599182 | 2,821487 | 1,63 | 0,106333 |
| Género | 0,0064338 | 0,1109437 | 0,058 | 0,953875 |
| Edad | 0,0039112 | 0,0067203 | 0,582 | 0,561919 |
| Años de educación | 0,0126391 | 0,0125093 | 0,986 | 0,335537 |
| Trabaja actualmente | −0,0531093 | 0,0901696 | −0,589 | 0,557235 |
| Comorbilidades hipertensión | −0,1930493 | 0,0784649 | −2,46 | 0,01565* |
| Comorbilidades diabetes | 0,1298826 | 0,1396206 | 0,93 | 0,135649 |
| Comorbilidades dislipemia | 0,122835 | 0,0775374 | 1,584 | 0,116402 |
| Comorbilidades alcoholismo | 0,4596608 | 0,4169481 | 1,102 | 0,272998 |
| Comorbilidades tabaquismo | 0,2553205 | 0,0917879 | 2,782 | 0,006499** |
| Comorbilidades caídas | 0,1686204 | 0,0943899 | 1,786 | 0,079057 |
| MMSE | −0,0529631 | 0,0218335 | −2,426 | 0,017124* |
| Yesavage | 0,0326295 | 0,0201624 | 1,618 | 0,108837 |
| AVDI | −0,0117357 | 0,0781924 | −0,15 | 0,881007 |
| DAD | −0,0340097 | 0,0099966 | −3,5449 | 0,000973*** |
| CRI Total | 0,0427181 | 0,0335566 | 1,273 | 0,206181 |
| CRI Escuela | 0,0181977 | 0,0156027 | 1,166 | 0,246474 |
| CRI Trabajo | −0,0209699 | 0,0152217 | −1,378 | 0,171487 |
| CRI Tiempo libre | −0,0121839 | 0,0142227 | −0,857 | 0,393749 |
| EFE Puntaje de cambio total | 0,4036336 | 0,3210494 | 1,257 | 0,211688 |
| EFE Puntaje de pérdida total | 0,4184801 | 0,3308484 | 1,266 | 0,208457 |
| EFE Suma | −0,4338826 | 0,330829 | −1,314 | 0,192064 |
| GB Recuerdo total libre | 0,0120968 | 0,0341902 | 0,354 | 0,724251 |
| GB Recuerdo facilitado | 0,0235162 | 0,0325941 | 0,721 | 0,474113 |
| GB Recuerdo total | −0,0109612 | 0,0339397 | −0,323 | 0,747421 |
| Intrusiones | 0,0509214 | 0,0833915 | 0,611 | 0,542873 |
| Recuerdo diferido libre | 0,2563645 | 0,1510831 | 1,697 | 0,092933 |
| Recuerdo diferido facilitado | 0,2637295 | 0,1527712 | 1,726 | 0,087477 |
| Recuerdo diferido total | −0,3169672 | 0,1457956 | −2,174 | 0,032134* |
| Dígitos directos | 0,0948451 | 0,0950506 | 0,998 | 0,311219 |
| Dígitos inversos | 0,0594093 | 0,0638781 | 0,93 | 0,354658 |
| WAIS total | −0,0142473 | 0,0283692 | −0,502 | 0,61657 |
| TMT A | −0,0001814 | 0,0016319 | −0,111 | 0,912124 |
| TMT B | 0,0004172 | 0,0006785 | 0,615 | 0,540026 |
| Reloj | 0,0312637 | 0,0231328 | 1,351 | 0,179683 |
| Fluencia semántica | −0,0079102 | 0,0124686 | −0,634 | 0,527308 |
| Fluencia fonológica | 0,0182459 | 0,0108451 | 1,681 | 0,09978 |
| Denominación | −0,0249063 | 0,0072303 | −3,445 | 0,000846*** |
| Copia figura de Rey | 0,0252977 | 0,0067479 | 3,749 | 0,000302*** |
| Fazekas | −0,0640121 | 0,0458171 | −1,397 | 0,165565 |
Los asteriscos indican niveles de significación:
En el grupo DCLa se verifica una diferencia entre variables entre aquellos pacientes que progresaron a demencia vs. los que no progresaron.
En el CP1, los DCLa que se mantuvieron estables se asociaron a mejores resultados en las subescalas de la prueba de recuerdo libre/facilitado de palabras recuerdo inmediato (libre 0,78, facilitado 0,85 y total 0,95), recuerdo diferido (libre 0,77, facilitado 0,72 y total 0,93), MMSE (0,39) y menor cantidad de intrusiones (−0,47).
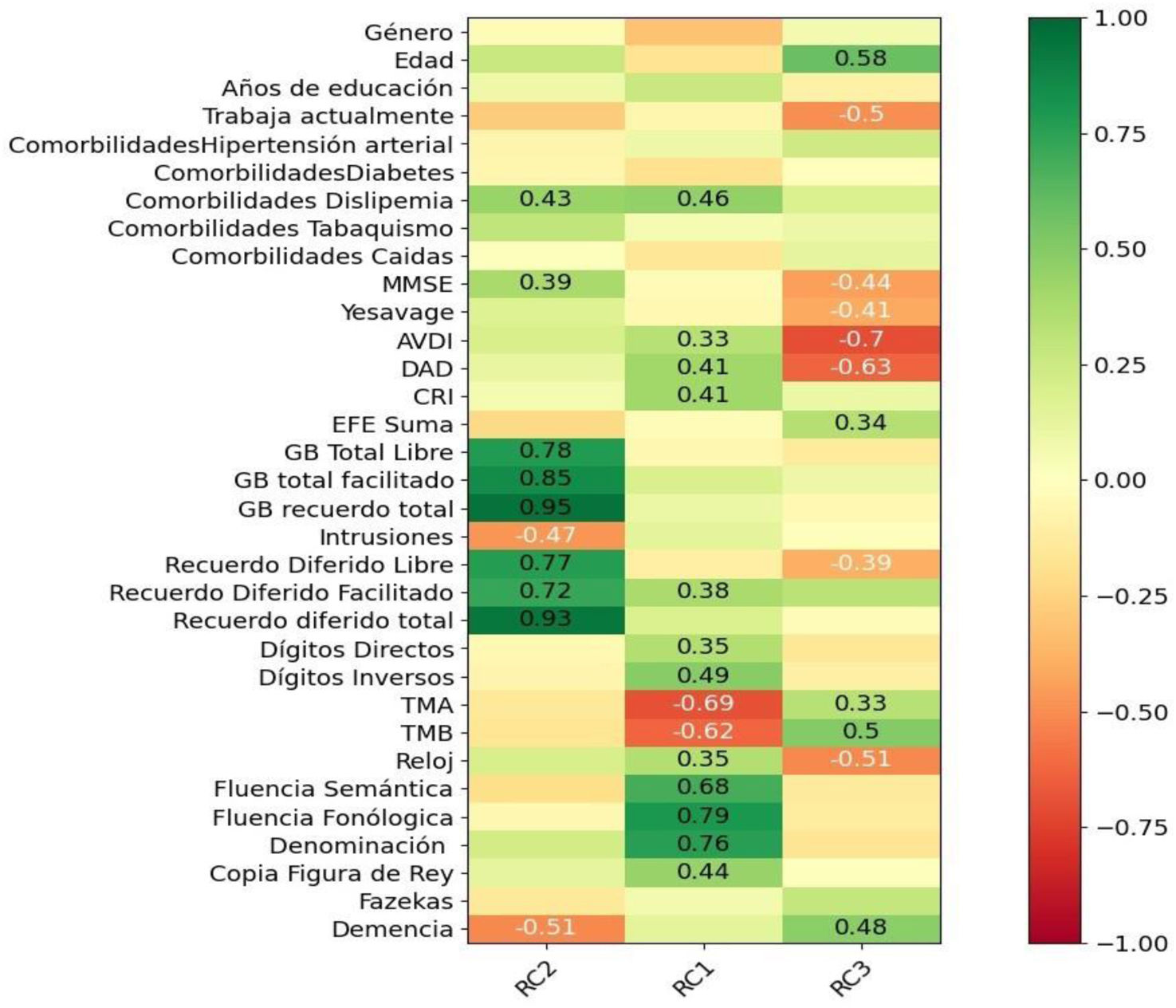
En CP3 se asociaron los DCLa que progresaron a demencia, con menores resultados en DAD (−0,63), AVDI (−0,70), mayor edad (0,58), no trabajar actualmente (0,50), menores puntajes en el test del Reloj (−0,51), en MMSE (−0,44), recuerdo diferido libre (−0,39), escala Yesavage (−0,41), EFE (0,34), TMT A (0,33) y TMB (0,50) (fig. 1).
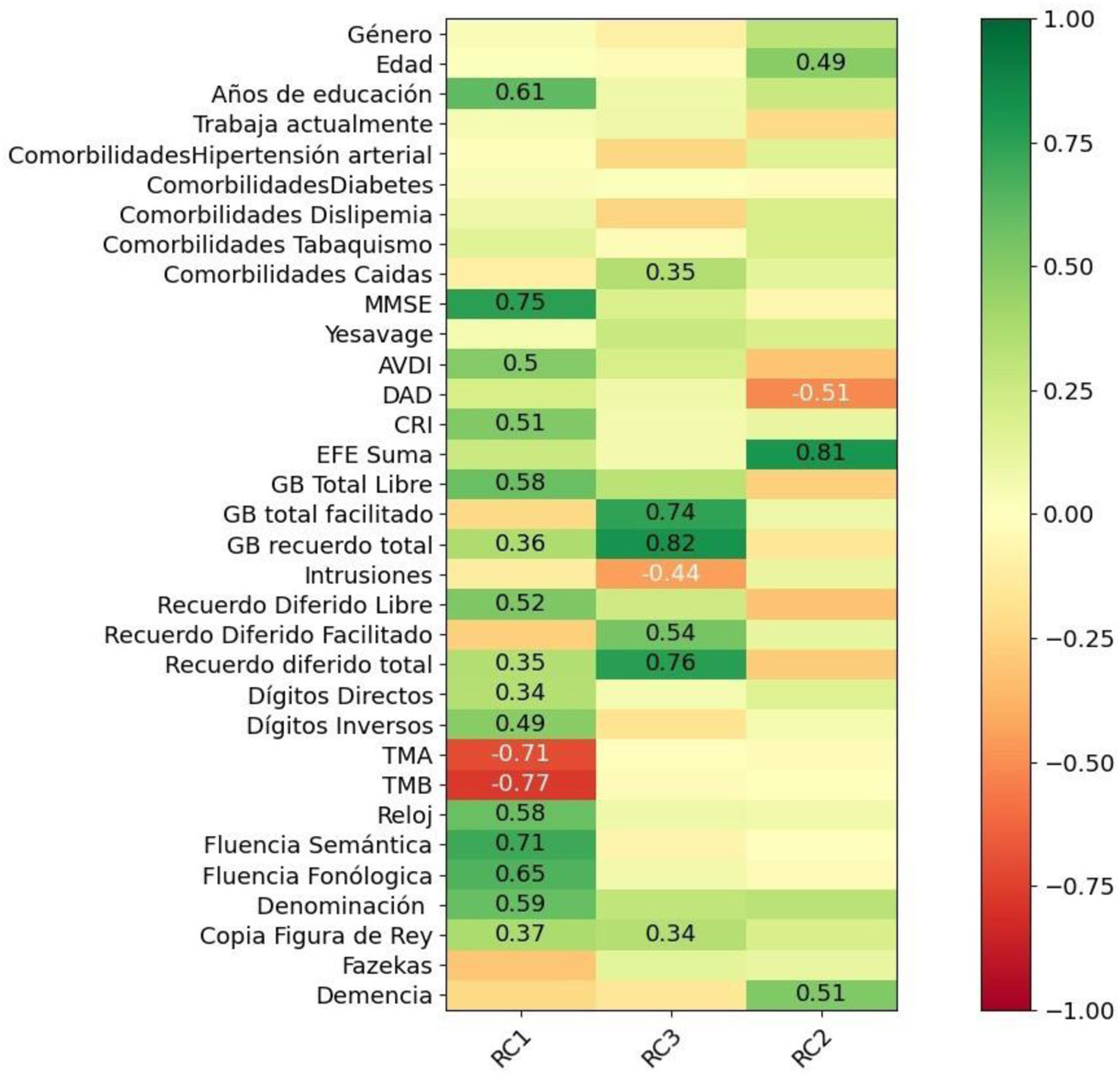
En los pacientes con DCLm que se mantuvieron estables el ACP mostró los siguientes resultados: en el CP1 se asociaron los DCLm con mayores puntajes en MMSE (0,75), CRI (0,51), AVDI (0,50), recuerdo total libre (0,58), recuerdo diferido libre (0,52), dígitos directos (0,34), dígitos inversos (0,49), test del Reloj (0,58), fluencia semántica (0,71), fluencia fonológica (0,65), denominación (0,59), copia de figura compleja de Rey (0,37), TMA (−0,71), TMB (−0,77) y con un mayor nivel educativo (0,61). En el CP2 se asociaron los DCLm que progresaron a demencia (0,51), con peor puntaje total del EFE, en una asociación robusta (0,81), un menor puntaje en el DAD (−0,51) y con una mayor edad (0,49) (fig. 2).
DiscusiónLos resultados obtenidos muestran que más del 40% de los pacientes con DCL evolucionaron a demencia en un lapso de 24 meses desde la evaluación inicial. La población con mayor progresión fue la de DCLa. Estos hallazgos coinciden con estudios previos4–6, que reportan una tasa anual de progresión a demencia entre el 25% y 30%, especialmente en pacientes con mayor compromiso mnésico. Aunque no se pudo determinar el inicio exacto del DCL en nuestra población, la severidad del déficit mnésico sugiere un inicio temprano en los casos más graves.
El estudio longitudinal de Espinosa, con 550 pacientes, mostró que el subtipo DCLa tuvo un riesgo 8,5 veces mayor de conversión a demencia en comparación con el DCL no amnésico. Maioli et al. también reportaron tasas de conversión anuales del 38% para DCLa y del 20% para DCL no amnésico, con un mayor riesgo en pacientes mayores con puntuaciones MMSE más bajas y mayor atrofia en neuroimagen8. Estos resultados destacan la importancia de identificar pacientes de alto riesgo.
En nuestra investigación, los pacientes que progresaron a demencia mostraron puntajes más bajos en escalas cognitivas y funcionales, especialmente en tareas de memoria episódica verbal. Estudios anteriores de Labos et al. también encontraron que mayor edad y menor nivel educativo en la evaluación basal se asociaron con progresión a demencia. Las pruebas de cribado mostraron peor rendimiento en MMSE, memoria, funciones ejecutivas y lenguaje en pacientes que progresaron22.
Otros trabajos confirman estos hallazgos, y en nuestra población, la prueba de recuerdo libre/facilitado de palabras fue efectiva para detectar déficit. Las intrusiones fueron más frecuentes en el grupo DCLa que progresó. Coincidiendo con otros trabajos encontramos un mayor porcentaje de progresión a demencia en DCLa respecto a DCLm, destacando el papel de la memoria episódica verbal como marcador de progresión.
La severidad de los trastornos mnésicos se asoció con un mayor déficit funcional en tareas complejas. Según Petersen, los criterios diagnósticos para DCLa incluyen queja de memoria corroborada, deterioro de memoria relativo a la edad y nivel educativo, función cognitiva global normal, normalidad en actividades diarias y ausencia de demencia4. Sin embargo, Jekel et al. mostraron una disminución en actividades instrumentales y complejas en pacientes con DCL25.
Nuestro grupo ha estudiado las fallas funcionales en DCL, elaborando la escala EFE que cuantifica cambios y pérdidas en relación con un estado anterior, detectando déficit en funcionalidad compleja, propuesto como deterioro funcional leve26,27.
En relación con la variable daño vascular, vimos que se verificó en un bajo porcentaje de la muestra y obtuvo una significación clínica independientemente del tipo de DCL, ya que incidió de igual modo en los DCL multidominio que en los amnésicos.
En un trabajo anterior con 346 pacientes con DCL, la edad y el MMSE se asociaron con Fazekas alto y daño vascular severo28.
En este estudio las escalas cognitivas predictivas incluyeron la prueba de recuerdo diferido y la prueba de recuerdo libre/facilitado de palabras, el MMSE y tareas atencionales.
Las escalas funcionales predictivas se relacionaron con peor desempeño en funcionalidad compleja (AVDI, DAD, y EFE) en ambos tipos de DCL. En DCLa, las escalas predictivas incluyeron el test del Reloj, Trail Making A, Recuerdo diferido, MMSE, EFE y DAD. En DCLm, la progresión se asoció con peor puntaje en EFE, DAD y mayor edad.
Diferencias en los marcadores de progresión entre DCL amnésico y multidominio fueron observadas, con el hallazgo común del trastorno funcional complejo.
La reserva cognitiva se identificó como factor protector en la no progresión a demencia, sugiriendo que el mantenimiento cognitivo y funcional es clave.
Estos hallazgos son importantes para evaluar el pronóstico en DCL, indicando que una mejor cognición y funcionalidad son factores protectores de progresión.
ConclusiónEste estudio de 24 meses de seguimiento de pacientes con DCL mostró una progresión a demencia del 44,28%, siendo mayor en el subtipo DCLa. Se identificaron predictores cognitivos diferenciados entre ambos subtipos de DCL, destacando el déficit en la funcionalidad compleja como un posible predictor de progresión a demencia en ambos tipos. Los resultados sugieren que las fallas ejecutivas predicen la pérdida de independencia funcional en individuos con deterioro cognitivo.
Las escalas predictoras de progresión más significativas fueron la DAD y la EFE a nivel funcional, y la prueba de recuerdo libre/facilitado de palabras en sus fases inmediata y diferida a nivel cognitivo. Estos resultados coinciden con otras investigaciones que destacan la importancia de identificar predictores de progresión de bajo costo económico.
El presente estudio sugiere la necesidad de implementar evaluaciones neuropsicológicas sistematizadas en la clínica, que incluyan escalas de funcionalidad compleja y de memoria para detectar amnesia hipocampal.
Asimismo, se sugiere una reflexión sobre la transmisión diagnóstica respecto a la posible progresión a demencia, ya que el tema de la trasmisión diagnóstica conlleva muchas controversias, sobre todo en el momento actual donde el diagnóstico temprano de enfermedad de Alzheimer se realiza en pacientes prácticamente asintomáticos a nivel cognitivo y funcional en su vida cotidiana29.
Finalmente, se enfatiza la importancia de identificar predictores cognitivo-funcionales en etapas tempranas para facilitar la prevención y seguimiento de pacientes con DCL.
FinanciaciónEsta investigación fue financiada por la Universidad de Buenos Aires.
Conflicto de interesesNinguno.