Introducción
En diversos estudios recientes se estima que el 7,7-8,3 % de la población de Estados Unidos utiliza alguna forma de medicina complementaria o alternativa 1-3. Es probable que alrededor del 30-40 % de estos individuos reciba manipulación vertebral 1. Pruebas potentes respaldan el uso de esta técnica para aliviar a los pacientes con lumbalgia aguda y dolor cervical 4,5. Aunque se han descrito, los beneficios de la manipulación vertebral sobre otros procesos son menos claros, como la lumbalgia crónica y los procesos viscerales 4,6-8. A pesar de las pruebas clínicas de los beneficios y el uso difundido evidente de la manipulación vertebral, se desconocen los mecanismos biológicos que son la base de sus efectos. Aunque esto no niega los efectos clínicos de la manipulación vertebral, impide su aceptación por parte de las comunidades científicas y de asistencia sanitaria más amplias, y dificulta que se establezcan estrategias racionales para mejorar su provisión. El objetivo del presente artículo de revisión es examinar la base neurofisiológica y los efectos neurofisiológicos de la manipulación vertebral.
Consideraciones biomecánicas de la manipulación vertebral
Por su naturaleza, la manipulación vertebral es una energía mecánica dirigida a los tejidos de la columna vertebral. En Estados Unidos los quiroprácticos proporcionan más del 90 % de estas manipulaciones 9. La manipulación vertebral se distingue en diversos aspectos de la movilización vertebral 10. Durante la manipulación vertebral, el terapeuta produce un movimiento de impulso (thrust) dinámico en una vértebra específica. El terapeuta controla la velocidad, magnitud y dirección del impulso 11. El arte o la habilidad de la manipulación vertebral reside en la capacidad del terapeuta para controlar estos 3 factores una vez se establece contacto específico con una vértebra. En ocasiones se utilizan técnicas de movilización como preparación de la manipulación. Ésta también se distingue de la movilización porque se proporciona en el extremo o casi el extremo de la amplitud fisiológica del movimiento (los llamados límites parafisiológicos 12), pero sin superar los límites anatómicos del movimiento. Con frecuencia se escucha un ruido de chasquido o crujido, aunque no necesariamente acompaña a la manipulación, ya que el mecanismo de separación de las superficies articulares (decoaptación) crea una cavitación que provoca el "estallido" de la burbuja de gas originada de la descompresión del líquido sinovial 13,14.
La forma más habitual de manipulación vertebral usada por los quiroprácticos es un movimiento de impulso de baja amplitud, alta velocidad y brazo de palanca corto 15. El terapeuta suele proporcionar el impulso dinámico a través de un brazo de palanca corto con la contracción manual de los tejidos paraespinales que recubren las apófisis espinosas, transversas o mamilares de la vértebra que se está manipulando. Por otra parte, el terapeuta contacta con los tejidos que recubren la lámina o el pilar articular de la vértebra. Para manipular la pelvis, se utiliza la espina ilíaca o la espina isquial 10. La manipulación vertebral también puede proporcionarse a través de un brazo de palanca larga. Mientras que una mano puede contactar con un área específica sobre la vértebra que se está manipulando, la otra mano contacta con un área del cuerpo distante del contacto específico. La fuerza se desarrolla a través de este brazo de palanca larga. Sin embargo, el uso del brazo de palanca corta aplicado directamente sobre la vértebra reduce a un mínimo la fuerza necesaria para lograr la manipulación 10 reduciendo la cantidad de tejido distensible a través del cual debe transmitirse la fuerza.
Diversos laboratorios han estudiado las características biomecánicas de la manipulación de palanca corta, alta velocidad y baja amplitud. El grupo de Herzog 16 fue el primero en describir las características biomecánicas de la manipulación vertebral en una revista indexada. Identificaron 2 características comunes a la provisión de manipulación vertebral: a) una fuerza de precarga seguida de; b) una mayor fuerza del impulso. Utilizando 2 quiroprácticos cuantificaron la fuerza de precarga y la fuerza de impulso máxima, aplicadas perpendicularmente al punto de contacto y la duración del impulso durante la manipulación de la articulación sacroilíaca. Las fuerzas de precarga y carga variaron desde 20 a 180 N, y las fuerzas máximas variaron desde 220 a 550 N. Con frecuencia, la precarga fue aproximadamente el 25 % de la carga del impulso. La duración del impulso de alta velocidad varió desde 200 a 420 ms (milisegundos).
Diversos estudios han confirmado el perfil de fuerza-tiempo descrito inicialmente por Hessel et al 16. Herzog et al 17 demostraron que el tiempo hasta alcanzar el impulso máximo fue similar durante la manipulación de las vértebras torácicas y de la articulación sacroilíaca (alrededor de 150 ± 77 ms [media ± DE]). La precarga aplicada perpendicularmente y las fuerzas de impulso máximas también fueron similares durante las manipulaciones vertebrales aplicadas a la región torácica (139 ± 46 frente a 88 ± 78 N, respectivamente) y sacroilíaca (328 ± 78 frente a 399 ± 119 N, respectivamente). Los estudios sobre las vértebras cervicales indican que la precarga, fuerza de impulso máximo y tiempo hasta el impulso máximo son menores en comparación con las vértebras torácicas y lumbosacras 17-19. En función del tipo de técnica manipulativa cervical utilizada, las fuerzas de precarga varían desde 0 hasta alrededor de 50 N, y las fuerzas de impulso máximo varían desde alrededor de 40 N hasta aproximadamente 120 N. Durante las manipulaciones cervicales, las fuerzas distribuidas se desarrollan con mayor rapidez que durante la manipulación de las vértebras torácicas y la articulación sacroilíaca. La duración del impulso es de alrededor de 30 ms hasta aproximadamente 120 ms. Es preciso reconocer la amplia variabilidad en las fuerzas y duraciones aplicadas. Se desconoce la influencia de esta variabilidad en los mecanismos biológicos que podrían contribuir a los efectos clínicos de la manipulación.
Unos conocimientos completos sobre la biomecánica de la manipulación vertebral requieren una comprensión del modo en que las cargas manipulativas se transmiten a una vértebra específica. Experimentalmente, esto es mucho más difícil y más complejo comparado con la medición de las cargas aplicadas. Las cargas transmitidas pueden ser diferentes de las aplicadas debido a los efectos de la posición del paciente y las contribuciones procedentes de las cargas de inercia, los movimientos de carga y las propiedades activas y pasivas de los tejidos conjuntivo y muscular participantes. Triano y Schultz 20 calcularon las cargas máximas transmitidas en el segmento lumbar determinando las cargas transmitidas hasta una plataforma de fuerza o estabilométrica sobre la que se coloca el paciente. La plataforma de fuerza fue capaz de transducir las fuerzas y los movimientos a través de los 3 ejes ortogonales. Las fuerzas máximas transmitidas al segmento lumbar durante una manipulación vertebral en posición lateral tuvieron tendencia a ser más altas que las fuerzas máximas aplicadas durante una manipulación torácica o sacroilíaca en posición de decúbito prono según lo medido por Herzog et al 17. Las duraciones del impulso transmitido fueron similares a las duraciones del impulso aplicado, determinadas por Herzog et al 17. Los movimientos transmitidos máximos fueron aproximadamente 3 o 4 veces menores que las fuerzas transmitidas máximas. Las cargas transmitidas se consideraron inferiores al nivel umbral capaz de provocar una lesión de las vértebras lumbares (para una discusión adicional véase referencia 20).
Además de las cargas aplicadas y transmitidas se ha estudiado el desplazamiento o movimiento relativo entre vértebras contiguas durante la manipulación vertebral. Nathan y Keller 21 midieron el movimiento lumbar intervertebral utilizando agujas insertadas en las apófisis espinosas lumbares. Las manipulaciones se distribuyeron utilizando un dispositivo de ajuste mecánico (Activator Adjusting Instrument, Activator Methods International, Ltd., Phoenix, AZ 22). Utilizando este dispositivo, la duración del impulso es del orden de 5 ms, una duración más breve que la usada en la manipulación manual. Los impulsos distribuidos a la apófisis espinosa de L2 produjeron un desplazamiento axial máximo de 1,62 mm ± 1,06 mm (en el plano longitudinal), un desplazamiento de cizallamiento de 0,48 ± 0,1 mm (en el plano transverso) y 0,89 ± 0,49° de rotación entre L3 y L4 21. Smith et al 23 midieron desplazamientos vertebrales similares en la columna lumbar de animales (perros). L2 se trasladó 0,71 ± 0,03 mm y rotó 0,53 ± 0,15° sobre L3 con cargas del impulso de 53 N. Gal et al 24 efectuaron mediciones en las vértebras torácicas pero sus resultados son difíciles de comparar con los descritos previamente para las vértebras lumbares. Sin embargo, los movimientos inducidos durante una carga manipulativa vertebral sugieren que los procesos mecánicos pueden desempeñar un papel en los efectos biológicos de la manipulación vertebral.
Mecanismos neurofisiológicos y biomecánicos que son la base de los efectos de la manipulación vertebral
Se han propuesto numerosas teorías para explicar los efectos de la manipulación vertebral 25,26. Un riesgo habitual de muchas de estas teorías es que los cambios de la dinámica anatómica, fisiológica o biomecánica normal de las vértebras contiguas puedan afectar adversamente la función del sistema nervioso 27,28. Se considera que la manipulación vertebral corrige estos cambios.
En consecuencia se han formulado como hipótesis una serie de cambios biomecánicos producidos por el movimiento vertebral durante la manipulación vertebral. La fuerza mecánica introducida en la columna vertebral durante una manipulación vertebral puede alterar directamente la biomecánica segmentaria a través de la liberación de los meniscos atrapados, la liberación de adherencias o reduciendo la distorsión del anillo fibroso 29-33. Por otra parte, los segmentos individuales del movimiento pueden experimentar distorsión, produciendo movimientos vertebrales relativamente amplios que consiguen una nueva posición de equilibrio estable 34. Los cambios mecánicos desencadenados por la manipulación pueden proporcionar la energía suficiente para restablecer el segmento distorsionado a un nivel de energía inferior, lo que reduce el estrés o la tensión mecánica ejercida sobre los tejidos paraespinales blandos y duros 35. Una importante consecuencia de estos cambios mecánicos, desencadenados por la manipulación, que se formula como hipótesis, podría ser el restablecimiento de la movilidad de la articulación interapofisaria y del juego articular 31. De hecho, en una discusión de expertos sobre manipulación vertebral se considera que "el objetivo de la manipulación es restablecer el movimiento máximo, libre de dolor, del sistema musculoesquelético" (referencia 35, también véase referencias 31, 36 y 37).
Los cambios biomecánicos causados por la manipulación tienen consecuencias fisiológicas por medio de sus efectos sobre el influjo de información sensorial hasta el sistema nervioso central 25,36. A través de la liberación de los meniscoides atrapados, material discal o adherencias segmentarias, o normalizando los segmentos distorsionados, en último término, las aferencias mecánicas pueden reducir las aferencias nociceptivas de las terminaciones nerviosas receptivas en los tejidos paraespinales inervados. Esto sería compatible con la observación de que la manipulación vertebral no es dolorosa cuando se administra correctamente. Además, el thrust o impulso mecánico podría estimular o silenciar las terminaciones nerviosas receptivas mecanosensitivas, no nociceptivas de los tejidos paraespinales, incluida la piel, músculos, tendones, ligamentos, carillas articulares y disco intervertebral 28,38,39. Estas aferencias neurales podrían influir en los mecanismos productores de dolor, al igual que en otros sistemas fisiológicos controlados o influidos por el sistema nervioso.
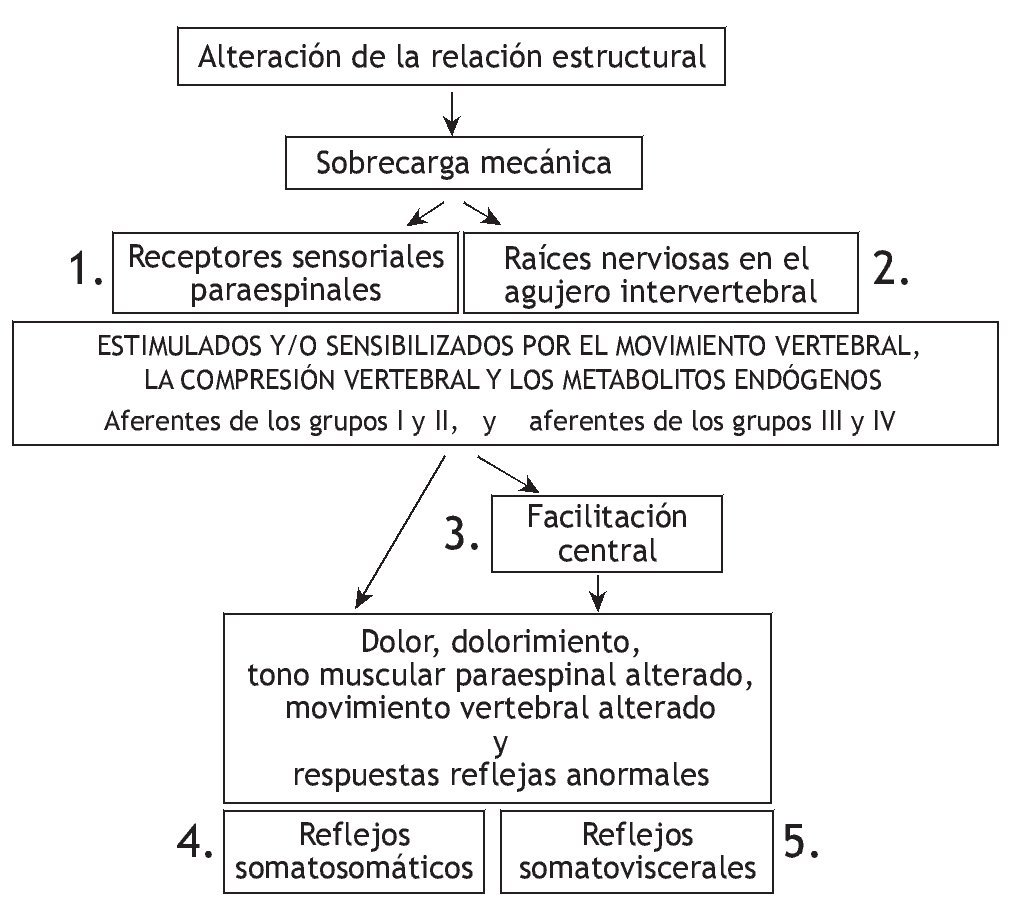
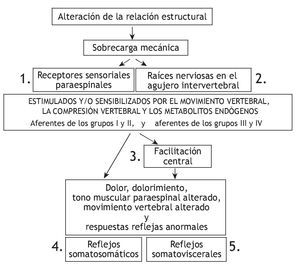
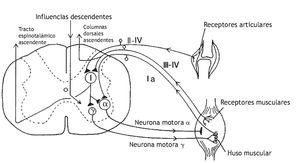
En la figura 1 se representan las relaciones teóricas entre la manipulación vertebral, la biomecánica segmentaria, el sistema nervioso y la fisiología de los órganos nobles. Como hipótesis, una alteración biomecánica entre los segmentos vertebrales produce una sobrecarga biomecánica cuyos efectos pueden alterar las propiedades de señalización de las neuronas sensibles mecánica o químicamente en los tejidos paraespinales. Estos cambios de las aferencias sensoriales modifican la integración neural afectando directamente a la actividad refleja y/o afectando la integración neural central dentro de las reservas neuronales motoras, nociceptivas y posiblemente vegetativas. Cualquiera de estos cambios en las aferencias sensoriales puede desencadenar cambios en la actividad somatomotora y visceromotora eferente. El dolor, malestar, alteración de las funciones musculares o alteración de las actividades visceromotoras comprenden los signos o síntomas que pueden propiciar que el paciente solicite una manipulación vertebral. Por lo tanto, en teoría, la manipulación vertebral altera el influjo de señales sensoriales desde los tejidos paraespinales de una manera que mejora la función fisiológica. Esta explicación comprende una de las bases neurofisiológicas más racionales de los mecanismos subyacentes de los efectos de la manipulación vertebral. Como se describe más adelante, reciben cada vez más atención los esfuerzos experimentales para comprender el procesamiento sensorial de los tejidos paraespinales y los efectos de la manipulación vertebral sobre dicho procesamiento. Cada una de las secciones descritas más adelante aborda un componente de la relación teórica representada en la figura 1, correspondiendo el número de cada sección al componente numerado en la figura.
Figura 1 Modelo teórico que demuestra los componentes que describen la relación entre la manipulación vertebral, biomecánica segmentaria, sistema nervioso y fisiología. Los efectos neurofisiológicos de la manipulación vertebral pueden estar mediados en cualquiera de los cuadros numerados.
Efectos de la manipulación vertebral sobre los receptores sensoriales de los tejidos paraespinales
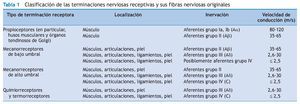
Aferentes de los grupos I y II (aferentes propioceptivas)
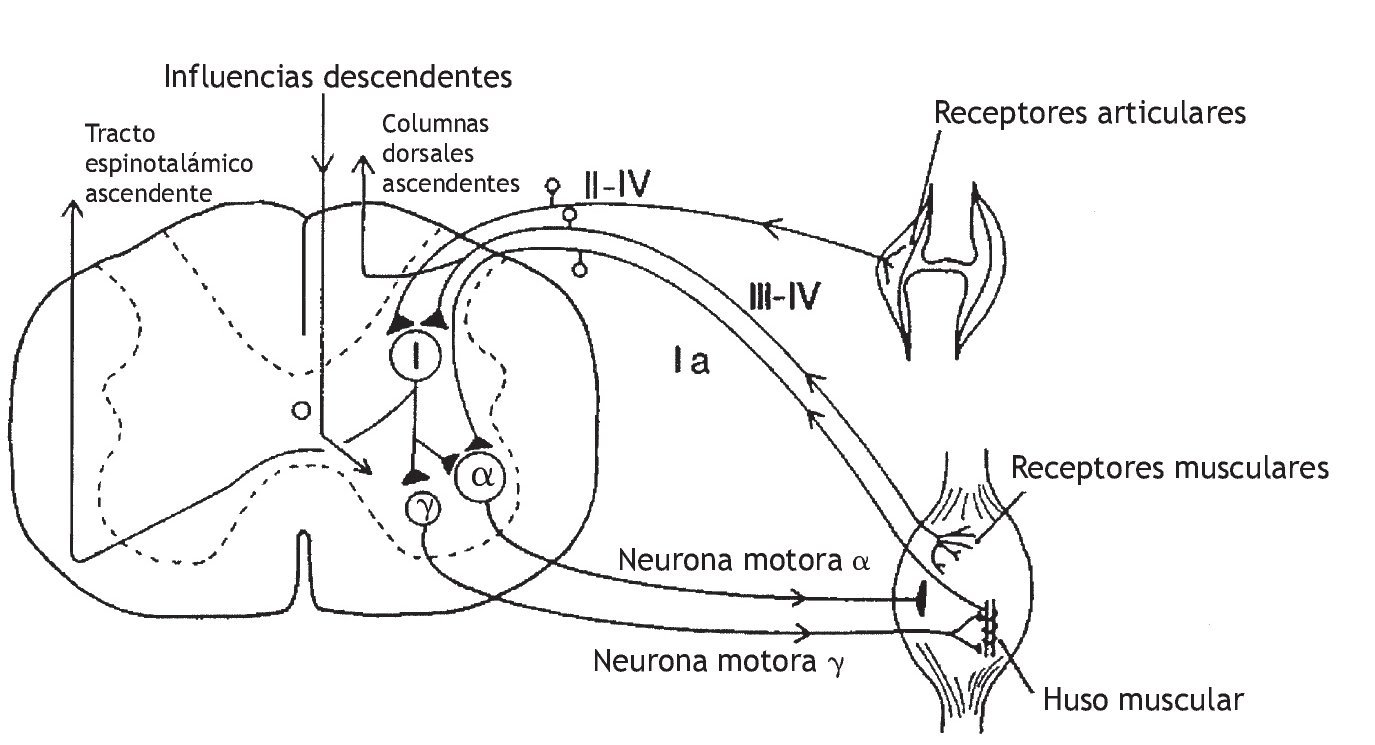
Korr 36 propuso que la manipulación vertebral aumenta la movilidad articular produciendo una descarga de impulsos en las aferentes del huso muscular y aferentes de diámetro más pequeño que, en último término, silencia las neuronas motoras gamma facilitadas. En la figura 2 se muestra el circuito neural de las vías que modulan la descarga de la neurona motora gamma. Korr formuló la hipótesis de que la descarga de la neurona motora gamma es elevada en los músculos de los segmentos vertebrales que responden a la manipulación vertebral. Un gran aumento del circuito gamma deterioraría la movilidad articular a través de la sensibilización del reflejo de estiramiento a los cambios anormalmente pequeños de la longitud muscular. Korr formuló la hipótesis adicional de que la manipulación vertebral estimula las aferentes del huso muscular, es decir, las aferentes del grupo Ia y posiblemente del grupo II (tabla 1). La descarga de impulsos desde estas aferentes producida por la manipulación vertebral reduciría el aumento del circuito gamma a través de una vía neural indeterminada. Aunque partes de este mecanismo siguen siendo especulativas, la contribución de las aferentes propioceptivas a la función vertebral y los efectos neurofisiológicos de la manipulación vertebral sobre estas aferentes reciben una atención cada vez mayor.
Figura 2 Representación esquemática que muestra las vías sensoriales que pueden modelar la descarga de la neurona motora g. Una descarga de alta frecuencia de las aferencias de los husos musculares podría afectar las aferencias descendentes hasta las neuronas motoras g. Además, las aferencias de las neuronas de los grupos III y IV de diámetro más pequeño podrían afectar a las neuronas motoras g.
Recientemente, en seres humanos se ha demostrado la importancia de las aferencias propioceptivas paraespinales en la función de la columna vertebral y de las vértebras lumbares, en particular. En diversos estudios se indica que las aferencias de los husos musculares de los músculos multífidos lumbares contribuyen a posicionar con precisión la pelvis y las vértebras lumbosacras. Los individuos sanos pueden reposicionar con precisión sus vértebras lumbosacras, pero su capacidad de reposicionamiento se deteriora cuando se hace vibrar el músculo multífido 40. La vibración estimula los husos musculares y crea una ilusión sensorial de que el músculo multífido se distiende y, por lo tanto, hay un aumento de la flexión de la columna vertebral, que es mayor que la que tiene en realidad. El error de reposicionamiento se produce debido a la percepción falsa de la posición vertebral. Es interesante destacar que la capacidad de reposicionamiento lumbosacro está deteriorada en individuos con antecedentes de lumbalgia, incluso en ausencia de vibración 41. Este hallazgo se asoció con una alteración de las aferencias propioceptivas de los husos musculares 41. Además, en individuos con antecedentes de lumbalgia los músculos paraespinales también se caracterizan por tiempos de respuesta más prolongados a las cargas súbitas, lo que también sugiere la presencia de una aferencia propioceptiva paraespinal anormal en estos individuos 42-44.
Recientemente se han desarrollado 2 modelos experimentales que deberían mejorar nuestros conocimientos neurofisiológicos sobre las vértebras lumbares y cervicales en general, y específicamente sobre la manipulación vertebral 45,46. Las preparaciones experimentales permiten el registro de la actividad neural a partir de los tejidos paraespinales en condiciones en las que pueden aplicarse cargas mecánicas controladas a una vértebra individual. Pueden determinarse las propiedades de descarga de las aferentes primarias con campos receptivos en los tejidos paraespinales y los efectos de estas aferencias sensoriales sobre las neuronas de la médula espinal. Las preparaciones aíslan la apófisis espinosa de una vértebra cervical 45 o lumbar 46, y usan un motor de dirección asistida para controlar el desplazamiento o una fuerza aplicada a la apófisis espinosa. Estas preparaciones permitirán efectuar estudios neurofisiológicos que no son posibles en el ser humano.
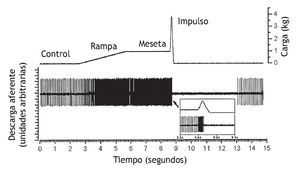
Hallazgos recientes que han usado uno de los modelos experimentales descritos previamente 46 demuestran que la manipulación vertebral modifica la descarga de las aferentes de los grupos I y II. Pickar y Wheeler 47 registraron la actividad de una unidad individual de las aferentes del huso muscular y del órgano tendinoso de Golgi con campos receptivos en los músculos multífido y dorsal largo al mismo tiempo que aplicaban una carga similar a la de una manipulación de una vértebra lumbar. En general, las aferentes del órgano tendinoso de Golgi permanecieron silenciosas en reposo y se activaron más con el impulso de una manipulación vertebral que con la carga estática previa al impulso. Su silencio se reanudó al término de la manipulación. En general, los husos musculares se caracterizaron por una descarga en reposo que también aumentó más con el impulso que con la precarga (el 200 % comparado con el 30 %). Los husos se silenciaron durante 1,3 s como media tras el impulso manipulativo. Además, un posible corpúsculo de Pacini respondió al impulso de una carga manipulativa, pero no a las cargas con un perfil de fuerza-tiempo más lento. La descarga de estos 3 tipos de aferentes podría representar una parte de la descarga neural registrada por Colloca et al 48 durante la manipulación vertebral en un paciente anestesiado sometido a una laminectomía de L4-L5. Estos autores registraron la actividad multiunidad de la raíz nerviosa S1 intacta durante las manipulaciones vertebrales de la región lumbosacra utilizando una carga de baja duración y baja fuerza (impulso) (es decir, el instrumento activator adjusting22).
Aferentes de los grupos III y IV
Los registros electrofisiológicos de las aferentes de los grupos III y IV que inervan las vértebras de ratas, conejos y gatos han contribuido a nuestra comprensión de los estímulos mecánicos y químicos que pueden excitar las terminaciones receptivas de las neuronas paraespinales sensoriales. Cavanaugh et al 49 registraron la actividad aferente de la rama medial de los ramos primarios dorsales tras eliminar los músculos lumbares superficiales y profundos de ratas. La exploración cuidadosa de la cápsula de la carilla articular desencadenó una descarga de adaptación lenta, mientras que la tracción enérgica del ligamento supraespinoso desencadenó una descarga de adaptación lenta de las aferentes de las vértebras lumbares. No se cuantificaron las fuerzas aplicadas a estos tejidos. Las aferentes a partir de las que Cavanaugh et al 49 obtuvieron los registros probablemente eran de conducción lenta, es decir, aferentes de grupo III y/o grupo IV, pero no se obtuvo la clasificación basada en las velocidades de conducción de una unidad individual. Pickar y McLain 50 registraron la actividad de una unidad individual de aferentes del grupo III (velocidad de conducción, 9,0 ± 6,6 m/s) y del grupo IV (velocidad de conducción, 1,5 ± 0,5 m/s) con campos receptivos en los tejidos paraespinales lumbares. Midieron la respuesta de estas neuronas de pequeño diámetro al movimiento de la carilla articular de L5-L6. La mayoría de aferentes, incluidas 7 con campos receptivos en la cápsula de la carilla articular o cerca de ella, respondió de manera progresiva a la dirección de una carga no nociva aplicada a la articulación. Yamashita et al 51 encontraron que sólo el 20 % de aferentes del grupo III en la articulación de la carilla articular y a su alrededor se asociaron a umbrales mecánicos elevados (mayores de 8,5 g), según lo determinado con filamentos de nailon de tipo von Frey. Este último hallazgo contrasta con las aferentes estudiadas en las vértebras cervicales, donde casi todas las aferentes del grupo III estudiadas se asociaron a umbrales mecánicos elevados 52. Sin embargo, Yamashita et al 51 demostraron adicionalmente que la sustancia P aumenta la descarga en reposo y disminuye el umbral de von Frey en +80 % y —30 %, respectivamente, de las aferentes en la carilla articular lumbar y su alrededor. Esto sugiere que la inflamación puede reducir los umbrales mecánicos de las terminaciones receptivas alrededor de la carilla articular lumbar. Una vez más, esto contrasta con las propiedades de descarga de las aferentes del grupo III en la región cervical, que no fueron sensibles a la bradicinina, un mediador inflamatorio 52. Hasta la fecha, no se han publicado estudios que hayan investigado los efectos de la manipulación vertebral sobre las propiedades de descarga de las neuronas sensoriales apenas mielinizadas y no mielinizadas, de pequeño diámetro que inervan los tejidos paraespinales.
Los estudios citados previamente hacen que sea razonable pensar que la manipulación vertebral puede añadir una nueva aferencia sensorial o eliminar una fuente de aferencia aberrante. Gillette 28 presentó un análisis especulativo, aunque exhaustivo, de las terminaciones nerviosas receptivas afectadas potencialmente por la manipulación vertebral. Sugirió que en la piel y en los tejidos profundos de la región paraespinal podrían activarse 40 tipos de terminaciones mecanorreceptivas, porque sus umbrales mecánicos están por debajo del grado de la fuerza mecánica aplicada durante una manipulación. Los mecanorreceptores incluyen los propioceptores (husos musculares, tanto terminaciones primarias como secundarias y órganos tendinosos de Golgi), mecanorreceptores de bajo umbral, mecanorreceptores de umbral elevado, mecanonociceptores de umbral elevado y nociceptores polimodales de umbral elevado 28. Por lo tanto, en teoría, la manipulación vertebral podría afectar a todas las clasificaciones de las neuronas sensoriales, es decir, fibras de los grupos Ia, Ib, II, III y IV (tabla 1).
Efectos de la manipulación vertebral sobre el tejido neural en el agujero intervertebral
Las raíces raquídeas en el agujero intervertebral (AIV) poseen propiedades anatómicas insólitas, ya que presentan menos soporte y protección del tejido conjuntivo en comparación con el nervio periférico 53,54. Cuando el tronco nervioso periférico penetra en el AIV, su epineuro se separa del tronco y se fusiona con la duramadre. El perineuro, que rodea los fascículos individuales, se pierde a medida que los fascículos se separan en la raíz ventral y dorsal. El endoneuro, que rodea las células de Schwann individuales que recubren los axones tanto mielinizados como no mielinizados, se continúa en las raíces nerviosas, pero el contenido de colágeno del endoneuro se hace menos denso y deja de estar organizado como una vaina protectora 55. Además, en el cuerpo y el segmento inicial de las células de los ganglios de la raíz dorsal (GRD), la densidad de los canales de Na+ es relativamente alta, lo que sugiere que estas regiones pueden ser excepcionalmente excitables 56. Estas propiedades hacen que el tejido neural del AIV sea vulnerable a los efectos de la compresión mecánica y del medio químico producido por los cambios del disco intervertebral o las carillas articulares 57.
Pruebas sustanciales demuestran que las raíces dorsales (RD) y GRD son más vulnerables a los efectos de la compresión mecánica que los axones de los nervios periféricos, porque con presiones sustancialmente más bajas se produce un deterioro o alteración de la función 57,58. Las cargas compresivas de tan sólo 10 mg aplicadas rápidamente a las RD aumentan ligeramente la descarga de las aferentes de los grupos I, II, III y IV 58. Las cargas repetidas lentamente o cargas gradualmente crecientes producen un bloqueo de la conducción 58,59. Presiones compresivas mantenidas de tan sólo 20 mmHg aplicadas a las RD causan un bloqueo de la conducción 60. A pesar de que las RD no son tan sensibles como los GRD a la presión mecánica, una lesión mecánica previa aumenta considerablemente la descarga de las RD en reposo. En comparación, es suficiente tan sólo una compresión mecánica ligera aplicada a los GRD para producir amplios aumentos prolongados de la descarga de aferentes de los grupos I, II, III y IV incluso en ausencia de una lesión mecánica previa 58-60.
La compresión mecánica de las RD o GRD, además de alterar la transmisión neural basada en impulsos (es decir, potenciales de acción), puede alterar los mecanismos no basados en impulsos (p. ej., transporte axoplásmico). Este concepto biológico se introdujo en los estudios publicados sobre manipulación vertebral casi un cuarto de siglo atrás 60. La aplicación de una presión de tan sólo 10 mmHg a las RD reduce en un 20-30 % el transporte nutricional a los axones periféricos según lo determinado por la glucosa marcada con un radioisótopo 62. La compresión de las RD reduce la tasa de transporte de la sustancia P, un neuropéptido, pero no del péptido vasointestinal 63. Además, la compresión de GRD aumenta la presión del líquido endoneural y se acompaña de edema y hemorragia en el GRD 64.
Los estudios sobre compresión, como el descrito previamente, establecieron las bases de la investigación experimental para examinar cómo los discos intervertebrales herniados afectan a la función de la raíz nerviosa. Claramente, la idea de que un disco herniado podría comprimir directamente las RD o GRD es simple. Recientemente se midió la presión entre un disco herniado y la raíz nerviosa en 34 individuos sometidos a cirugía por herniación discal lumbar 65. Se midieron presiones medias de 53 mmHg (límites, 7-256 mmHg). Una segunda idea que describe cómo los discos intervertebrales herniados podrían afectar a la función de la raíz nerviosa sugiere que sus efectos están mediados indirectamente por la liberación de sustancias químicas neuroactivas 66. Este mecanismo ayudaría a explicar la observación frecuente de que, incluso en ausencia de compresión, los discos herniados se acompañan de hallazgos neurológicos. Estudios recientes demuestran que la aplicación de núcleo pulposo a una raíz de un nervio lumbar provoca una hiperalgesia mecánica en el tercio distal de la extremidad y causa inflamación y disminución del flujo sanguíneo en el GRD 67,68. Además, la fosfolipasa A2 (PLA2), un mediador inflamatorio asociado a herniación discal 66,69, es neurotóxica en dosis altas para los grupos I, II, III y IV 61. En dosis moderadas, aumenta la sensibilidad mecánica de las RD, produciendo una descarga de larga duración y aumenta la descarga de células GRD previamente silenciosas 61,70.
Aunque un número cada vez mayor de pruebas demuestra que las consecuencias mecánicas y químicas de un disco herniado pueden afectar al tejido neural del AIV, no se encontraron estudios de investigación de los efectos de la manipulación vertebral sobre el entorno mecánico o químico del AIV. Se desconoce si la manipulación vertebral puede alterar la función neural a través de un cambio mecánico de las presiones de compresión o reduciendo la concentración de metabolitos en el AIV. Sin embargo, diversos estudios de casos 35,71,72 y estudios clínicos aleatorizados 73,74 revelan que la manipulación vertebral de pacientes con discos intervertebrales herniados puede ir seguida de una mejoría clínica. Estos hallazgos justifican una investigación adicional. Sin estudios adecuados de ciencia básica, será difícil determinar el mecanismo de acción que es la base de las mejorías clínicas observadas.
Efectos de la manipulación vertebral sobre la facilitación central
La facilitación central (también llamada sensibilización central) hace referencia a la mayor excitabilidad o al aumento de la respuesta de las neuronas del asta dorsal de la médula a las aferencias. La facilitación central puede manifestarse por un aumento de la actividad neural central espontánea, por un aumento de la descarga de las neuronas centrales a una aferencia o por un cambio de las propiedades de campo receptivo de las neuronas centrales 75. El grupo de Denslow (Denslow et al) 76 fue uno de los primeros grupos de investigadores que estudiaron sistemáticamente la organización neural de las áreas dolorosas de los tejidos paraespinales. Sus hallazgos se tradujeron en una de las bases predominantes para el uso clínico de la manipulación vertebral, es decir, la premisa de que las alteraciones persistentes de las aferencias sensoriales normales de una unidad vertebral funcional aumentan la excitabilidad de las células o circuitos neuronales de la médula espinal 25,36,76. Observaron que los músculos con una consistencia firme, que acompañan las anomalías posturales, muestran características electromiográficas (EMG) diferentes de las de músculos con una consistencia normal. Estuvo presente una actividad EMG espontánea o pudo inducirse actividad EMG a diferencia del área normal 77,78. En los estudios posteriores, Denslow et al 76,79 demostraron que la actividad vertebral erectora refleja evocada por la presión ejercida contra los tejidos paraespinales variaba entre individuos y entre segmentos vertebrales. Los patrones que observaron sugerían que las neuronas motoras a podrían mantenerse en un estado facilitado debido al bombardeo sensorial de las estructuras paraespinales segmentarias relacionadas. Los umbrales reflejos motores también se correlacionaron con los umbrales del dolor, lo que sugería adicionalmente que algunas vías sensoriales también estaban sensibilizadas o facilitadas en el segmento anómalo 76. Actualmente sabemos que el fenómeno de facilitación central aumenta el campo receptivo de las neuronas centrales y permite el acceso de estímulos mecánicos inocuos a las vías centrales del dolor 80. En otras palabras, los estímulos mecánicos subumbrales pueden iniciar el dolor porque las neuronas centrales se han sensibilizado. La eliminación de estos estímulos subumbrales debería ser beneficiosa desde un punto de vista clínico. Un mecanismo que es la base de los efectos clínicos de la manipulación vertebral podría ser la eliminación de los estímulos subumbrales inducida por los cambios del movimiento articular o el juego articular (v. sección previa: "Mecanismos neurofisiológicos y biomecánicos que son la base de los efectos de la manipulación vertebral"). Además, las propias aferencias mecánicas no nocivas también pueden producir un efecto terapéutico. La teoría del control de la compuerta, propuesta por Melzack y Wall 81, atrajo la atención hacia el papel activo del asta dorsal de la médula espinal. Ésta no sólo es una estación de relevo pasivo de los mensajes sensoriales sino que también puede modular los mensajes. Numerosos estudios inspirados por esta teoría demuestran claramente que las aferencias mecánicas no nocivas conducidas por medio de las neuronas de fibras A mielinizadas grandes, pueden inhibir la respuesta de las neuronas del asta dorsal a los estímulos nociceptivos de las fibras C (revisado en referencia 82). Se ha demostrado que la activación natural de las fibras A-α y A-β (tabla 1) reduce el dolor crónico y aumenta los niveles umbral del dolor (revisado en referencia 82). Si un mecanismo de compuerta contribuye a los efectos de la manipulación vertebral, es necesario entender los medios por los que esta aferencia mecánica no nociva, de breve duración, produce un efecto de acción prolongada.
Efectos sobre el dolor y el procesamiento del dolor
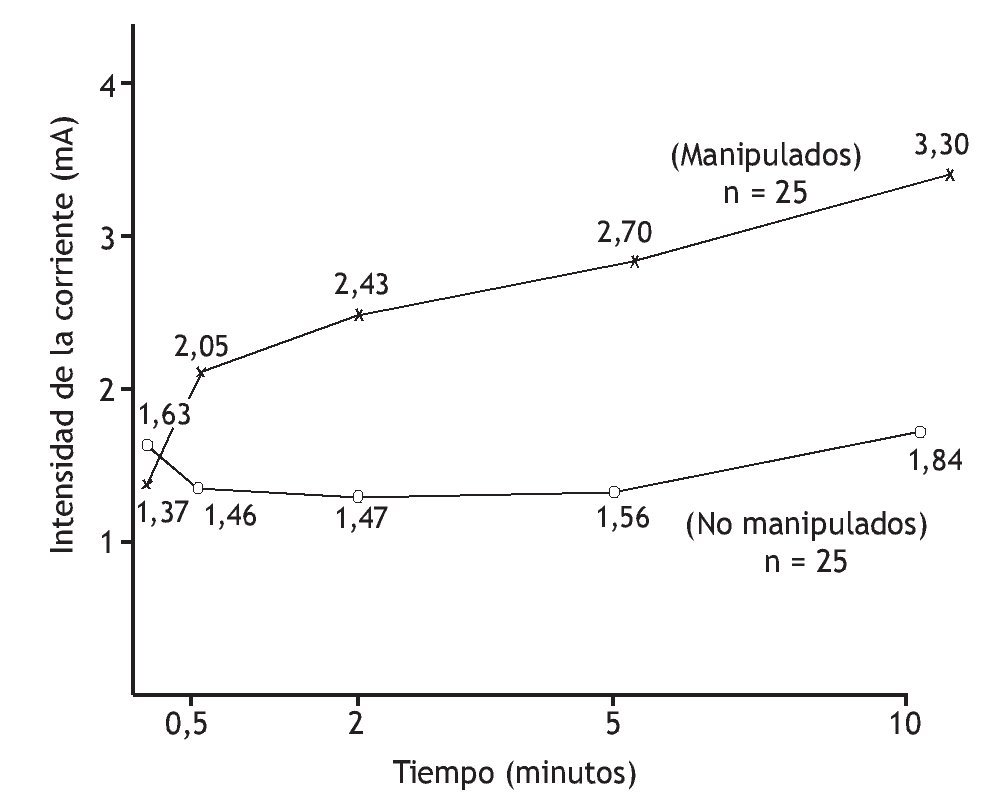
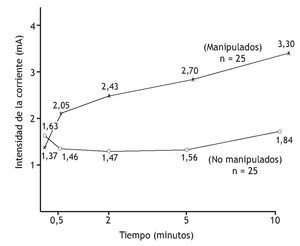
Numerosos estudios sugieren que la manipulación vertebral altera el procesamiento central de los estímulos mecánicos, inocuos, porque la tolerancia al dolor o a los niveles umbral aumenta. En pacientes con lumbalgia, Glover et al 83 examinaron las regiones de la piel lumbar que eran dolorosas a un pinchazo. A los 15 min de la manipulación vertebral de la región lumbar, el tamaño del área a partir de la que los pinchazos desencadenaron dolor disminuyó en comparación con el grupo de control, que recibió tratamiento de onda corta placebo. Terrett y Vernon 84 cuantificaron la disminución de la sensibilidad al dolor tras manipulación vertebral. Establecieron un modelo de sensación de dolor utilizando una estimulación eléctrica, graduada, de los tejidos paraespinales cutáneos. Un observador enmascarado valoró la corriente mínima necesaria para desencadenar el dolor (umbral del dolor) y la corriente tolerable máxima que desencadenó el dolor (tolerancia al dolor) en individuos con regiones dolorosas de las vértebras torácicas. La manipulación vertebral aumentó significativamente (1,5 veces) los niveles de tolerancia al dolor al cabo de 30 s. Durante los 9,5 min siguientes, los niveles de tolerancia aumentaron progresivamente (hasta 2,4 veces) (fig. 3).
Figura 3 Aumento del umbral de tolerancia al dolor tras manipulación vertebral. Umbral determinado por la corriente eléctrica necesaria para desencadenar el máximo dolor persistente. (Tomada de la referencia 84, reimpresa con permiso.)
Se han hecho esfuerzos continuados para determinar y cuantificar los efectos de la manipulación vertebral sobre el procesamiento nociceptivo utilizando el algómetro de presión. Se ha demostrado la fiabilidad y validez de este manómetro de presión 85,86. Vernon 87 determinó los cambios en el umbral de presión/dolor después de manipulación vertebral utilizando la sensación de este dispositivo. El umbral de presión/dolor representa la magnitud de la presión a la que el individuo refiere que la sensación de dolor cambia por una sensación de dolorimiento. En este estudio de casos, la manipulación vertebral aumentó el umbral medio de presión/dolor de 6 puntos dolorosos en la región cervical en aproximadamente el 50 % (desde 2 kg/cm 2 hasta 2,9 kg/cm 2). En un estudio de las vértebras lumbares, la manipulación vertebral y la movilización vertebral no cambiaron los umbrales de presión/dolor entre lugares estandarizados en pacientes con lumbalgia mecánica crónica 88. Los lugares estandarizados eran los puntos gatillo miofasciales asociados a lumbalgia pero que no eran necesariamente pertinentes desde un punto de vista clínico (es decir, dolorosos) para el paciente. Estos últimos resultados, comparados con los del estudio de Vernon 87, podrían sugerir que las respuestas fisiológicas a la manipulación vertebral son específicas de las regiones de la columna vertebral. Por otra parte, los resultados sugieren que los efectos neurofisiológicos de la manipulación vertebral sobre el procesamiento del dolor sólo se comprenderán cuando se elijan los lugares sintomáticos en función del grado de dolorimiento para el paciente. En conjunto, los hallazgos son sugestivos y justifican una investigación continuada. Si la manipulación vertebral inicia cambios del estado facilitador central de la médula espinal, la comprensión de la relación entre las aferencias biomecánicas y las respuestas neurofisiológicas de los tejidos paraespinales nos permitirá optimizar la distribución de estas manipulaciones.
El efecto de la manipulación vertebral sobre el dolor también podría estar mediado por el sistema neuroendocrino. Se sabe que el sistema opiáceo endógeno modifica los procesos del dolor 89, y se considera que diversas modalidades terapéuticas, incluida la acupuntura 90, la estimulación nerviosa transcutánea 91 y el ejercicio 92, ejercen efectos analgésicos a través de la activación de este sistema. Diversos estudios han investigado el efecto de la manipulación vertebral sobre los valores circulantes de β-endorfina. Los hallazgos han sido desiguales por las posibles razones descritas por Rosner 93. Vernon et al 94 documentaron un aumento del 8 % de los valores plasmáticos de β-endorfina 5 min después de la manipulación vertebral, pero no después de las intervenciones de control. Christian et al 95 no encontraron cambios de los valores plasmáticos de β-endorfina, pero su análisis habría detectado un aumento del 8 % porque su variación entre análisis fue mayor del 8 %. Por otra parte, Sanders et al 96 no encontraron cambios de los valores plasmáticos de β-endorfinas a pesar de una disminución en la escala de análogos visuales para valorar el dolor en el grupo que recibió manipulación vertebral. Los efectos analgésicos de la β-endorfina pueden estar mediados por su capacidad para fijarse a los receptores unidos a la membrana de las terminaciones nerviosas sensoriales de la periferia, al igual que los receptores de la médula espinal y el cerebro. No obstante, se desconoce la relación entre los valores circulantes de β-endorfina y la liberación de β-endorfina de la médula espinal 97. Por consiguiente, aunque los experimentos citados podrían indicar una respuesta mediada por los receptores periféricos, se desconocen los efectos de la manipulación vertebral sobre la liberación de β-endorfina en el sistema nervioso central.
Efectos de la manipulación vertebral sobre los reflejos somatosomáticos (musculares)
Diversas pruebas sustanciales demuestran que la manipulación vertebral desencadena reflejos musculares paraespinales y altera la excitabilidad de la neurona motora. En pacientes asintomáticos, el grupo de Herzog 98,99 demostró que los tratamientos de manipulación vertebral posteriores a anteriores aplicados en la región cervical, torácica, lumbar y sacroilíaca, aumentaron la actividad EMG paraespinal en un patrón relacionado con la región vertebral que se manipuló. Las latencias de la respuesta EMG tienen lugar al cabo de 50-200 ms tras iniciar el impulso manipulativo. De forma parecida, la manipulación vertebral utilizando el instrumento activator adjusting, aplicado a una apófisis transversa, desencadena una actividad EMG paraespinal en el mismo nivel segmentario pero al cabo de 2-3 ms 22. Colloca y Keller 100 confirmaron estos últimos hallazgos en pacientes sintomáticos con lumbalgia. Además describieron que la mayor actividad EMG, aunque se inicia a los 2-3 ms de la manipulación, alcanza un máximo al cabo de 50-100 ms. La actividad EMG representativa de una respuesta refleja potente desde un punto de vista de la amplitud máxima fue relativamente prolongada (> 273 ms), mientras que la actividad EMG representativa de respuestas reflejas débiles fue más breve (< 273 ms). Las respuestas EMG paraespinales fueron de mayor magnitud cuando la manipulación se distribuyó cerca del lugar del electrodo y, es interesante destacar, que cuanto más crónica es la lumbalgia, menor es la respuesta EMG. Es importante observar que los electrodos EMG no se colocaron en relación con ningún hallazgo físico asociado a la lumbalgia, por ejemplo, un supuesto lugar de espasmo muscular o dolorimiento muscular.
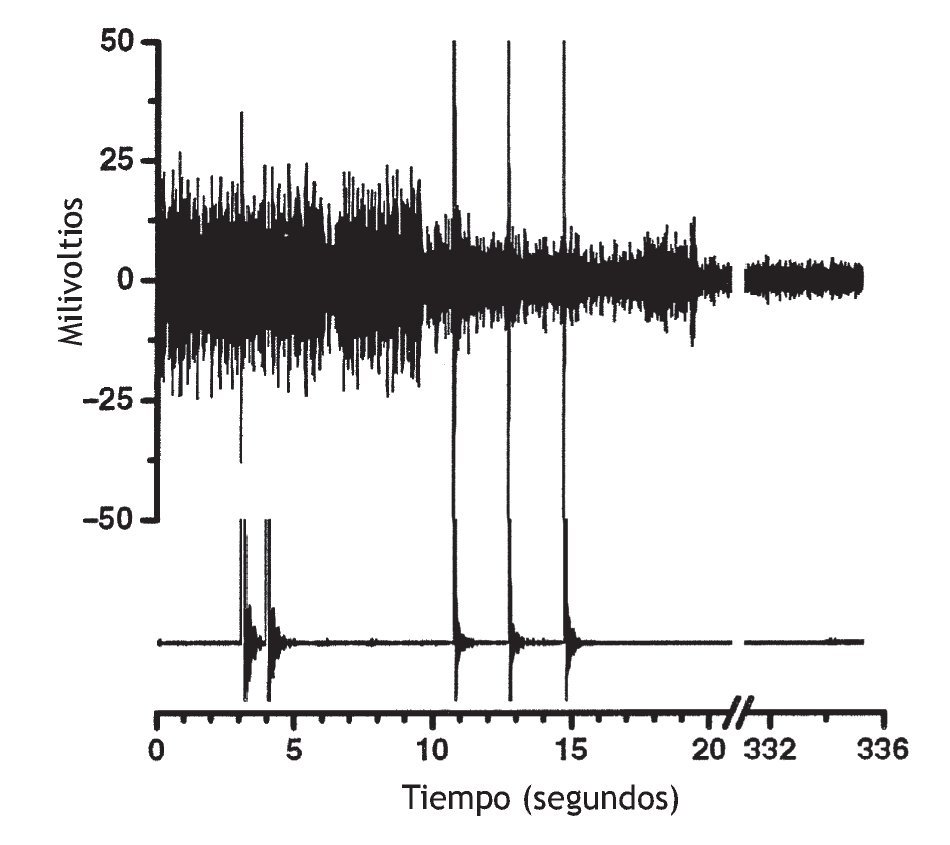
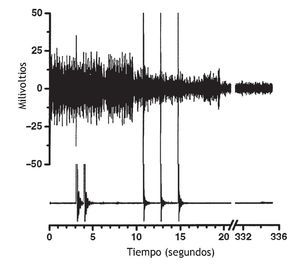
El efecto de la manipulación vertebral sobre la actividad muscular paraespinal no es sólo excitador. En un paciente sintomático con actividad muscular espontánea en las vértebras torácicas, Suter et al 99 observaron una disminución de la actividad EMG paraespinal al cabo de 1 s de la manipulación vertebral torácica. Devocht obtuvo hallazgos similares en un paciente sintomático con lumbalgia (observaciones no publicadas) (fig. 4). Aplicó los electrodos del EMG sobre los músculos paraespinales lumbares palpablemente tensos y, con frecuencia, observó una disminución de la actividad EMG espontánea después de la manipulación vertebral utilizando un instrumento activator adjusting y el protocolo de tratamiento. La disminución de la actividad muscular no se produjo instantáneamente.
Figura 4 Datos originales de un individuo que muestra actividad muscular paraespinal espontánea en las vértebras lumbares inferiores y su respuesta a la manipulación vertebral. La actividad electromiográfica (EMG) (trazado superior) disminuyó como respuesta a la manipulación vertebral utilizando el instrumento activator adjusting y el protocolo de tratamiento. Se aplicó un electrodo EMG tripolar, desechable, adhesivo, aproximadamente 2-3 cm a la derecha de la apófisis espinosa de L4 sobre el músculo paraespinal que estaba tenso cuando se palpó. El trazado inferior es el registro del acelerómetro fijado al cabezal del instrumento activator adjusting. Las puntas amplias del acelerómetro representan el inicio de cada impulso manipulativo vertebral. La manipulación vertebral se aplicó en 3 ocasiones en la base sacra (la tercera manipulación no se obtuvo del acelerómetro) y sucesivamente se aplicó a las apófisis mamilares de L5, L4 y L3. Las puntas amplias del trazado superior probablemente son artefactos mecánicos del impulso manipulativo (observaciones no publicadas).
Los efectos de la manipulación vertebral sobre la actividad somatomotora pueden ser muy complejos, produciendo efectos excitadores e inhibidores. Merece la pena mencionar que muchos de los estudios efectuados en seres humanos, citados previamente, se emprendieron en individuos sintomáticos o asintomáticos, pero no en ambos. Además, los registros EMG en ocasiones se obtuvieron de lugares estandarizados y en otros estudios se obtuvieron en relación con los hallazgos clínicos de fibras musculares tensas. Los hallazgos paradójicos pueden reconciliarse si los futuros estudios comparan los efectos de la manipulación vertebral en individuos sintomáticos frente a asintomáticos y sobre lugares anatómicos con signos identificados o cuantificados clínicamente. Claramente, el potencial de la manipulación vertebral para inhibir la actividad motora sólo puede determinarse en condiciones experimentales cuando la actividad muscular está presente espontáneamente o se ha desencadenado.
Los efectos de la manipulación vertebral sobre la actividad EMG paraespinal pueden asociarse con aumentos de la fuerza muscular determinada tras la manipulación vertebral. Suter et al 101 estudiaron a pacientes sintomáticos con disfunción de la articulación sacroilíaca, gonalgia anterior y pruebas de inhibición motora de los músculos extensores de la rodilla. Una manipulación vertebral postural lateral aplicada en la articulación sacroilíaca disminuyó significativamente la inhibición de los extensores de la rodilla en el lado del cuerpo al que se aplicó la manipulación. De forma similar, Keller y Colloca encontraron que la fuerza isométrica vertebral erectora (evaluada con la actividad EMG) aumentó después de manipulación vertebral comparada con manipulación simulada 102. Desde un punto de vista neurofisiológico, estos 2 estudios indican que la manipulación vertebral mejora la función muscular a través de la facilitación o desinhibición de las vías neurales.
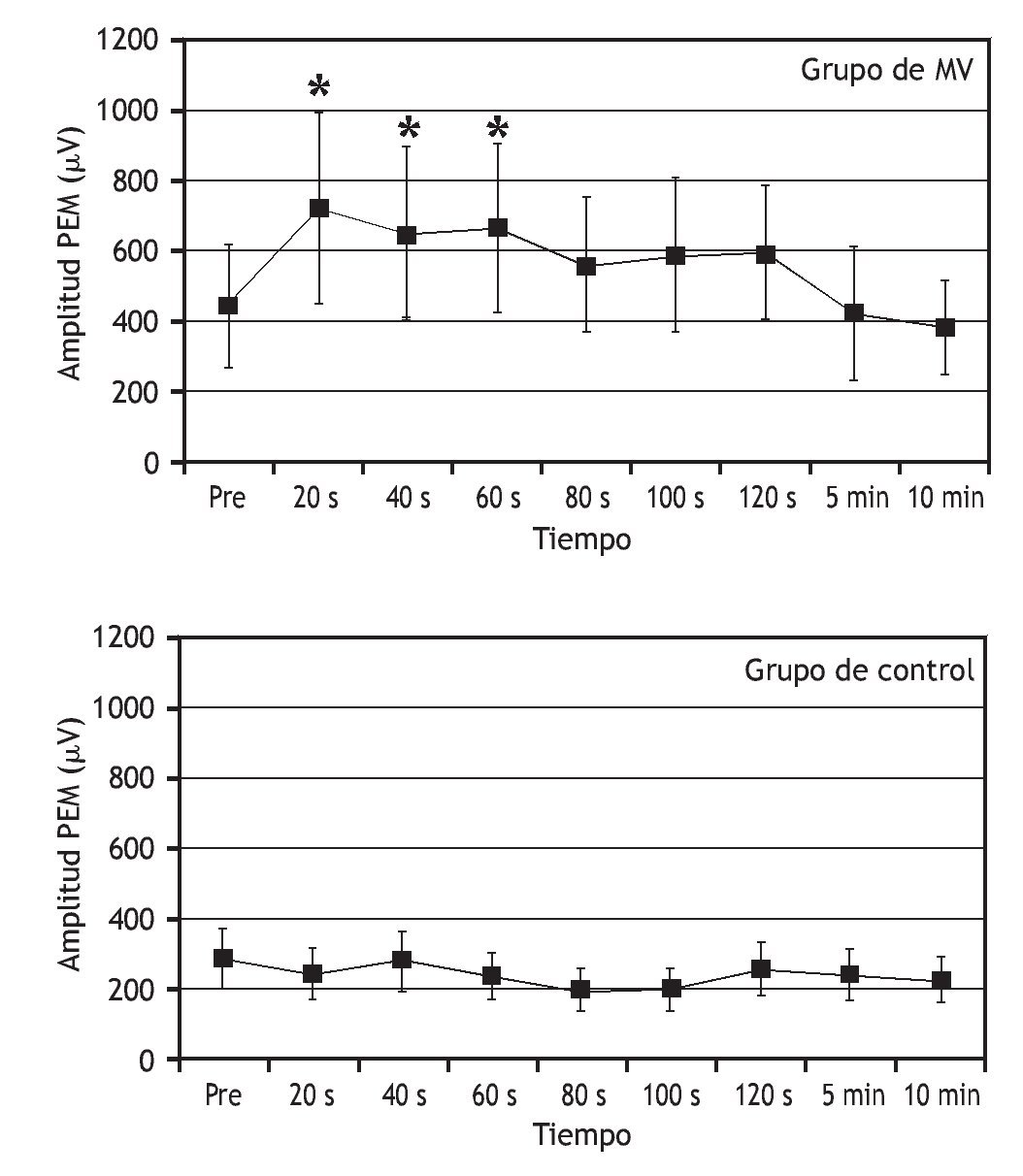
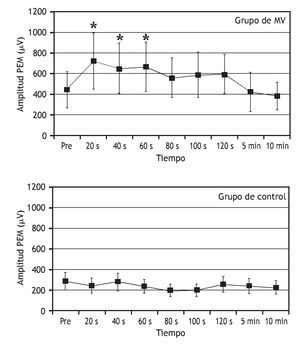
Una serie de estudios ha tratado de entender cómo la manipulación vertebral afecta al procesamiento central de la información sobre el control motor. Los estudios indican que la manipulación vertebral puede aumentar la excitabilidad de las vías motoras de la médula espinal y disminuir el influjo de información sensorial de los husos musculares. En pacientes asintomáticos, Dishman et al 103 demostraron que la manipulación vertebral aumenta la excitabilidad motora central (fig. 5). La actividad EMG del músculo gastrocnemio, desencadenada por la activación directa de los tractos corticoespinales descendentes utilizando estimulación magnética transcraneal, fue mayor tras manipulación vertebral lumbar comparada con el simple posicionamiento del paciente pero sin aplicar la manipulación. La manipulación vertebral también deprime el reflejo H. La manipulación aplicada a la articulación sacroilíaca en una dirección posterior a anterior disminuyó la magnitud del reflejo H del nervio tibial durante 15 min en seres humanos asintomáticos 104.
Figura 5 Efectos de la manipulación vertebral sobre los potenciales evocados motores en el músculo gastrocnemio. La actividad muscular se desencadenó utilizando estimulación magnética transcraneal aplicada cerca del vértice del cráneo. Se aplicó manipulación vertebral postural lateral a la derecha en L5-S1. Durante el control, los individuos se colocaron en una posición lateral pero no se manipularon. MV: manipulación vertebral; PEM: potencial evocado motor; Pre: antes de la manipulación o colocación. (Reimpresa con permiso de J Manipulative Physiol Ther 103).
De forma parecida, la manipulación lumbar postural lateral de la articulación L5-S1 inhibió el reflejo H del nervio tibial 105. Los efectos de la movilización exclusiva aplicados en la misma articulación fueron similares, pero los efectos de la manipulación tuvieron tendencia a ser mayores. Después de manipulación exclusiva, la inhibición persistió durante alrededor de 20 s, pero persistió hasta 1 min cuando la manipulación estuvo precedida de una movilización vertebral. Estos efectos opuestos sobre la actividad EMG, entre metodologías que usan los potenciales evocados motores frente al reflejo H, podrían reflejar los efectos diferenciales de las aferencias sensoriales desencadenadas por la manipulación vertebral sobre el procesamiento postsináptico, en comparación con la inhibición presináptica, respectivamente (para una discusión extensa, v. Dishman et al 103).
Los experimentos recientes sugieren el posible mecanismo que contribuye a los efectos inhibidores de la manipulación vertebral sobre el reflejo H y la actividad EMG paraespinal espontánea. Las aferencias sensoriales de los tejidos de la carilla articular estimulados durante la manipulación vertebral podrían disminuir de forma refleja la actividad muscular paraespinal. Indahl et al 106 desencadenaron actividad refleja (EMG) en el músculo dorsal largo y multífido estimulando eléctricamente el disco intervertebral en una preparación porcina. El estiramiento de la carilla articular mediante la inyección de 1 ml de suero salino fisiológico abolió la actividad EMG.
Hay razones para creer que, durante la manipulación vertebral, probablemente se produce el estiramiento de la cápsula de la carilla articular y los tejidos circundantes, aunque apenas se ha estudiado 107. Mediante resonancia magnética (RM) en un estudio efectuado en seres humanos, Cramer et al 108 demostraron que una manipulación vertebral de postura lateral se acompañó de cavitación y separa ciones de las carillas articulares. El espacio sinovial de las carillas articulares lumbares aumentó en 0,7 mm en los individuos que recibieron manipulación comparado con los de control, no manipulados. El tiempo transcurrido entre la manipulación y la RM no se documentó. En un estudio de la articulación metacarpofalángica, 5 min después de la cavitación, la separación articular continuaba aumentada en 0,4 mm y no recuperaron las dimensiones previas a la cavitación hasta 10 min después del chasquido audible 109. Sigue por demostrar si las separaciones articulares de esta magnitud son suficientes como carga de los tejidos de las carillas articulares. En caso afirmativo, suscita la posibilidad de que los tejidos que rodean la carilla articular puedan ser distendidos durante períodos más prolongados que la duración de la propia manipulación. Las aferencias sensoriales graduadas a partir de los tejidos que rodean la carilla articular 50 podrían desencadenar respuestas musculares reflejas similares a las medidas por Indahl et al 106.
Los cambios de las aferencias de los husos musculares, producidos por la manipulación vertebral, también podrían contribuir a la inhibición de los reflejos somatosomáticos. Utilizando estimulación magnética, Zhu et al 110,111 estimularon los músculos paraespinales lumbares y registraron los potenciales cerebrales evocados. La estimulación de los husos musculares paraespinales utilizando vibración redujo la magnitud de los potenciales cerebrales. De forma parecida, el espasmo muscular en seres humanos redujo la magnitud de los potenciales cerebrales evocados de los músculos paraespinales. La manipulación vertebral invirtió estos efectos mejorando el espasmo muscular y restableciendo la magnitud de los potenciales cerebrales evocados 111, lo que sugiere que, durante el espasmo muscular, el aumento de las aferencias sensoriales de los husos musculares paraespinales podría contribuir a la disminución de la magnitud de los potenciales cerebrales evocados. Merece la pena recordar las ideas de Korr 36 de que la manipulación vertebral aumenta la movilidad articular porque produce una explosión de impulsos en las aferentes de los husos musculares y aferentes de diámetro más pequeño, lo que, en último término, silencia las neuronas motoras g facilitadas (v. sección previa: "Efectos de la manipulación vertebral sobre las neuronas sensoriales que inervan los tejidos paraespinales; aferentes de los grupos I y II" [aferentes propioceptivas]).
A primera vista parece contrario a la intuición que la descarga de los husos musculares aumente durante el espasmo muscular, porque se podría anticipar un acortamiento muscular y una descarga de los husos durante el espasmo. Sin embargo, los extensos estudios del laboratorio efectuados por Proske (revisados en referencia 112) demuestran que una posición articular mantenida o un acortamiento muscular mantenido, incluso para duraciones breves, altera la sensibilidad del huso muscular a los movimientos articulares o distensión muscular posteriores. Por ejemplo, a partir de una longitud muscular dada, los husos musculares responden más a un estiramiento lento cuando un músculo de la pierna se ha mantenido previamente en una menor longitud comparado con una mayor durante tan sólo 10 s 113.
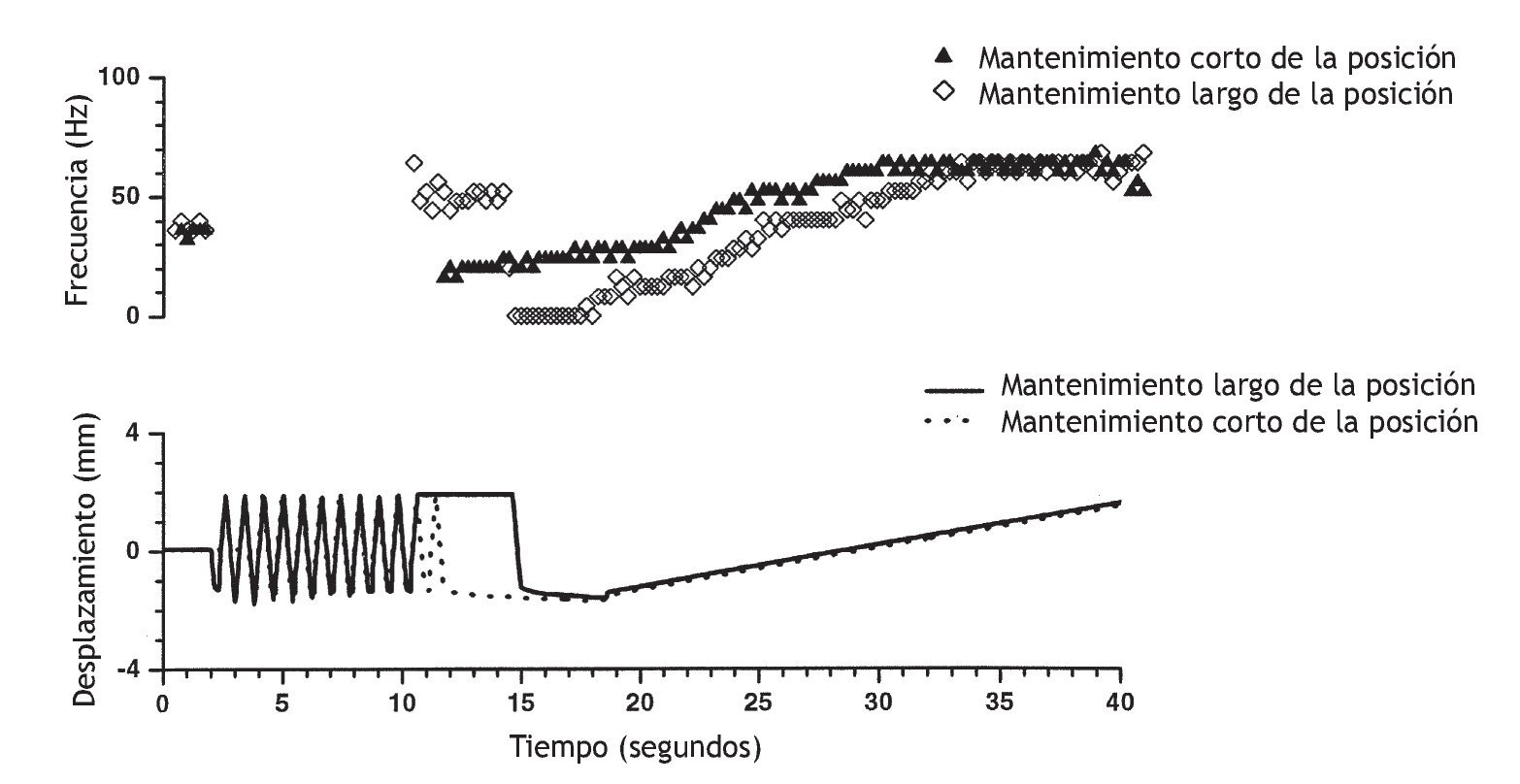
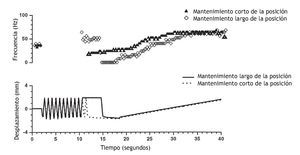
Recientemente, Pickar y Kang 114 observaron el mismo fenómeno en el músculo dorsal largo y multífido lumbar (fig. 6). La actividad del huso muscular como respuesta a una translación vertebral lenta que distendió el huso muscular dependió de si el músculo se había acortado previamente durante tan sólo 5 s (a través del desplazamiento lineal de la vértebra L6 en sentido dorsal) o distendido previamente (mediante el desplazamiento lineal de la vértebra L6 en sentido ventral). Si el espasmo muscular paraespinal da lugar al acortamiento muscular, o si una lordosis segmentaria se traduce en un acortamiento del músculo ipsolateral y en un alargamiento del músculo contralateral, para el mismo cambio de la longitud muscular, el estiramiento o la vibración posterior de los músculos afectados aumentaría la descarga de los husos más de lo esperado. Puesto que se ha demostrado que la manipulación vertebral estimula los husos musculares (fig. 7), la manipulación vertebral puede normalizar la biomecánica de los husos y normalizar la descarga de los husos musculares.
Figura 6 Sensibilidad del huso muscular paraespinal a cambios idénticos del desplazamiento vertebral determinada por los antecedentes a corto plazo de su longitud muscular. El campo receptivo del huso muscular se encontró en el músculo multífido lumbar. El panel superior muestra la frecuencia de descarga de la aferente del huso muscular registrada a partir de la raíz dorsal de L6. La frecuencia de descarga instantánea calculada como promedio fue de 25 ms bins. El panel inferior muestra el grado de desplazamiento de la vértebra L6 durante la flexión (desplazamiento negativo) y extensión (desplazamiento positivo). Estos desplazamientos acortaron y distendieron el músculo multífido, respectivamente, porque el mantenimiento de la vértebra L6 en una posición extendida (12-15 s) aumentó la frecuencia de descargas del huso comparado con el control. Al contrario, el mantenimiento de L6 en una posición flexionada (11-15 s) disminuyó la frecuencia de descarga del huso comparado con el control. La descarga del huso fue la misma al inicio de los protocolos (control, 0-2 s). Al inicio de cada protocolo, las extensiones y flexiones rápidas proporcionaron las mismas condiciones iniciales. (No se muestra la descarga del huso durante estos desplazamientos.) El panel inferior muestra el cambio de la sensibilidad del huso muscular a la extensión vertebral lenta (18,5 a 40 s) tras mantener el músculo multífido en posición acortada (¿) y en posición distendida ◊. Obsérvese que la posición vertebral se mantuvo durante tan sólo 5 s. (Reimpresa con permiso de J Neuromusculoskel Sis, Data Trace Publishing Company 114).
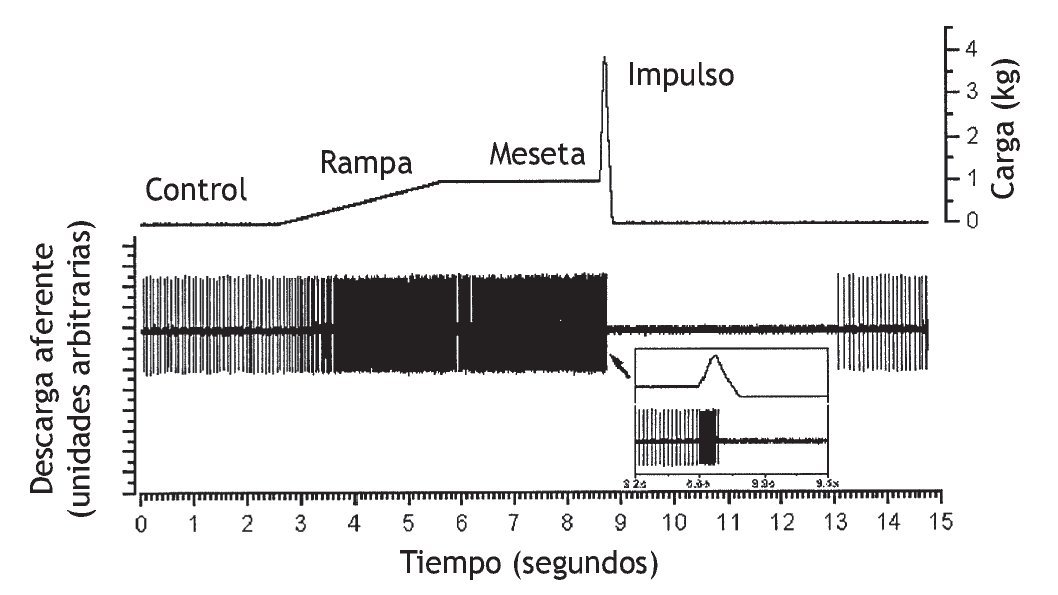
Figura 7 Trazado original de la respuesta de un huso muscular a una carga similar a la manipulación vertebral. Se obtuvo la actividad de una unidad individual a partir de una aferente del huso muscular en la raíz dorsal de L6. El huso muscular se localizaba en los músculos paraespinales lumbares. En el recuadro se muestra la descarga del huso en una escala de tiempo expandida inmediatamente antes, durante y poco después del impulso. (Tomada de la referencia 47, reimpresa con permiso.)
Efectos de la manipulación vertebral sobre los reflejos somatoviscerales
Diversos experimentos en animales proporcionan pruebas que respaldan la relación entre la alteración de las aferencias sensoriales paraespinales y el cambio somatovisceral mostrado en la figura 1. Las aferencias sensoriales de los tejidos paraespinales pueden desencadenar reflejos viscerales que afectan al sistema nervioso simpático y pueden alterar la función de los órganos nobles. En general, una aferencia sensorial paraespinal no nociva parece producir un efecto inhibidor sobre las eferencias simpáticas, mientras que una aferencia nociva parece producir un efecto excitador. No obstante, no se han efectuado los experimentos suficientes para determinar la variación regional de este efecto, es decir, el cambio en las eferencias simpáticas a los diferentes órganos. No obstante, los datos son sugestivos porque indican que las aferencias neurales de los tejidos axiales pueden desencadenar reflejos somatoviscerales.
Sato y Swenson 115 aplicaron un estímulo mecánico no nocivo a varias vértebras de las regiones torácica y lumbar de ratas aplicando fuerza a la cara lateral de las apófisis espinosas. Se registraron las actividades de los nervios simpáticos renales y suprarrenales. Puesto que la musculatura paraespinal se extrajo, las aferencias sensoriales se derivaron presumiblemente de las carillas articulares, discos intervertebrales y/o ligamentos intervertebrales. El estímulo mecánico disminuyó de modo reflejo el nivel de la actividad nerviosa simpática renal y suprarrenal en un 25-40 %. Los estímulos fueron de duración breve (unos 30 s) y las respuestas se atenuaron rápidamente. Las aferencias sensoriales de los tejidos paraespinales tuvieron acceso a los centros como mínimo en la médula espinal cervical superior porque la sección transversal de la médula espinal en C1-C2 abolió la inhibición. Sato y Swenson concluyeron que los estímulos mecánicos no nocivos aplicados a las vértebras inhibieron de manera refleja el nivel de actividad nerviosa simpática por medio de un reflejo supraespinal.
Budgell et al 116,117 también estimularon estructuras paraespinales utilizando estímulos químicos nocivos y no nocivos. Las inyecciones se aplicaron en las carillas articulares lumbares o en los tejidos interespinosos lumbares. Se determinaron la presión arterial y el flujo sanguíneo del nervio ciático 116. Un pequeño volumen (20 μl) de una sustancia química no nociva (suero salino fisiológico al 0,9 %) inyectado en el ligamento interespinoso produjo una respuesta depresora y una disminución concomitante del flujo sanguíneo del nervio ciático. Un volumen similar de capsaicina en dosis bajas (2 μg), que activa las neuronas nociceptivas 118, causó un aumento inicial de la presión arterial y del flujo sanguíneo del nervio ciático. No obstante, cuando se inyectó en la carilla articular, la capsaicina produjo una respuesta depresora. Los resultados del ligamento interespinoso son compatibles con la sugerencia ofrecida por Sato y Swenson 115 de que la estimulación de las terminaciones receptoras sensibles a los estímulos mecánicos inocuos en los tejidos paraespinales produce reflejos somáticos-simpáticos inhibidores. Los hallazgos de las carillas articulares sugirieron a los autores que la capsaicina podría producir más eficazmente cambios mecánicos inocuos en la carilla articular comparado con el ligamento interespinoso aumentando la permeabilidad de la microvasculatura de la membrana sinovial. Al igual que los efectos cardiovasculares producidos por la inyección de capsaicina en el ligamento interespinoso lumbar, la inyección en los tejidos interespinosos lumbares también aumentó la actividad nerviosa simpática suprarrenall y la secreción de catecolaminas 117, mientras que la inyección de suero salino fisiológico careció de efectos. Por consiguiente, la estimulación nociva de los tejidos paraespinales puede producir reflejos somáticos-simpáticos excitadores.
Más recientemente, Pickar et al 119, en un estudio preliminar, demostraron que el aceite de mostaza, una sustancia nociceptiva que también produce inflamación, inyectado en el músculo multífido lumbar aumenta la descarga de nervios simpáticos en el riñón y el bazo. La respuesta es un reflejo mediado por las ramas segmentarias del ramo dorsal y está integrada por los centros de la médula espinal cervical superior. La organización de este reflejo es similar a la encontrada por Sato y Swenson 115 para los nervios simpáticos del riñón y la glándula suprarrenal. Es interesante destacar que los estudios efectuados en animales también demuestran que el aumento de la descarga nerviosa simpática esplénica es inmunosupresora, disminuyendo el número de linfocitos agresores naturales liberados. La estimulación refleja somatovisceral de las eferencias simpáticas al bazo podría contribuir a la disminución de las concentraciones de linfocitos agresores naturales determinada en individuos con lumbalgia 120.
La estimulación mecánica de los tejidos paraespinales puede ser suficiente para inhibir la motilidad gástrica. La actividad bioeléctrica de la pared del tracto gastrointestinal en conejos que mantenían el estado de vigilia disminuyó mediante aferencias mecánicas prolongadas (2,5 min) 121. En estos experimentos no quedó claro si la estimulación mecánica era nociva o inocua, pero la inhibición de la motilidad gástrica fue mayor cuando la estimulación mecánica se aplicó en la sexta vértebra torácica, y disminuyó a medida que la estimulación se aplicó en sentido craneal o caudal. Estos resultados han sido confirmados por Budgell y Suzuki 122. La estimulación química nociva inhibió la motilidad gástrica y el efecto tuvo tendencia a ser mayor cuando el estímulo se aplicó en la región torácica media comparado con la región lumbar. Además se demostró que la respuesta inhibidora era refleja con un predominio de cambios de las eferencias simpáticas y, en menor grado, de las vagales.
Es importante destacar que estos estudios no proporcionan pruebas del potencial exclusivo de los tejidos paraespinales para desencadenar reflejos somatosimpáticos. Pruebas sustanciales demuestran que la estimulación nociva de los tejidos en el esqueleto apendicular también desencadena reflejos somatosimpáticos 123, pero no se conoce la magnitud relativa de los reflejos somatosimpáticos desencadenados por los tejidos axiales frente a los apendiculares. Aunque los datos sobre motilidad gástrica sugieren una especificidad segmentaria, no está claro el grado hasta el cuál las aferencias segmentarias de los tejidos paraespinales producen cambios regionalmente específicos de la actividad nerviosa simpática.
Se han llevado a cabo pocos estudios de ciencia básica orientados clínicamente o de laboratorio para determinar los efectos de la manipulación vertebral sobre el sistema nervioso simpático. Recientemente, Budgell e Hirano 124 midieron los cambios de la variabilidad de la frecuencia cardíaca tras manipulación vertebral cervical superior frente a manipulación vertebral simulada. El análisis espectral Doppler de la variabilidad de la frecuencia cardíaca demostró que la manipulación aumentó el cociente de los componentes de baja frecuencia/alta frecuencia indicativo de un posible cambio en el equilibrio del control vegetativo del corazón hacia el sistema nervioso parasimpático.
La manipulación vertebral puede alterar la respuesta de las células inmunológicas al igual que la producción de citocinas inmunomoduladoras y neuromoduladoras. En una serie de estudios efectuados en seres humanos en la década de los noventa, Brennan et al 120,125,126 demostraron que la manipulación vertebral, pero no la simulada ni el masaje de tejidos blandos, estimuló los leucocitos polimorfonucleares y los monocitos. La manipulación vertebral aumentó el estallido respiratorio (un marcador de actividad fagocítica) de estos leucocitos a una provocación concreta. El mecanismo no está claro, aunque se describió el posible papel de la sustancia P. La manipulación vertebral también estimuló los leucocitos polimorfonucleares, cuya producción de citocinas aumentó según lo determinado por la liberación de factor de necrosis tumoral como respuesta a la provocación con endotoxinas. El efecto estimulador fue de corta duración, siendo de más de 15 min tras la manipulación, comparado con 30 y 45 min. Todavía no se han investigado las consecuencias biológicas de estos cambios, pero sus cambios sugirieron su uso potencial, como mínimo, como marcadores de la manipulación vertebral eficaz.
Conclusión
Se ha presentado un marco teórico para comprender los efectos neurofisiológicos de la manipulación vertebral. Se formula la hipótesis de que las razones que son la base de los cambios biomecánicos en la columna vertebral afectan a las aferencias neurales, con una alteración posterior del procesamiento central y afectando a las eferencias somatomotoras o somatoviscerales reflejas. En la tabla 2 se resumen las pruebas de la relación teórica presentada en esta revisión. La manipulación vertebral desencadena cambios en el sistema osteomuscular. Las pruebas experimentales indican que la carga del impulso de una manipulación vertebral influye en las neuronas aferentes primarias propioceptivas de los tejidos paraespinales. Además, la manipulación vertebral puede afectar al procesamiento del dolor, posiblemente alterando el estado facilitado central de la médula espinal y puede afectar al sistema de control motor. Los experimentos en animales demuestran que las aferencias sensoriales de los tejidos paraespinales tienen capacidad para alterar de forma refleja las eferencias neurales al sistema nervioso vegetativo. Sin embargo, los efectos de la manipulación vertebral sobre el sistema nervioso vegetativo se han investigado con menos detalle. Las pruebas neurofisiológicas que demuestran efectos fisiológicos producidos por la manipulación vertebral son cada vez más numerosas. Probablemente, más de un mecanismo explica los efectos de la manipulación vertebral. Durante los 10-20 últimos años se han desarrollado estrategias experimentales nuevas de los mecanismos que son la base de esta técnica. Los estudios neurofisiológicos vertebrales utilizando modelos animales son difíciles, aunque sólo sea porque los tejidos paraespinales de interés recubren directamente el sistema nervioso central y las distancias entre los tejidos paraespinales y la médula espinal son cortas. Diversos modelos experimentales han ofrecido soluciones a esta dificultad. La investigación continuada en este campo nos ayudará a entender mejor los mecanismos terapéuticos que son consecuencia de la manipulación vertebral.
*Artículo publicado previamente en The Spine Journal 2 (2002) 357-371.
Correo electrónico:pickar_j@palmer.edu