La cardiomiopatía de Takotsubo es poco reconocida en la población infantil, lo que ha llevado a su subdiagnóstico. Puede ser secundaria a estrés físico o psicológico y lleva a una lesión cardiaca reversible. Se caracteriza por el desarrollo de insuficiencia cardiaca aguda, con cambios electrocardiográficos y paraclínicos sugestivos de infarto agudo del miocardio y elevación de la concentración de troponinas, con circulación coronaria indemne. El ecocardiograma muestra discinesia característica en forma de abombamiento apical del ventrículo izquierdo o “trampa japonesa de pulpo”, aunque puede encontrarse cualquier alteración de la movilidad de la pared ventricular. La sepsis de origen bacteriano es una causa común de cardiomiopatía de Takotsubo, por la producción de sustancias lesivas para el miocardio; la función ventricular retorna a la normalidad en días a semanas.
Se presenta el caso de una paciente previamente sana, de dos meses de edad, sin antecedentes relevantes, con choque séptico, cardiogénico e hipovolémico, función ventricular seriamente disminuida y dilatación importante del ventrículo izquierdo. Después de 36 días de hospitalización, recuperó su función cardiaca normal.
Takotsubo cardiomyopathy is an under-recognised disease in the paediatric population. It could be caused by physical or psychological stress that leads to a reversible cardiac injury. It is characterised by the onset of heart failure signs and symptoms, including electrocardiographic changes, with positive cardiac troponins and healthy coronary circulation. Characteristic apical bulging dyskinesia on left ventricle can be seen in echocardiogram traces, also known as the “Japanese octopus trap”, although any type of dyskinesia may be found. Bacterial sepsis is a well-known cause of Takotsubo reversible cardiomyopathy.
The case id presented of a 2-month old previously healthy female child with cardiogenic-septic-hypovolaemic shock with severely reduced ejection fraction and markedly left ventricle dilatation, which returned to normal parameters after 36 days of intensive care treatment.
La cardiomiopatía inducida por estrés, o cardiomiopatía de Takotsubo, es un síndrome raro en la población pediátrica. Se presenta con más frecuencia en adultos, secundaria a un evento de estrés físico o emocional, y su incidencia en la población infantil está subestimada y poco diagnosticada1.
Fue descrita por primera vez en Japón en 1990, y recibe su nombre por la forma característica que adquiere en el ecocardiograma, el ventrículo izquierdo por abombamiento apical debido a discinesia, descrita como “trampa de pulpo”, en la mayoría de los casos. La presentación clínica típica es la aparición súbita de insuficiencia cardiaca congestiva aguda o dolor torácico, asociados con cambios electrocardiográficos sugestivos de infarto anterior de miocardio1,2. El curso clínico se caracteriza por recuperación total de la función ventricular izquierda en pocos días o semanas1.
Se describe el caso de una paciente de dos meses de edad, que presenta insuficiencia cardiaca aguda, disnea y choque séptico, y se recupera posteriormente.
Caso clínicoSe presentó al servicio de urgencias una paciente de dos meses de edad, procedente de la zona urbana de la ciudad de Pereira.
La madre, ama de casa, tenía 20 años, y el padre, 40 años y se dedicaba a oficios varios; tenía un hermano de un año, sano. No había historia de consanguinidad. La paciente fue llevada a consulta por un cuadro clínico de cuatro días de evolución, caracterizado por tos húmeda, rinorrea, fiebre no cuantificada en picos y dificultad respiratoria progresiva. Los antecedentes médicos, quirúrgicos, farmacológicos, alérgicos y familiares fueron negativos. Fue producto de un embarazo controlado, con amenaza de parto prematuro y maduración pulmonar, atendido sin complicaciones en una institución.
La paciente ingresó letárgica e hipotónica, con dificultad respiratoria importante, aleteo nasal, tiraje subcostal y supraclavicular, jadeante, cianótica, con saturación de oxígeno de 60% y recibiendo oxígeno suplementario por cánula nasal. Los signos vitales mostraban taquicardia de 180 latidos por minuto y taquipnea de 72 respiraciones por minuto. La perfusión distal era mayor de cuatro segundos y en la auscultación se encontraron sibilancias y roncus generalizados. Fue intubada y trasladada a la unidad de cuidado intensivo pediátrico.
Al ingresar a dicha unidad se diagnosticó choque mixto séptico, hipovolémico-cardiogénico e insuficiencia cardiaca aguda por ecocardiografía, y se aisló el virus sincitial respiratorio. Presentaba múltiples trastornos hidroelectrolíticos (hipomagnesemia, hiperfosfatemia, hipocloremia e hiponatremia), anemia y trombocitosis (tabla 1).
Evolución por resultados de laboratorio
| Ingreso | Día 5 | Día 10 | Día 15 | Día 20 | Día 25 | Día 30 | Día 35 | |
|---|---|---|---|---|---|---|---|---|
| Hemograma | GB: 20,260, N: 70%, L: 20,1%, HB 8,3, HTO: 25,5, PLAQ: 619.000 | GB: 12,710, N: 69,4%, L: 24,3%, HB 7,8, HTO: 23,6, PLAQ: 289.000 | GB: 16,870, N: 63,2%, L: 25,9%, HB 14,6, HTO: 42,7, PLAQ: 381.000 | GB: 13,510, N: 49,2%, L: 38,3%, HB 13, HTO: 38, PLAQ: 621.000 | GB: 19,450, N: 32,1%, L: 52,6%, HB 10,4, HTO: 30,7, PLAQ: 1′049.000 | GB: 15,970, N: 38,9%, L: 47,1%, HB 7,2, HTO: 22, PLAQ: 1.058.000 | GB: 14,310, N: 30,6%, L: 39,6%, HB 9,5, HTO: 28,5, PLAQ: 867.000 | GB: 14.260, N: 22%, L: 67,5%, HB 11,1, HTO: 32,8, PLAQ: 739.000 |
| PCR | 11,5 | 18 | 11,7 | 10,9 | 4 | 8,2 | 4,6 | |
| PCT* | 6,54 | 0,67 | ||||||
| Troponina | 0,39 | 0,11 | 0,08 | 0,34 | ||||
| LDH* | 2088 | 1790 | ||||||
| Cultivos | Hemocultivo: Staphylococus epidermidis Resistente CIM>8 para eritromicina, CIM>16 gentamincina, CIM>4 para oxacilina | Urocultivo: Candida parapsilosis Sensible a fluconazol, caspofungina, voriconazol y micafungina | ||||||
| TSH* | 0,33 | 0,11 | ||||||
| T4L* | 0,62 | 2,69 | ||||||
| T3T* | 0,47 | 0,64 | ||||||
| TP* | 20,1 | 13,3 | 11,5 | 14,7 | 15,3 | 13 | ||
| TPT* | 31,6 | 33,6 | 26,7 | 111 | 25,4 | 25,8 | ||
| Fibrinógeno | 303 | 445 | 444 | |||||
| Dímero D | 511 | 1008 | 1099 | |||||
| BUN | 11 | 16 | 20 | 13 | 22 | |||
| Creatinina | 0,2 | 0,2 | 0,2 | 0,2 | 0,3 | |||
GB: globulos blancos, N: neutrófilos, L: linfocitos, Hb: hemoglobina, Hto: hematocrito, Plaq: plaquetas, PCR: proteína C reactiva, PCT: procalcitonina, LDH: deshidrogenasa láctica, TSH: hormona estimulante de la tiroides, T4L: T4 libre, T3T: T3 total, TP: tiempo de protrombina, TPT: tiempo de tromboplastina, BUN: nitrógeno ureico sanguíneo
Durante los 19 días de estancia en la unidad de cuidados intensivos, se administraron diferentes tratamientos, entre los que se incluyeron: sedoanalgesia, esteroides, antibióticos, inotrópicos, diuréticos, inodilatadores, vasopresores, antifúngicos, concentrado globular (cinco ocasiones), inmunoglobulina G y sildenafil. Se evidenciaron glucometrías elevadas, más de 180mg/dl, por lo que se administró insulina y se corrigieron en dos días.
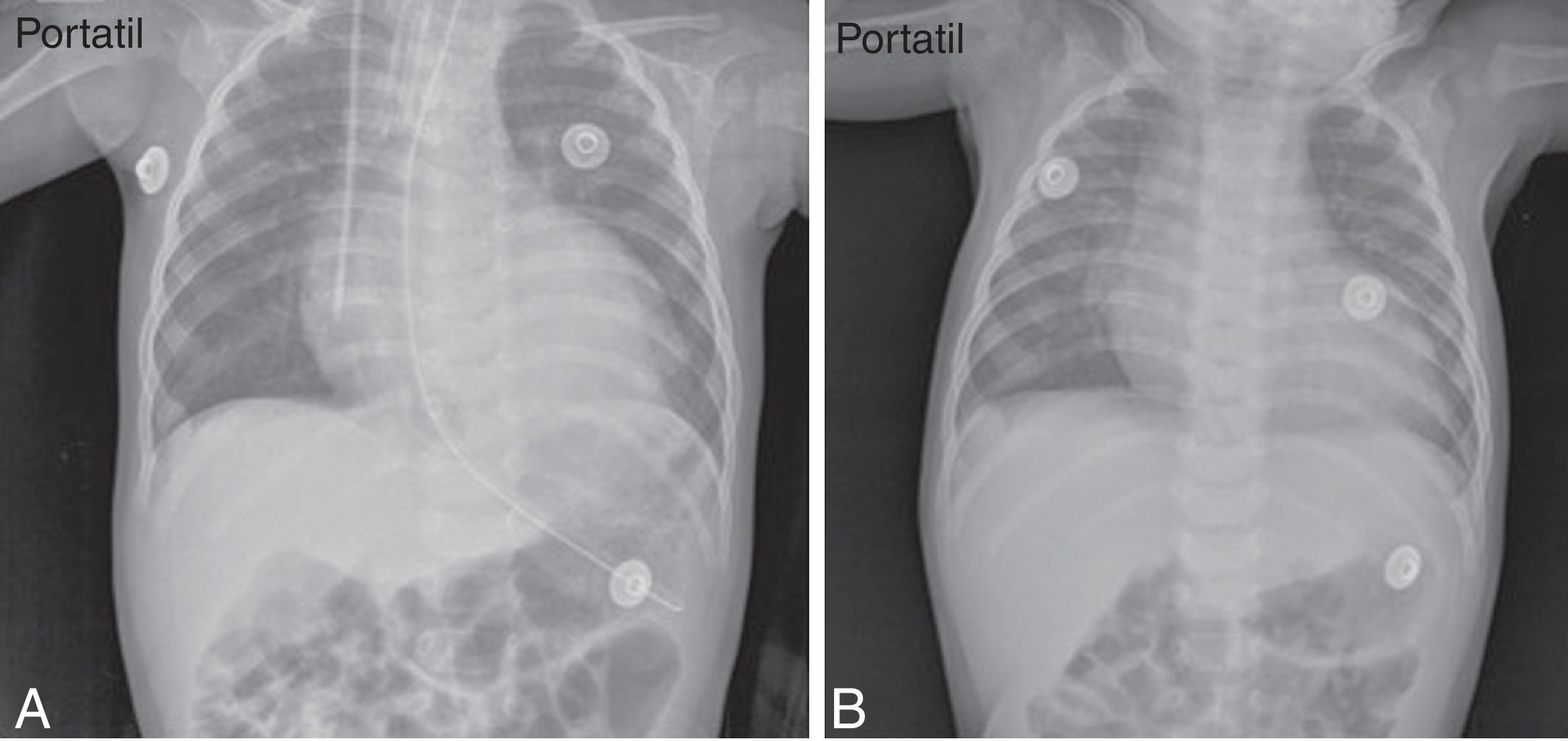
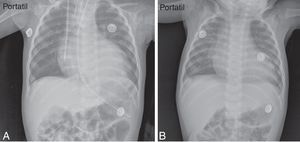
También, se dio soporte vasoactivo y respiratorio, y se pudo retirar el tubo de tórax en el día 19. Paulatinamente, se suspendieron el oxígeno suplementario y los vasoactivos, con buena tolerancia. Varios ecocardiogramas y las radiografías de tórax practicados durante su estancia, mostraron mejoría progresiva de la función y el tamaño ventricular izquierdo, hasta llegar a la normalidad (tabla 2) (fig. 1). Se dio de alta a los 36 días de hospitalización.
Evolución ecocardiográfica
| Ingreso (Día 2) | Corazón en levocardia con levoápex, drenaje venoso pulmonar normal a la aurícula izquierda y drenaje venoso sistémico normal a la aurícula derecha, septum interauricular e interventricular íntegros, aurículas de tamaño normal, válvulas tricúspide, mitral, aortica y pulmonar de aspecto normal con apertura y cierre adecuado, ventrículo derecho de tamaño y contractilidad normales, ventrículo izquierdo con dilatación marcada y contractilidad disminuida. (FEVI 20%) AO:12,2mm AI:11,6mm SP:3,4mm VID:27,4mm VIS:25mm PP:3,9mm FA:8,7% FE:20% |
| (Día 9) | Dilatación ventricular izquierda con disfunción moderada (FEVI 38%), sin signos indirectos de hipertensión pulmonar,no hay defecto cardiaco congénito. Resto normal. AO:13mm AI:14mmSP:4.7mm VID:25mm VIS:23mm PP:4mm FA:17% FE:38% |
| (Día 16) | Leve dilatación ventricular izquierda. (FEVI 62%). Insuficiencia mitral leve, sin signos indirectos de hipertensión pulmonar. AO:10mm AI:11mm SP:3mm VID:21mm VIS:13,7mm PP:3mm FA:31% FE:62% |
| (Día 23) | No hay signos de crecimiento ventricular actual, no hay signos indirectos de hipertensión pulmonar. Buena función sistólica ventricular. (FEVI 75%) AO:13mm AI:12.4mm SP:4mm VID:21mm VIS:12mm PP:4mm FA:42% FE:75% |
La cardiomiopatía de Takosubo, cardiomiopatía por estrés o síndrome de discinesia apical transitoria del ventrículo izquierdo, fue descrita por primera vez en Japón en 19901,3. Es un síndrome cardiaco agudo que semeja un infarto del miocardio, con elevación del segmento ST y aumento de las enzimas cardiacas en ausencia de enfermedad coronaria obstructiva4, caracterizado por acinesia apical e hipercinesia basal del ventrículo izquierdo durante la sístole, lo que le da la forma característica de “trampa japonesa de pulpo”. Aunque es poco común, puede presentarse con cualquier otra anormalidad de la movilidad de la pared ventricular3,5,6, como fue el caso de esta paciente. Afecta principalmente a mujeres posmenopáusicas después de un evento de estrés físico o emocional, como la muerte reciente de un familiar, ejercicio intenso, beber grandes cantidades de alcohol, una riña, excitación o un accidente súbito4.
La etiología parece estar relacionada con una excesiva estimulación adrenérgica, la cual produce un efecto tóxico en los cardiomiocitos, lo que podría generar una sobrecarga de calcio y, así, una disfunción contráctil transitoria del miocardio ventricular más que una necrosis miocárdica5,6.
Clínicamente se caracteriza por dolor torácico, hipotensión, colapso y, con menor frecuencia, disnea3. El curso clínico es usualmente benigno, con recuperación total en dos a cuatro semanas, pero se ha informado recurrencia del choque cardiogénico.
Su incidencia es de 150 a 200 casos en adultos con síndrome coronario agudo, la edad media de aparición es de 66 años en hombres y de 69 años en mujeres7; solo se han descrito unos pocos casos en niños8, lo que lo hace poco reconocido por pediatras y, por consiguiente, es subdiagnosticado en esta población3.
La disfunción ventricular asociada a estrés físico puede estar relacionada con alteraciones neurológicas, como hemorragia subaracnoidea, enfermedad isquémica cerebral y convulsiones; alteraciones respiratorias, como crisis asmática grave, obstrucción de la vía aérea o neumotórax; alteraciones metabólicas, como cetoacidosis diabética, y alteraciones hemodinámicas, como hipovolemia y sangrado gastrointestinal6.
En cuanto a la sepsis, que es el factor desencadenante en esta paciente, se han propuesto varios mecanismos por los cuales puede producir lesión cardiaca, entre los cuales se incluyen productos bacterianos y reacción inmunitaria del huésped. Existe activación, adhesión e infiltración cardiaca por parte de los monocitos, activación del sistema de coagulación, liberación de citocinas, activación endotelial con aumento de la endotelina, altas concentraciones de óxido nítrico, alteración de la microcirculación coronaria con deterioro de la utilización del oxígeno y la estimulación catecolaminérgica antes mencionada9.
Cabe descartar que el diagnóstico de esta condición clínica continúa siendo una sospecha diagnóstica en la paciente, ya que existen múltiples causas de insuficiencia cardiaca aguda en niños, entre las cuales se incluyen anormalidades estructurales cardiacas, anormalidades congénitas, sobrecarga de volumen por cortocircuito de derecha a izquierda desde la circulación sistémica a la pulmonar, defectos valvulares10, y miocarditis producidas por virus (como coxsackie virus, adenovirus, virus de Epstein-Barr, virus de la influenza A y B, virus del herpes simple de tipo 6, citomegalovirus y parvovirus B 19)11; además, bacterias como estreptococos y parásitos como Trypanosoma cruzi12.
En el presente caso, se destaca el virus sincitial respiratorio positivo, como diagnóstico etiológico y diferencial importante.
Los hallazgos electrocardiográficos incluyen elevación prominente del segmento ST en las derivaciones V4 a V6 respecto a las derivaciones V1 a V3, ausencia de cambios recíprocos en derivaciones inferiores, inversión global o precordial de la onda T y prolongación del intervalo QT. En algunas ocasiones, los cambios electrocardiográficos pueden ser inespecíficos6.
Este artículo pretende sensibilizar al personal de salud sobre la importancia de la miocardiopatía de Takotsubo como diagnóstico diferencial de la insuficiencia cardiaca aguda en niños.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflictos de interesesLos autores declaran que no hubo financiamiento y que no presentan conflictos de intereses.