INTRODUCCION
El tratamiento de la enfermedad de Hodgkin representa uno de los mayores éxitos de la medicina del siglo xx. Hace 50 años, el paciente sobrevivía sólo unos pocos años, mientras que actualmente la tasa de supervivencia a los 5 años es más del 85%. Este éxito se basa en la ampliación de los campos de radioterapia y en los actuales esquemas de quimioterapia, que combinan varios fármacos. Sin embargo, el seguimiento a largo plazo de los pacientes ha demostrado que el precio de este avance ha sido el incremento de las neoplasias secundarias.
Se han identificado 3 tipos de segundos tumores tras un linfoma Hodgkin: leucemia aguda, linfoma no hodgkiniano y tumores sólidos. El riesgo se asocia al uso de radioterapia y de agentes alquilantes contenidos en los regímenes MOPP (meclorotiamina, vincristina, procarbacina y prednisona) y ChlVPP (clorambucil, vinblastina, procarbacina y prednisona)1,2.
El cáncer de mama es el tumor sólido más frecuente en las mujeres diagnosticadas y tratadas de enfermedad de Hodgkin3,4. Las tasas aumentadas de cáncer de mama se atribuyen a la irradiación del tórax y a la conocida sensibilidad de la mama a las radiaciones ionizantes, especialmente de la mama en desarrollo5.
El tipo histológico de mayor frecuencia es el ductal infiltrante, más comúnmente bilateral y receptor hormonal negativo. Es un cáncer que no depende de la historia reproductiva y no se asocia con las mutaciones genéticas conocidas6.
CASOS CLINICOS
Caso 1
Paciente de 43 años, que acude a nuestra unidad de mama remitida desde las consultas del área por un hallazgo mamográfico sospechoso.
En la anamnesis, no refería antecedentes familiares de interés, ni historia de cáncer de mama.
Había sido diagnosticada de linfoma de Hokgkin (esclerosis nodular), en estadio II-A, de localización mediastínica a los 28 años.
Recibió quimioterapia según esquema ABVD (adriamicina, bleomicina, vimblastina, dacarbacina) en 6 ciclos, obteniendo una respuesta completa. No obstante, se completó el tratamiento con telecobaltoterapia a través de 2 campos anterior y posterior (según la técnica de MANTLE), cubriendo áreas ganglionares supradiafragmáticas, con una dosis total de 40 Gy.
Se encontraba en remisión completa desde la conclusión del tratamiento.
Entre los antecedentes obstétrico-ginecológicos, cabe comentar que la menarquia sobrevino a los 12 años, con tipo menstrual 4/30. Tuvo 2 embarazos de curso normal, el primero a los 25 años (que terminó en cesárea por presentación podálica) y el segundo a los 32 (tras el linfoma de Hodgkin, que concluyó en parto eutócico), con lactancia materna en ambos (9 meses).
En la exploración mamaria se apreciaba un ligero aumento de densidad, asimétrico y localizado en los intercuadrantes superiores de la mama derecha, sin nódulo definido. La paciente no presentaba adenopatías axilares.
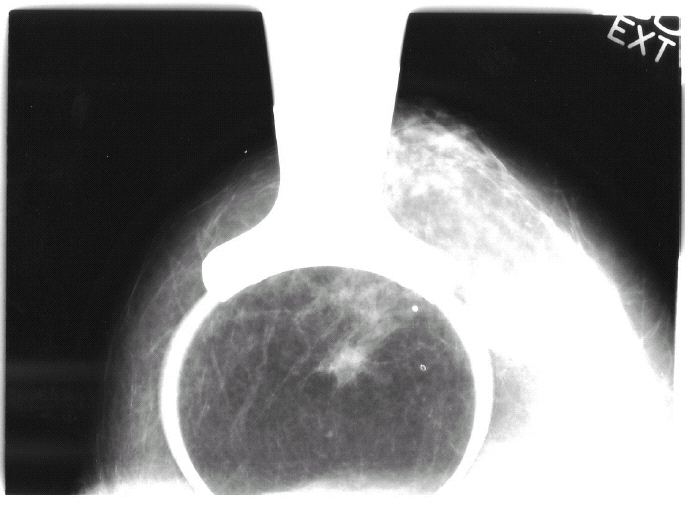
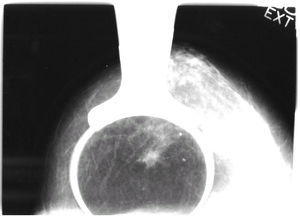
La mamografía informaba de la presencia de una «imagen seudonodular espiculada en ICS-CSI de la mama derecha con microcalcificaciones en su interior, sospechosa de malignidad» (fig. 1).
Figura 1. Mamografía: imagen seudonodular sospechosa de malignidad en ICS-CSI de la mama derecha.
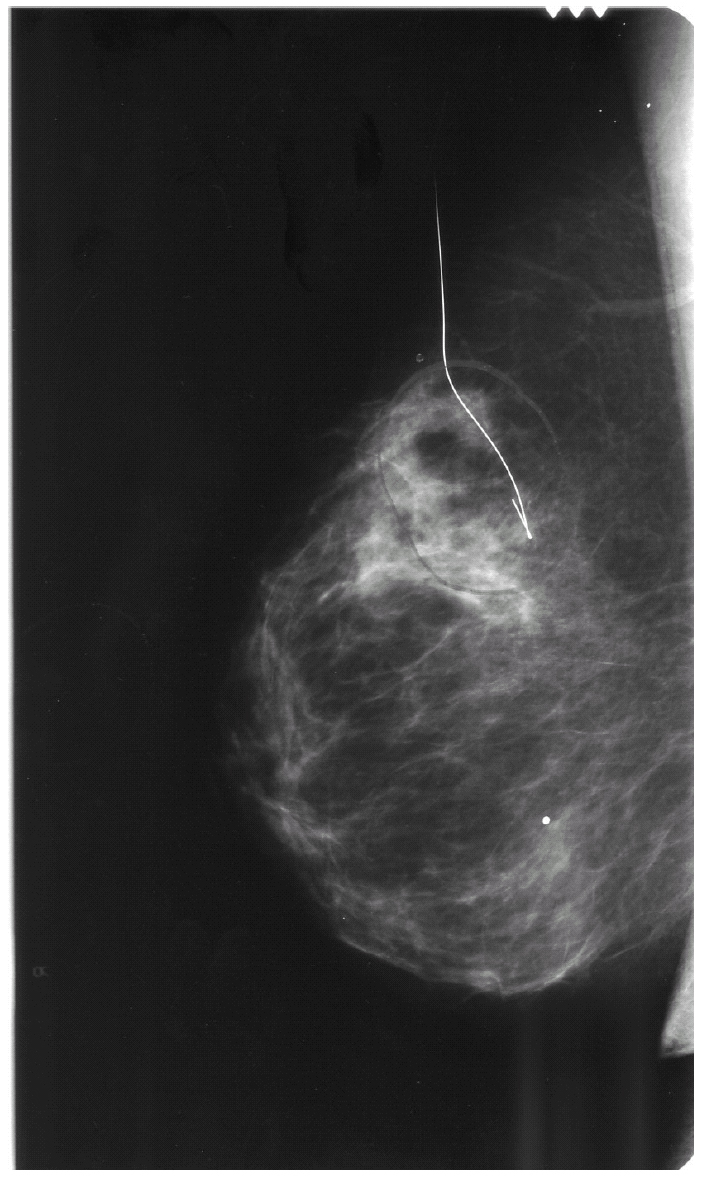
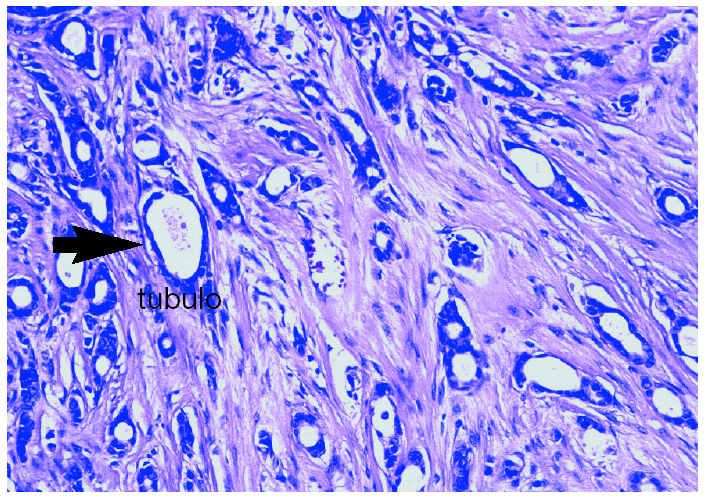
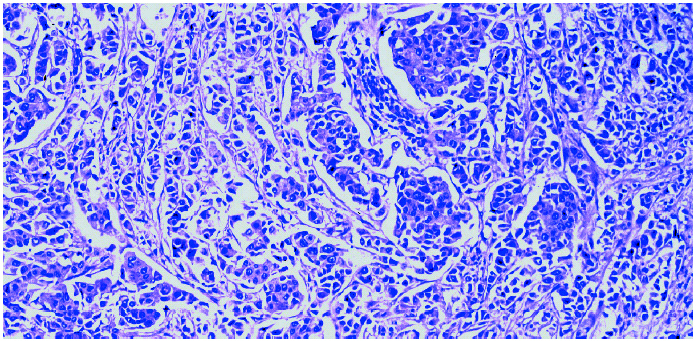
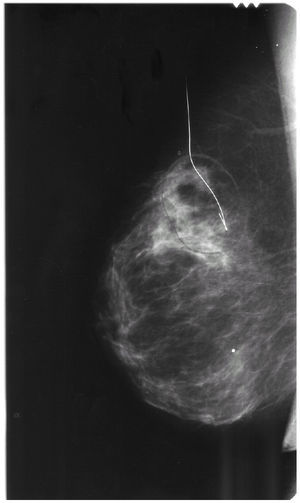
Se cursaron estudios preoperatorios y se programó una biopsia con arpón de la citada lesión (fig. 2). El informe histológico fue «carcinoma ductal infiltrante G-I de 1,5 cm. Imágenes de carcinoma tubular. Carcinoma ductal in situ G-II con patrón cribiforme. Carcinoma lobulillar in situ. Afección de bordes anterior y posterior. Receptores hormonales: RE (+ al 65%) y RP (+ al 50%), Cerb2 (), p53 ()» (fig. 3).
Figura 2.Imagen del arpón que señaliza la lesión en ICS-CSI de la mama derecha previo a la biopsia.
Figura 3. Imágenes histológicas de carcinoma ductal infiltrante de grado I.
Tras completar el estudio de extensión se propuso, debido a su alto riesgo, la realización de «mastectomía con linfadenectomía derechas, mastectomía profiláctica izquierda y reconstrucción inmediata con colocación de expansores». La mastectomía profiláctica contralateral se llevó a cabo por el riesgo para desarrollar un carcinoma en la mama izquierda, condicionado por la irradiación de los cuadrantes internos de ambas mamas en la enfermedad de Hodgkin de localización mediastínica.
La histología de la pieza (mastectomía derecha) mostró la presencia de «carcinoma ductal in situ residual G-II en CSE y ambos cuadrantes internos e imágenes de carcinoma lobulillar in situ en todos los cuadrantes. Doce ganglios aislados negativos». En la mama izquierda se encontraron únicamente «cambios mastopáticos».
Posteriormente, se sustituyeron los expansores por prótesis definitivas por parte del servicio de cirugía plástica de nuestro hospital.
La paciente inició hormonoterapia adyuvante con tamoxifeno, tratamiento con el que sigue en la actualidad.
Tras 2 años de la cirugía, la paciente se encuentra bien y sin evidencia de enfermedad.
Caso 2
Paciente de 34 años, remitida a nuestra consulta desde el área por la presencia de «un nódulo palpable sospechoso en la mama izquierda».
Durante la anamnesis, la paciente no referió antecedentes familiares de cáncer ginecológico ni mamario.
A los 22 años había sido diagnosticada y tratada por un linfoma de Hodgkin, esclerosis nodular, de localización mediastínica, en estadio II-A. Se trató inicialmente con quimioterapia según el esquema ABVD en 3 ciclos, con la que se consiguió una notable disminución de la afección ganglionar, persistiendo las adenopatías paratraqueales. Seguidamente, se remitió al servicio de radioterapia, donde se trató con cobalto-60 mediante 2 campos anteroposteriores según la técnica de MANTLE, englobando todas las cadenas ganglionares supradiafragmáticas. La dosis total fue de 40 Gy. La exploración al final del tratamiento fue negativa (respuesta completa). La paciente se encontraba en remisión desde entonces. Como antecedentes obstétrico-ginecológicos cabe mencionar la aparición de la menarquia a los 12 años, tipo menstrual 4/29, y una gestación que finalizó con la muerte de un feto a término, 1 año antes del diagnóstico del cáncer de mama que nos ocupa. El estudio necrópsico posterior del feto no mostró la presencia de hallazgos que justificaran la muerte del niño.
En la exploración se palpaba una tumoración de 2 cm, localizada en el cuadrante superoexterno de la mama izquierda, bien definido y no adherido a planos adyacentes. No se palpaban ganglios axilares.
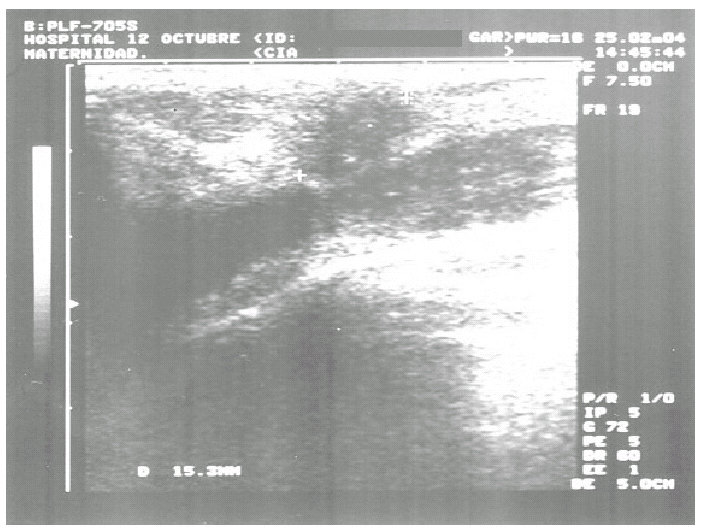
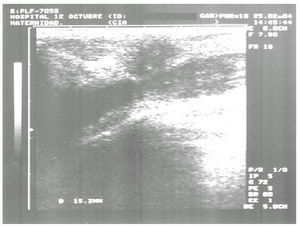
En la mamografía y la ecografía mamarias se visualizaba un nódulo de 2 cm en el cuadrante superoexterno (CSE) de la mama izquierda, con microcalcificaciones en su interior, sospechoso de carcinoma (fig. 4).
Figura 4. Ecografía de mama: nódulo de 2 cm sospechoso de malignidad en cuadrante superoexterno de mama izquierda.
Realizamos punción con aguja gruesa, con diagnóstico anatomopatológico de «carcinoma ductal infiltrante G-III. Receptores hormonales negativos».
Los estudios preoperatorio y de extensión previos resultaron normales. Se programó «mastectomía y linfadenectomía axilar izquierdas». Se desestimó la mastectomía profiláctica derecha ante la negativa de la paciente.
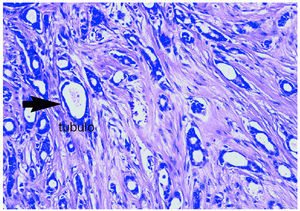
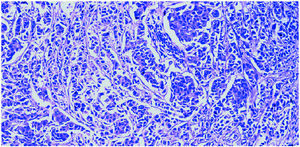
El informe histológico confirmó la presencia de un «carcinoma ductal infiltrante G-III, de 2,5 cm de tamaño, con componente intraductal extenso G-III comedocarcinoma. Siete ganglios aislados sin infiltración de carcinoma. Inmunohistoquímica: RE y RP negativos. Cerb2 (+++), p53 (+, 15%)» (fig. 5).
Figura 5. Anatomía patológica de la tumoración, compatible con carcinoma ductal infiltrante de grado III.
La paciente recibió quimioterapia adyuvante según el esquema AC (adriamicina, ciclofosfamida) en 6 ciclos, seguido de herceptín.
Posteriormente, se remitió al servicio de cirugía plástica para la reconstrucción mamaria diferida.
Tras 2 años del tratamiento quirúrgico, la paciente se encuentra bien y sin evidencia de enfermedad.
DISCUSION
Aunque el riesgo de cáncer de mama está aumentado en un 50% en las mujeres tratadas por la enfermedad de Hodgkin en la mayoría de los estudios7, el riesgo relativo es mucho mayor en las pacientes tratadas a edades tempranas, especialmente en la infancia y la adolescencia8,9. De manera que las pacientes menores de 21 años tienen un riesgo relativo de 15-258,10-14. El riesgo absoluto en este grupo es del orden de 20-40 por 10.000 pacientes al año. Es mayor en las mujeres tratadas entre los 10 y 16 años8-10,12.
La probabilidad de padecer un cáncer de mama también está aumentado en las mujeres tratadas en su juventud (20-29 años) y, aunque el riesgo relativo puede ser menor que en la adolescencia, el riesgo absoluto encontrado es similar8,13,15.
Los tratamientos en ≥ 30 años no estarían asociados al desarrollo de un tumor mamario según la mayoría de los estudios8,16,17, aunque en un largo estudio de seguimiento durante 25 años en Holanda, se halló un riesgo relativo de 2,4 (0,9-5,2) en las pacientes tratadas entre los 31 y 39 años13, y en el estudio americano llevado a cabo por Ng et al14 el riesgo relativo también estaba aumentado en las mujeres tratadas entre los 30-35 años (3,7 [rango, 1-9,5]) y los 36-40 años (3,4 [rango, 0,4-12,1])15. Por tanto, es probable que se extienda a los tratamientos a mujeres mayores de 40 años, pero es difícil cuantificarlo, sobre todo porque necesitaríamos períodos de seguimiento muy largos.
La edad media al diagnóstico de cáncer de mama es de 40 años18.
El tiempo de inducción hasta que aparece la neoplasia es largo: de 10-14 años14,15,19 o 15-19 años8,13. Tras el tratamiento en la infancia y la adolescencia, el tiempo de inducción es aparentemente más corto9,10,12,18, incluso de 5 años según el estudio de Bhatia et al8.
Nuestras 2 pacientes fueron tratados por el linfoma Hodgkin con 28 y 22 años, edades asociadas con un riesgo aumentado de cáncer de mama, tal como refieren la mayoría de los estudios consultados. Los tiempos de inducción fueron de 21 y 21 años.
El tiempo durante el cual el riesgo permanece aumentado es incierto. Algunos estudios lo han encontrado en seguimientos de 20 años8,9,11-13 y 25 años o más en el estudio de Travis et al6. Según el Comité de Efectos Biológicos de las Radiaciones Ionizantes, y a juzgar por otros grupos de pacientes expuestos a radiaciones, se puede esperar que el riesgo esté aumentado sustancialmente durante 40 años o más tras la radioterapia.
La probabilidad de sufrir un cáncer de mama se incrementa significativamente con la dosis de radiación aplicada, así como su localización. El riesgo relativo oscilaría entre 4,5 (rango, 1,3-16)17 y 8 (rango, 2,6-26,4)18 para dosis ≥ 38,5 Gy, respecto al grupo que recibía < 4 Gy. La irradiación axilar y mediastínica y el hecho de que el punto de dosis máxima sea anterior está asociado significativamente con el desarrollo de un tumor mamario20.
La quimioterapia aislada no parece estar asociada con un incremento en la incidencia de carcinoma de mama13,14,19, incluso se ha observado una reducción del mismo (riesgo relativo de 0,6) con el uso de sólo agentes alquilantes19. Los análisis en los pacientes que han recibido combinación de radioterapia y quimioterapia muestran riesgos menores de neoplasias mamarias en comparación con el grupo que fue tratado sólo con radioterapia: 4,6 frente a 14,413,17-19,21. Esta disminución se debe tanto a la acción de los citotóxicos sobre la células epiteliales mamarias precancerosas como a la ablación hormonal que producen por su toxicidad sobre los ovarios.
Además, el riesgo relativo disminuye con el número de ciclos con agentes alquilantes18, lo cual se encuentra en relación directa con el efecto sumatorio de los mismos de producir menopausia química. Esto explicaría también el menor riesgo de desarrollar cáncer de mama en las mujeres tratadas a partir de los 30 años de edad, ya que el tiempo de exposición a las hormonas sexuales hasta la menopausia sería menor que en las pacientes más jóvenes.
En nuestros 2 casos, las pacientes recibieron radioterapia mediastínica a dosis de 40 Gy y quimioterapia según el esquema ABVD sin agentes alquilantes.
Ambas continuaron con menstruaciones regulares tras finalizar el tratamiento por el linfoma Hodgkin, y las dos habían cursado un embarazo posteriormente a la enfermedad. La primera tuvo un embarazo espontáneo y sin incidencias con un parto eutócico; en la segunda la gestación, de curso normal, finalmente concluyó con muerte fetal a término anteparto.
Aunque este tipo de tumores suelen ser receptores hormonales negativos, las hormonas ováricas podrían ser críticas en la carcinogénesis de la radioterapia. El riesgo aumentado de cáncer de mama tras radioterapia se debe, en parte, a los cambios mutacionales que provoca, y que tras años de estimulación hormonal desembocan en cáncer de mama.
Es preciso comprobar si también tendrían un efecto protector los regímenes quimioterápicos actuales que no contienen agentes alquilantes y no producen fallo ovárico temprano y, sin embargo, reducen el riesgo de leucemia aguda (ABVD).
Varias son las estrategias para el diagnóstico temprano del cáncer de mama en mujeres irradiadas por enfermedad de Hodgkin:
-- Información y consejo apropiado a la paciente.
-- Cribado mamográfico. Cabe pensar que en las mujeres jóvenes, la mamografía es menos sensible debido a la mayor densidad de la mama, pero hay evidencias del beneficio que reporta22. Se ha evaluado la resonancia magnética como método de cribado en las mujeres jóvenes y los datos sugieren que es un método muy sensible, pero con una alta tasa de falsos positivos23.
-- En cuanto al tratamiento, la tendencia actual es reducir el uso de radioterapia, sobre todo en enfermedad avanzada y diseminada donde no hay evidencia clara del beneficio de la radioterapia sobre la supervivencia global24. En la forma temprana o más localizada, el empleo de quimioterapia neoadyuvante permite reducir el campo y la dosis de irradiación25. No se ha demostrado que la quimioterapia sola sea más eficaz que la radioterapia o que los regímenes combinados (radioterapia y quimioterapia) en el control de la enfermedad de Hodgkin26. Se está investigando el papel de la tomografía de emisión de positrones para predecir las mujeres con enfermedad temprana y tratadas inicialmente con quimioterapia (AVBD), que podrían evitar la radioterapia27.
Como conclusión, en las mujeres menores de 30 años, que requieren irradiación supradiafragmática, hay que intentar minimizar la dosis y limitar el volumen de tejido mamario irradiado y asegurarse de que están informadas y aceptan el riesgo asociado de desarrollar cáncer de mama.
Correspondencia:
Dra. M. Rosario Noguero Meseguer.
Departamento de Obstetricia y Ginecología.
Hospital 12 de Octubre.
Jazmín, 127. 28529 Madrid. España.
Correo electrónico: rnoguero.hdoc@salud.madrid.org
Fecha de recepción: 3/6/05.
Aceptado para su publicación: 11/10/05.