Describimos y analizamos el caso de una gestación múltiple bicigótica, consistente en un feto genotípica y morfológicamente sano junto a una mola hidatiforme completa, que desembocó en un parto prematuro en el segundo trimestre debido a complicaciones hipertensivas maternas. Tras la evacuación tanto del producto fetal como del tejido molar, la paciente desarrolló enfermedad trofoblástica gestacional persistente. Hemos querido centrar el caso en torno a esta última patología, y abordar los casos en que la enfermedad se presenta en un embarazo gemelar y exponer el curso diagnóstico y el posterior manejo médico de la fase persistente de la enfermedad trofoblástica gestacional.
We describe and analyse the case of a multiple dizygotic pregnancy, formed by a genotypically and morphologically healthy foetus with a complete hydatidiform mole that ended in a preterm birth in the 2nd trimester due to maternal hypertension complications; after the evacuation of both foetus and the molar tissue, the patient developed a post-gestational Trophoblastic Neoplastic disease. We would like to focus on this pathology, looking at cases where the disease occurs in a twin gestation, explaining the diagnostic procedure and subsequent medical management of the persistent phase of gestational trophoblastic disease.
Los casos de embarazos gemelares con presencia de enfermedad trofoblástica gestacional (ETG) concomitante son muy poco frecuentes en la práctica médica. Se estima que la incidencia es de, aproximadamente, 1 de cada 20.000 a 100.000 casos. Es, por tanto, una circunstancia obstétrica poco conocida, con lo que el profesional carecerá muy probablemente de experiencia respecto a su correcto manejo, en caso de presentársele la ocasión de tratarlo alguna vez. Hay que tener en cuenta que tales casos implican no sólo una atención obstétrica máxima, velando por eventuales complicaciones maternas (enfermedad hipertensiva gestacional, TEP por líquido amniótico, etc.) y fetales (muerte fetal, prematuridad), sino que también habría que prestar atención a la evolución de la ETG presente en el embarazo gemelar, tanto durante como después del nacimiento y la extracción fetoplacentaria. Esto sería debido a la tendencia a las complicaciones derivadas de la enfermedad molar, entre ellas el hipertiroidismo materno, las lesiones uterinas, el hidramnios de la bolsa afectada o la aparición de ETG persistente (ETGP) o posmolar.
CASO CLÍNICOMujer de 28 años, primigesta, con asma extrínseca y una fractura de fémur intervenida como únicos antecedentes destacables; sin antecedentes ginecoobstétricos. Su última regla fue el 12 de enero de 2007, con ciclos menstruales regulares. Acudió a la consulta obstétrica por el hallazgo, en la ecografía de las 12 semanas, de un hematoma subcorial que, valorado por nuestro servicio, se redefinió como una imagen centroplacentaria de aspecto vesicular, por lo que la primera impresión diagnóstica fue de mola hidatiforme parcial. Por ello, se estudió y controló en el ámbito hospitalario.
Ante la sospecha, se realizó una determinación de gonadotropina coriónica beta (β-HCG) en sangre materna, que arrojó un resultado de 986.840 U/l, muy por encima de los valores esperables para la semana 16 de gestación (estimados en torno a los 10.000-30.000 para el segundo trimestre)1. Este dato apoyó firmemente el diagnóstico de ETG en el contexto de un embarazo gemelar.
En cuanto al feto, la ecografía realizada en la semana 20 descartó malformaciones objetivables y el estudio citogenético del líquido amniótico arrojó un resultado normal. Con el diagnóstico de feto sano y mola hidatiforme coexistente (que se confirmó histológicamente como mola completa con el estudio de la masa tras su evacuación), se planteó la posibilidad de continuar el embarazo, que fue aceptada por la madre, por lo que continuó el control hospitalario de su gestación.
Tras dos trimestres de evolución sin incidencias, la gestante se presenta en la urgencias ginecológicas a las 23 + 6 semanas de gestación por un cuadro de dolor abdominal sin metrorragia; presentaba, además, una presión arterial > 140/90mmHg de manera mantenida. Se decidió su ingreso, con diagnóstico de probable enfermedad hipertensiva más APP, para su estudio y control mediante batería analítica básica más ionograma, con control del balance hídrico, y para la administración de tratamiento hipotensor. A su vez, se procedió a la monitorización biofísica del feto, con ecografía al ingreso para biometría (acorde a FUR), estudio Doppler (normal), y cardiotocograma basal continuo.
Preceptivamente, se indicó tratamiento madurador para el feto.
A pesar de la actuación médica, la paciente presentó complicaciones en su evolución, con riesgo muy alto de evolucionar a una situación eclámpsica, por lo que se decidió la terminación del embarazo a las 36h de su ingreso, por peligro materno. Se practicó una cesárea que resultó en el nacimiento de un feto vivo de 24 semanas y 630g de peso, que necesitó reanimación neonatal e ingreso en la unidad de cuidados intensivos por su condición de gran prematuro, aunque presentó algunos cuadros patológicos de prematuridad (enfermedad de la membrana hialina, anemia, bajo peso, retinopatía de prematuridad, etc.). En la actualidad, evoluciona favorablemente y continúa los controles en el servicio de pediatría de nuestro hospital.
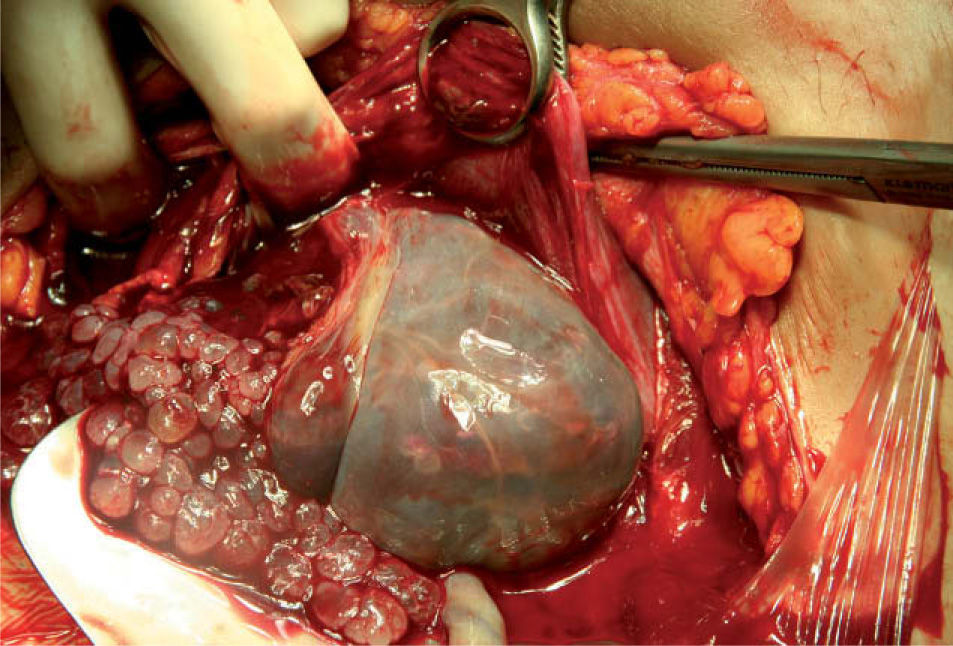
En el mismo acto quirúrgico (fig. 1) se practicó la evacuación uterina del tejido molar, mediante extracción manual y un legrado posterior, con legra roma, de la cavidad. Se practicaron varios lavados abdominales con suero fisiológico para arrastrar y limpiar todo el material vesicular liberado a la apertura del amnios. El tejido extraído (fig. 2) se envía al laboratorio de anatomía patológica para estudio, que confirma el diagnóstico de mola hidatiforme completa.
La revisión del lecho uterino donde asentaba la mola fue escrupulosa, pero no se objetivó ninguna invasión macroscópica del miometrio ni ningún implante extrauterino.
Tras la intervención, la paciente ingresó en la unidad de cuidados postoperatorios inmediatos, donde se estabilizó su situación hemodinámica y se logró una recuperación satisfactoria, tras lo cual regresó a la zona de hospitalización obstétrica, donde además de ser atendida en su posparto inmediato, comenzó el control postevacuación de la ETG.
Para dicho control, en primer lugar se le realizaron una radiografía de tórax y una determinación de β-HCG plasmática durante el ingreso, la primera informada como normal y en el segundo caso con un valor de 164.540mU/ml (fig. 3). Su caso pasó a la consulta de oncología ginecológica.
En las siguientes semanas, la paciente experimentó un descenso progresivo de los valores plasmáticos de β-HCG hasta la cuarta semana, cuando estos valores se estancaron y presentaron una meseta desde la cuarta hasta la séptima semana (fig. 4) en torno a 520 y 590mU/ml. Se decidió, por tanto, aplicar el protocolo diagnóstico y terapéutico relativo a la ETGP de nuestro hospital:
- –
El estudio de extensión (tomografía computarizada [TC] toraco-abdómino-pélvica) no objetivó presencia de focos metastáticos ni extensión extrauterina (estadio I).
- –
La paciente cumplió los criterios que definen el estadio de riesgo bajo en la clasificación FIGO.
Valores de β-HCG desde el 19 de julio de 2007 hasta el 25 de septiembre de 2007, donde se observa que, tras un primer descenso, la hormona presenta una meseta en torno a los 570–590mU/ml en 4 mediciones sucesivas (valores englobados en la elipse). β-HCG: gonadotropina coriónica beta.
La paciente pasó a cargo del servicio de oncología médica para recibir tratamiento quimioterápico según protocolo. Dado que se ha etiquetado a la paciente como de riesgo bajo, se optó por el empleo de la terapia con único agente: metrotexato a dosis de 0, 4mg/kg por vía intravenosa, en 2 ciclos de 5 y 4 días, respectivamente, con un lapso entre ellos de, aproximadamente, 3 semanas. Se objetivó un descenso progresivo de los valores de β-HCG a partir del inicio del tratamiento. Como única complicación reseñable, la paciente presentó una mucositis secundaria a la quimioterapia que requirió de ingreso, aunque únicamente para recibir tratamiento analgésico y antibiótico por vía intravenosa, con lo que el cuadro mejoró.
Tres semanas después del segundo ciclo de quimioterapia por vía intravenosa, recibió una dosis más de metrotexato, esta vez de 30mg/m2 y por vía intramuscular, como tratamiento de consolidación.
En el control realizado al cumplir 2 meses desde el inicio del tratamiento farmacológico, y en 87.° día posevacuación, se constató la negativización de la β-HCG plasmática (fig. 3); la paciente permaneció asintomática (salvo por las secuelas de la mucositis iatrógena). Además, se le realizó una TC toraco-abdómino-pélvica, que no reveló ninguna señal de lesiones invasoras locales ni implantes extrauterinos. El servicio de oncología dio de alta a la paciente, por lo que quedó a cargo, nuevamente, del servicio de ginecología del hospital para el seguimiento indicado según protocolo. En la actualidad, permanece asintomática y sin signos de reaparición de la enfermedad.
DISCUSIÓNLa ETGP o maligna es una entidad dentro del espectro de la ETG, que comprende la mola invasora, el coriocarcinoma y el tumor de lecho placentario. Esta variante de la enfermedad trofoblástica aparece hasta en un 20 % de casos; la gran mayoría proviene de una lesión molar anterior (completa o parcial). Puede presentarse como ETGP no metastásica (tejido molar retenido, o bien como mola invasora), en un 15%, o en su forma metastásica (5% restante)3.
Para el diagnóstico, se siguen los criterios postulados por la FIGO, en consenso con varios organismos (Society of Gynecologic Oncology, The International Society for the Study of Trophoblastic Disease y The International Gynecology Cancer Society), que afirman lo siguiente:
- –
Cuatro valores de β-HCG en meseta (variación del 10%), durante 3 semanas.
- –
Incremento de más del 10% en tres valores consecutivos en un período de 2 semanas (tomados los días 1, 7 y 14).
- –
Cuando se mantiene detectable tras 6 meses postevacuación.
- –
Cuando se tiene un diagnóstico histológico de coriocarcinoma3.
Antes de decidir el tratamiento, será necesario realizar la estadificación de la enfermedad. Para ello hoy día se emplea un sistema de clasificación propuesto por la FIGO y basado en la evaluación de 2 tipos de criterios:
- –
Criterios anatómicos, para la estadificación propiamente dicha: divididos en 4 estadios, I a IV, dependiendo de la localización de la mayor lesión tumoral: si intraútero (estadio I) o fuera de él (estadio II; si en pulmón, estadio III), o bien con focos metastásicos extrapulmonares (estadio IV).
- –
Criterios pronósticos: factores de riesgo a los que se asigna una puntuación, que al sumarlos ofrecen una puntuación total que identifica la enfermedad como de riesgo bajo o alto4,5.
Con ello, contamos con un sistema de clasificación objetivo que permite ajustar el tratamiento quimioterápico que se debe emplear en cada caso, dependiendo de la orientación pronóstica que nos ofrece. Así, en la disyuntiva del empleo de un solo quimioterápico frente a la poliquimioterapia (± adyuvantes) elegimos el tratamiento único para los casos de riesgo bajo con estadios I a III, y puntuación pronóstica ≤ 6, mientras que usaríamos pautas combinadas con los casos de riesgo alto, como son en estadio IV y aquéllos con puntuaciones > 66,7.
En el caso que nos ocupa, el estudio de imagen completo, que se realizó a la paciente con TC toraco-abdómino-pélvica, demostró ausencia de focos metastáticos. Además, la paciente contaba con pocos factores de riesgo (β-HCG > 100.000 y tamaño tumoral > 5cm), por lo que obtuvo una puntuación pronóstica baja. Se la clasificó como estadio I de riesgo bajo, por lo que se optó por la monoterapia. El tratamiento con 3 ciclos de metotrexato resulta efectivo sin necesidad de reajustarlo a poliquimioterapia.
Nuestro resultado concuerda con los datos positivos obtenidos por diversos autores relacionados con la efectividad del tratamiento en casos de ETGP en embarazos múltiples afectados por lesiones molares, como ocurre en el caso que nos ocupa. En la literatura científica, la revisión más extensa de casos de la misma naturaleza la realizaron Sebire et al8, que data del año 2000; en el estudio registran 77 casos de embarazos gemelares compuestos por mola hidatiforme completa y feto sano. En dicha revisión presentan datos sobre el devenir de los embarazos y distinguen los casos llegados a término de los interrumpidos, tanto antes como después de la viabilidad. La revisión informa de embarazos llevados a término exitosamente hasta en un 40% de los casos. Por otro lado, también analizan la aparición de ETGP en dichos embarazos, así como el tratamiento que recibieron los casos con presencia de enfermedad molar maligna. Informan de que 15 (19%) de las 77 mujeres presentaron la enfermedad, sin que hubiese diferencia estadísticamente significativa entre el grupo de las mujeres que interrumpieron su embarazo antes de la semana 14 (n = 19) y las que continuaron adelante (n = 58). Por otro lado, estudiando la necesidad de quimioterapia (monoterapia frente a poliquimioterapia), constataron que de esos 19 casos sólo 4 necesitaron de tratamiento con agentes múltiples; en todos los casos el tratamiento fue satisfactorio, ya que no hubo ninguna muerte materna. Con estos datos Sebire et al8 plantean en sus conclusiones que parece no existir un riesgo mayor de aparición de enfermedad trofoblástica posmolar en los casos de embarazos gemelares con mola completa y feto sano en los que se decide continuar, comparados con los casos en los que se decide abortar por la seguridad materna. Por otro lado, informan de que los casos en los que la ETGP se presenta obtienen buenos resultados con el tratamiento habitual, incluso con el tratamiento de agente único, por lo que, en su opinión, es puede plantear la continuación de tales gestaciones en un contexto de normalidad de su evolución.
Existen otras revisiones, como la de Bruchim et al9, con 15 casos. En esta serie, la ETGP aparece hasta en un 53% del total de los casos, con una incidencia del 27% de enfermedad metastásica, datos que se acercan a los observados por Steller et al10 (55% de casos de ETGP y 23% de enfermedad metastásica), y superando las cifras observadas por Bristow et al11 pocos años antes (28,6% de casos de ETGP), datos que, según los autores, demuestran un comportamiento postevacuación inusualmente agresivo en esos casos de embarazos gemelares asociados a mola hidatídica completa.
Por otro lado, Bruchim et al9 en su estudio comparan la incidencia total, sin hacer distinción entre embarazos llevados a término con los interrumpidos o los nacidos en semanas previables, tal y como hacen Sebire et al8 y Bristow et al11. Estos últimos autores contaban con 19 casos con evacuación del producto fetal antes de la viabilidad, y otros 7 embarazos que dieron neonatos vivos: informaban de un 68,4% de casos de ETGP en los embarazos tempranos, con sólo un 28,6% de casos en los embarazos finalizados con resultado de fetos viables.
Por tanto, la experiencia obtenida en el manejo de esta afección habla de resultados favorables en los casos de embarazos bien controlados, que deciden llevarse adelante, con tasas de enfermedad posmolar similares a las que veríamos en embarazos únicos y muchas opciones de un buen resultado neonatal. Nuestro caso en concreto se suma a estos, ya que la gestante tuvo un embarazo libre de enfermedad hasta una edad gestacional relativamente avanzada, cuando se produjo la aparición del cuadro preeclámpsico. Además, presentó un parto y una evacuación de la lesión satisfactorios y, aunque desarrollase EGTP en la fase postevacuatoria, reunía criterios de riesgo bajo y fue suficiente el tratamiento con monoquimioterapia para frenar su desarrollo y que, en la actualidad, la paciente esté libre de enfermedad.