INTRODUCCIÓN
El ácido glutámico es el principal neurotransmisor excitador del sistema nervioso central (SNC). Las acciones fisiológicas de este aminoácido se producen mediante la activación de dos familias de receptores cerebrales: receptores ionotrópicos (NMDA, AMPA y kainato) y receptores metabotrópicos del glutamato. Los receptores metabotrópicos del glutamato (mGlu) no forman canales iónicos, sino que actúan acoplándose a proteínas G y regulan la actividad de la membrana y de los canales iónicos. Así, este segundo tipo de receptores media la actividad sináptica excitatoria lenta, pero de forma prolongada, en las zonas del SNC donde se encuentran. Hasta la fecha, se han descrito ocho subtipos de receptores metabotrópicos del glutamato (mGluR1-8), divididos en tres grupos diferenciados por su homología de aminoácidos, los mecanismos de transducción de señales, el segundo mensajero al que se acoplan y su farmacología. Por lo tanto, se han caracterizado receptores metabotrópicos del grupo I, que incluirían mGlu1 y mGlu5, receptores del grupo II, formado por mGlu2 y mGlu3 y, por último, receptores del grupo III, en el que estarían incluidos mGlu4, mGlu6, mGlu7 y mGlu81-3.
Diversos estudios realizados con modelos animales han involucrado al neurotransmisor glutamato en la regulación de la agresión. Así, en los primeros trabajos en los que se examinó la administración de antagonistas del receptor NMDA del glutamato, como la fenciclidina (PCP) o la dizocilpina (MK-801), se evidenciaron cambios en la conducta agresiva de los animales, aunque con resultados contradictorios, pues se observó un efecto tanto proagresivo como antiagresivo, dependiendo de los agentes farmacológicos utilizados, las dosis administradas y la especies animales elegidas como sujetos experimentales4-6.
Más recientemente, Belozertseva et al7, utilizando un modelo de agresión inducida por aislamiento, analizaron el efecto de agentes que actuaban sobre el receptor NMDA con características farmacodinámicas distintas: antagonistas no competitivos (PCP, MK-80), antagonistas con poca afinidad por el receptor NMDA (memantina y MRZ 2/579) y antagonistas competitivos (D-CPPene). Los resultados mostraron que, a dosis bajas, aunque sin diferencias significativas, se apreciaba una tendencia proagresiva tras la administración de antagonistas no competitivos del receptor NMDA. Todos los agentes que demostraron un efecto antiagresivo lo hacían a dosis a las que también producían déficit en la actividad motriz, y la mayoría de ellos no aumentaba las conductas sociales no agresivas, a excepción del D-CPPene, único antagonista competitivo evaluado.
Por otro lado, se ha constatado la implicación del receptor AMPA en la conducta agresiva. Así, en un primer estudio, Vekoviskeva et al8 encontraron una reducción de la conducta agonística en ratones machos manipulados genéticamente que carecían de la subunidad GluR-A de este receptor. En un trabajo posterior, se comparó el efecto de distintos antagonistas del receptor AMPA, dos de ellos competitivos y poco selectivos (CNQX y NBQX) y uno no competitivo y muy selectivo (GYKI 52466), en la conducta agresiva de dos grupos de ratones que diferían en sus grados de agresión innata. Los resultados obtenidos pusieron de manifiesto que la administración de antagonistas competitivos disminuía el componente "morder" de la conducta de ataque en los dos grupos de ratones, mientras que la administración del antagonista no competitivo producía una disminución de todos los componentes de la conducta de ataque en ambos grupos. Aunque todos ellos ocasionaron una disminución de alguna categoría de la conducta agresiva, también incrementaron los niveles de ansiedad durante el encuentro agonístico9. Asimismo, otros fármacos que actúan (al menos parcialmente) modulando la actividad de los receptores AMPA, como el topiramato, han demostrado también efectos antiagresivos en modelos animales10.
Una reciente línea de investigación está centrada en la manipulación de la enzima dipeptidasa acídica acoplada a la a-N-acetilada (NAALADasa), que interviene en la formación de glutamato en el SNC. Esta enzima se caracteriza por hidrolizar al neurotransmisor N-acetil-aspartilglutamato (NAAG) y convertirlo en glutamato y N-acetilaspartato, con lo que su inhibición impide la trasformación de NAAG en glutamato, con lo que disminuye la cantidad de glutamato cerebral. Así, Lumley et al11 observaron que tras la administración de GPI-2232, agente farmacológico que actúa inhibiendo la enzima NAALADasa, se producía un efecto antiagresivo, utilizando un modelo de agresión inducida por aislamiento. La inhibición de esta enzima provoca una disminución del glutamato cerebral por distintas vías. Por un lado, que no se trasforme NAAG en glutamato hace que decaiga la cantidad de glutamato en el SNC y, por otra parte, esta inhibición origina una acumulación de NAAG en el cerebro, y esta sustancia actúa como agonista total para los receptores presinápticos mGlu3 del glutamato, y además es un agonista parcial para los receptores NMDA.
La implicación de los receptores mGlu en la modulación de la conducta agresiva es poco conocida. Recientemente, Navarro et al12 han encontrado que la administración de un antagonista no competitivo de los receptores mGlu5 (MPEP) produjo una reducción significativa de las conductas ofensivas (amenaza y ataque) en ratones machos. Estos receptores se distribuyen ampliamente por el SNC, y hay grandes cantidades en regiones como el bulbo olfatorio y zonas adyacentes, sustancia gris periacueductal (SGP), el estriado dorsal, núcleo accumbens y la formación hipocampal, así como en la corteza cerebral, regiones del hipotálamo, tálamo anterior, tracto trigémino y cerebelo13,14. Distintas áreas corticolímbicas en las que se ha evidenciado la expresión de este receptor están claramente involucradas en la regulación de la agresión.
En un intento por profundizar en el papel de los receptores mGlu5 en la modulación de la conducta agresiva, realizamos un experimento para analizar el efecto de un agonista selectivo de los receptores mGlu5 (2-cloro-hidroxifenilglicina: CHPG) en las interacciones agonísticas entre ratones machos, utilizando un modelo de agresión inducida por aislamiento.
MÉTODO
Animales
Se utilizó un total de 188 ratones albinos adultos de la cepa Swiss OF.1, adquiridos en el Servicio de Animales de Labo ratorio de la Universidad de Málaga. A la llegada a nuestro laboratorio, todos los animales fueron alojados en grupos de 5 durante una semana para permitir su adaptación a nuestras instalaciones y al ciclo de luz/oscuridad impuesto (luz, 20.00 a 8.00), antes de iniciar el período de aislamiento. Transcurrido el período de adaptación, la mitad de los animales (94) fueron empleados como animales experimentales y controles, alojados individualmente (durante un período de 30 días) en jaulas de plástico transparentes (Tecniplast-Letica, Madrid) de 24 3 13,5 3 13 cm. Una vez finalizado el período de aislamiento, estos animales fueron distribuidos aleatoriamente a las distintas condiciones experimentales (control y dosis de 0,75; 1,5; 3, 6 y 12 mg/kg de CHPG). El resto de los ratones se utilizaron como oponentes "anósmicos", y fueron alojados en grupos de 5 en jaulas de las mismas características que las anteriores hasta el momento de la realización de la prueba conductual. Para todos los animales la comida y la bebida se administró ad libitum. Las condiciones ambientales del laboratorio donde estaban ubicados los animales fueron cuidadosamente controladas, manteniéndose una temperatura (20 °C) y humedad constantes.
Este experimento se ha realizado de acuerdo con los principios de la guía para el cuidado y el uso de los animales de laboratorio aprobado por la Directiva del Consejo de la Comunidad Europea (86/609/EEC).
Modelo de agresión inducida por aislamiento y descripción de la anosmia
En nuestra investigación hemos empleado el modelo de agresión inducida por aislamiento, considerado uno de los modelos de elección para provocar conductas ofensivas entre ratones machos. El procedimiento seguido consiste en alojar a los animales machos en jaulas individuales durante un período de 30 días, durante los cuales disponen de comida y bebida ad libitum. Pasado este tiempo, se realizan los encuentros conductuales de agresión cuya duración es de 10 min. El animal dominante muestra conductas de amenaza y ataque dirigidas hacia el oponente, mientras que el subordinado no ataca y adopta posturas defensivas15-18.
Numerosas evidencias implican al sistema olfatorio en el desencadenamiento de la conducta agresiva en roedores. Así, se ha demostrado que una vez extirpados los bulbos olfatorios los animales ya no manifiestan conductas ofensivas, ni siquiera al ser mordidos por miembros de su misma especie19. El procedimiento más habitual para producir una anosmia periférica (y transitoria) consiste en administrar sulfato de cinc (al 4%) a través de los orificios nasales, lo que origina una necrosis reversible del epitelio nasal. La razón por la cual los ratones machos no luchan contra sus oponentes probablemente resida en que no pueden oler una feromona presente en la orina de los ratones, que constituye una señal desencadenante de la conducta ofensiva en ratones con un olfato normal20. En nuestro caso, la anosmia se llevó a cabo mediante instilación de un volumen de 0,025 ml de sulfato de cinc al 4% en cada orificio nasal de los roedores. Este procedimiento se efectuó los días 1 y 3 previos a la realización de cada prueba conductual.
Administración del fármaco
El CHPG fue adquirido comercialmente en los laboratorios Tocris (Madrid), y disuelto en agua destilada para preparar las dosis correspondientes. Las dosis elegidas para el tratamiento fueron 0,75; 1,5; 3; 6 y 12 mg/kg, mientras que los animales del grupo control recibieron agua destilada (15-16 por grupo). En ambos casos, la administración se realizó por vía intraperitoneal (ip) y de forma proporcional al peso del animal (volumen constante, 10 ml/kg). Tanto el fármaco como el vehículo fueron administrados 30 min antes de la realización de la prueba conductual.
Evaluación conductual
Los encuentros agonísticos entre los animales aislados (experimentales y controles) y los oponentes anósmicos tuvieron lugar en un área neutral. Como zona neutral se utilizó un recipiente de cristal transparente con dimensiones de 50 3 26 3 30 cm. Tras la realización de cada encuentro se renovaba el serrín de dicho recipiente, con el fin de evitar posibles interferencias de olores.
Antes de comenzar la prueba conductual se mantenía a los dos animales en extremos opuestos del área neutral durante un período de adaptación de 1 min, tras lo cual se retiraba el separador y daba comienzo la prueba conductual, que duraba 10 min. Todos los encuentros agonísticos fueron grabados en vídeo para su posterior análisis etológico mediante un programa de ordenador diseñado al efecto21. Todas las pruebas conductuales se realizaron a los 30 min tras la administración del fármaco, iniciándose los encuentros agresivos en la segunda hora del período de oscuridad (y por tanto de actividad) de los ratones.
Las diez categorías conductuales analizadas fueron las siguientes: cuidado corporal; escarbar; exploración no social; exploración a distancia; investigación social; amenaza; ataque; evitación/huida; defensa/sumisión, e inmovilidad. Cada categoría representa una suma de diferentes elementos y posturas. Una descripción más detallada de estas categorías, así como de sus elementos constituyentes, se puede encontrar en Brain et al21. La evaluación conductual se efectuó tan sólo sobre las conductas exhibidas por el animal experimental. La valoración se realizó a ciegas, e inicialmente el investigador no sabía a qué condición experimental pertenecía cada animal evaluado.
Análisis estadístico
Con el objeto de establecer si había diferencias significativas entre los diferentes grupos experimentales (control y tratamiento) en cada una de las categorías conductuales evaluadas, se realizó un análisis de la variancia no paramétrico (prueba de Kruskal-Wallis). Para realizar comparaciones entre pares de grupos se utilizó una prueba no paramétrica para muestras independientes (prueba de la U de Mann-Whitney).
RESULTADOS
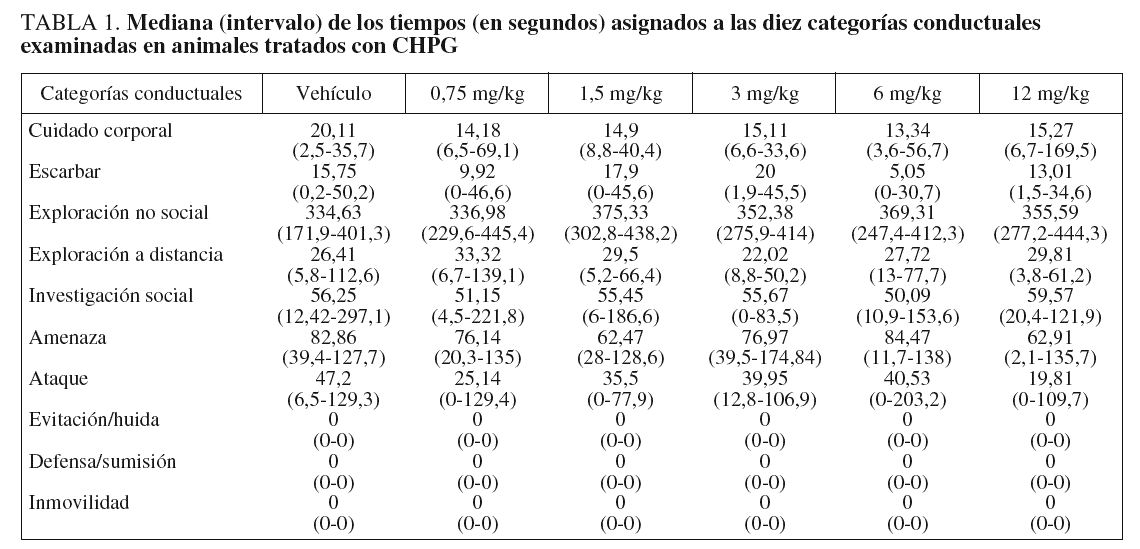
En la tabla 1 se muestran las medianas (intervalos) del tiempo acumulado (en segundos) en cada una de las categorías conductuales para cada grupo de tratamiento. La prueba de Kruskal-Wallis indicó que no había diferencias estadísticamente significativas entre los distintos grupos experimentales. Del mismo modo, la prueba de Mann-Whitney no mostró diferencias estadísticamente significativas entre pares de grupos.
DISCUSIÓN
El experimento fue diseñado para evaluar los efectos de la administración aguda de CHPG, un agonista selectivo del receptor mGlu5, sobre la conducta agonística en ratones machos en un modelo de agresión inducida por aislamiento. Ninguna de las dosis de CHPG utilizadas en este estudio (0,75-12 mg/kg, ip) modificaron de forma estadísticamente significativa las conductas ofensivas (amenaza y ataque), en comparación con el grupo control. Del mismo modo, tampoco se observaron diferencias significativas en el resto de las categorías conductuales examinadas. Al tratarse del primer trabajo que estudia el efecto de la administración de CHPG sobre la conducta agonística, carecemos de datos conductuales con los que contrastar nuestros resultados.
En un trabajo reciente, Navarro et al12 comprobaron que tras la administración aguda del MPEP (5-25 mg/kg, ip), un antagonista selectivo para el mGlu5, se producía un efecto antiagresivo empleando el mismo modelo de agresión inducida por aislamiento. Teniendo en cuenta estos resultados, cabría esperar que al administrar un agonista selectivo para el mGlu5, como el CHPG, se observase un aumento de las conductas agresivas. Sin embargo, el mecanismo de acción de ambos fármacos presenta algunas diferencias relevantes. Por un lado, el MPEP actúa como modulador alostérico para el receptor mGlu5, es decir, su lugar de unión al receptor difiere de aquel al que se acopla el neurotransmisor endógeno, mientras que el CHPG se acopla al receptor mGlu5 compitiendo con el glutamato por la misma ubicación. Por otro lado, estudios recientes han mostrado que la activación del mGlu5 interviene en la modulación de ciertos sistemas de neurotransmisores tradicionalmente involucrados en la conducta agresiva, como el glutamato, el GABA y la dopamina. Concretamente datos recientes revelan que la administración intracerebroventricular de CHPG, agonista selectivo para el receptor mGlu5, potencia la activación de los receptores NMDA en zonas del tálamo, hipocampo, cuerpo estriado y SGP1-3,14. Por otra parte, algunos trabajos han evidenciado que la administración de CHPG aumenta los valores basales de GABA en la SGP22, y que al inyectar CHPG en el núcleo accumbens aisladamente, aumentan los valores de GABA en el globo pálido ventral ipsolateral23. Por último, en relación con la dopamina, existen estudios que han constatado que la inyección local de MPEP provoca un aumento de dopamina en el cuerpo estriado14, en la corteza prefrontal y en el núcleo accumbens24.
La ausencia de resultados significativos podría estar relacionada también con las dosis de CHPG utilizadas en el experimento. De hecho, las dosis empleadas tuvieron una función marcadamente exploratoria, puesto que todos los estudios publicados hasta el momento realizaban administraciones intracerebroventriculares del fármaco (utilizando unidades molares), mientras que en nuestro trabajo administramos el CHPG por vía ip y, aunque empleamos un rango de dosis bastante amplio (0,75-12 mg/kg), es posible que se requieran dosis más altas para producir cambios significativos en las conductas evaluadas.
Por otra parte, en nuestro experimento los encuentros agonísticos entre ratones se realizaron a los 30 min de la administración del fármaco, siguiendo el período establecido por otros estudios en los que se describe que el CHPG comienza a tener claros efectos farmacológicos. Sin embargo, también se ha descrito un máximo de activación del receptor mGlu5 a las 2 h tras la inyección intracerebroventricular del CHPG en algunas regiones cerebrales25, por lo que cabe la posibilidad de que las propias características farmacocinéticas del CHPG estén afectando a los resultados obtenidos en nuestro estudio, puesto que además la vía de administración empleada en nuestro caso fue ip.
Tampoco hay que olvidar que algunos trabajos indican que el CHPG podría actuar como agonista parcial del glutamato14,26, con lo que tendría gran afinidad para acoplarse al receptor mGlu5, pero en presencia del neurotransmisor endógeno competiría por el mismo lugar de unión al receptor, y una vez hubiera conseguido acoplarse, su efecto sería menor que el del propio glutamato, o que otro agonista total, lo cual podría explicar los resultados obtenidos en esta investigación, al no compor tarse como un agonista total.
En conclusión, nuestros resultados indican que la administración de CHPG no produce efectos significativos sobre la conducta agonística con ninguna de las dosis utilizadas (0,75-12 mg/kg), y estos resultados pueden deberse a diversos factores, como las características propias del ligando utilizado (agonista parcial contra agonista total), el lugar de unión agonista-receptor, el rango de dosis elegido o el intervalo utilizado entre la administración del agente farmacológico y la evaluación de su efecto.