Cariprazina es un antipsicótico de nueva generación cuyo mecanismo de acción se basa en el agonismo parcial de los receptores de la dopamina D2 y D3, además de los receptores de serotonina 5HT1A. El uso de cariprazina ha sido aprobado por la Agencia Española del Medicamento para el tratamiento de la esquizofrenia. Sin embargo, la literatura científica ha demostrado también su eficacia en episodios maníacos, mixtos y depresivos del trastorno bipolar, indicaciones aprobadas en Estados Unidos y otros países. Asimismo, en la actualidad, se dispone de evidencia acerca de la eficacia clínica, la seguridad y la tolerabilidad de cariprazina como tratamiento adyuvante en el trastorno depresivo mayor, indicación recientemente aprobada por la Food and Drug Administration (FDA). Aunque 3 ensayos clínicos han mostrado resultados negativos, otros 2 han observado una reducción significativa de los síntomas depresivos y ansiosos, lo cual ha sido confirmado además en un ensayo abierto de larga duración. A pesar de presentar un perfil favorable de efectos adversos en comparación con otros antipsicóticos, cariprazina se ha asociado con acatisia e inquietud. Con base en la evidencia actual, el uso de cariprazina como coadyuvante en el tratamiento antidepresivo puede ser beneficioso en pacientes con trastorno depresivo mayor, especialmente cuando se ha producido una respuesta insuficiente a antidepresivos tradicionales. Futuros estudios permitirán elucidar su eventual eficacia en monoterapia y su papel en la prevención de recurrencias depresivas.
Cariprazine is a new generation antipsychotic whose mechanism of action is based on partial agonism of dopamine D2 and D3 receptors, in addition to serotonin 5HT1A receptors. Its use has been approved by the Spanish Agency of Medicines and Medical Devices for the treatment of schizophrenia. However, the available literature has demonstrated its efficacy in the treatment of manic, mixed, and depressive episodes of bipolar disorder, all them approved indication in the United Sattes and several other countries. Likewise, there is currently evidence regarding the clinical efficacy, safety, and tolerability of cariprazine as an adjunctive treatment in major depressive disorder, which has granted this compound the approval by the Food and Drug Administration (FDA). While three clinical trials have shown negative results, two others have observed a significant reduction in depressive and anxiety symptoms, which has also been confirmed in a long-term open-label trial. Despite presenting a favorable adverse effect profile compared to other antipsychotics, cariprazine has been associated with akathisia and restlessness. Based on current evidence, the use of cariprazine as an adjunctive treatment to antidepressants may be beneficial in major depressive disorder. Future studies may address its efficacy in monotherapy, and its role in the prevention of depressive recurrences.
Los trastornos depresivos suponen una de las mayores causas de incapacidad en el mundo1–3, con una prevalencia estimada de 264 millones de individuos a nivel global4. El trastorno depresivo mayor, definido por la presencia de uno o más episodios depresivos mayores en ausencia de episodios maníacos o hipomaníacos5, tiene una prevalencia del 20% a lo largo de la vida6–8. Entre los individuos que reciben un tratamiento antidepresivo de primera línea, aproximadamente el 50% no logran la remisión clínica9,10. Esta enfermedad supone un aumento de la morbimortalidad y tiene un impacto sobre la calidad de vida de los pacientes que la padecen11, a la vez que impacta sobre el desarrollo social y laboral12,13 e incrementa el riesgo de suicidio7,14.
Entre los objetivos del tratamiento en el trastorno depresivo mayor se encuentran lograr la remisión sintomática, recuperar el funcionamiento previo, mejorar la calidad de vida y prevenir las recurrencias, asegurando la mayor seguridad y tolerabilidad7,15. Las guías de tratamiento disponibles diferencian entre intervenciones de primera, segunda y tercera líneas y se basan en la evidencia científica acerca de la eficacia, seguridad y tolerabilidad de las diferentes opciones terapéuticas15. En episodios depresivos leves y moderados, la psicoterapia y la farmacoterapia han mostrado una eficacia similar, por lo que la combinación de ambas puede ser considerada como una estrategia terapéutica eficaz7. En episodios severos, las guías Canadian Network for Mood and Anxiety Treatments (CANMAT) recomiendan dicha combinación. En cuanto al tratamiento farmacológico, en episodios sin síntomas psicóticos se aconseja el uso de un antidepresivo, mientras que cuando existen síntomas psicóticos es recomendable el uso de un antidepresivo y un antipsicótico atípico15–17. En episodios depresivos graves o resistentes al tratamiento farmacológico y ante situaciones de riesgo (por ejemplo, negativa a la ingesta o elevado riesgo suicida), debe plantearse la terapia electroconvulsiva17. Esketamina y la estimulación magnética transcraneal son otras alternativas en el abordaje de la depresión resistente al tratamiento18,19.
Los tratamientos psicológicos que han demostrado eficacia incluyen la terapia cognitivo-conductual, la terapia interpersonal y la terapia de activación conductual7,15. Los tratamientos farmacológicos de primera línea incluyen aquellos antidepresivos con mejor perfil de seguridad, como los inhibidores selectivos de la recaptación de serotonina (ISRS), los inhibidores selectivos de la recaptación de serotonina y noradrenalina (IRSN), agomelatina, bupropion, vortioxetina y mirtazapina15. Los tratamientos de segunda línea incluyen antidepresivos tricíclicos, quetiapina y trazodona, mientras que los de tercera línea incluyen los inhibidores de la monoaminoxidasa (IMAO) y la reboxetina15.
Algunos tratamientos adyuvantes han demostrado su eficacia en el trastorno depresivo mayor resistente al tratamiento antidepresivo en monoterapia, como aripiprazol, litio, quetiapina y triyodotironina20. También brexpiprazol ha demostrado eficacia en dicha indicación21. Los antipsicóticos atípicos son considerados el tratamiento de primera elección como fármacos adyuvantes en los episodios depresivos, dado que han mostrado amplia evidencia en cuanto a eficacia y seguridad. En la actualidad, la aprobación y comercialización recientes de antipsicóticos con un mejor perfil de tolerabilidad resulta una estrategia prometedora en el tratamiento del trastorno depresivo mayor que instan al desarrollo de estudios clínicos que evalúen su potencial eficacia y seguridad. Sin embargo, en España solo quetiapina está formalmente aprobada en dicha indicación.
CariprazinaCariprazina es un antipsicótico atípico que actúa como agonista parcial de los receptores de dopamina D2 y D3, y de los receptores de serotonina 5HT1A22,23, y como antagonista 5HT2B, 5HT2A y de los receptores de histamina H123,24. No muestra unión a los receptores colinérgicos y presenta una baja afinidad por los receptores 5HT2C y α1 adrenérgicos23,25,26. Por su elevada afinidad por los receptores D3 y D2, se comporta como un agonista parcial ante una baja actividad dopaminérgica, mientras que actúa como antagonista cuando la actividad dopaminérgica es alta23. Los receptores D3 se encuentran predominantemente en el sistema límbico, el hipotálamo, el área tegmental ventral y la sustancia negra27, lo cual explica sus efectos beneficiosos a nivel cognitivo y como antidepresivo, reportados tanto en estudios animales como en humanos28–32. Se ha postulado que la existencia de un ambiente prodopaminérgico junto al agonismo parcial sobre los receptores 5HT1A22,25 podrían explicar los efectos antidepresivos de cariprazina. Su baja inhibición de la transmisión dopaminérgica en el núcleo estriado explicaría una baja incidencia de síntomas extrapiramidales en comparación con otros antipsicóticos26.
Cariprazina se metaboliza principalmente por el citocromo CYP3A4 y, en menor medida, por el citocromo CYP2D623, y tiene como metabolitos principales la desmetil-cariprazina y la didesmetilcariprazina, equipotentes a la cariprazina26,33. Estos metabolitos presentan una semivida de eliminación de entre 1 y 3 semanas34, mayor que el resto de antipsicóticos atípicos. Se trata de un fármaco seguro en pacientes con insuficiencia renal o hepática leve o moderada35.
La molécula está aprobada por la United States Food and Drug Administration (FDA) para el tratamiento de la esquizofrenia, episodios maníacos, mixtos o depresivos asociados al trastorno bipolar (TB) tipo I y como terapia coadyuvante de los antidepresivos para el tratamiento del trastorno depresivo mayor36,37. Las guías CANMAT15,38 recomiendan su uso como tratamiento de segunda línea en depresión bipolar. En esta población, mientras que un ensayo clínico aleatorizado (ECA) no mostró diferencias en comparación con placebo39, 3 ECA con diseños similares40–42 que evaluaban el uso de dosis fijas de cariprazina de 1,5 y 3 mg frente a placebo en la depresión bipolar sin síntomas psicóticos, observaron una reducción estadísticamente significativa de los síntomas depresivos medidos con la escala Montgomery-Asberg Depression Rating Scale (MADRS) respecto a placebo40–42. Un análisis agrupado mostró que estas diferencias estadísticamente significativas se mantuvieron en el análisis por subgrupos: por sexo, edad (menor de 45 años y mayor o igual a 45 años), raza (blanca y negra) e índice de masa corporal ([IMC] menor de 30 kg/m2), siendo igualmente eficaz en sujetos con predominio de polaridad maníaca como depresiva, e independientemente del grado de severidad de la enfermedad43. Asimismo, se reportaron diferencias estadísticamente significativas entre cariprazina y placebo para la gran mayoría de los ítems evaluados en la MADRS, especialmente para tristeza, lasitud, incapacidad para sentir y apetito reducido a dosis de 1,5 y 3 mg44. También ha mostrado eficacia en episodios depresivos de características mixtas45, y mejoría de la sintomatología ansiosa46 y del funcionamiento47,48. Cariprazina fue en general bien tolerada en todos los estudios49, con tasas de discontinuación similares a placebo44. Los eventos adversos más comúnmente reportados fueron: náuseas, acatisia, inquietud y efectos extrapiramidales44. La tasa de discontinuación fue de menor al 3% para todos los grupos de tratamiento50 y no se observaron cambios significativos en los parámetros metabólicos, en el peso corporal44, ni tampoco en los niveles séricos de prolactina51.
La evidencia disponible apunta hacia un potencial beneficio como tratamiento antidepresivo en pacientes con trastorno depresivo mayor, además de un perfil favorable de efectos adversos, ya demostrado en otras poblaciones. Por ello, este artículo tiene como objetivo evaluar con base en la evidencia científica disponible la eficacia, seguridad y tolerabilidad de cariprazina en el trastorno depresivo mayor mediante una revisión sistemática de la literatura.
Material y métodosEsta revisión sistemática se llevó a cabo siguiendo la declaración Preferred Reporting Items for Systematic reviews and Meta-Analyses (PRISMA, por sus siglas en inglés)52.
Estrategia de búsquedaSe realizó una búsqueda sistemática de la literatura a través de las siguientes bases de datos: Pubmed, Web of Science, PsycInfo y Cochrane Library. Los términos utilizados para la búsqueda fueron los siguientes: «cariprazine» AND («depression» OR «depressive»). Además, se revisaron las referencias bibliográficas de los principales estudios para la identificación de estudios adicionales.
Criterios de selecciónLos criterios de inclusión establecidos fueron los siguientes: a) población: adultos (mayor de 18 años) con diagnóstico de trastorno depresivo mayor según DSM-55, CIE-1053 o CIE-1154, y con un episodio actual depresivo mayor, sin características mixtas55; b) intervención: cariprazina utilizada en monoterapia o como tratamiento coadyuvante; c) comparación: cualquier tratamiento antipsicótico y/o antidepresivo utilizado como comparador activo o placebo, o ausencia de grupo comparador; d) resultados: datos sobre eficacia, tolerabilidad y seguridad de cariprazina, incluyendo respuesta a tratamiento (disminución más del 50% de la puntuación inicial en la escala de depresión MADRS), remisión clínica (puntuación menos del 12 de la escala MADRS y menos de 10 en el momento final), efectos adversos y discontinuación del estudio, así como cambios en parámetros analíticos (colesterol, triglicéridos, prolactina, etc.); e) diseño: ECA, estudios observacionales prospectivos y análisis post hoc de ECA y/o estudios observacionales prospectivos agrupados. No se aplicaron limitaciones por el idioma ni por la fecha de publicación del estudio.
Se excluyeron reportes y series de casos, cartas al editor, editoriales, capítulos de libros, pósteres o resúmenes presentados en conferencias o convenciones, estudios observacionales retrospectivos, revisiones y metaanálisis.
Selección de los estudiosInicialmente se identificaron los estudios duplicados mediante el uso de una herramienta automatizada (Rayyan; disponible en: https://www.rayyan.ai), y fueron posteriormente revisados manual e independientemente por 2 investigadores (Lidia Ilzarbe y Anna Giménez-Palomo) para su exclusión. En un segundo paso, se excluyeron por título o resumen del estudio aquellos estudios que no cumplían los criterios de inclusión establecidos después de una revisión independientemente realizada por los 2 investigadores. Finalmente, se revisó la versión a texto completo de los estudios restantes para determinar su elegibilidad teniendo en cuenta los criterios de selección previamente definidos. Las discrepancias se resolvieron consensuadamente entre todos los autores del estudio.
Extracción de datosLos datos extraídos de cada uno de los estudios finalmente incluidos, utilizando una hoja de cálculo de extracción de datos especialmente diseñada para este propósito, fueron los siguientes: primer autor, año de publicación, diseño del estudio, número de registro del ensayo clínico en caso de ECA, tiempo de duración del estudio, criterios de inclusión y exclusión, diagnóstico, criterios diagnósticos, brazos de tratamiento del estudio, dosis de antipsicótico, tamaño de la muestra, características sociodemográficas de los participantes (edad y sexo), puntuación basal y cambio medio, desviación estándar al final del estudio en las escalas de valoración clínica (MADRS) y efectos adversos.
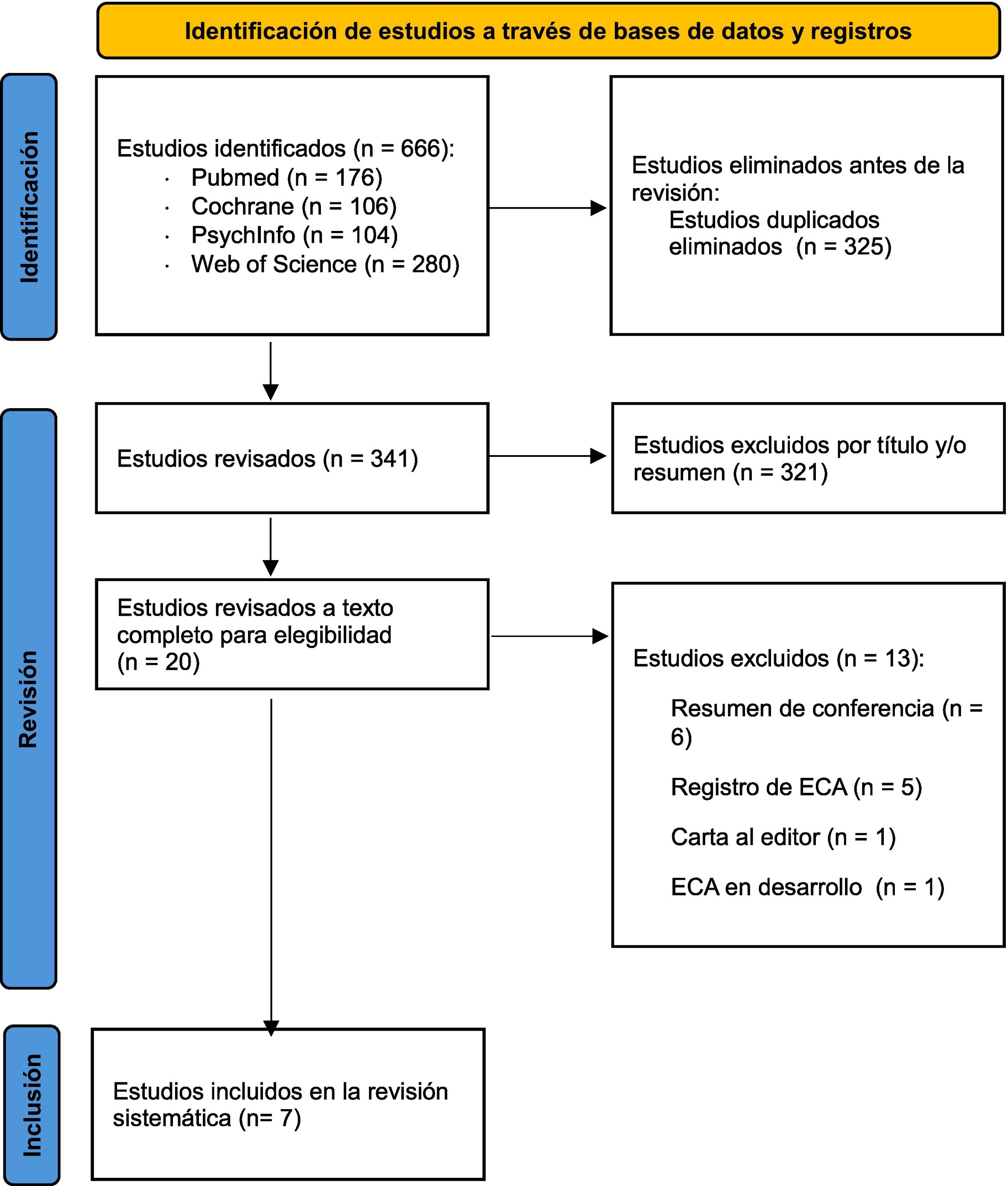
ResultadosRevisión de la literaturaSe identificaron un total de 341 estudios a través de la estrategia de búsqueda previamente definida, después de haber eliminado 325 trabajos duplicados o que analizaban datos de un mismo estudio. Tras la revisión y exclusión por título y resumen, 20 estudios fueron incluidos para la revisión a texto completo. Finalmente, fueron 7 los estudios incluidos en la revisión sistemática. Las razones para la exclusión de los 13 estudios restantes están detalladas en la figura 1.
Características de los estudios incluidosEn total, se incluyeron en la revisión sistemática 7 estudios que reportaron datos sobre la eficacia, seguridad y tolerabilidad de cariprazina como tratamiento para un episodio depresivo mayor sin características mixtas, en el seno de un trastorno depresivo mayor. Entre los estudios seleccionados, se incluyeron ECA doble ciego (n = 5)36,56–59, ECA abierto (n = 1) y análisis agrupado post hoc de ECA (n = 1)60. Las características de los estudios incluidos se recogen en la tabla 1 y las de los ECA incluidos en la tabla 2.
Características de los estudios incluidos
| Autor (año) | Región | Identificador del estudio/número NCT(fase) | Diseño/Duración del estudio | Diagnóstico | Criterios de inclusión | Criterios de exclusión | Medidas de eficacia |
|---|---|---|---|---|---|---|---|
| Durgam et al. (2016) | EE. UU. y Europa | RGH-MD-75/ NCT01469377(fase 2b) | 8 semanasECA DC | TDM (DSM-IV-TR),EDM actual (duración 8–24 semanas) | 18–65 años, respuesta inadecuada al actual AD, MADRS≥22, IMC ≥18 y ≤ 40, exploración física normal | Otros trastornos mentales, episodios depresivos con síntomas psicóticos o catatónicos, demencia o trastornos cognitivos, TUS (últimos 6 meses), riesgo suicida o lesivo | MADRS (primaria)SDS (secundaria)Respuesta MADRS (reducción ≥50% puntuación), remisión MADRS (puntuación MADRS ≤10), CGI-S, subescalas SDS, CGI-I, respuesta CGI-I (puntuación ≤2) |
| Fava et al. (2018) | EE. UU. | RGH-MD-71/NCT00854100(fase 2) | 8 semanas AD ECA SC abierto+8 semanas PBO/no respondedores aleatorizados DC | TDM (DSM-IV-TR),EDM actual (duración ≥8 s) | 18–65 años, respuesta inadecuada a 1–2 AD (ATRQ), HDRS-17 ≥ 18 (ítem 1 ≥ 2) | Otros trastornos mentales, demencia o trastornos cognitivos, TUS (últimos 6 meses), riesgo suicida o lesivo | MADRS (primaria)CGI-I (secundaria)Respuesta MADRS (reducción ≥50% puntuación), remisión MADRS (puntuación MADRS ≤10), HDRS-17, HDRS-24, remisión HDRS-17 (puntuación ≤7), CGI-S, respuesta CGI-I (puntuación ≤2) |
| Earley et al. (2018) | EE. UU. | RGH-MD-72/NCT01715805(fase 3) | 8 semanas AD ECA SC abierto+8 semanas PBO/no respondedores aleatorizados DC | TDM (DSM-IV-TR),EDM actual (duración ≥8 s) | 18–65 años, respuesta inadecuada a 1–2 AD (ATRQ), HDRS-17 ≥ 18 (ítem 1 ≥ 2) | Otros trastornos mentales, episodios hipo/maníacos o episodios depresivos con síntomas psicóticos, demencia o trastornos cognitivos, TUS (últimos 6 meses), riesgo suicida o lesivo | MADRS (primaria)SDS (secundaria)Respuesta MADRS (reducción ≥50% puntuación), remisión MADRS (puntuación MADRS ≤10), CGI-S, HDRS-17, HAM-A, subescalas SDS (laboral, social y familiar), respuesta CGI-I (puntuación ≤2) |
| Vieta et al. (2019) | EE. UU. y Europa | RGH-MD-72/ NCT01715805(fase 3) | 8 semanas AD ECA SC abierto+26 semanas ECA abierto | TDM (DSM-IV-TR), EDM actual (duración ≥8 s) | 18–65 años, respuesta inadecuada a 1–2 AD (ATRQ) | Otros trastornos mentales, episodios hipo/maníacos o episodios psicóticos, trastornos del desarrollo, demencia o trastornos cognitivos, TUS (últimos 6 meses), riesgo suicida o lesivo | MADRS (primaria)CGI-S (secundaria)Respuesta MADRS (reducción ≥50% puntuación), remisión MADRS (puntuación MADRS ≤10) |
| Riesenberg et al. (2023) | EE. UU., Canadá y Europa | 3111-302-001/NCT03739203(fase 3) | 6 semanasECA DC | TDM (DSM-5),EDM actual (duración 8 s-24 m) | 18–65 años, respuesta inadecuada a 1–3 AD (ATRQ), HDRS-17 ≥ 22 (ítem 1 ≥ 2) | No respuesta a más de 3 AD, otros trastornos mentales, episodios hipo/maníacos, YMRS≥12, TUS (últimos 3 meses), riesgo suicida o lesivo | MADRS (primaria)CGI-S (secundaria)Respuesta MADRS (reducción ≥50% puntuación), remisión MADRS (puntuación MADRS ≤10), HDRS-17, HAM-A, CGI-I, respuesta CGI-I (puntuación ≤2) |
| Sachs et al. (2023) | EE. UU., Reino Unido y Europa | 3111-301-001/NCT03738215(fase 3) | 6 semanasECA DC | TDM (DSM-5),EDM actual (duración 8 s-24 m), | 18–65 años, respuesta inadecuada a 1–3 AD (ATRQ), HDRS-17 ≥ 22 (ítem 1 ≥ 2) | No respuesta a más de 3 AD, otros trastornos mentales, episodios hipo/maníacos, YMRS≥12, TUS (últimos 3 meses), riesgo suicida (último año) | MADRS (primaria)CGI-S (secundaria)Respuesta MADRS (reducción ≥50% puntuación), remisión MADRS (puntuación MADRS ≤10), HDRS17, HARS, CGI-I, respuesta CGI-I (puntuación ≤2) |
| Thase et al. (2024) | EE. UU. | NCT03738215 (fase 3), NCT03739203 (fase 3), NCT00854100 (fase 2), NCT01715805 (fase 3), NCT01469377 (fase 2b) | Análisis agrupado | TDM (DSM-IV-TR),EDM actual (duración 8 s-24 m) | 18–65 años, respuesta inadecuada a 1–2 AD (ATRQ) | Otros trastornos mentales, demencia o trastornos cognitivos, TUS (últimos 6 meses), riesgo suicida o lesivo | Reporte o detección de efectos adversos(primaria) SAS, BARS, C-SSRS (secundarias) |
AD: antidepresivo; ATRQ: Antidepressant Treatment Response Questionnaire; BARS: Barnes Akathisia Rating Scale; CGI-I: Clinical Global Impressions Scale-Improvement, CGI-I: Clinical Global Impressions Scale-Improvement, CGI-S: Clinical Global Impressions Scale-Severity; C-SSRS: Columbia–Suicide Severity Rating Scale; DC: doble ciego; ECA: ensayo clínico aleatorizado; EDM: episodio depresivo mayor; EE. UU.: Estados Unidos; HDRS-17: Hamilton Depression Rating Scale-17 items, HDRS-24: Hamilton Depression Rating Scale-24 items; m: meses; MADRS: Montgomery-Asberg Depression Rating Scale; PBO: placebo; s: semanas; SAS: Simpson-Angus Scale; SC: simple ciego; SDS: Severity of Dependence Scale; TDM: trastorno depresivo mayor; TUS: trastorno por uso de sustancias.
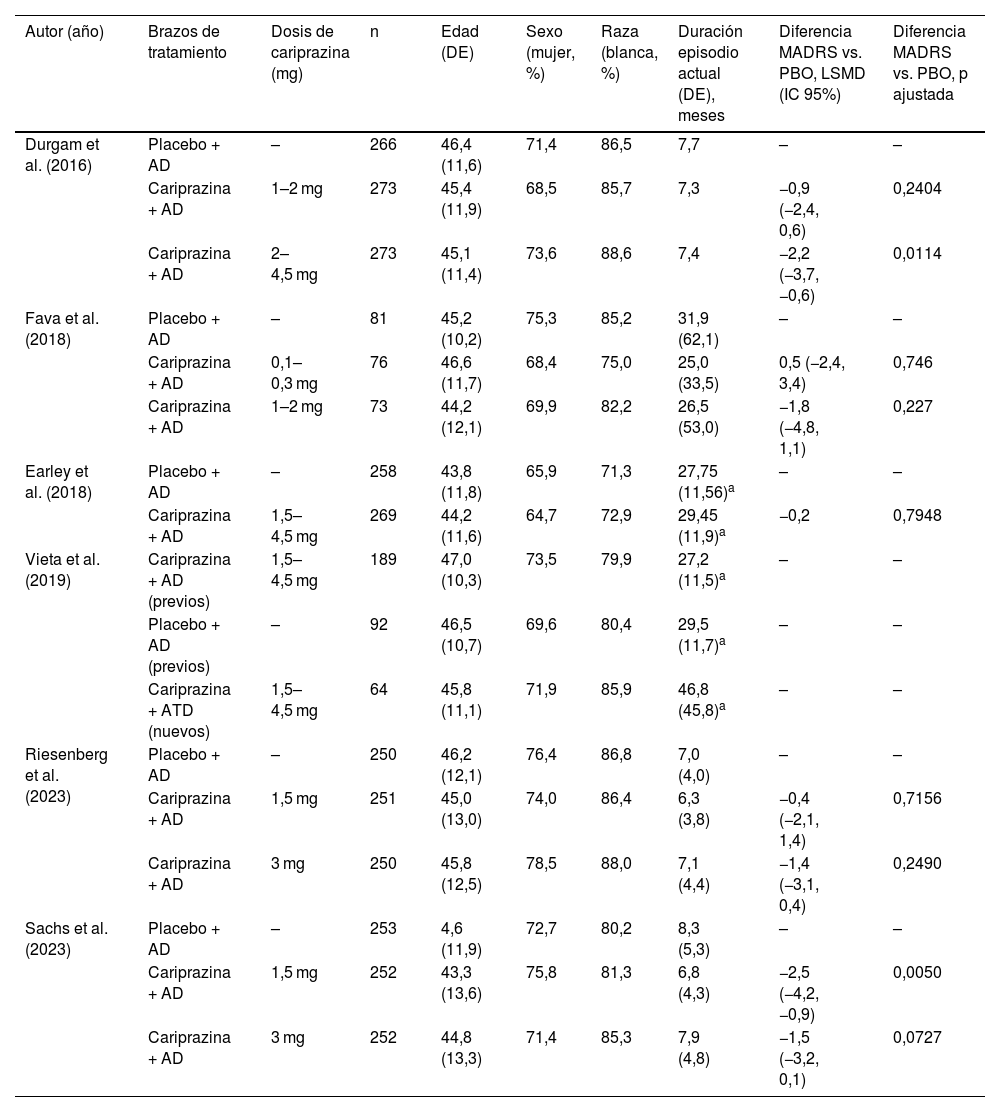
Características de los participantes de los ensayos clínicos aleatorizados incluidos
| Autor (año) | Brazos de tratamiento | Dosis de cariprazina (mg) | n | Edad (DE) | Sexo (mujer, %) | Raza (blanca, %) | Duración episodio actual (DE), meses | Diferencia MADRS vs. PBO, LSMD (IC 95%) | Diferencia MADRS vs. PBO, p ajustada |
|---|---|---|---|---|---|---|---|---|---|
| Durgam et al. (2016) | Placebo + AD | – | 266 | 46,4 (11,6) | 71,4 | 86,5 | 7,7 | – | – |
| Cariprazina + AD | 1–2 mg | 273 | 45,4 (11,9) | 68,5 | 85,7 | 7,3 | −0,9 (−2,4, 0,6) | 0,2404 | |
| Cariprazina + AD | 2–4,5 mg | 273 | 45,1 (11,4) | 73,6 | 88,6 | 7,4 | −2,2 (−3,7, −0,6) | 0,0114 | |
| Fava et al. (2018) | Placebo + AD | – | 81 | 45,2 (10,2) | 75,3 | 85,2 | 31,9 (62,1) | – | – |
| Cariprazina + AD | 0,1–0,3 mg | 76 | 46,6 (11,7) | 68,4 | 75,0 | 25,0 (33,5) | 0,5 (−2,4, 3,4) | 0,746 | |
| Cariprazina + AD | 1–2 mg | 73 | 44,2 (12,1) | 69,9 | 82,2 | 26,5 (53,0) | −1,8 (−4,8, 1,1) | 0,227 | |
| Earley et al. (2018) | Placebo + AD | – | 258 | 43,8 (11,8) | 65,9 | 71,3 | 27,75 (11,56)a | – | – |
| Cariprazina + AD | 1,5–4,5 mg | 269 | 44,2 (11,6) | 64,7 | 72,9 | 29,45 (11,9)a | −0,2 | 0,7948 | |
| Vieta et al. (2019) | Cariprazina + AD (previos) | 1,5–4,5 mg | 189 | 47,0 (10,3) | 73,5 | 79,9 | 27,2 (11,5)a | – | – |
| Placebo + AD (previos) | – | 92 | 46,5 (10,7) | 69,6 | 80,4 | 29,5 (11,7)a | – | – | |
| Cariprazina + ATD (nuevos) | 1,5–4,5 mg | 64 | 45,8 (11,1) | 71,9 | 85,9 | 46,8 (45,8)a | – | – | |
| Riesenberg et al. (2023) | Placebo + AD | – | 250 | 46,2 (12,1) | 76,4 | 86,8 | 7,0 (4,0) | – | – |
| Cariprazina + AD | 1,5 mg | 251 | 45,0 (13,0) | 74,0 | 86,4 | 6,3 (3,8) | −0,4 (−2,1, 1,4) | 0,7156 | |
| Cariprazina + AD | 3 mg | 250 | 45,8 (12,5) | 78,5 | 88,0 | 7,1 (4,4) | −1,4 (−3,1, 0,4) | 0,2490 | |
| Sachs et al. (2023) | Placebo + AD | – | 253 | 4,6 (11,9) | 72,7 | 80,2 | 8,3 (5,3) | – | – |
| Cariprazina + AD | 1,5 mg | 252 | 43,3 (13,6) | 75,8 | 81,3 | 6,8 (4,3) | −2,5 (−4,2, −0,9) | 0,0050 | |
| Cariprazina + AD | 3 mg | 252 | 44,8 (13,3) | 71,4 | 85,3 | 7,9 (4,8) | −1,5 (−3,2, 0,1) | 0,0727 |
a: semanas; AD: antidepresivo; DE: desviación estándar; LSMD: Least-Squares Mean Difference; MADRS: Montgomery-Asberg Depression Rating Scale; PBO: placebo.
Tres ECA36,56,59 que incluyeron pacientes con trastorno depresivo mayor y utilizaron tratamiento antidepresivo y cariprazina en dosis fijas (1,5 y 3 mg/día) o flexibles (0,1–0,3 y 1–2 mg/día, y 1,5–4,5 mg/día) como tratamiento coadyuvante resultaron negativos. Estos estudios no hallaron diferencias estadísticamente significativas entre cariprazina y placebo para la principal medida de eficacia (cambio medio en la puntuación total de la escala MADRS desde la situación basal hasta las 6-8 semanas de tratamiento).
Sin embargo, otros 2 ECA57,58, que evaluaron también el uso de cariprazina como tratamiento coadyuvante en pacientes con trastorno depresivo mayor, reportaron diferencias entre el grupo de tratamiento y el grupo placebo para las medidas de eficacia definidas. Sachs et al.58 observaron una reducción significativa de los síntomas depresivos (cambio medio en la puntuación total de la escala MADRS, medida de eficacia primaria, y la escala HDRS a las 6 semanas) y ansiosos (cambio medio en la puntuación total de la escala HAM-A) para cariprazina 1,5 mg/día57. Asimismo, reportaron una respuesta a tratamiento (reducción en la puntuación total de MADRS desde el basal mayor al 50%) mayor que placebo para este mismo grupo de tratamiento. No hallaron diferencias estadísticamente significativas para cariprazina 3 mg. Por otro lado, Durgam et al.57 mostraron que cariprazina 2–4,5 mg/día fue consistentemente más eficaz que el placebo en la reducción de síntomas depresivos (reducción en la puntuación total de MADRS desde el basal menor al 50%) y de la severidad de la enfermedad (reducción en la puntuación total de la escala de Impresión Clínica Global – Gravedad (CGI-S, por sus siglas en inglés). La respuesta al tratamiento fue significativamente mayor que placebo para ambos grupos de tratamiento (cariprazina 1–2 mg/día y cariprazina 2–4,5 mg/día)57.
Un ensayo clínico fase 3 incluyó la muestra de pacientes aleatorizados en un ECA previo de 8 semanas de duración56, los cuales mantuvieron el antidepresivo previo a la misma dosis. Aquellos que respondieron a antidepresivo y placebo continuaron con el mismo tratamiento en simple ciego. Los pacientes no respondedores, así como los nuevos pacientes, se incluyeron en un ensayo abierto de 26 semanas de duración con dosis de cariprazina de 3–4,5 mg/día. Se objetivó una reducción significativa en la semana 26 en las puntuaciones de la escala MADRS y CGI-S, además de una tasa de remisión del 53,3% de los pacientes61. A nivel de efectos adversos, cariprazina fue bien tolerada, con un predominio de efectos adversos extrapiramidales, fundamentalmente acatisia y cefalea, en el grupo de tratamiento61.
Un análisis agrupado de los estudios previos analizó la seguridad y tolerabilidad de cariprazina. Este mostró que la tasa de eventos adversos emergentes del tratamiento fue globalmente mayor para cariprazina comparado con placebo (39,4 vs. 51,7%, respectivamente), aunque solo acatisia e inquietud doblaron la tasa del grupo placebo. Además, la gran mayoría de los efectos adversos (mayor al 90%) fueron leves o moderados. Se reportó una respuesta dosis-dependiente para insomnio y acatisia, siendo la acatisia el único efecto adverso que supuso una tasa de discontinuación mayor al 1% en todos los grupos de tratamiento. La tasa de acatisia fue del 2% para el grupo placebo y de 8,1% para el grupo de tratamiento. Menos del 1% de los participantes presentaron efectos adversos graves, y en ninguno de los casos se relacionó con el tratamiento con cariprazina. No se observaron cambios significativos en el peso corporal, ni elevaciones en los principales parámetros bioquímicos y metabólicos para ninguno de los grupos, con una media de aumento de peso de menos de 1 kg tanto con cariprazina (0,70 kg) como con placebo (0,16 kg). No se describió un incremento de riesgo de hipomanía/manía60.
Estudios activos sin resultados publicadosEn la actualidad, se está desarrollando un ECA (NCT05933538) fase 4 que pretende evaluar la efectividad de cariprazina en monoterapia para el tratamiento del trastorno depresivo mayor en la población adulta (18–65 años). En este estudio, existen 2 brazos de tratamiento: un grupo de cariprazina en monoterapia, a dosis flexible con posibilidad de incrementarse en función de las características y necesidades del participante; y un grupo de tratamiento habitual, que recibirá tratamiento antidepresivo, psicoterapia o ambas. Este estudio evaluará la eficacia de cariprazina mediante el cambio medio en la puntuación total de la MADRS a las 6 semanas de tratamiento, como medida primaria y también a través del cambio en la puntuación de la escala CGI, como medida secundaria. Además, se evaluarán efectos adversos y la tolerabilidad en ambos grupos de tratamiento. El tamaño muestral esperado es de 110 participantes. Se prevé completar el estudio en 2030.
DiscusiónEl manejo terapéutico del trastorno depresivo mayor es un proceso complejo, teniendo en cuenta que un porcentaje significativo de pacientes no responde a tratamiento farmacológico, además de las comorbilidades asociadas y la mortalidad relacionada con estas y con el trastorno propiamente dicho7. Es por ello por lo que frecuentemente resulta imperativo el uso de tratamientos coadyuvantes con el fin de potenciar la efectividad del tratamiento antidepresivo, reducir la morbimortalidad y mejorar la calidad de vida de los pacientes con trastorno depresivo mayor. Desde diciembre de 2022, cariprazina se ha sumado a la lista de antipsicóticos atípicos aprobados por la FDA (junto a aripiprazol, quetiapina y brexpiprazol) para el tratamiento coadyuvante del trastorno depresivo mayor36.
Dos de los ECA publicados hasta el momento, y recogidos en esta revisión sistemática, han reportado una reducción significativa de la clínica depresiva y ansiosa en el trastorno depresivo mayor y una adecuada respuesta al tratamiento medida según la reducción de la escala MADRS, utilizando dosis de cariprazina de 1,5–4,5 mg/día. Estos resultados fueron similares a los observados en otros estudios en los que se ensayó el uso de cariprazina para el tratamiento de episodios depresivos en el seno de un trastorno bipolar41–43,59,62 y también para el tratamiento de episodios mixtos45,63.
Estas diferencias estadísticamente significativas a nivel de eficacia halladas entre cariprazina y placebo para el tratamiento del trastorno depresivo mayor contrastan con los resultados negativos obtenidos en los otros 3 ECA que se incluyen en este estudio36,56,57. No obstante, se han de considerar las limitaciones de cada uno de estos estudios para la interpretación de los resultados. El estudio de Durgam et al.57 fue un primer análisis exploratorio, fase 2b, que tenía como objetivo el establecimiento de los regímenes de titulación de dosis, y por lo que las dosis óptimas y que posteriormente han demostrado ser efectivas se alcanzaron en las últimas semanas del estudio, posiblemente limitando la efectividad del tratamiento. Por otro lado, el tamaño muestral fue notablemente menor64 y, la duración del episodio depresivo, mayor, en el estudio de Fava et al.56 comparado con el resto de ECA. Por último, la respuesta a placebo fue mayor en el estudio de Riesenberg et al.36, comparado con su homólogo58 (−13,4 vs. −11,5) que reportó resultados positivos para cariprazina como tratamiento coadyuvante en el trastorno depresivo mayor. En cuanto al tratamiento a largo plazo, existe evidencia sobre el beneficio de cariprazina en la reducción de sintomatología depresiva y en la remisión clínica tras 26 semanas de tratamiento65.
A nivel de tolerabilidad y seguridad, cariprazina ha mostrado una mayor tasa de efectos adversos que placebo (39,4 vs. 51,7%, respectivamente), con predominio de síntomas leves o moderados, principalmente acatisia o inquietud60. Se ha observado una posible relación dosis-dependiente en cuanto a los síntomas extrapiramidales, los cuales podrían requerir, en algunos casos, un cambio de tratamiento, y en otros, la adición de un tratamiento concomitante. No se ha objetivado un efecto perjudicial en los factores metabólicos, lo cual debería tenerse en cuenta en la práctica clínica habitual por la frecuencia de estas enfermedades cardiovasculares, riesgo de diabetes y aumento de peso en la población psiquiátrica66, y por el perfil metabólico desfavorable de otros tratamientos antipsicóticos también utilizados con frecuencia en episodios depresivos, como quetiapina u olanzapina. Este perfil favorable a nivel metabólico, incluyendo el peso corporal, se corroboró en un ensayo abierto con cariprazina durante 26 semanas65.
Además de la efectividad y el perfil favorable de efectos adversos, la literatura científica, junto con el mecanismo de acción de la cariprazina, sugieren un beneficio potencial en el tratamiento del trastorno depresivo mayor unipolar a nivel cognitivo. La literatura sugiere que cariprazina podría tener efectos procognitivos y mejorar la funcionalidad más allá de la clínica depresiva, lo cual implicaría una mejoría sustancial en la calidad de vida de individuos con trastorno depresivo mayor. No obstante, la evidencia disponible al respecto se ha reportado en pacientes con esquizofrenia, evidenciándose una mejora de la función cognitiva de estos pacientes con una dosis de cariprazina de 1,5 mg/día67–69 y también en pacientes con trastorno bipolar en análisis conjuntos de los estudios con este fármaco48. Considerando las alteraciones cognitivas que suelen aparecer en pacientes con trastorno depresivo mayor, que suponen un impacto significativo en su funcionalidad, futuros estudios permitirán elucidar sus efectos a nivel cognitivo además de en el resto de sintomatología depresiva. El desarrollo de nuevos tratamientos con un perfil de efectos adversos favorable y una acción en la función cognitiva permitirá una mejoría en la adherencia terapéutica, en el desarrollo funcional y en la calidad de vida de estos pacientes, lo cual supondría una reducción en la carga de morbimortalidad en la población con trastorno mental, por lo que debe considerarse un avance relevante que podría suponer un beneficio en la esperanza de vida de esta población.
La actual revisión sistemática presenta varias limitaciones, como la cantidad de ECA, todavía escasos, que evalúen la eficacia y la seguridad de cariprazina en la depresión unipolar, así como la falta de evaluación de esferas específicas como los aspectos cognitivos. Asimismo, los estudios incluidos no utilizan comparadores activos y excluyen pacientes con determinadas características (comorbilidad o ideación suicida), lo cual repercute en una falta de validez externa de los resultados presentados. Los tiempos variables de tratamiento y la corta duración de los ECA también puede limitar la determinación de la eficacia y de efectos adversos de este tratamiento. Además, por el momento, no existe evidencia acerca del uso de cariprazina en monoterapia para el tratamiento de episodios depresivos, tampoco del potencial beneficio de cariprazina en la prevención de recurrencias en el trastorno depresivo mayor recurrente, ni se han establecido recomendaciones acerca de la duración del tratamiento. Por todo ello, son necesarios futuros ECA a largo plazo que permitan corroborar el beneficio de cariprazina en el trastorno depresivo mayor.
No obstante, la evidencia disponible, no solamente en el trastorno bipolar, sino también en el trastorno depresivo mayor, sugiere que cariprazina puede considerarse una opción válida como tratamiento adyuvante en individuos con respuestas clínicas subóptimas al tratamiento con antidepresivos en monoterapia, y que dicha estrategia debería considerarse antes del uso de antidepresivos con mayor riesgo de efectos adversos, dado el perfil favorable observado con cariprazina. Asimismo, teniendo en cuenta el mecanismo de acción de cariprazina, deberían desarrollarse ensayos clínicos que evalúen su eficacia antidepresiva en monoterapia en comparación con placebo y con otros fármacos antidepresivos, además de estudios que pretendan identificar perfiles específicos de pacientes en los que este fármaco pueda tener mayor eficacia. El aumento de la evidencia científica permitirá determinar su beneficio como tratamiento en monoterapia, además de como adyuvante a otros antidepresivos. Estos nuevos diseños corroborarán la evidencia previa, medirán con mayor precisión su papel en el rendimiento cognitivo y en la funcionalidad, y dotarán a los profesionales en el futuro de una alternativa terapéutica en el tratamiento del trastorno depresivo mayor.
Conclusiones y aspectos prácticosCariprazina es un antipsicótico de nueva generación aprobado por la Agencia Europea de Medicamentos (AEM) para el tratamiento de la esquizofrenia; y por la FDA, para el tratamiento de los episodios agudos en el trastorno bipolar, incluyendo episodios depresivos y mixtos, y para la depresión mayor con respuesta insuficiente a antidepresivos, en combinación con estos. En la actualidad, la evidencia proveniente de 2 ECA apunta hacia su eficacia como tratamiento adyuvante a los antidepresivos en el trastorno depresivo mayor a dosis alrededor de los 1,5 mg/día, a pesar de no haberse hallado diferencias frente a placebo en otros 3 ECA. Dosis mayores a 1,5 mg/d pueden ser útiles en algunos pacientes, por lo que, si se produce respuesta parcial a la adición de cariprazina a un antidepresivo, tiene sentido buscar la remisión completa aumentando a 3 mg/día. Si se produce acatisia o inquietud, en la mayor parte de los casos se puede optar por añadir propranolol o una benzodiacepina de forma temporal, o reducir la dosis a 0,75 mg/día (una forma práctica de hacerlo es dar 1,5 mg a días alternos, dada la larga vida media del fármaco). Hay pacientes que responden a esas dosis algo más bajas, aunque la dosis óptima parece ser la de 1,5 mg. Cariprazina puede combinarse con cualquier antidepresivo aprobado para la depresión mayor. Por el momento, la literatura disponible acerca de su tratamiento a largo plazo es limitada y muestra su eficacia en un ensayo abierto a las 26 semanas de tratamiento. La pregunta de cuánto tiempo habría que mantener la cariprazina asociada al antidepresivo tras obtener respuesta no tiene una respuesta clara todavía, pero probablemente sería de «al menos 6 meses».
Cariprazina ha demostrado ser un fármaco seguro y bien tolerado, cuyos efectos adversos más frecuentes son la acatisia y la inquietud. En la actualidad, se dispone de evidencia que indica un beneficio de cariprazina en la sintomatología cognitiva en pacientes con esquizofrenia y trastorno bipolar con beneficios en la funcionalidad, pero esta esfera no ha sido evaluada en pacientes con trastorno depresivo mayor. El futuro estudio acerca de su eficacia en aspectos cognitivos en esta población podría permitir mitigar esta sintomatología desde el inicio del tratamiento de los episodios depresivos, lo cual supondría un beneficio a nivel de funcionamiento social y calidad de vida. Considerando el perfil de seguridad y el mecanismo de acción de cariprazina, su aprobación en el tratamiento de la depresión en Estados Unidos, el favorable perfil metabólico del fármaco y la evidencia disponible, su uso como tratamiento adyuvante en el trastorno depresivo mayor se encuentra justificado desde el punto de vista científico. Futuros estudios permitirán corroborar su eficacia a largo plazo, examinar su eficacia como tratamiento en monoterapia y analizar su papel en la prevención de recurrencias depresivas en esta población específica.
FinanciaciónLos autores declaran que no recibieron financiación para la realización de este trabajo.
Conflicto de interesesLos autores han realizado actividades docentes o investigadoras no relacionadas con este trabajo para AB-Biotics, AbbVie, Adamed, Angelini, Biogen, Boehringer-Ingelheim, Casen-Recordati, Celon Pharma, Compass, Dainippon Sumitomo Pharma, Ferrer, Gedeon Richter, GH Research, Glaxo-Smith Kline, Janssen, LCN, Lundbeck, Medincell, Merck, Neuraxpharm, Newron, Novartis, Orion Corporation, Organon, Otsuka, Rovi, Sage, Sanofi-Aventis, Sunovion, Takeda, Teva, y Viatris.
AgradecimientosLos autores de este estudio agradecen el apoyo del Ministerio de Ciencia e Innovación de España e Innovación (PI18/00805, PI21/00787) integrado en el Plan Nacional de I + D + I y cofinanciado por el ISCIII-Subdirección General de Evaluación y el Fondo Europeo de Desarrollo Regional (FEDER); el Instituto de Salud Carlos III; el CIBER de Salud Mental (CIBERSAM); la Secretaria d'Universitats i Recerca del Departament d'Economia i Coneixement (2021 SGR 1358) y el CERCA Programa/Generalitat de Catalunya.