La localización preoperatoria de la patología paratiroidea, por lo general un adenoma paratiroideo, puede ser difícil en algunos casos debido a las variantes anatómicas que presentan estas glándulas. El objetivo de esta revisión es analizar las diferentes técnicas de diagnóstico por imagen utilizadas en la localización preoperatoria de la patología paratiroidea (gammagrafía, ecografía, TC, RM y PET).
Existe una gran variabilidad entre las diferentes pruebas para la localización preoperatoria de esta patología. La importancia de conocer las diferentes opciones de diagnóstico radica en la necesidad de elegir la técnica más adecuada en cada ocasión y para cada paciente para un manejo adecuado del hiperparatiroidismo primario (HPTP) con criterio quirúrgico.
Preoperative localization of parathyroid pathology, generally a parathyroid adenoma, can be difficult in some cases due to the anatomical variants that these glands present. The objective of this review is to analyse the different imaging techniques used for preoperative localization of parathyroid pathology (scintigraphy, ultrasound, CT, MRI and PET).
There is great variability between the different tests for the preoperative localization of parathyroid pathology. The importance of knowing the different diagnostic options lies in the need to choose the most suitable test at each moment and for each patient for an adequate management of primary hyperparathyroidism (PHP) with surgical criteria.
Las glándulas paratiroides son pequeñas estructuras ovaladas ubicadas en pares a cada lado de la parte posterior de la glándula tiroides, pesan menos de 50mg cada una y miden unos 6×3-4mm de diámetro (craneocaudal × transversal)1. Dichas glándulas están formadas por 3 tipos de células: un 50-60% de células principales (que contienen pocas mitocondrias y secretan hormona paratiroidea [PTH], un 30-40% de células claras [que se convierten en células principales con la edad, contienen mucho glucógeno citoplasmático y cuya función real se desconoce] y menos de un 5% de células oxífilas [ricas en mitocondrias y cuya función también se desconoce])2.
El hiperparatiroidismo primario (HPTP) es el tercer trastorno endocrino más frecuente después de la diabetes y la enfermedad tiroidea, y es la causa más común de hipercalcemia, resultado de la secreción excesiva de PTH. Afecta al 0,3-1% de la población, siendo más frecuente en mujeres con una proporción de 3:1 respecto a los varones, con una incidencia máxima en las décadas cuarta y quinta de la vida1,3–5.
En la actualidad, la presentación más frecuente es asintomática. En los casos de HPTP sintomático, los órganos más afectados son los huesos, debido a la disminución de la densidad mineral ósea y sus consiguientes fracturas; seguidos de los riñones, debido al daño causado por la nefrolitiasis. Hay otros síntomas menos frecuentes, entre los que se encuentran problemas gastrointestinales (pancreatitis, úlcera péptica, estreñimiento, náuseas, vómitos o reflujo gastroesofágico), cardiovasculares (hipertensión, calcificaciones de las válvulas cardiacas y del miocardio, hipertrofia del ventrículo izquierdo y acortamiento del intervalo QT, lo que favorece arritmias y un incremento de la mortalidad por infarto agudo de miocardio e ictus) y afecciones neuropsiquiátricas (confusión, depresión, deterioro cognitivo, trastornos del sueño, irritabilidad o disminución de la concentración)1,6.
En cuanto a su etiología, hasta el 85-90% de los casos de HPTP se deben a la presencia de un adenoma paratiroideo solitario, el 5-10% a una hiperplasia de la glándula y <1% a un carcinoma paratiroideo1.
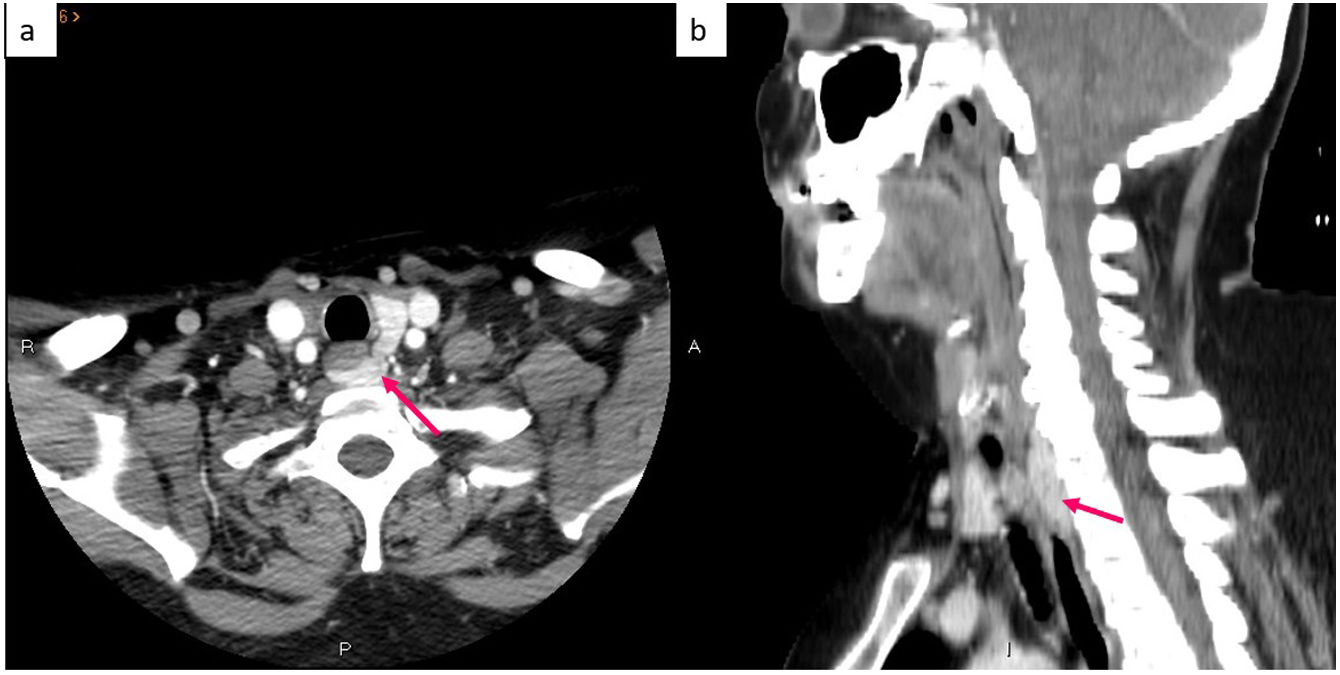
El diagnóstico del HPTP se realiza mediante una historia clínica adecuada junto con una medición del calcio corregido por albúmina y la PTH en suero, y el único tratamiento eficaz es la cirugía. Tradicionalmente, la cirugía consistía en una exploración bilateral del cuello y la escisión de las glándulas afectadas4, pero el hecho de que la mayoría de los casos de HPTP se deben a la afectación de una sola glándula, junto con la mejora de la monitorización intraoperatoria de la PTH y la localización preoperatoria mediante estudios de imagen han favorecido el desarrollo de la paratiroidectomía mínimamente invasiva2,7. Esta última modalidad tiene tasas de curación similares a la exploración quirúrgica bilateral, con tasas similares de recurrencia, persistencia y reintervención. Sin embargo, al minimizar la disección tisular, acelera el tiempo de recuperación, reduce el dolor postoperatorio y disminuye las cicatrices (lo que lleva a mejores resultados estéticos), además de tener un coste menor y menos complicaciones. Asimismo, la exploración quirúrgica bilateral requiere ingreso hospitalario, mientras que la cirugía unilateral es un procedimiento ambulatorio, por lo que se ha establecido como un método seguro y eficaz8–11. El éxito de la cirugía mínimamente invasiva depende indudablemente de la experiencia del cirujano1, pero también de una localización prequirúrgica precisa de la glándula paratiroides afectada, determinando no solo la lateralización sino también el cuadrante específico12. Sin embargo, la localización de la paratiroides patológica mediante técnicas de imagen suele ser problemática debido a las variantes anatómicas que pueden presentar dichas glándulas; en especial, las inferiores, debido a su migración embriológica más prolongada8. De hecho, aproximadamente el 16% de los casos tienen una o más paratiroides hiperfuncionantes en una localización ectópica3 (figs. 1-6).
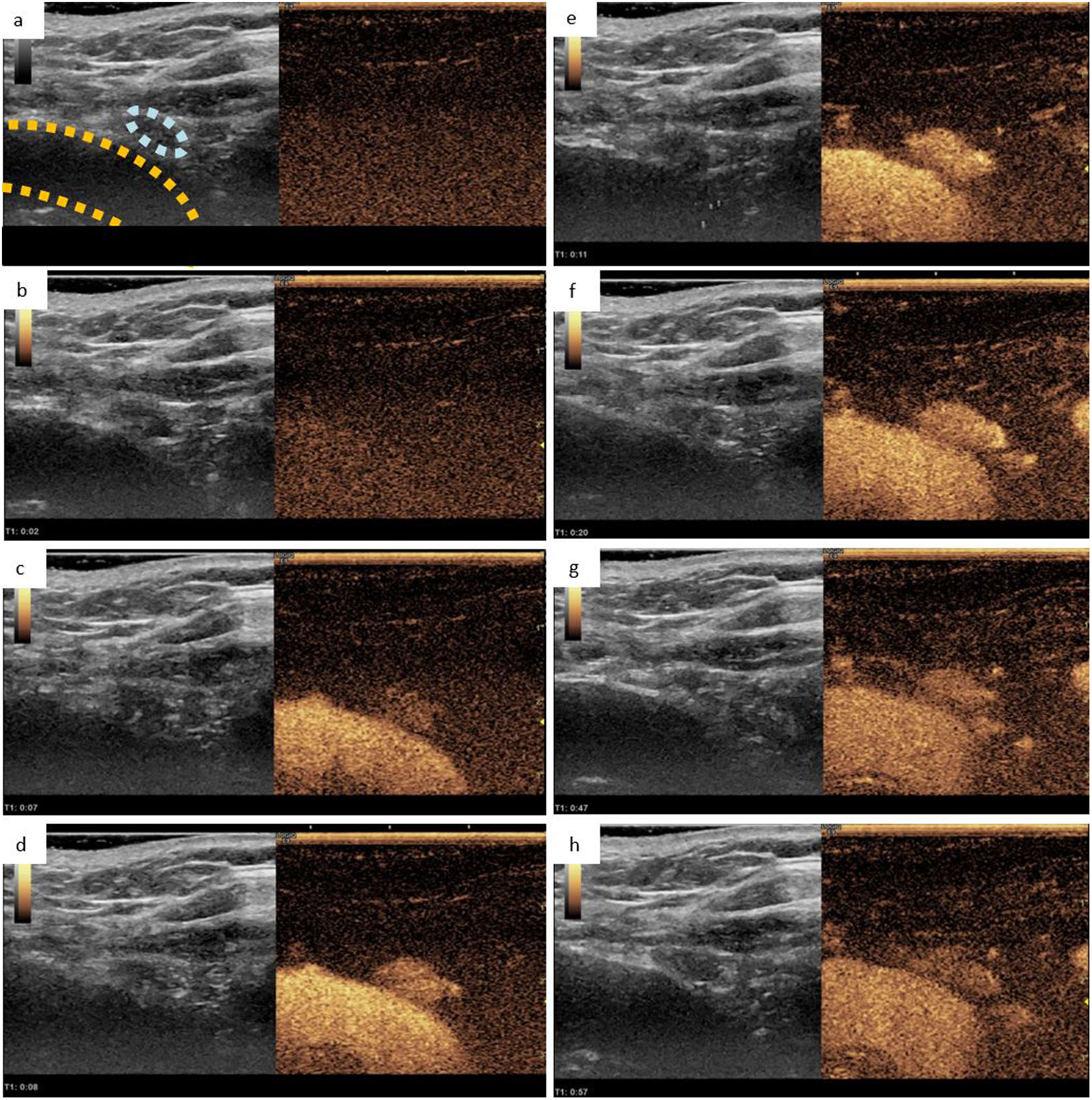
Adenoma paratiroideo inferior derecho observado mediante ecografía con contraste: a) Ecografía en modo B que muestra una lesión hipoecoica de 5mm (rodeada en azul claro) adyacente al tronco braquiocefálico derecho (rodeado en amarillo), junto con una imagen que muestra un índice mecánico inferior, y que permite la visualización del medio de contraste, ambas obtenidas antes de su administración. b-h) Representación del estudio dinámico a los 2, 7, 8, 11, 20, 47 y 57s, respectivamente tras la administración del contraste ecográfico. En este estudio dinámico, podemos observar como la lesión sospechosa presenta un realce intenso y precoz con lavado tardío, hallazgos que sugieren un adenoma paratiroideo.
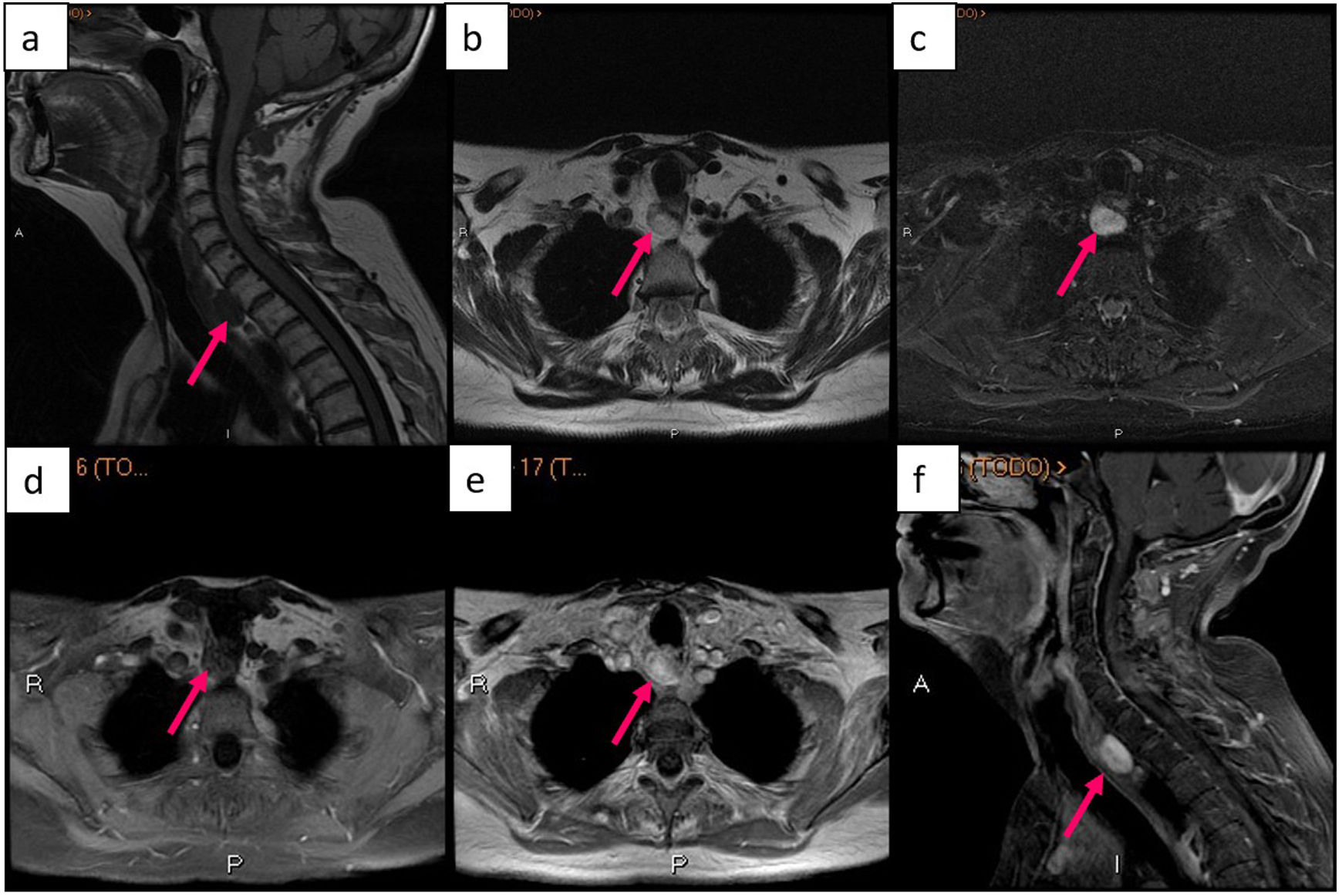
Adenoma paratiroideo retrotraqueal visto mediante RM: a) imagen sagital de secuencia potenciada en T1, b) imagen axial de secuencia potenciada en T2, c) imagen axial de secuencia STIR, d) imagen axial de secuencia potenciada en T1 con supresión de grasa y sin contraste, e) imagen axial de secuencia potenciada en T1 con contraste, f) imagen sagital de secuencia potenciada en T1 con supresión de grasa y contraste.
Este artículo tiene 2 objetivos principales: actualizar el estado del papel que desempeñan las diferentes técnicas de imagen en la localización preoperatoria de la patología paratiroidea, y exponer las diferentes ventajas, inconvenientes y causas de falsos positivos y negativos de las diferentes técnicas.
Resumen de las diferentes técnicas de imagenLas pruebas de imagen utilizadas para la localización preoperatoria de la patología paratiroidea que se incluyen en los artículos revisados son la gammagrafía, la ecografía cervical, la tomografía computarizada (TC), la resonancia magnética (RM) y la tomografía por emisión de positrones (PET). Cada una de ellas se analiza en detalle a continuación. La sensibilidad, la especificidad y la precisión diagnóstica de las diferentes pruebas se describen en la tabla 1.
Sensibilidad, especificidad y precisión de diferentes pruebas de imagen utilizadas para la localización de patología paratiroidea
| Descripción de la técnica empleada | Sensibilidad | Especificidad | Precisión | Referencia |
|---|---|---|---|---|
| Gammagrafía | ||||
| Gammagrafía planar con 99mTC-sestamibi bifásico | 49,1%, 50%, 63%, 64%, 71%, 80%, 88,9%, 91% | 33,3%, 57%, 67%, 75%, 90%, 98% | 64%, 70%, 75%, 76,7% | 1,8,16–21 |
| Gammagrafía planar con 99mTC-sestamibi (doble marcador con sustracción) | 41%, 70-94%, 76%, 88,9% | 100%, 21%, 72,2%, 100% | 66%, 85,6% | 17,25,30,32 |
| SPECT 99mTc-sestamibi | 80%, 91% | 93% | 77% | 22,23 |
| SPECT/TC 99mTc-sestamibi | 48,3-76%, 56%, 61%, 77,8%, 83%, 89,6%, 96% | 86%, 92,5%, 93,7-95,6%, 96%, 100% | 71%, 67,7%, 83% | 7,22–28 |
| SPECT/TC 99mTc-sestamibi (doble marcador con sustracción) | 74,5%, 89,2%, 93,1% | 22,2%, 66,7%, 95,8% | 81,3%, 85,6%, 87,2% | 30,35,37 |
| Ecografía | ||||
| Ecografía convencional | 29%, 32%, 40%, 51,8%, 52,3-74,8%, 54,2%, 58%, 58,6%, 67,8%, 69-71%, 70%, 79,4%, 84%, 89%, 91,7%, | 28,5%, 38,9%, 44,4%, 57%, 75%, 86%, 91%, 91,8-92,6%, 99% | 32%, 39%, 65%, 66%, 68%, 81,1%, 82% | 1,8,11,18–21,24,26,27,30,37,45,52 |
| Ecografía convencional + gammagrafía planar con 99mTc-sestamibi bifásico | 81%, 91% | 71%, 99% | 80% | 1,8 |
| Ecografía convencional + SPECT/TC 99mTc-sestamibi doble marcador | 73%, 77,8%, 97,5% | 55,6%, 83%, 93,9% | 76%, 83,3%, 95,2% | 24,30,37 |
| Ecografía con contraste | 66,7%, 100% | ND | ND | 26,59 |
| SPECT/TC 99mTc-sestamibi + ecografía con contraste | 82,7% | ND | ND | 26 |
| Detección de PTH mediante lavado de PAAF guiada por ecografía | 94%, 95,9% | 91-100% | 96% | 49,50 |
| TC | ||||
| TC4D (4 fases) | 55-88%, 86,6%, 87,8%, 89,7% | 50%, 94% | 86%, 87%, 86%, 87,1% | 7,12,19,52,62,63 |
| TC4D (4 fases) + SPECT/TC 99mTc-sestamibi | ND | ND | 93,5% | 7 |
| 3 fases | 72,9%, 74%, 75%, 76,9%, 82,3% | 40%, 85,6% | 54,5% | 20,21,27,42,51 |
| 3 fases (sin contraste y fase arterial con energía dual, fase venosa en modo simple) | 96,7% | 66,6% | 95,2% | 62 |
| RM | ||||
| RM de 1,5 T | 96,7% | 66,6% | 95,2% | 62 |
| RM de 3 T | 91-92% | 95% | 70% | 63,65 |
| PET | ||||
| PET/TC 18F-colina | 81%, 82%, 90,5%, 92%, 95,8% | 12,5%, 86%, 99,7% | 56,8%, 84% | 21,24,25,51,69–72 |
| PET/TC 18F-colina + TC en 3 fases | 100% | ND | 72,7% | 51 |
| PET/TC 18F-colina/RM:T2 coronal y axial, STIR coronal y TC axial con y sin contraste (33);T1, T2 y STIR postcontraste axial y sagital (9) | 90%, 96,2% | ND | ND | 9,34 |
| PET/TC C11-metionina | 75% | 50% | 71% | 74 |
ND: no disponible; RM: resonancia magnética; SPECT/TC: tomografía computarizada por emisión de fotón único; STIR: Short I Inversion Recovery; TC: tomografía computarizada.
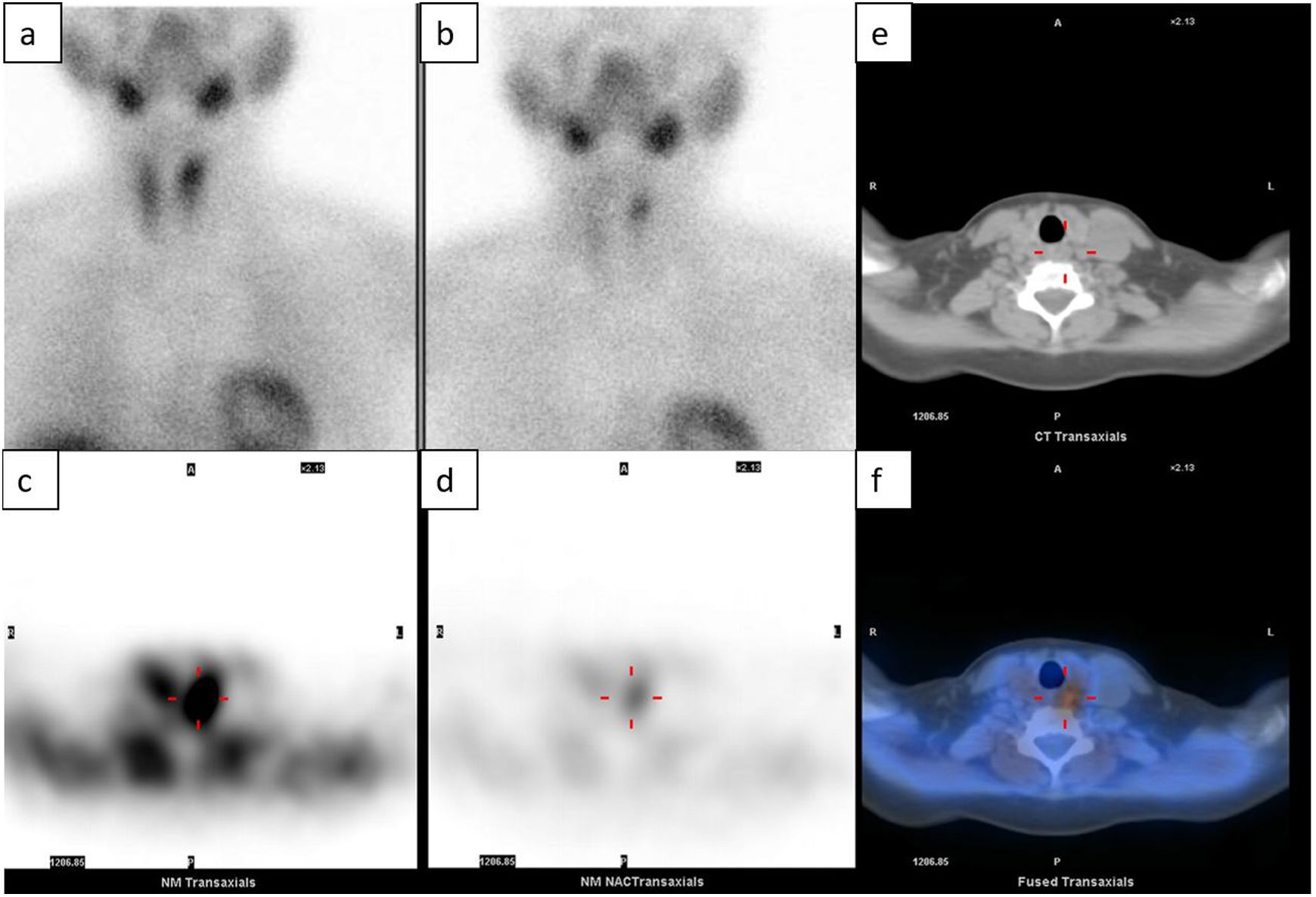
En 1989, Coakley et al. descubrieron fortuitamente que el 99mTc-sestamibi (sesta-metoxiisobutilisonitrilo) utilizado para las pruebas de perfusión miocárdica era captado de forma predominante por las glándulas paratiroides anómalas13. El sestamibi es un catión lipofílico que atraviesa pasivamente las membranas celulares y queda atrapado en las mitocondrias debido al potencial transmembrana negativo. El mecanismo exacto de su captación por las glándulas paratiroides no está del todo claro. Se cree que se debe a una combinación de factores, como el aumento del flujo sanguíneo y la mayor presencia de células oxifílicas, ricas en mitocondrias, por parte de las glándulas paratiroides hiperfuncionantes14,15. De este modo, el 99mTc-sestamibi es captado tanto por la glándula tiroides como por la paratiroides, aunque existe una diferencia de lavado entre ambas, de modo que la imagen típica del adenoma paratiroideo consiste en una hipercaptación focal en la fase inicial (5-20min tras su administración, según los distintos protocolos), con un lavado lento en la fase tardía (a los 120-180min). Esta técnica de doble fase es el enfoque clásico más utilizado13–15.
Existen múltiples estudios publicados sobre la gammagrafía planar utilizada en este contexto, que describen una sensibilidad del 49,1-91%, una especificidad del 33,3-98% y una precisión del 64-76,7% para la detección del adenoma paratiroideo1,8,16–21. Por su parte, la SPECT (siglas en inglés de la tomografía computarizada por emisión de fotón único) permite la detección volumétrica tridimensional, lo que mejora la sensibilidad del 99mTc-sestamibi para la detección de un adenoma solitario antes de la cirugía hasta el 80-91%, con una especificidad del 93% y una precisión del 77%22,23. Asimismo, la SPECT con 99mTc-sestamibi en combinación con la tomografía computarizada (TC) mejora la detección de adenomas paratiroideos, pues alcanza una sensibilidad del 48,3-96%, una especificidad del 86-100% y una precisión del 67,7-83%7,22–28 (tabla 1). Además, esta combinación con TC también permite una localización anatómica precisa previa de la cirugía de adenomas ectópicos retrotraqueales o mediastínicos, lo que facilita una planificación quirúrgica adecuada16.
No existe consenso respecto a la dosis de 99mTc-sestamibi que debe administrarse; según los distintos estudios, varía entre 10mCi (370MBq)17 y 25mCi (925MBq)7,9.
Algunos autores afirman que las imágenes en fase retardada no mejoran la precisión diagnóstica, ya que la actividad paratiroidea residual en las imágenes retardadas ya está presente en las imágenes en fase temprana, solo oscurecida por la actividad tiroidea de fondo, y que, por lo tanto, la interpretación cuantitativa en las exploraciones iniciales es suficiente para el diagnóstico18.
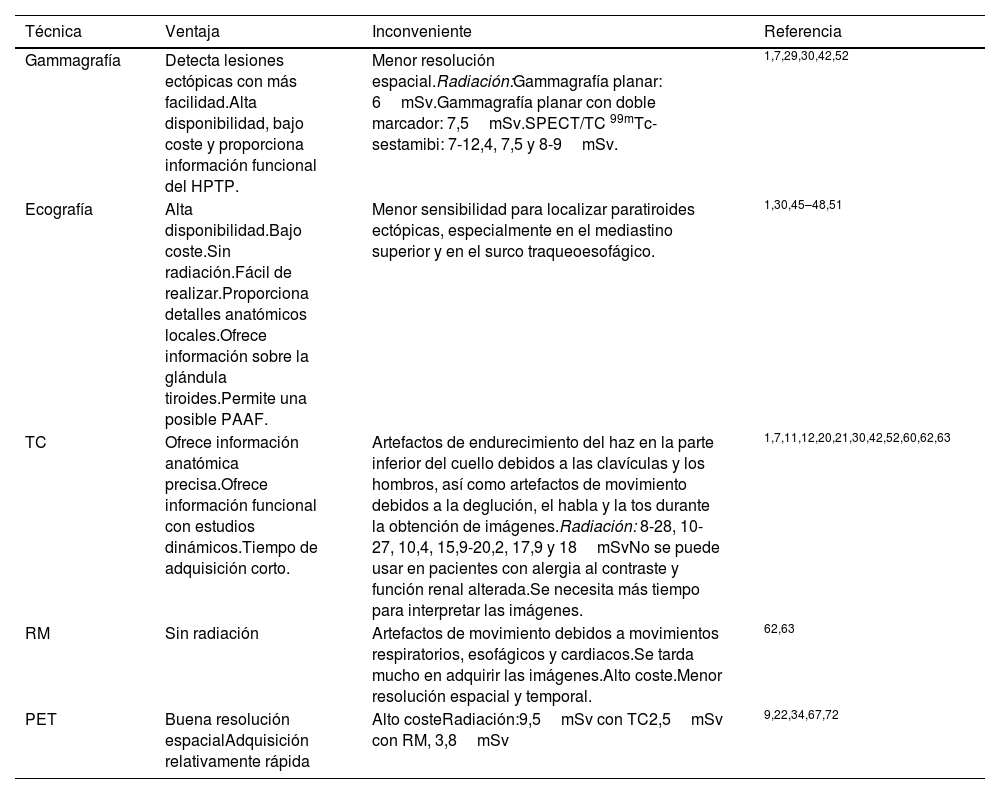
Entre las ventajas de esta técnica se encuentran que es fácil de realizar, está ampliamente disponible, tiene un bajo coste, permite detectar lesiones ectópicas con mayor facilidad y proporciona información funcional en relación con el HPTP29,30. Entre sus desventajas, destacan la escasa delimitación anatómica y una menor resolución espacial31 (tabla 2). Además, el patrón típico de captación y lavado del 99mTc-sestamibi se produce en el 70-75% de los casos. En algunos pacientes, el lavado del adenoma paratiroideo y de la glándula tiroides se produce al mismo tiempo, lo que se denomina «lavado rápido». Se cree que está relacionado con factores como el número de células ricas en mitocondrias o el grado de angiogénesis32. Por este motivo, existen las modalidades de doble isótopo, de forma que este segundo isótopo sea captado solo por el tiroides y la sustracción de imágenes permita diagnosticar la lesión paratiroidea. Ese segundo isótopo utilizado puede ser I12332–34 o Tc99m-pertecnetato17,35,36. Los estudios describen diferentes rangos de sensibilidad, especificidad y precisión de localización (tabla 1).
Ventajas e inconvenientes de las técnicas de diagnóstico utilizadas
| Técnica | Ventaja | Inconveniente | Referencia |
|---|---|---|---|
| Gammagrafía | Detecta lesiones ectópicas con más facilidad.Alta disponibilidad, bajo coste y proporciona información funcional del HPTP. | Menor resolución espacial.Radiación:Gammagrafía planar: 6mSv.Gammagrafía planar con doble marcador: 7,5mSv.SPECT/TC 99mTc-sestamibi: 7-12,4, 7,5 y 8-9mSv. | 1,7,29,30,42,52 |
| Ecografía | Alta disponibilidad.Bajo coste.Sin radiación.Fácil de realizar.Proporciona detalles anatómicos locales.Ofrece información sobre la glándula tiroides.Permite una posible PAAF. | Menor sensibilidad para localizar paratiroides ectópicas, especialmente en el mediastino superior y en el surco traqueoesofágico. | 1,30,45–48,51 |
| TC | Ofrece información anatómica precisa.Ofrece información funcional con estudios dinámicos.Tiempo de adquisición corto. | Artefactos de endurecimiento del haz en la parte inferior del cuello debidos a las clavículas y los hombros, así como artefactos de movimiento debidos a la deglución, el habla y la tos durante la obtención de imágenes.Radiación: 8-28, 10-27, 10,4, 15,9-20,2, 17,9 y 18mSvNo se puede usar en pacientes con alergia al contraste y función renal alterada.Se necesita más tiempo para interpretar las imágenes. | 1,7,11,12,20,21,30,42,52,60,62,63 |
| RM | Sin radiación | Artefactos de movimiento debidos a movimientos respiratorios, esofágicos y cardiacos.Se tarda mucho en adquirir las imágenes.Alto coste.Menor resolución espacial y temporal. | 62,63 |
| PET | Buena resolución espacialAdquisición relativamente rápida | Alto costeRadiación:9,5mSv con TC2,5mSv con RM, 3,8mSv | 9,22,34,67,72 |
HPTP: hiperparatiroidismo primario; PAAF: biopsia con aspiración de aguja fina; PET: tomografía de emisión de positrones; RM: resonancia magnética; SPECT/TC: tomografía computarizada por emisión de fotón único; TC: tomografía computarizada.
Otras causas de falsos negativos en los estudios gammagráficos son el pequeño tamaño de los adenomas, la presencia de glándulas ectópicas, una enfermedad multiglandular, adenomas del lado derecho o de localización superior, o la toma de AINE28,32,38–40. Además, la glicoproteína P es una lipoproteína de la membrana plasmática multirresistente a los fármacos y se cree que, del mismo modo que su sobreexpresión aumenta la liberación de fármacos quimioterapéuticos de las células cancerosas, también expulsa el sestamibi de las células oxífilas, provocando falsos negativos en los estudios gammagráficos35,41.
Otro aspecto preocupante es la exposición a radiaciones ionizantes, cuya dosis efectiva se estima en aproximadamente 6mSv en el caso de técnicas con uso de trazador único1, 7,5mSv si se utiliza doble trazador con sustracción1 y 7-12,4mSv si se asocia a la TC de baja dosis1,7,42 (tabla 2). Dado que una radiografía simple de tórax es de aproximadamente 0,02mSv, estas modalidades corresponderían a aproximadamente 300, 375 y 400-500 radiografías de tórax, respectivamente1,23.
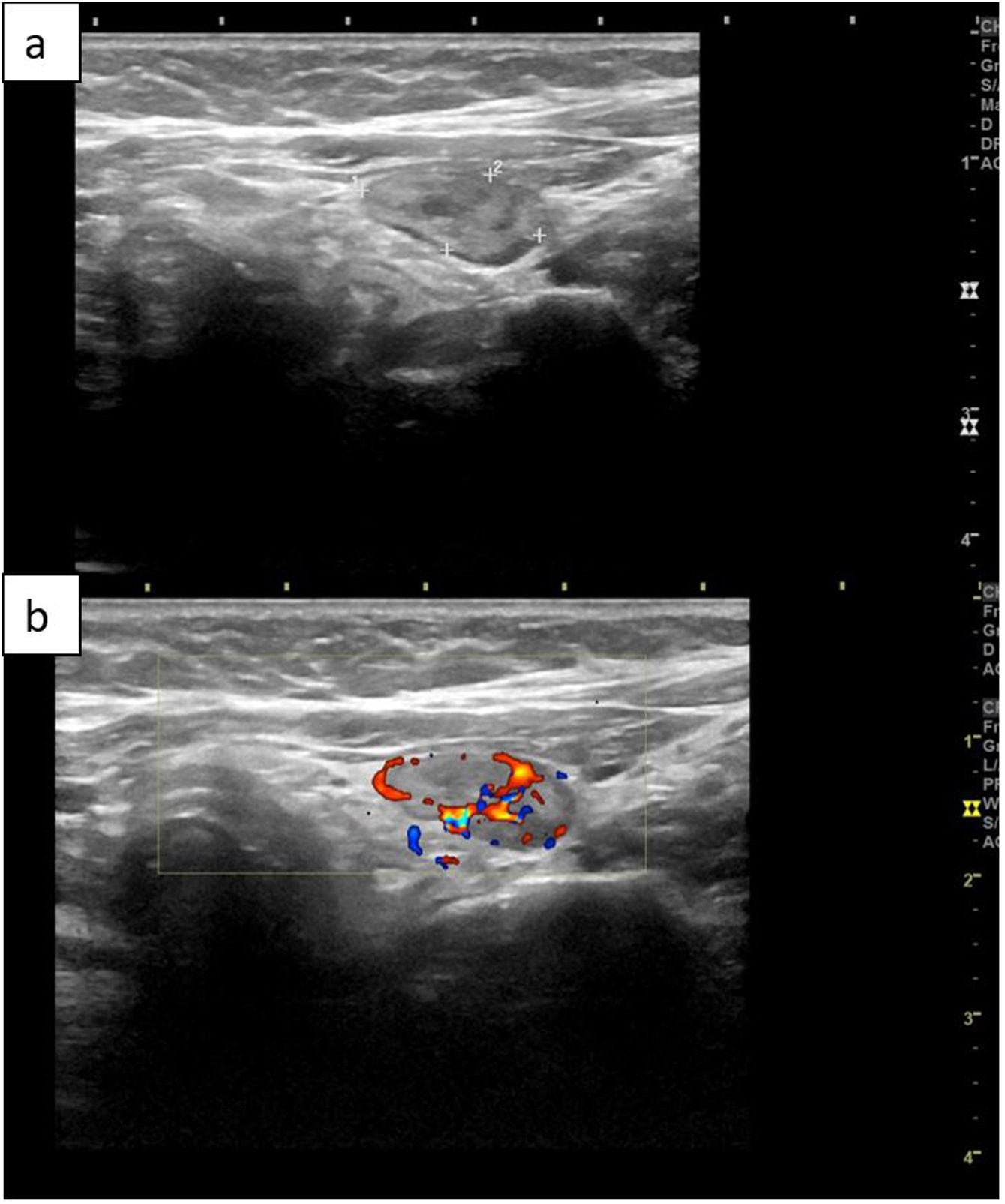
Ecografía cervicalLas glándulas paratiroides normales no son visibles con esta técnica. Un adenoma paratiroideo se observa generalmente en el modo B como una lesión hipoecoica homogénea y bien definida. En el modo Doppler suelen aparecer como masas hipervasculares5,43. Cuando se aprecie una estructura compatible, se debe observar en 2 planos (longitudinal y transversal) para descartar que se trate de una falsa imagen debida, por ejemplo, a la musculatura prevertebral43.
De hecho, los ganglios linfáticos aparecen con frecuencia como estructuras redondeadas hipoecoicas y pueden confundirse con adenomas paratiroideos. La presencia de un hilio graso central hipervascular en el modo Doppler indica que se trata de un ganglio linfático. Sin embargo, los ganglios linfáticos reactivos, asociados normalmente con una tiroiditis autoinmune, no suelen mostrar un hilio, y pueden inducir a error43.
Por otro lado, el carcinoma paratiroideo también debe incluirse en el diagnóstico diferencial a pesar de su baja prevalencia, que se sitúa en torno al 1%. Aunque hay signos que nos pueden hacer sospechar la existencia de un carcinoma, como una glándula paratiroides agrandada y heterogénea con bordes irregulares o con evidencia de invasión de estructuras adyacentes, o bien que la lesión sea más alta que ancha o presente calcificaciones en su interior43–45, Huang et al. observaron que no existían diferencias entre el carcinoma paratiroideo y el adenoma en cuanto a ecogenicidad, diámetro máximo, áreas quísticas internas, edad, distribución por sexos o niveles séricos de calcio. No obstante, los niveles elevados de PTH sí se correlacionan con la existencia de carcinoma, de forma que encontrar niveles de PTH superiores a 1.000pg/ml asociados a calcificaciones intralesionales tiene una sensibilidad del 71% y una especificidad del 100% para un tumor maligno45.
Las ventajas de esta técnica son su alta disponibilidad, la ausencia de radiación ionizante y su bajo coste1,30,45. Además, permite identificar patología tiroidea concomitante1,30,46,47 y, en caso de duda, una punción aspirativa con aguja fina (PAAF) guiada por ecografía permite descartar la existencia de células tiroideas malignas mediante citología48 (tabla 2). Asimismo, se puede realizar un lavado de la PAAF con 0,5-1cc de solución salina al 0,9% para cuantificar los niveles de PTH, de forma que, si los niveles de PTH en el lavado son al menos el doble de los niveles de PTH de una muestra de sangre obtenida simultáneamente, podemos concluir la presencia de una lesión paratiroidea con una sensibilidad del 94-95,9%, una especificidad del 91-100% y una precisión del 96%49,50 (tabla 1).
Entre los inconvenientes destacan la dificultad para evaluar las glándulas paratiroides en el mediastino superior o en la región retrotraqueal, la menor sensibilidad para detectar glándulas hiperplásicas, así como las dificultades derivadas de la condición del paciente (p. ej., que tenga un cuello obeso o una hipercifosis cervical)1,5,30,44,51 (tabla 2).
Existe mucha variabilidad en la literatura respecto a la sensibilidad diagnóstica de la ecografía, que oscila entre el 29 y el 91,7%, con la especificidad entre el 28,5-99% y la precisión entre el 32-82%1,8,11,18–21,24,26,27,30,37,45,52. Claramente, el factor más importante en la variabilidad de la sensibilidad de esta prueba es la experiencia del personal que la realiza1,43 (tabla 1).
Otra modalidad asociada a esta técnica es la ecografía con contraste (EC), también llamada CEUS por sus siglas en inglés. El contraste ecográfico está compuesto de microburbujas de hexafluoruro de azufre, un gas inerte, recubiertas de fosfolípidos53,54. Cuando dichas microburbujas se someten a un haz de ultrasonidos, se produce una reflexión de la onda en la superficie de la burbuja debido a la gran diferencia de impedancia acústica entre el gas y el plasma, que se traduce en una señal ecográfica hiperecoica que debe ser interpretada por el ecografista55. Es un contraste extremadamente seguro, con una baja incidencia de efectos adversos; no provoca efectos cardiotóxicos, hepatotóxicos ni nefrotóxicos56–58.
Entre sus inconvenientes destaca que hay que colocar una vía intravenosa para su administración, lo que requiere 2 personas, una para realizar la ecografía y otra para inyectar el contraste. Otra desventaja es que no permite evaluar más de una o 2 lesiones concretas, aunque este hecho puede corregirse administrando dosis posteriores de contraste53,58. Se ha utilizado principalmente para la caracterización de lesiones focales hepáticas31,54, mientras que su uso para la localización de paratiroides aún no figura en la ficha técnica. Sin embargo, algunos artículos señalan que puede ser una técnica prometedora y rentable para localizar patología paratiroidea con una sensibilidad diagnóstica superior a la ecografía, y que puede ayudar a diferenciar adenomas paratiroideos de ganglios linfáticos y lesiones tiroideas en función del patrón de captación del contraste. Los hallazgos apuntan a una lesión paratiroidea si observamos una hipervascularización arterial temprana en los primeros 30s desde la periferia hacia el centro, seguida de un lavado central en la fase tardía hasta los 120s. En caso de que la lesión sospechosa muestre un realce centrípeto progresivo en la fase tardía, nos indicará que estamos ante tejido tiroideo o una adenopatía26,59. Parra Ramírez et al. informaron de una sensibilidad diagnóstica de la EC del 66,7% y, en combinación con la SPECT/TC 99mTc-sestamibi, del 82,7%26, mientras que Platz et al. hallaron una sensibilidad diagnóstica de la EC del 100%59 (tabla 1).
Tomografía computarizadaOtra técnica que se ha investigado en los últimos años es el uso de la TC multifásica, descrita inicialmente con 4 fases (de ahí el nombre TC4D). Se inicia con una fase sin contraste, seguida de la inyección de 60-120ml de contraste yodado no iónico a una velocidad de 4-5ml/s. Después, se obtienen imágenes desde el ángulo de la mandíbula hasta la carina en la fase arterial a los 15-25s, en la fase venosa temprana a los 55-65s y en la fase venosa tardía o fase retardada a los 85-100s7,12,60.
En la fase arterial, las lesiones paratiroideas presentan un realce significativo que alcanza las 138-180UH. Se ha descrito que la absorción máxima se produce entre 25 y 60s después de la inyección. Este hecho permite diferenciar estas lesiones de los ganglios linfáticos, que muestran un realce progresivamente creciente tras la inyección de contraste, llegando al máximo en fases tardías. Asimismo, las características de captación también permiten diferenciar las lesiones paratiroideas de los nódulos tiroideos que, aunque también muestran un realce intenso en la fase arterial, podrían presentar una alta atenuación en la fase sin contraste debido a su alto contenido en yodo. De esta forma, los adenomas paratiroideos pueden diagnosticarse con una sensibilidad que varía entre el 55 y el 89,7%, una especificidad del 50-94% y una precisión diagnóstica del 86-87,1% según diferentes estudios7,12,19,52,61,62 (tabla 1).
El principal inconveniente de la TC es la elevada cantidad de radiación que recibe el paciente, siendo la dosis media efectiva por TC multifásica de 10-28mSv según diferentes autores7,11,12,21,42,52,60,62 (tabla 2). Esta preocupación ha llevado a la realización de estudios en 3 o incluso 2 fases, con una precisión diagnóstica equivalente pero con menos radiación20,21,27,42,51,60. También se han llegado utilizar tecnologías de TC más recientes, como la energía dual que, al usar diferentes kilovoltajes, es capaz de reducir la radiación a 3-5mSv (inferior a una SPECT/TC 99mTc-sestamibi)11 (tabla 1). Moosvi et al. afirman que, a pesar de que el riesgo global de desarrollar una neoplasia puede aumentar (la radiación media absorbida por persona en el Reino Unido es de 2,7mSv/año), este riesgo se vería compensado por el beneficio que aportaría un examen con mayor precisión de localización preoperatoria y la consiguiente cirugía mínimamente invasiva60.
Entre otros inconvenientes se encuentran las contraindicaciones relacionadas con el uso de contraste yodado en pacientes alérgicos o con afectación renal (recordemos que el HPTP puede afectar a la función renal), y el tiempo necesario para la interpretación de las imágenes52,63. Además, su capacidad para detectar adenomas puede verse limitada por el pequeño tamaño de los adenomas paratiroideos, los artefactos por endurecimiento del haz en la parte inferior del cuello debidos a las clavículas y los hombros (que pueden disminuirse si el paciente baja los hombros o se coloca una toalla enrollada entre las escápulas) o los artefactos por movimiento si el paciente traga, habla o tose durante la adquisición de la imagen52 (tabla 2).
La TC se considera superior a la ecografía y la gammagrafía, ya que proporciona información anatómica precisa, así como información funcional20,30,52,60, y es un estudio rápido de realizar61 (tabla 2). Por lo tanto, a pesar de que se consideraba de segunda línea para los casos discordantes o no concluyentes19, muchos autores creen que podría ser una modalidad de imagen precisa de primera línea11,12,27,52.
Resonancia magnéticaExisten pocas publicaciones sobre la utilidad de la RM en la localización preoperatoria de las lesiones del HPTP. En general, la RM se utiliza en pacientes con HPTP persistente o recurrente61. Los adenomas paratiroideos suelen presentar una señal intermedia similar a la del músculo en secuencias potenciadas en T1, y suelen ser hiperintensos en imágenes potenciadas en T2, lo que restringe la difusión. Los estudios dinámicos mediante secuencias T1 con contraste (tras la inyección de 0,1mmol/kg de gadolinio a una velocidad de 4ml/s), muestran una captación precoz del contraste pocos segundos después del inicio del realce carotídeo y con máxima intensidad de señal en la fase venosa precoz, a diferencia de los nódulos tiroideos o los ganglios linfáticos, que tienen un realce en la fase tardía62–64.
La sensibilidad para el diagnóstico del adenoma paratiroideo es similar tanto con 1,5T (96,7%)62 como con 3T (91-92%)63,65. Sin embargo, existen mayores diferencias en cuanto a la especificidad, ya que se ha descrito un 66,6%62 si se utiliza 1,5T, frente al 95% si se utiliza 3T65 (tabla 1). Esto podría deberse al hecho de que Nael et al. llevaron a cabo estudios de perfusión utilizando secuencias TWIST. Hallaron que un umbral de tiempo al pico (TP) de 37s permitía diferenciar un único adenoma paratiroideo de la glándula tiroides con una sensibilidad del 86% y que un wash-in superior a 5,27 mostraba la mayor especificidad (90%) para diferenciar un único adenoma paratiroideo de la glándula tiroides. Una combinación de TP (umbral de 30s), wash-in (umbral de 5,86) y washout (umbral de 0,67) mejoró la capacidad diagnóstica, dando como resultado un área bajo la curva de 0,96 con una sensibilidad del 91% y una especificidad del 95%65.
Por último, también se ha descrito el uso de la espectroscopia por RM. En esta técnica, el aumento de los niveles de colina, glicerofosfocolina, fosforilcolina, glucosa, lactato, succinato, glutamina y ascorbato se asocia con los adenomas paratiroideos, pero no con la hiperplasia66.
Esta técnica ha demostrado una sensibilidad y una especificidad similares a la TC multifásica, pero sin riesgo de radiación62–64. No obstante, en las imágenes puede haber artefactos causados por el movimiento respiratorio, la motilidad esofágica o la pulsación cardiaca62. Además, la RM es una prueba que requiere un largo tiempo de adquisición, es cara y tiene una menor resolución espacial y temporal62–64. Aparte, la anatomía del cuello podría dificultar una supresión de la grasa adecuada. Se recomienda la técnica de Dixon para mejorarla65.
Por todo lo anterior, la RM se considera una modalidad de imagen de segunda línea cuando las modalidades de primera línea son negativas o no concluyentes62–64 (tabla 2).
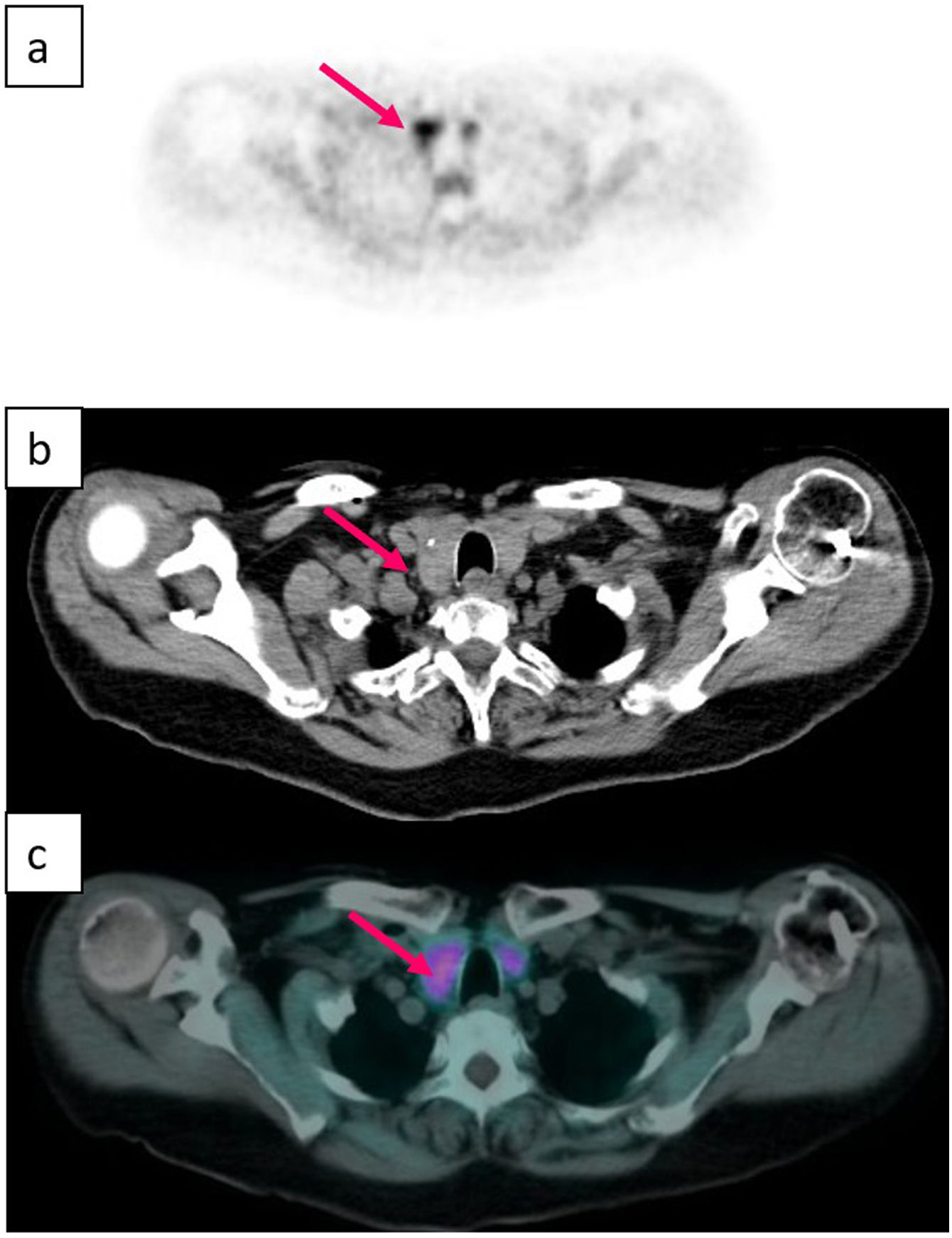
Tomografía por emisión de positronesRecientemente se han descrito adenomas paratiroideos hallados incidentalmente mediante PET/TC 18F-colina durante la evaluación de pacientes con cáncer de próstata. Existen algunos estudios preliminares sobre el uso de la PET/TC 18F-colina en pacientes con HPTP y sin cáncer de próstata que afirman que esta técnica puede localizar adenomas paratiroideos67. La colina sirve de precursor para la biosíntesis de los fosfolípidos, por lo que las células con un alto índice de proliferación celular, como las de un adenoma paratiroideo, tienen una mayor demanda de fosfolípidos. Las células absorben la colina y las enzimas colina quinasas la fosforilan, lo que la deja retenida en el interior de las mitocondrias de forma similar al sestamibi en las células oxífilas. La alta captación precoz por los adenomas paratiroideos se debe en parte a la alta vascularización y al aumento de la actividad de la proteína quinasa dependiente de fosfolípidos9,67,68. Estos datos han suscitado un gran interés en los últimos años y existen numerosas publicaciones que afirman que esta técnica tiene una sensibilidad del 81-95,8%, una especificidad del 12,5-99,7% y una precisión del 56,8-95,3%21,24,25,51,69–72 (tabla 1). Si bien es sabido que, en las imágenes estáticas, los ganglios linfáticos también pueden mostrar captación y provocar falsos positivos, en estudios dinámicos se ha observado que la discriminación entre adenomas y ganglios linfáticos es óptima entre 2 y 5min después de la inyección del isótopo68.
La PET tiene la ventaja de ser mucho más rápida y tener mayor resolución espacial que la SPECT22,70. Entre sus inconvenientes se encuentran su elevado coste (3-4 veces superior al de una SPECT/TC con 99mTc-sestamibi34,72) y una exposición a la radiación de alrededor de 9,5mSv, dado que se combina con la TC9. Por estos motivos, actualmente se utiliza como técnica de imagen de segunda línea34. La preocupación por su radiación ha llevado a estudiar el uso de PET/RM con 18F-colina, que alcanza tasas de éxito similares mientras que minimiza la dosis de radiación efectiva a 2,5-3,8mSv9,34 (tabla 2).
La PET/TC con 11C-metionina también se ha investigado con rendimientos diagnósticos similares, con una sensibilidad, especificidad y precisión del 75, del 50 y del 71%, respectivamente. Sin embargo, la corta semivida de la metionina limita su aplicabilidad diaria5,17,69,71,73,74 (tabla 1).
ConclusiónEn resumen, existe una gran variabilidad entre las diferentes pruebas utilizadas para la localización preoperatoria de patología paratiroidea. La importancia de conocer las diferentes opciones de diagnóstico radica en la necesidad de elegir la técnica más adecuada en cada ocasión y para cada paciente, para un manejo adecuado de pacientes con HPTP con criterio quirúrgico.
Debemos recordar que el manejo multidisciplinar entre cirujanos, endocrinólogos, nefrólogos, radiólogos y médicos nucleares es importante, sobre todo en casos de discrepancia, ya que una adecuada localización determina una cirugía mínimamente invasiva con menos riesgos, menor número de complicaciones y menores costes.
FinanciaciónEsta investigación no ha recibido ninguna subvención específica de organismos de financiación de los sectores público, comercial o sin ánimo de lucro.
Conflicto de interesesLos autores declaran que no tienen intereses económicos ni relaciones personales que pudieran haber influido en el trabajo presentado en este artículo.
Los autores desean agradecer a todas las personas que han participado en este estudio por su voluntad de colaborar.