El estudio los nervios periféricos (NNPP) mediante técnicas de imagen ha experimentado un notable crecimiento en la última década. Más allá del abordaje clásico y todavía vigente mediante ecografía de los NNPP, el desarrollo de nuevas técnicas neurográficas a partir de secuencias morfológicas convencionales (incluyendo estudios 3D isotrópicos con supresión grasa) está permitiendo valorar los distintos NNPP y plexos incluyendo pequeñas ramas terminales sensitivas y/o motoras con gran precisión. El uso de secuencias potenciadas en difusión (DWI) y tensor de difusión (DTI) ha permitido abrir un nuevo horizonte en los estudios de neurografía. Este nuevo abordaje proporciona información morfológica y funcional acerca de la estructura interna y fisiopatología de los NNPP y las distintas patologías relacionadas con ellos. En esta actualización realizamos una puesta al día de las distintas modalidades de neurografía mediante resonancia magnética disponibles para el estudio de los NNPP, con especial atención a las nuevas secuencias basadas en difusión.
Imaging studies of peripheral nerves have increased considerably in the last ten years. In addition to the classical and still valid study by ultrasound, new neurographic techniques developed from conventional morphological sequences (including 3D isotropic studies with fat suppression) are making it possible to assess different peripheral nerves and plexuses, including small sensory and/or motor branches, with great precision. Diffusion-weighted sequences and diffusion tensor imaging have opened a new horizon in neurographic studies. This new approach provides morphological and functional information about the internal structure and pathophysiology of the peripheral nerves and diseases that involve them. This update reviews the different MR neurography techniques available for the study of the peripheral nerves, with special emphasis on new sequences based on diffusion.
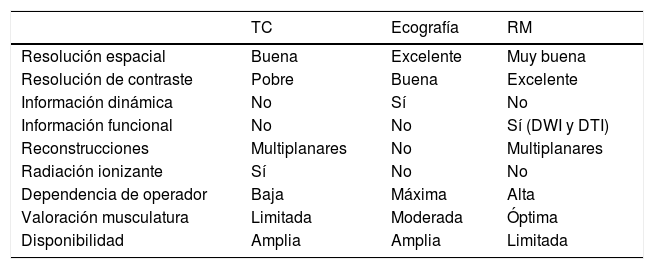
El estudio de los nervios periféricos (NNPP), plexos braquial y lumbar mediante técnicas de imagen ha experimentado un notable avance en los últimos años gracias al desarrollo de técnicas de imagen específicas para su valoración1. Hasta hace pocos años, la única forma de obtener información acerca del mecanismo de conducción nerviosa en el interior de los NNPP se basaba en la realización de estudios de neurofisiología: electroneurografía y electromiografía, principalmente. Dichas técnicas continúan vigentes y son de gran utilidad para el estudio de las neuropatías; sin embargo, son invasivas y en determinadas ocasiones escasamente reproducibles con una variabilidad entre sujetos no despreciable2. Los NNPP pueden ser evaluados mediante distintas técnicas de imagen, tales como la ecografía, la tomografía computarizada (TC) o la resonancia magnética (RM), cuyas principales características están resumidas en la tabla 13. En el caso de la TC, la escasa resolución de contraste de dicha técnica, unido al inherente uso de radiación ionizante, limita su aplicación a situaciones muy concretas como es el caso de valorar la relación de NNPP con estructuras óseas, estudio de calcificaciones asociadas o infiltración grasa muscular4. De esta forma, el estudio del nervio periférico (NP) mediante técnicas de imagen se basa principalmente en el uso de ecografía y RM. Entre las principales ventajas de la ecografía se encuentran su accesibilidad, resolución espacial y la capacidad de proporcionar información en tiempo real a través de maniobras dinámicas5. Una de las principales limitaciones de la ecografía reside en la elevada dependencia del grado de capacitación y experiencia por parte del operador, lo cual puede incrementar la tasa de falsos negativos y falsos positivos3. Además, muchos NNPP muestran localización profunda o se encuentran en relación con estructuras óseas o vísceras abdominales como es el caso del plexo lumbar, lo que dificulta su correcta valoración mediante ecografía.
Técnicas de imagen para la valoración de nervios periféricos
| TC | Ecografía | RM | |
|---|---|---|---|
| Resolución espacial | Buena | Excelente | Muy buena |
| Resolución de contraste | Pobre | Buena | Excelente |
| Información dinámica | No | Sí | No |
| Información funcional | No | No | Sí (DWI y DTI) |
| Reconstrucciones | Multiplanares | No | Multiplanares |
| Radiación ionizante | Sí | No | No |
| Dependencia de operador | Baja | Máxima | Alta |
| Valoración musculatura | Limitada | Moderada | Óptima |
| Disponibilidad | Amplia | Amplia | Limitada |
DTI: tensor de difusión; DWI: imagen potenciada en difusión.
La introducción de la RM para la valoración de NNPP normales y patológicos ha permitido alcanzar una elevada sensibilidad y especificidad en distintos escenarios clínicos, en muchos de los cuales mejora las prestaciones ofrecidas hasta el momento por técnicas convencionales6. La introducción de secuencias neurográficas de RM (las cuales permiten identificar y representar de manera selectiva o no selectiva el trayecto y características morfológicas o funcionales de los NNPP) ha permitido obtener imágenes de alta resolución de los mismos con independencia de su localización anatómica, proporcionando un gran detalle de las características morfológicas y patológicas de estos, lo que es de gran utilidad en el estudio de las neuropatías periféricas7–9. El desarrollo de nuevas técnicas avanzadas de RM-neurografía está permitiendo pasar de una valoración morfológica y cualitativa de los NNPP y plexos a una valoración funcional y cuantitativa de estos10. Esta transición es posible a través de secuencias funcionales de RM basadas en imagen potenciada en difusión (DWI, Diffusion Weighted Imaging) e imagen de tensor de difusión (DTI, Diffusion Tensor Imaging)11. Dichas técnicas han sido aplicadas durante las últimas décadas con excelentes resultados, especialmente en el sistema nervioso central para la valoración de patología isquémica y tumoral, entre otras12. La extrapolación de estas técnicas para el estudio de los NNPP supone un reto tanto técnico como diagnóstico, ya que la semiología y parámetros derivados de estas han de ser evaluados según el contexto clínico y las características anatómicas de cada región a estudiar.
En este artículo actualizaremos los distintos tipos de secuencias morfológicas y funcionales, selectivas y no selectivas, para la valoración de los NNPP. También serán puestas al día las potenciales aplicaciones clínicas de las secuencias de RM-neurografía para la valoración no solo morfológica sino también fisiopatológica de los plexos y los NNPP.
RM-neurografía morfológicaLa valoración de los NNPP mediante secuencias no selectivas o selectivas de RM se denomina RM-neurografía. Se consideran no selectivas aquellas secuencias en las que no solo aparecen representados los NNPP, sino también estructuras óseas o musculares, mientras que en las selectivas, a través de distintos ajustes técnicos, se consiguen suprimir las estructuras de fondo y/o potenciar la señal de los NNPP para hacerlos más fácilmente identificables1.
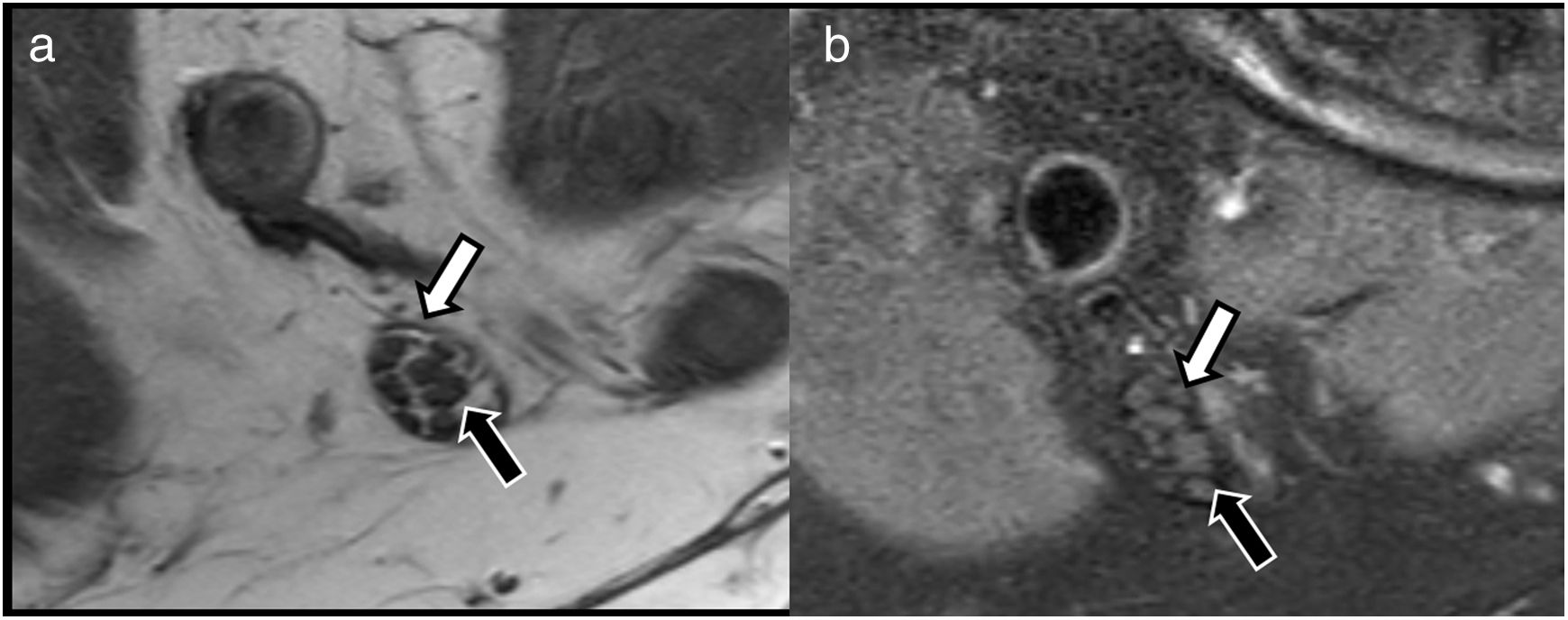
Estos estudios se basan en secuencias convencionales potenciadas en T1 y T2 con algunas particularidades técnicas. El uso de adquisiciones con vóxel isotrópico permitirán la obtención de secuencias 3D que podrán ser reconstruidas en distintos planos del espacio, incluidos planos oblicuos o curvos13. De esta forma se permite identificar el trayecto de los NNPP incluso en regiones anatómicas complejas como son los plexos o desfiladeros osteotendinosos14. Las secuencias potenciadas en T1 proporcionan un gran detalle sobre la estructura del nervio, ya que permiten delimitar con gran resolución los distintos fascículos que lo componen distinguiendo entre endoneuro, perineuro y epineuro, que a menudo contienen finas láminas de tejido conectivo y grasa (fig. 1). En la última década, la adquisición de secuencias altamente potenciadas en T2 con vóxel isotrópico, que asocian pulsos de supresión de la grasa, está permitiendo mejorar la resolución anatómica de los NNPP así como su contraste con las estructuras adyacentes10. Estos pulsos de supresión de la grasa suelen realizarse a través de secuencias SPAIR o 3D SPIR, las cuales proporcionan una adecuada relación señal/ruido, aunque presentan el inconveniente de obtener una adecuada supresión de la grasa lejos del isocentro de la adquisición debido a una menor homogeneidad del campo magnético. En estos casos, el uso de secuencias de supresión grasa basadas en técnicas Dixon puede ser una buena aproximación, ya que permite una supresión más homogénea de la grasa, siendo menos sensible a las heterogeneidades del campo magnético. Las técnicas Dixon permiten, además, obtener a través de una sola adquisición cuatro sets de imágenes (en fase, fuera de fase, solo agua y solo grasa), con el consecuente ahorro de tiempo de estudio que esto conlleva.
Valoración de la estructura de los nervios periféricos con secuencias de neurografía convencionales. A) Sección axial mediante secuencia T1 TSE. B) T2 con supresión grasa SPAIR del nervio tibial en el hueco poplíteo que muestra patrón fascicular preservado, fácilmente valorable debido al contenido de tejido conectivo y graso que separa el endoneuro del perineuro (flecha negra) y epineuro (flecha blanca).
Otras optimizaciones técnicas, tales como el uso de antenas multicanal, antenas con dedicación anatómica específica según el área a estudiar (incluyendo antenas de superficie), están permitiendo mejorar la calidad de los estudios logrando obtener secuencias isotrópicas de alta resolución. El uso de técnicas de adquisición en paralelo, tanto en equipos de 1.5T como especialmente en 3.0T, también ha de ser considerado para reducir el tiempo de exploración e incluso aumentar la relación señal/ruido de las adquisiciones y reducir los posibles artefactos.
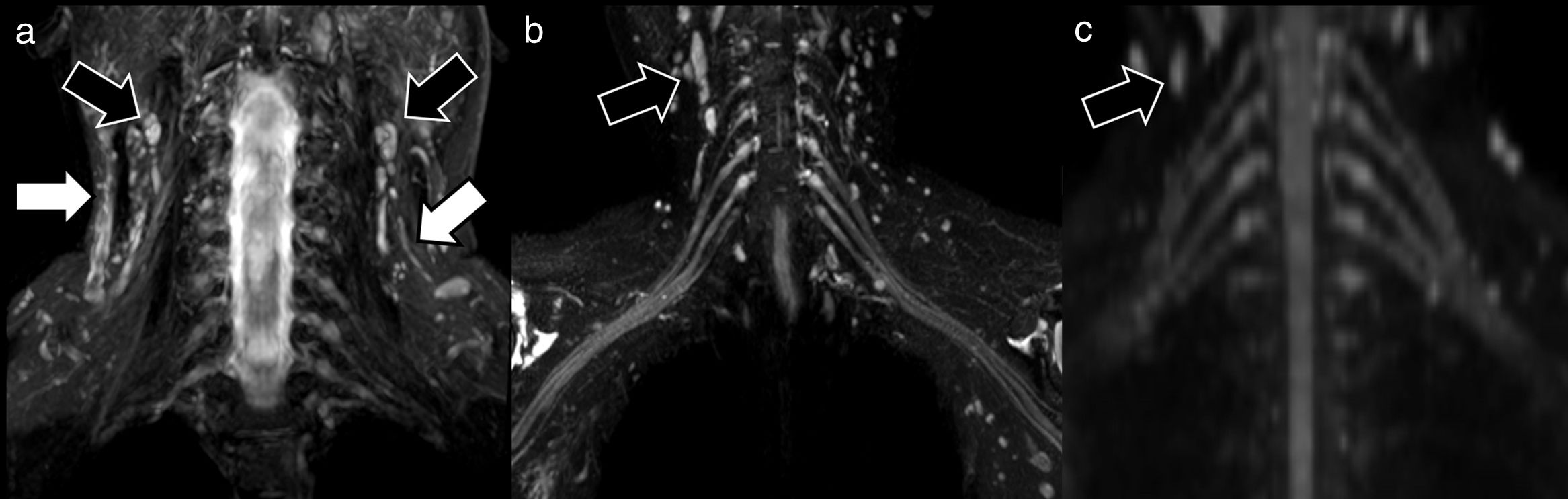
El uso de pulsos específicos de supresión de la señal en el interior de los vasos o la aplicación de gradientes de difusión con valores b bajos (50 s/mm2) forma parte de una nueva gama de secuencias técnicamente optimizadas para una valoración selectiva de los NNPP15. Mediante estas secuencias, se facilita la visualización de los NNPP disminuyendo la posibilidad de falsos positivos por la presencia de estructuras vasculares adyacentes (fig. 2). En el caso de la RM-neurografía morfológica, el uso de gadolinio queda limitado a circunstancias especiales en las que se sospeche patología infecciosa/inflamatoria o se necesite caracterizar lesiones tumorales3. En estos pacientes, la rotura de la barrera hematoneural condicionará la existencia de captaciones patológicas. Existe, de igual forma, una amplia semiología descrita para intentar caracterizar y diferenciar las distintas lesiones tumorales asociadas a NNPP, tales como los schwannomas, los neurofibromas y los tumores malignos de la vaina neural, o seudotumores como los neuromas, basada en el grado de desplazamiento de los fascículos nerviosos o la preservación de planos grasos con estructuras vecinas16.
Ejemplos de técnicas neurográficas para la valoración de plexo braquial. Las secuencias morfológicas basadas en adquisiciones con supresión grasa (A), STIR coronal en este caso, permiten valorar los troncos y raíces del plexo braquial, pero de manera no selectiva, ya que también se representan otras estructuras como músculos, vasos (flechas blancas), hueso o estructuras linfáticas (flechas negras). En el caso de las técnicas híbridas como el 3D Nerve View (plano coronal) (B) el uso de pulsos selectivos de supresión de la señal procedente de los vasos (fuente principal de falsos positivos) permite una valoración más precisa de los nervios; no obstante, no elimina el resto de estructuras, como los ganglios linfáticos, flechas negras. Las secuencias selectivas funcionales, DWI con reconstrucción MPR en coronal (C) representan de manera prácticamente exclusiva los nervios periféricos (con excepción de algunos ganglios linfáticos, flechas negras, los cuales muestran igualmente restricción fisiológica de la difusión en el plano axial) con adecuada supresión de la señal de fondo.
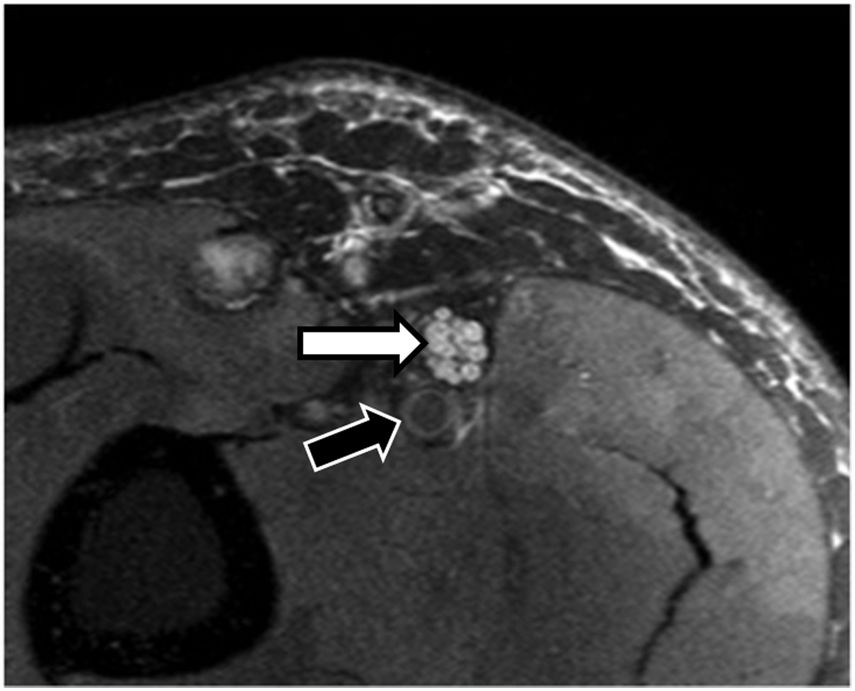
La apariencia de los NNPP patológicos en los estudios de RM-neurografía puede variar en función de distintos escenarios clínicos (compresión, tracción, sección, inflamación e infiltración). Como norma general, un NP patológico mostrará un aumento en su diámetro, así como un incremento en su intensidad de señal en secuencias potenciadas en T2 que se hará más evidente si se aplican pulsos de supresión de la grasa. Dicho incremento de intensidad de señal y volumen del nervio puede ser fácilmente evaluado si se compara con otros nervios adyacentes o incluso con el paquete vascular (arteria y vena) que suelen acompañar al nervio de interés y que pueden servir como referencia interna17. Por ejemplo, para el nervio ciático, un aumento de la ratio del diámetro entre dicho nervio y el vaso superior a 0,89 debe ser considerado como patológico18. Este aumento en la intensidad de señal y diámetro se debe principalmente a un incremento en el agua existente entre los distintos fascículos nerviosos como consecuencia de congestión venosa, edema, isquemia y en última instancia cambios por degeneración walleriana19 (fig. 3).
Varón de 38 años que acude por parestesias en territorio del nervio mediano izquierdo. Se realizó estudio mediante secuencia DP SPAIR axial que muestra un engrosamiento fascicular del nervio mediano (flecha blanca). Se aprecia un incremento de volumen e intensidad de señal del nervio con respecto al vaso adyacente (flecha negra) compatible con neuritis con diagnóstico de vasculitis inespecífica en biopsia.
Variaciones en la localización anatómica esperable de cada NP o la presencia de adherencias con estructuras osteotendinosas vecinas harán sospechar la existencia o no de un NP patológico20. En función del grado de afectación del NP, en el caso de patología traumática, Seddon y posteriormente Sunderland establecieron una clasificación del tipo de daño neural21,22. De esta forma, el grado más leve de afectación es la neuroapraxia (grado I), en la que se puede identificar discreta alteración de la intensidad de señal del NP en secuencias potenciadas en T2 (sin y con supresión de la grasa). A continuación, se encuentra la axonotmesis, en la que existe daño axonal con probables cambios por degeneración walleriana, aunque con continuidad del NP preservada. Según Sunderland, la axonotmesis se puede subdividir en tres estadios en función de si la estructura dañada corresponde al axón (grado II), al endoneuro (grado III) o al perineuro (grado IV). Por último, se halla la neurotmesis, en la que existe una discontinuidad en el NP, normalmente por sección o tracción del mismo con daño del epineuro (grado V)23. Como normal general, las lesiones de grado IV y V requerirán cirugía.
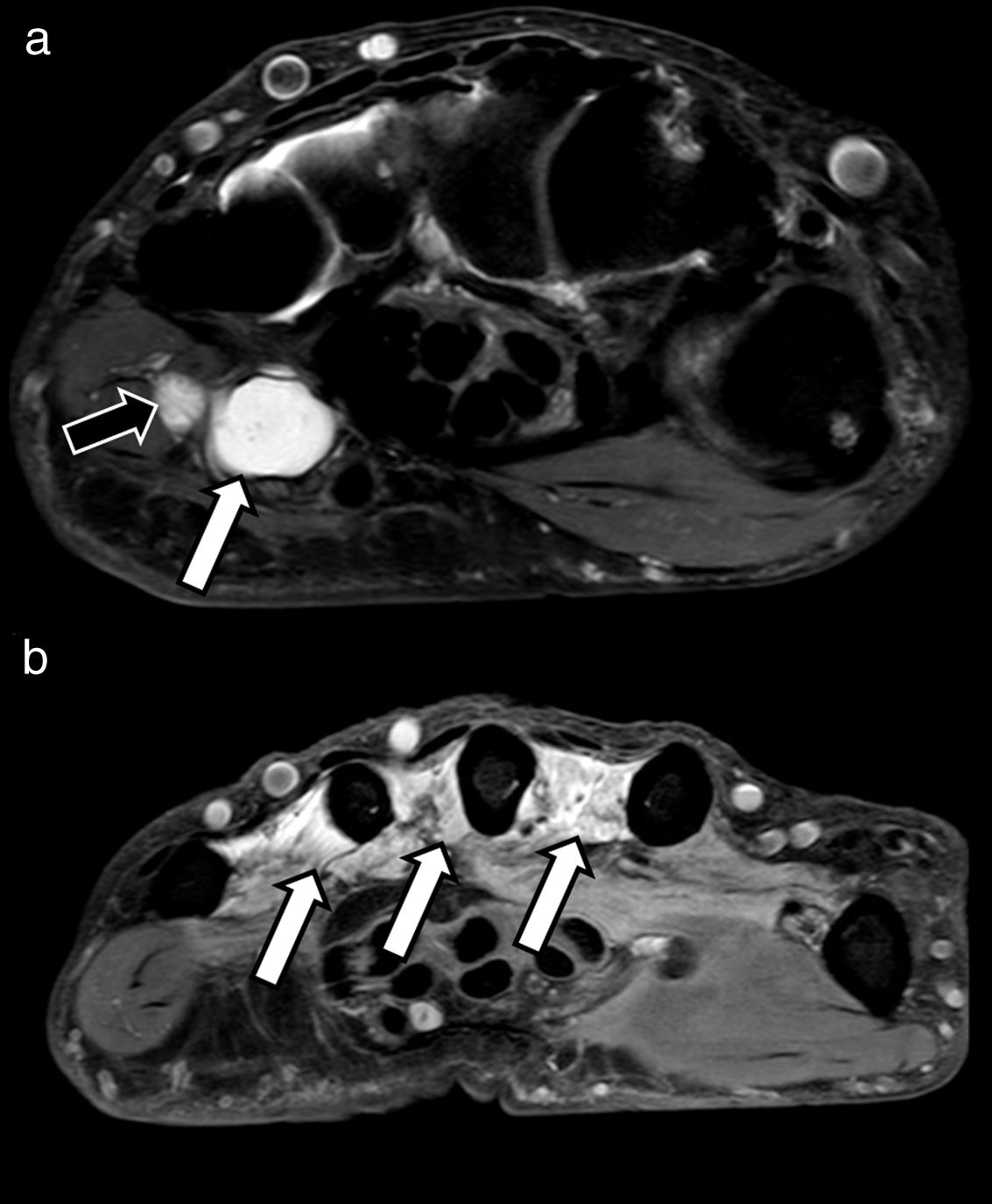
Un signo secundario que suele acompañar a los NNPP patológicos es la existencia de un mapa de denervación muscular (aguda, subaguda o crónica) debido a cambios en la intensidad de señal en los grupos musculares distales dependientes del mismo, especialmente en los casos en los que exista lesión de un nervio mixto con función sensitiva y motora24 (fig. 4). Dicho mapa de denervación muscular puede orientar en muchas ocasiones acerca del tipo de NP afectado.
Compresión extrínseca de nervio cubital en varón de 32 años con pérdida de fuerza en los dedos de la mano derecha de meses de evolución. A) El estudio mediante secuencias DP SPAIR muestra lesión compatible con ganglión (flecha blanca) en la entrada del canal de Guyon que contacta con nervio cubital (flecha negra), el cual se muestra engrosado e hiperintenso, sugerente de neuroapraxia por compresión extrínseca. B) En el mismo estudio se pueden identificar extensa alteración de la intensidad de señal de los músculos lumbricales (flechas blancas) compatible con cambios por denervación muscular subaguda.
Esta aproximación se encuadra dentro de los estudios de RM-neurografía selectivos y se basa en la aplicación de secuencias de DWI y DTI. Las secuencias DWI son capaces de valorar y cuantificar, in vivo, el movimiento de las moléculas de agua en el interior de las estructuras biológicas. Este movimiento se puede encontrar limitado o no por la presencia de un mayor número de barreras biológicas (membranas) o por la existencia de un incremento o disminución en el espacio extracelular12.
En el caso de la valoración de los NNPP, su propia estructura macro y microscópica también es susceptible de ser estudiada mediante técnicas basadas en difusión. Los NNPP poseen una estructura altamente organizada con existencia de numerosas barreras como son el epineuro, el perineuro y el endoneuro. Estas capas, junto con la presencia de las vainas de mielina en torno a los axones, condicionan la existencia de dos tipos de movimiento en el interior de los NNPP. El primero tiene lugar en el eje corto (perpendicular) del nervio y es un movimiento altamente limitado de las moléculas de agua debido a la existencia de las barreras fisiológicas referidas anteriormente. Dicho movimiento, conocido como difusión isotrópica, puede ser estudiado mediante secuencias DWI convencionales que son capaces de detectar esa limitación del movimiento del agua en el plano axial25.
El segundo tipo es el desplazamiento facilitado del agua a lo largo de los axones y del eje mayor del nervio. Dicho tipo de movimiento se conoce como difusión anisotrópica, en la que existe una dirección dominante de desplazamiento de las moléculas de agua. Esta propiedad es el fundamento que permite que los NNPP puedan ser estudiados usando técnicas basadas en DTI de forma similar a los tractos de sustancia blanca del sistema nervioso central. De esta forma se podrán realizar representaciones en 3D neurográficas de dichos NNPP valorando su relación tanto con estructuras vecinas como con lesiones intrínsecas y extrínsecas26 (fig. 5).
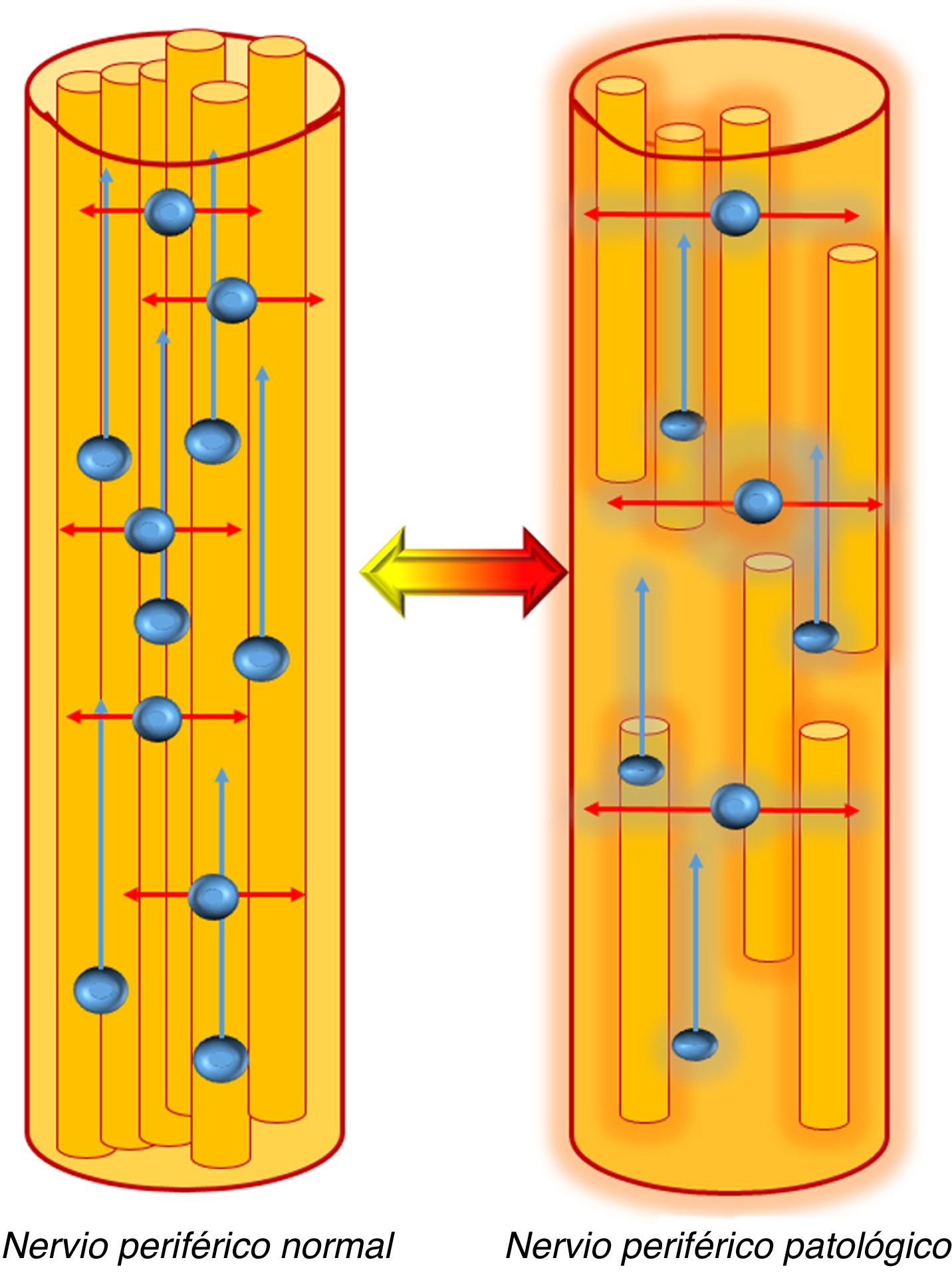
Comportamiento de las moléculas de agua en el interior de los nervios periféricos. En un nervio periférico normal, la presencia de barreras fisiológicas como las vainas de mielina y la propia estructura en capas de los nervios periféricos limita el movimiento del agua en el plano axial (transversal, flechas rojas) lo que permite que sean estudiados mediante secuencias DWI clásicas mostrando de manera fisiológica restricción de la difusión en dicho plano. Además, existe un movimiento facilitado de las moléculas de agua en el interior de los nervios periféricos en el eje mayor de los mismos (flechas azules). Dicha difusión dominante (anisotrópica) en el eje mayor del nervio permite que estas estructuras sean estudiadas mediante secuencias DTI.
En un nervio periférico patológico, la existencia de un daño intrínseco o extrínseco en la estructura de dicho nervio supondrá la presencia de edema con incremento del espacio extracelular o pérdida de mielina, en cuyo caso existirá un incremento en la difusión del agua en el plano axial (flechas rojas), que se reflejará como aumento de los valores del coeficiente de difusión aparente (ADC)/difusividad media y de la difusividad radial (DR), así como una disminución en el nivel de organización axonal que asociará descenso de los valores de fracción de anisotropía (FA). Este proceso puede ser reversible si se recupera el daño neural, en cuyo caso se identificará una normalización de los valores referidos con incremento de la FA y disminución del ADC/difusividad media y difusividad radial.
En cuanto a las especificaciones técnicas, la secuencia de DWI-neurografía está basada en la clásica imagen echo-planar (EPI) bajo la modalidad de Single Shot. La mayoría de las publicaciones recomiendan adquirir, en el caso de los estudios de neurografía basada en difusión, valores b máximos de entre 600 y 800 s/mm2,7,27. De esta forma se permite identificar los NNPP, raíces o troncos de plexos con una adecuada supresión de la señal de fondo del resto de estructuras. No obstante, en determinadas áreas anatómicas, como es el caso del cuello o la pelvis, existen estructuras que presentan de manera fisiológica un incremento relativo en la intensidad de señal en secuencias DWI, como es el caso de las adenopatías, anejos o vasos con flujo lento como las varices pélvicas. Por ello es fundamental un posprocesado minucioso mediante técnicas de reconstrucción multiplanar (MPR) para diferenciar entre ambas estructuras tomando como referencia la imagen morfológica28.
En lo que respecta a los estudios de DTI, también basados en adquisiciones Single Shot EPI, se usarán valores b máximos de 600-800 s/mm2 con un número de direcciones que oscilará entre las 6 y las 32. Esta secuencia es más sensible a las heterogeneidades del campo, las cuales se ven acentuadas en la valoración de determinadas áreas anatómicas como es el caso del plexo braquial. Esto es debido a la existencia de múltiples interfases entre agua, grasa, hueso y aire, y suponen un reto para la obtención de estudios de neurografía funcional con una adecuada calidad diagnóstica.
A la hora de decidir qué tipo de estudio realizar, DWI vs. DTI, se han de tener en cuenta algunas consideraciones previas. Los estudios de neurografía DWI permiten obtener imágenes de coberturas anatómicas más amplias, con una adecuada supresión de la señal de fondo en un menor tiempo de exploración. Los estudios de DTI requieren tiempos de exploración más prolongados, por lo que a priori deberían reservarse para realizar estudios dirigidos en determinadas zonas con una menor cobertura anatómica. Los estudios de DTI proporcionan una mayor cantidad de parámetros con respecto a la neurografía con DWI como veremos a continuación. En cuanto al tipo de imán, como norma general, los estudios en equipos de 3T tendrán una mayor resolución espacial y necesitarán un menor tiempo de adquisición que en los de 1.5T; sin embargo, están sujetos a mayores artefactos por susceptibilidad27. Estos artefactos son más pronunciados en aquellas regiones anatómicas en las que exista una mayor heterogeneidad del campo magnético como ocurre en el plexo braquial. Como hemos comentado anteriormente, el uso de antenas específicas, que se ajusten adecuadamente a la anatomía del área de estudio, así como técnicas de adquisición en paralelo, contribuirá a disminuir dichos artefactos.
Además de permitir la visualización, desde un punto de vista morfológico, de los NNPP, las técnicas de neurografía derivadas de secuencias DWI y DTI tienen el valor añadido de aportar un gran número de parámetros cuantificables. Dichos parámetros, resultado del posproceso de los datos obtenidos, reflejan distintas características de los NNPP.
El coeficiente de difusión aparente (Apparent Diffusion Coefficient, ADC) se deriva de los estudios de DWI convencional. Dicho parámetro cuantifica el grado de libertad de movimiento de las moléculas de agua en el espacio extracelular, y se encuentra aumentado en aquellas circunstancias en las que exista un incremento en el agua entre los axones, por lo que permite cuantificar el edema en las lesiones de los NNPP. Si por el contrario existe una disminución del espacio extracelular, bien sea por fibrosis o por proliferación celular, como es el caso de los tumores de NNPP, dichos valores de ADC disminuirán16.
A través de la aplicación de gradientes de difusión en múltiples direcciones del espacio, los estudios de DTI permiten identificar los eigenvectors y calcular sus valores correspondientes (eigenvalues). A través de la combinación de estos eigenvalues, se derivan un mayor número de parámetros cuantificables en comparación con los estudios convencionales de DWI. Esto permite obtener una mayor información de las características fisiopatológicas de los NNPP. La tabla 2 enumera dichos parámetros y resume sus principales características. Entre ellos, los más estudiados y aplicables en la práctica diaria son la fracción de anisotropía (FA) y la difusividad radial (DR). La FA es considerada el marcador más sensible para detectar pérdida de la organización fascicular de los NNPP, y se encuentra disminuida cuando existe daño neural. La DR es considerada el marcado más específico de afectación de la vaina de mielina, que es la que determina la difusividad de las moléculas de agua en el eje corto (transverso, perpendicular o radial) del NP. Dicha DR aumentará en el caso de que exista daño o pérdida de la calidad de la mielina de los NNPP. Otro parámetro menos utilizado es la difusividad axial (DA), que equivale al eigenvalue mayor y refleja la conducción axonal a lo largo del NP. Esta DA hipotéticamente se verá disminuida distal al sitio de la lesión, especialmente en pacientes con daño de NP de grado IV y V de la clasificación de Sunderland. Por último, la difusividad media (DM) es considerada una aproximación más precisa al estado del espacio extracelular que el ADC, ya que considera para su cálculo los 3 eigenvalues principales. La DM se encontrará aumentada cuando haya incremento del espacio extracelular, como es el caso del edema, y disminuida en el caso de lesiones tumorales en las que la hipercelularidad de estas reduzca el espacio extracelular27.
Parámetros derivados del DTI para la valoración de nervios periféricos
| Fracción de anisotropía (FA) | Difusividad Media (DM) | Difusividad Axial (DA) | Difusividad Radial (DR) | |
|---|---|---|---|---|
| Unidades | 0-1 | mm2/s | mm2/s | mm2/s |
| Fórmula | 12λ1−λ22+λ2−λ32+λ3−λ12λ12+λ22+λ32 | λ1+λ2+λ33 | λ1=λ∥ | λ1=(λ2+λ3)/2 |
| Valoración | Organización fascicular | Compartimento extracelular | Integridad axonal | Integridad de la mielina |
ADC: coeficiente de difusión aparente; DTI: tensor de difusión; λ1: eigenvalue principal; λ2 λ3: eigenvalues menores.
En nuestra opinión hay que ser prudentes en el uso de dichos parámetros como puntos de corte para diferenciar entre NNPP sanos y patológicos a la hora de tomar decisiones tanto diagnósticas como terapéuticas. Hoy día son muy pocos los estudios de normalidad realizados para establecer valores umbrales de estos parámetros. En ocasiones se puede considerar como punto de referencia los parámetros derivados del mismo NP o raíz de plexo en el miembro contralateral aparentemente sanos. Hay que tener en cuenta que los valores pueden variar en función del tipo de imán usado, los valores b o el número de direcciones adquiridas.
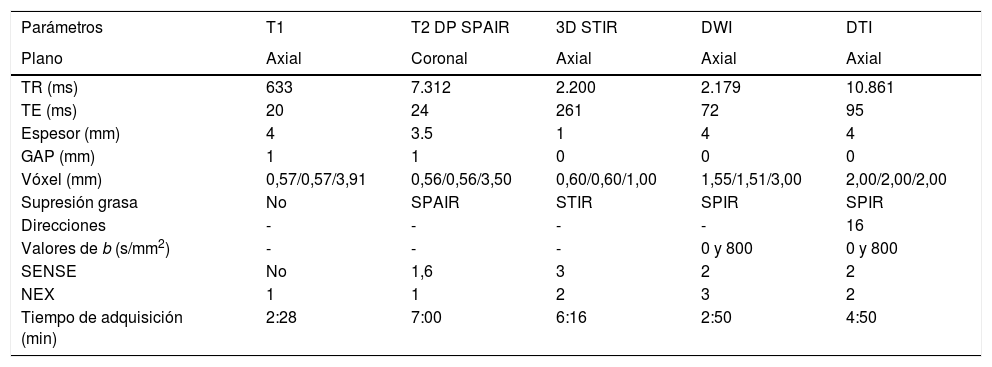
Aplicaciones clínicasLa aplicación de estudios de RM-neurografía tanto en su vertiente morfológica como a través del uso de técnicas avanzadas de DWI y DTI ha experimentado un gran crecimiento en los últimos años para la valoración de NNPP en casos de patología compresiva o traumática, como es el caso del nervio mediano en pacientes con síndrome de túnel carpiano, así como en otro tipo de atrapamiento nerviosos29,30. Asimismo, estas técnicas están demostrando resultados prometedores en el estudio de diversos tipos de neuropatías, incluyendo el seguimiento y monitorización de los cambios posquirúrgicos27,31. Los estudios de RM-neurografía también pueden ser usados para el estudio de las lesiones tumorales, ya que facilitan el diagnóstico diferencial de las mismas16. Con fines prácticos, en la tabla 3 se propone un protocolo básico para un adecuado abordaje diagnóstico de estas patologías tanto con técnicas morfológicas como funcionales. Algunos de estos parámetros podrán variar o necesitarán ser ajustados en función de las características técnicas de cada equipo de RM para obtener resultados interpretables y reproducibles a la hora de valorar los NNPP.
Protocolo básico de neurografía y parámetros de adquisición
| Parámetros | T1 | T2 DP SPAIR | 3D STIR | DWI | DTI |
|---|---|---|---|---|---|
| Plano | Axial | Coronal | Axial | Axial | Axial |
| TR (ms) | 633 | 7.312 | 2.200 | 2.179 | 10.861 |
| TE (ms) | 20 | 24 | 261 | 72 | 95 |
| Espesor (mm) | 4 | 3.5 | 1 | 4 | 4 |
| GAP (mm) | 1 | 1 | 0 | 0 | 0 |
| Vóxel (mm) | 0,57/0,57/3,91 | 0,56/0,56/3,50 | 0,60/0,60/1,00 | 1,55/1,51/3,00 | 2,00/2,00/2,00 |
| Supresión grasa | No | SPAIR | STIR | SPIR | SPIR |
| Direcciones | - | - | - | - | 16 |
| Valores de b (s/mm2) | - | - | - | 0 y 800 | 0 y 800 |
| SENSE | No | 1,6 | 3 | 2 | 2 |
| NEX | 1 | 1 | 2 | 3 | 2 |
| Tiempo de adquisición (min) | 2:28 | 7:00 | 6:16 | 2:50 | 4:50 |
El diagnóstico de lesión traumática o compresiva de los NNPP, incluidos los plexos braquial y lumbar, suele hacerse normalmente mediante secuencias neurográficas morfológicas32. Sin embargo, los estudios de neurografía basados en difusión son capaces de detectar anomalías funcionales en pacientes sin hallazgos relevantes en el estudio morfológico convencional27. Como normal general, la existencia de un proceso traumático o compresivo sobre un nervio periférico condiciona una desorganización de su estructura fibrilar, lo que se traduce en un descenso de los valores de FA y un incremento en la DR33. Dichos datos permiten cuantificar la gravedad del daño de los NNPP y de esta forma establecer un pronóstico, poder planificar el tratamiento a seguir y monitorizar la efectividad de dicho tratamiento34. Con respecto a las técnicas morfológicas de RM convencional y estudios de electrofisiología, las secuencias funcionales neurográficas permiten realizar un diagnóstico más precoz del tipo de lesión, previo a la existencia de cambios por denervación o de otra naturaleza en el resto de técnicas de imagen o test neurofisiológicos35. No obstante, serán necesarios estudios más amplios para poder validar los parámetros derivados de los estudios de DWI y DTI como potenciales biomarcadores de daño neural (fig. 6).
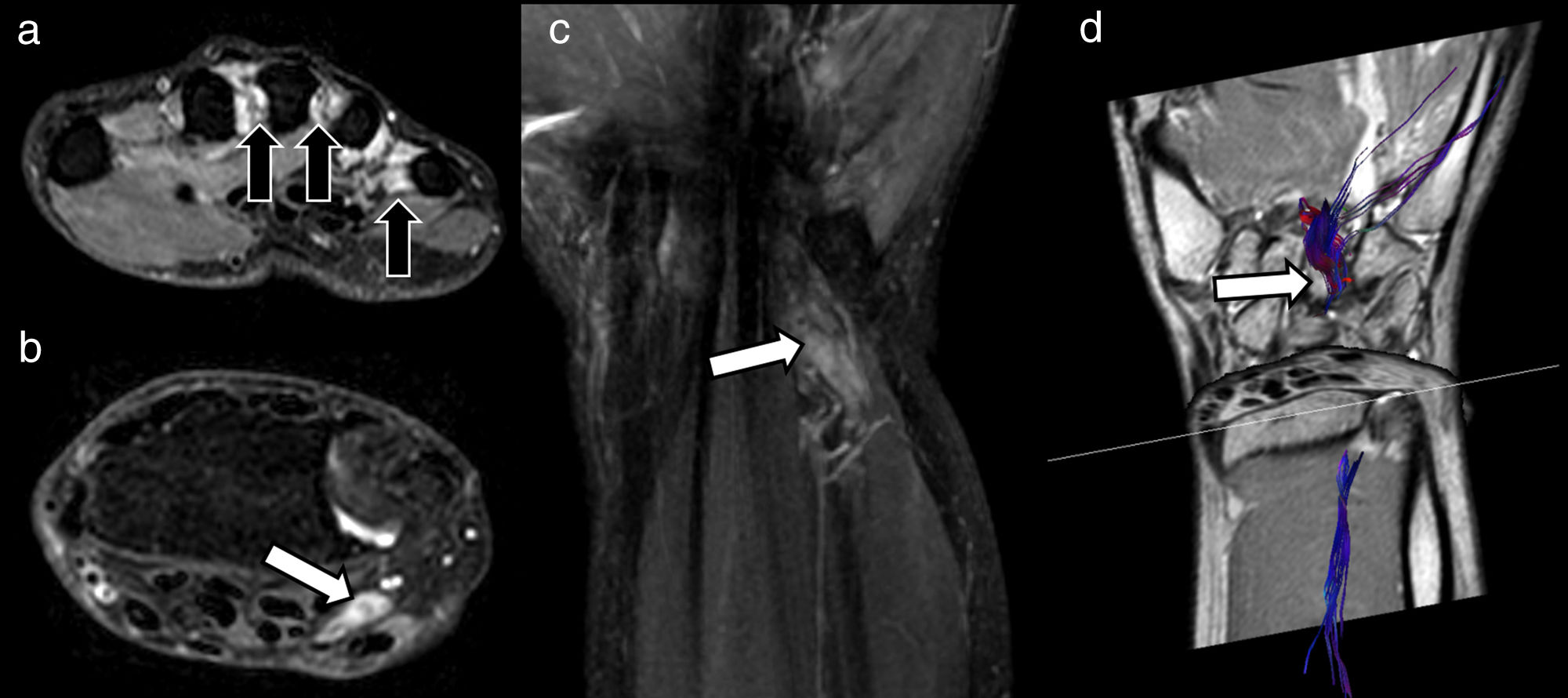
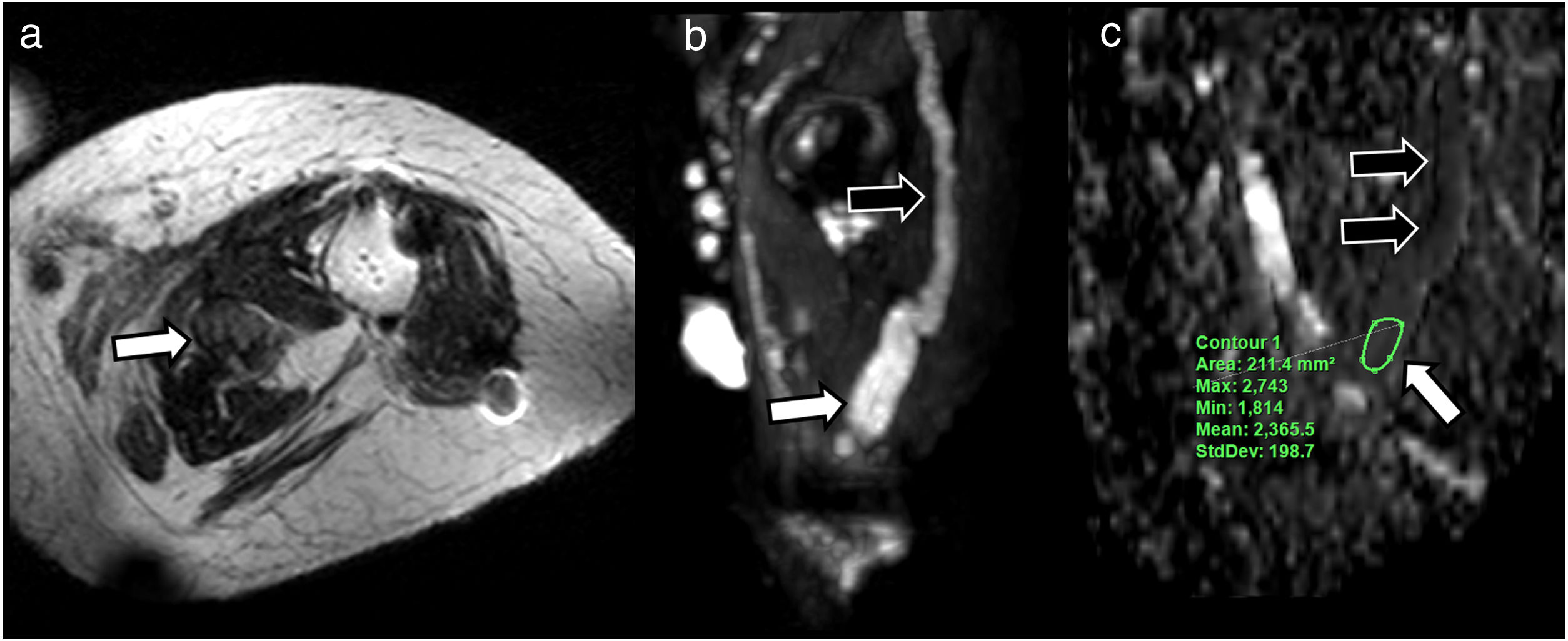
Varón de 47 años que acude para reevaluación de parestesias y pérdida de fuerza en territorio del nervio cubital de la mano derecha 3 meses después de herida inciso-contusa en cara volar de muñeca ipsilateral. A) El estudio morfológico mediante secuencias T2 Dixon solo agua axiales identifica signos de denervación subaguda/crónica en músculos lumbricales (flechas negras), con interrupción del trayecto de nervio cubital con presencia de pequeño neuroma terminal en cabo proximal (flecha blanca) (B), también valorable en la adquisición T2 Dixon solo agua coronal (C). Se solicitó valoración mediante neurografía basada en imágenes de tensor de difusión (DTI) (D) con vistas a planificación quirúrgica y predicción de respuesta a neurorrafia. La neurografía DTI más allá de demostrar la existencia de una solución de continuidad entre ambos segmentos del nervio cubital puede ayudar a valorar la viabilidad funcional del segmento distal (flecha blanca) con el fin de predecir una respuesta favorable a la cirugía. El hecho de que pueda ser representado mediante la reconstrucción neurográfica de DTI hace pensar que sus valores de fracción de anisotropía (FA) y, por ende, su estructura fascicular, se encuentra preservada sin claros cambios en sus parámetros que sugieran degeneración walleriana instaurada.
La valoración del nervio mediano en general, pero especialmente en el estudio del síndrome del túnel carpiano, ha sido clásicamente un reto para la radiología. Numerosos estudios han demostrado la utilidad de la ecografía como herramienta válida para realizar una primera aproximación, y en muchas ocasiones proporcionar el diagnóstico definitivo36. Sin embargo, en algunos pacientes no se encuentra causa aparente de compresión del nervio mediano incluso mediante RM convencional pese a mostrar claros síntomas. Es aquí en donde las técnicas de neurografía basadas en difusión están mostrando resultados prometedores en el diagnóstico y monitorización tras el tratamiento29,37. Diversos estudios han demostrado que existe una disminución de hasta dos desviaciones estándar por debajo de lo normal en los valores de FA en aquellos pacientes con síntomas compatibles con síndrome del túnel carpiano, hallazgos que sugieren que debido a la compresión, el nervio pierde su estructura fibrilar fisiológica con el consecuente incremento del espacio extracelular y desorganización axonal secundaria al edema y/o congestión38. Por otra parte, estudios recientes han valorado las variaciones en FA y ADC en aquellos pacientes sometidos a cirugía liberadora del nervio mediano con estudios antes y después de la intervención. Se ha demostrado que existe un incremento progresivo 6 semanas e incluso hasta 6 meses después de la operación de los valores de FA en aquellos pacientes intervenidos, acompañado de un descenso de los valores de ADC39.
En los últimos años existe un creciente interés en la aplicación de técnicas avanzadas de neurografía basadas en DTI para la valoración y monitorización del tratamiento quirúrgico de los NNPP31. Técnicas quirúrgicas tales como la neurólisis, injertos, transposiciones o neurotizaciones pueden ser valoradas adecuadamente mediante neurografía basada en DTI, proporcionando información adicional acerca del resultado, no solo morfológico, sino funcional de la cirugía. La viabilidad de las suturas o injertos así como de las complicaciones derivadas más frecuentes (dehiscencias, fibrosis o neuromas) pueden ser estudiadas con estas técnicas de imagen avanzada40.
El nervio ciático, uno de los NNPP más importantes del organismo tanto por su longitud como por sus implicaciones en la práctica clínica habitual, también ha sido valorado con técnicas de RM-neurografía. La presencia de lesiones intrínsecas o extrínsecas a nivel lumbar o a lo largo de su trayecto pélvico o extrapélvico puede condicionar la existencia de síntomas relacionados con la compresión del mismo. En los últimos años ha aumentado el interés por la valoración del síndrome piramidal y la compresión subglútea del ciático como causa de síntomas relacionados con la neuropatía ciática en pacientes sin aparente patología discal asociada41. La existencia de un músculo piramidal accesorio o la hipertrofia de este, que por ejemplo tiene lugar en corredores de fondo, puede generar una compresión sobre el nervio ciático a su paso que justifique la sintomatología del paciente. Esta valoración se realiza normalmente mediante estudios de RM convencional42,43. Sin embargo, en numerosas ocasiones, los estudios morfológicos no revelan ninguna anomalía que justifique la clínica. Es aquí donde las técnicas de neurografía basadas en difusión pueden aportar una información adicional que refleje las características funcionales del nervio ciático a su paso por el foramen ciático.
En estos pacientes, las secuencias de RM-neurografía basadas en difusión, a través de reconstrucciones de máxima intensidad de proyección (MIP) facilitan la valoración del nervio en todo su trayecto detectando de forma cualitativa diferencias en cuanto a la intensidad de señal del nervio afectado con respecto al contralateral. Además, en el punto de compresión, el nervio mostrará unos valores de ADC mayores que en el resto debido a la coexistencia de edema44.
El plexo braquial y el lumbosacro también han sido estudiados mediante secuencias neurográficas basadas en DWI y DTI45,46. Los estudios con DTI han demostrado una potencial utilidad en la valoración de lesiones traumáticas y neoplásicas de las raíces de plexo braquial y lumbar, así como de las lesiones derivadas de patología degenerativa discal47. En cuanto a la radiculopatía lumbar, varios estudios han evaluado el uso del DTI en la valoración de la FA y ADC de las raíces nerviosas lumbares en pacientes con patología discal, obteniendo un descenso significativo en la FA y un aumento en el ADC de las raíces afectadas comparadas con las contralaterales48,49. Esta valoración cuantitativa puede constituir una herramienta en un futuro no muy lejano para detectar alteraciones funcionales en las raíces lumbares en aquellos pacientes con sintomatología, aunque sin hallazgos relevantes en el estudio de rutina (fig. 7).
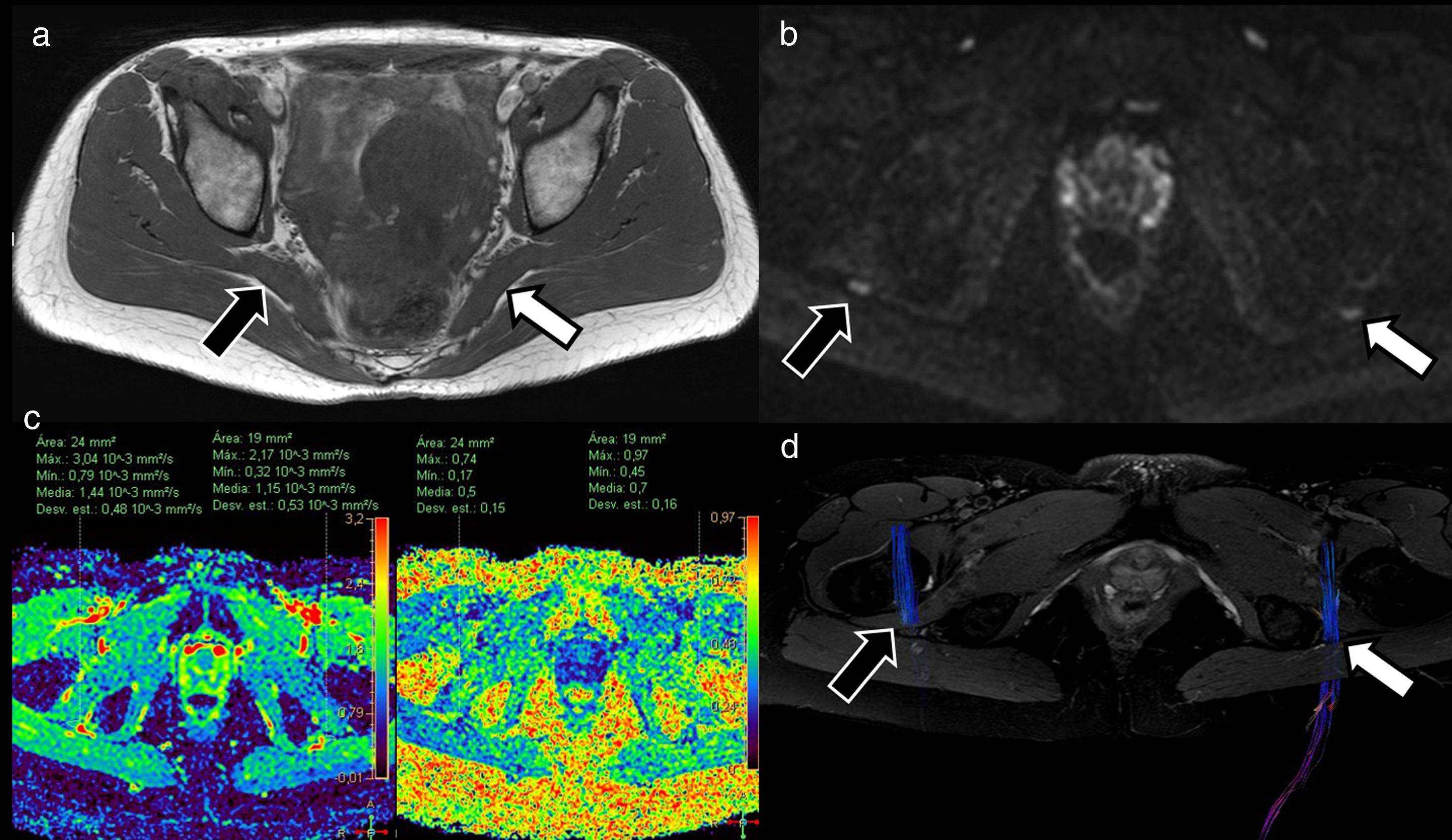
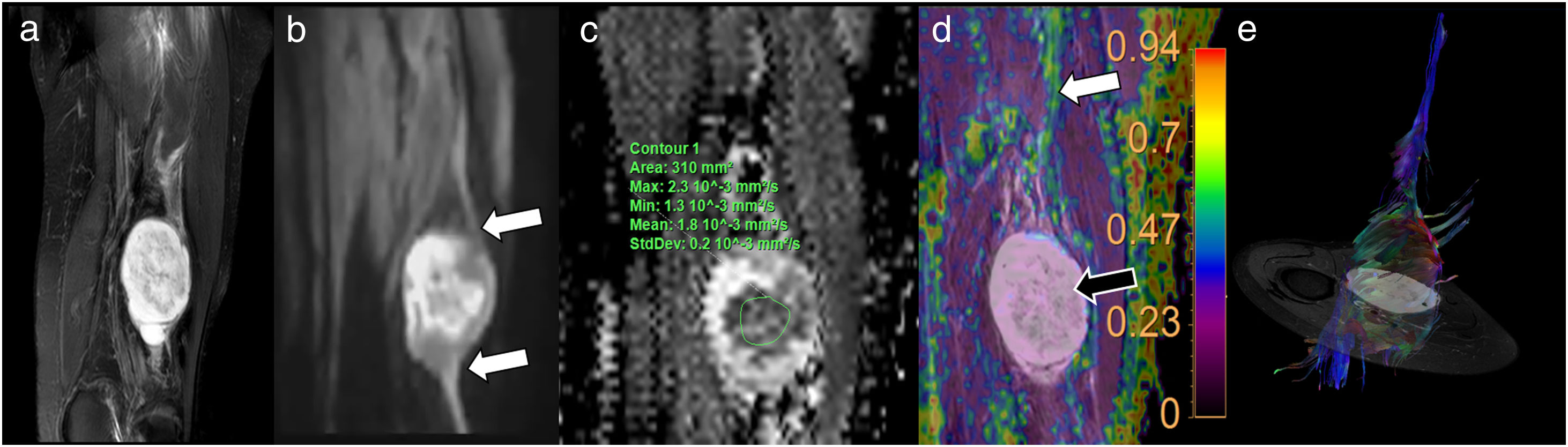
Mujer de 41 años que presenta cuadro clínico compatible con síndrome piramidal derecho. El estudio morfológico con secuencia axial T1 TSE (A) muestra ligero engrosamiento asimétrico del músculo piramidal derecho (flecha negra) con respecto al izquierdo (flecha blanca). El estudio de neurografía basada en secuencias potenciadas en difusión (DWI) (B) identificó ligero incremento asimétrico en la intensidad de señal del nervio ciático derecho (flecha negra) sobre el izquierdo (flecha blanca) en la salida del foramen ciático. El estudio de neurografía mediante tensor de difusión (DTI) (C) permitió demostrar incremento en los valores de difusividad media del nervio ciático derecho (1,44×10-3 mm2/s) con respecto al izquierdo (1,15×10-3 mm2/s) y descenso en la fracción de anisotropía (FA) del nervio ciático derecho (0,5) con respecto al izquierdo (0,7), hallazgos que sugieren la existencia de edema con incremento de espacio extracelular y pérdida parcial de organización fascicular, compatibles con neuroapraxia del ciático derecho. La reconstrucción neurográfica de los estudios de DTI (D) (basada principalmente en el valor umbral de FA) confirma dicha asimetría con menor representación del nervio ciático derecho (debido a presentar valores FA disminuidos) con respecto al izquierdo.
Los estudios de neurografía funcional también pueden ayudar a valorar diversos tipos de neuropatías periféricas de naturaleza infecciosa, inflamatoria o metabólica a través de los parámetros derivados de dichas técnicas. En estos casos, el objetivo no es valorar la integridad o no de los fascículos nerviosos, sino intentar caracterizar si la patología afecta predominantemente a la conducción axonal o a la integridad de las vainas de mielina como complemento a los datos clínicos, analíticos y electrofisiológicos. De esta forma se pueden detectar, por ejemplo, cambios en pacientes con neuropatía diabética o la polineuropatía crónica inflamatoria desmielinizante de una manera más exacta, pudiendo monitorizar la evolución de estas enfermedades o valorar su respuesta al tratamiento. En el caso de estas patologías, la existencia de una pérdida de mielina bien primaria o secundaria como ocurre en la diabetes debido al daño isquémico de los vasa nervorum, los estudios de neurografía basados en DTI pueden detectar, además de descenso en la FA, incrementos en los valores de difusividad radial como parámetro más específico, incluso en nervios con estructura morfológica aparentemente normal5,50 (fig. 8).
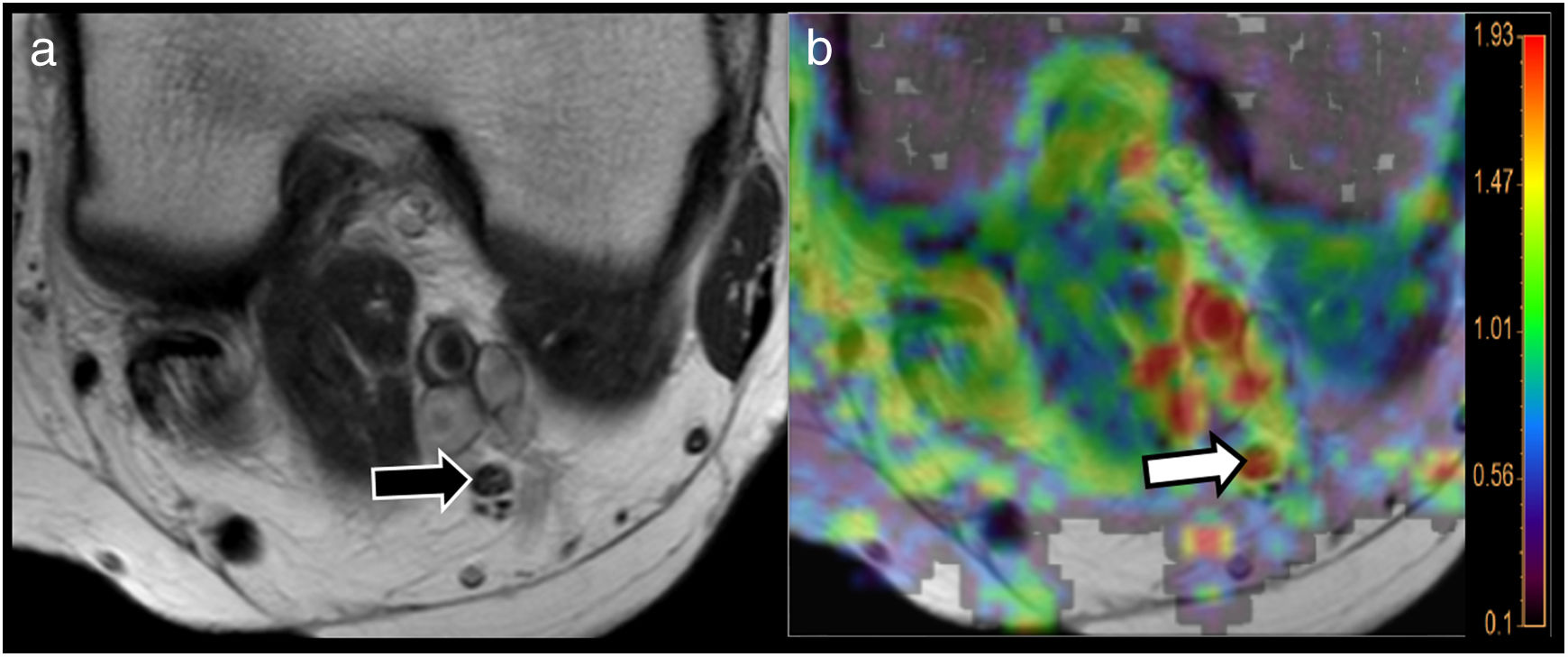
Utilidad de la RM-neurografía mediante tensor de difusión (DTI) para la valoración de neuropatías. Mujer de 64 años con diabetes tipo 2 que refiere parestesias en miembros inferiores de 1 año de evolución. La secuencia T2 TSE (A) a nivel de hueco poplíteo identificó nervio tibial de características morfológicas preservadas (flecha negra). El mapa de difusividad radial (DR) derivado del estudio de RM-neurografía mediante DTI mostró incremento en los valores DR de dicho nervio (flecha blanca señalando área de tonalidad roja en mapa paramétrico superpuesto a imagen morfológica), por encima de 1,9×10-3 mm2/s (véase escala de color adjunta a la figura) sugestiva de afectación de las vainas de mielina. Recordemos que uno de los principales mecanismos de la neuropatía diabética reside en la pérdida de mielina secundaria al daño microvascular de dicha patología.
La ventaja que aporta el DTI a través de la neurografía con la visualización en 3D del trayecto de los NNPP está suponiendo un gran avance en la valoración de la patología tumoral nerviosa. De esta forma se permite especialmente demostrar la continuidad o grado de relación de la lesión a estudio con las raíces o troncos del plexo o NP del que dependa, con lo cual el diagnóstico diferencial de dicha lesión se reduce sensiblemente51. En segundo lugar, una vez demostrada su dependencia, los estudios mediante tractografía permiten evaluar la relación de las fibras nerviosas con dicha lesión, valorando la posible destrucción de estas, su desplazamiento o desorganización. En el caso de los neurofibromas, por ejemplo, la lesión suele provocar una afectación fusiforme del nervio con una pérdida difusa de fibras. Sin embargo, el schwannoma suele asociar un desplazamiento excéntrico de los fascículos nerviosos16,52 (fig. 9). Otro tipo de lesiones relacionadas con los NNPP cuyo estudio es posible mediante estas técnicas son los neuromas de continuidad o terminales asociados a lesiones traumáticas53.
Paciente de 57 años que refiere sensación de masa palpable en cara posterior de muslo derecho. El estudio de resonancia magnética convencional mediante secuencia coronal STIR (A) muestra una masa fusiforme, sólida, que se encuentra en íntima relación con el trayecto del nervio ciático. La reconstrucción neurográfica mediante técnicas de reconstrucción multiplanar (MPR) de la adquisición de imagen potenciada en difusión (DWI) (B) confirma que existe continuidad morfológica y funcional con la lesión referida (flechas blancas), la cual muestra valores de coeficiente de difusión aparente (ADC) mínimos de 1,3×10-3 mm2/s (C). Se complementa exploración con estudio de neurografía con tensor de difusión (DTI) que muestra una marcada disminución de los valores de fracción de anisotropía (FA), próximos a 0 (flecha negra) comparado con el resto del nervio, 0,6, codificado en verde-amarillo (flecha blanca) (D) debido a ausencia de organización fibrilar en el interior de la lesión y disposición excéntrica de los fascículos nerviosos en torno a la lesión principal en la reconstrucción neurográfica (E), siendo la lesión sugerente de schwannoma.
Como norma general, los tumores malignos presentan una mayor población celular que predomina sobre el espacio extracelular, lo que supone valores más bajos de ADC y también de FA, ya que existe un menor grado de organización fibrilar (fig. 10). Sin embargo, los tumores benignos como los neuromas, los neurofibromas o los schwannomas suelen mostrar valores más elevados de ADC, por encima de 1,1×10-3 mm2/s16. Mediante los estudios de neurografía se permite igualmente valorar la invasión de estructuras nerviosas por otras lesiones tumorales o cambios posradioterapia como es el caso del plexo braquial54.
Varón de 33 años con cirugía de amputación de miembro inferior izquierdo por osteosarcoma. La secuencia axial T2 TSE (A) muestra una lesión nodular próxima al lecho quirúrgico (flecha blanca) de intensidad de señal heterogénea. Se realizó estudio de RM-neurografía basada en imagen potenciada en difusión (DWI) con reconstrucción multiplanar sagital (B) que muestra continuidad anatómica y funcional del nervio ciático con la lesión referida (flechas negras). La reconstrucción sagital del mapa ADC (C) muestra valores de 1,8×10-3 mm2/s siendo compatible con neuroma terminal de amputación.
La valoración de los NNPP mediante técnicas de imagen está experimentado un importante crecimiento gracias al desarrollo de secuencias específicas para su valoración. El uso de técnicas de RM morfológicas y funcionales permite caracterizar las lesiones que afectan a los NNPP con una elevada precisión. Las secuencias basadas en DWI y DTI proporcionan información cuantitativa adicional a través de parámetros tales como la FA o la DR que permiten incrementar la sensibilidad y la especificidad de los estudios de RM-neurografía. No obstante, estas técnicas deben ser completamente validadas a través de estudios adicionales.
Autoría- 1.
Responsable de la integridad del estudio: TMN y RB.
- 2.
Concepción del estudio: TMN.
- 3.
Diseño del estudio: TMN.
- 4.
Obtención de los datos: TMN y RB.
- 5.
Análisis e interpretación de los datos: TMN y RB.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: TMN y RB.
- 8.
Redacción del trabajo: TMN y RB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: TMN y RB.
- 10.
Aprobación de la versión final: TMN y RB.
Los autores declaran no tener ningún conflicto de intereses.