El cáncer gástrico es el quinto cáncer más frecuente en el mundo. El subtipo histológico más frecuente es el adenocarcinoma. Para su estadificación se utiliza la 8.ª edición de la clasificación TNM de la American Joint Comittee on Cancer. Los ligamentos perigástricos, el mesenterio, el omento y los espacios potenciales entre los revestimientos peritoneales parietal y visceral, son estructuras con gran implicación en la estadificación. La diseminación de la enfermedad se ve afectada por la localización del tumor en el estómago, así como por la anatomía ligamentaria y linfática. La tomografía computarizada es la modalidad de imagen de elección para la estadificación clínica preoperatoria del cáncer gástrico, y es esencial para la planificación del tratamiento. Existen múltiples vías de diseminación en el cáncer gástrico que se deben conocer para poder realizar una correcta valoración radiológica: linfática, subperitoneal, invasión directa, transperitoneal, hematógena e invasión venosa extramural.
Gastric cancer is the fifth most common cancer in the world. The most common histologic subtype is adenocarcinoma. Gastric adenocarcinomas are staged using the American Joint Committee on Cancer's 8th TNM classification. The perigastric ligaments, mesentery, omentum, and potential spaces between the parietal and visceral peritoneal linings are important structures for staging. The spread of disease is influenced by the location of the tumor within the stomach, as well as by the anatomy related to the ligaments and lymph vessels. CT is the imaging modality of choice for the preoperative clinical staging of gastric cancer, and it is essential for planning treatment. To be able to do an adequate imaging workup, radiologists need to know the different pathways through which gastric cancer can spread: lymphatic, subperitoneal, direct invasion, transperitoneal, hematogenous, and extramural venous invasion.
El adenocarcinoma gástrico (AG) es una neoplasia maligna epitelial con origen en las glándulas de la mucosa gástrica y corresponde al 95% de los tumores gástricos malignos1. Es el quinto cáncer más frecuente en el mundo y la cuarta causa más frecuente de muertes por cáncer2. La edad media al diagnóstico es de 68 años y es más frecuente en hombres que en mujeres (relación 2:1)1,3. Su incidencia es mayor en Asia oriental (sobre todo en Japón) y Europa oriental2. El principal factor de riesgo es la infección por Helicobacter pylori (HP), sobre todo en el AG no cardial2,3. Según varios estudios, existe un riesgo persistente incluso tras la curación de la infección por posibles cambios histológicos en la mucosa4–6. Otros factores de riesgo a tener en cuenta son la escasa ingesta de fruta y verduras, el elevado consumo de sal y carne procesada, el consumo de alcohol y tabaco, el síndrome metabólico o la gastrectomía parcial previa. En los AG cardiales, los principales factores de riesgo son la obesidad y el reflujo gastroesofágico2,3. Aproximadamente un 30% de los AG se localizan en el fundus y el cardias, un 30% en el cuerpo gástrico, un 30% en el antro y un 10% se presenta como una enfermedad infiltrativa difusa1. Las clasificaciones histológicas más utilizadas son la de Lauren y la de la World Health Organization (WHO). La primera, y más utilizada, divide los AG en tipo intestinal (54%), difuso (32%) e indeterminado. El AG de tipo intestinal es más frecuente en ancianos, hombres, en el antro, y suele estar relacionado con la metaplasia intestinal y el HP2,7–9. El tipo difuso es más frecuente en jóvenes y discretamente más frecuente en mujeres. Afecta más al cuerpo y tiene peor pronóstico2,7–9. La clasificación de la WHO separa los AG tubular, papilar y mucinoso (que equivaldrían al tipo intestinal) del carcinoma con células en anillo de sello y el carcinoma pobremente cohesivo (que equivaldrían al tipo difuso)7,9.
Los objetivos del artículo son realizar una revisión del AG utilizando la última clasificación TNM de la AJCC y revisar las vías de diseminación y su importancia en la estadificación tumoral.
Recuerdo anatómicoAnatómicamente, el estómago se divide en 5 partes: cardias, fundus, cuerpo, antro y píloro. La pared gástrica está formada por 5 capas: mucosa (que a su vez de divide en epitelio, lámina propia y muscular de la mucosa), submucosa, muscular propia, subserosa y serosa. El grosor normal de la pared es de 5mm cuando el estómago está distendido y 10mm cuando está poco distendido10,11. Aunque la ecoendoscopia puede diferenciar las 5 capas, en la tomografía computarizada (TC) solo pueden visualizarse 3. La mucosa se ve como una fina capa hiperdensa (1-3mm), la submucosa como una capa hipodensa intermedia de grosor variable, y la muscular, subserosa y serosa se observan como una única capa tenuemente hiperdensa10,12,13.
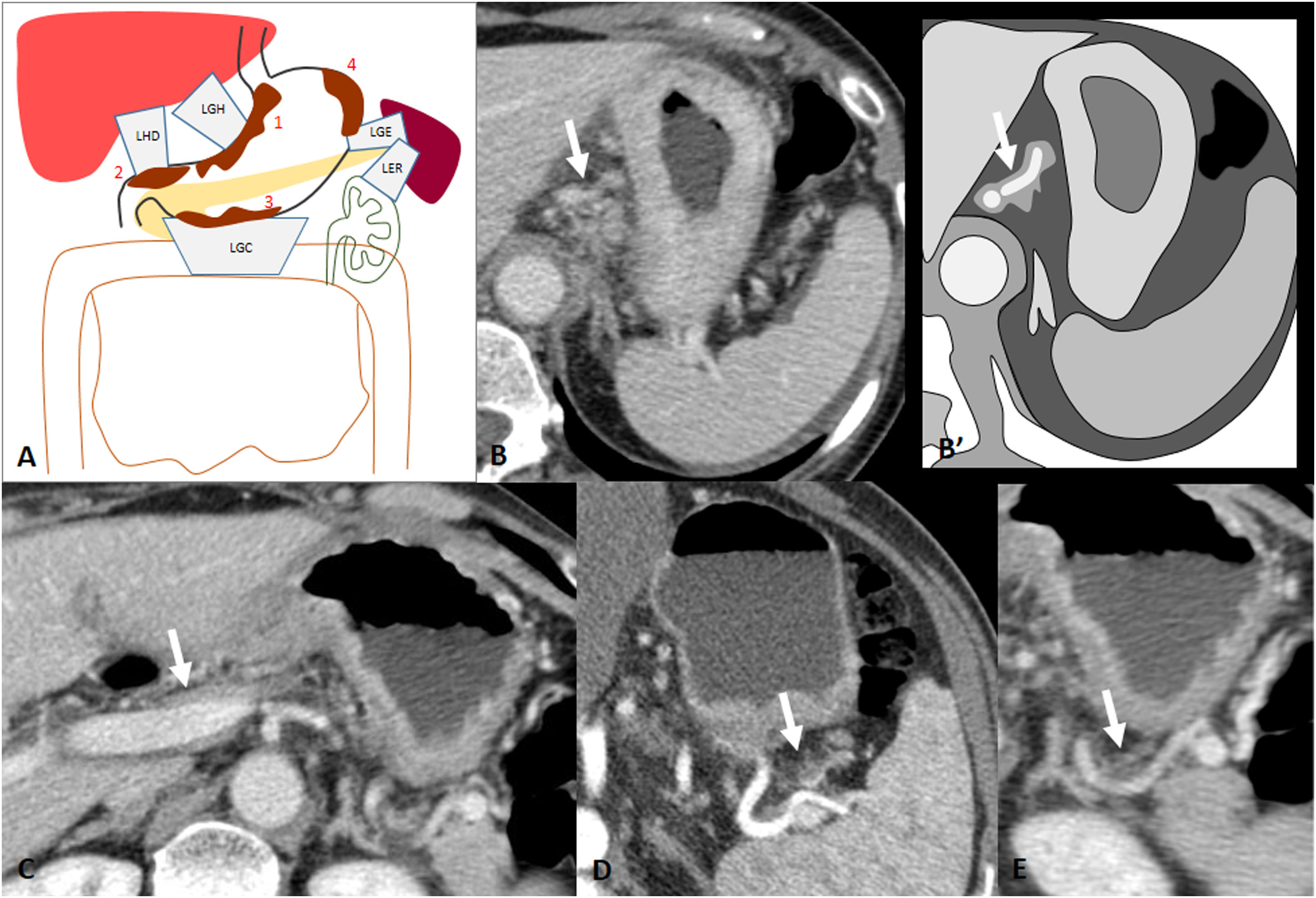
Por fuera del estómago, pero en íntimo contacto con el mismo, se encuentra el peritoneo, que a medida que se refleja y se pliega para cubrir los órganos da lugar a ligamentos, mesenterio, omento y a los espacios potenciales entre los revestimientos peritoneales parietal y visceral. El espacio subperitoneal es el espacio de interconexión continuo debajo del peritoneo, que contiene los ligamentos, mesenterios y órganos abdominopélvicos suspendidos. Radiológicamente, y concretamente mediante la TC, utilizaremos las estructuras vasculares presentes en cada ligamento para reconocer su localización1 (tabla 1) (fig. 1).
Ligamentos perigástricos: estructuras conectadas, referencias vasculares anatómicas y órganos con potencial invasión directa
| Ligamento | Conexión | Referencia vascular | Órgano con potencial invasión directa |
|---|---|---|---|
| Gastrohepático (LGH) | Cardias y curvatura menor-superficie inferior del hígado | Vasos gástricos | Hígado |
| Hepatoduodenal (LHD) | Duodeno proximal y curvatura menor-porta hepatis | Vena porta y arteria hepática | HígadoCabeza de páncreas |
| Gastrocólicoa (LGC) | Curvatura mayor-colon transverso anterior | Vasos gastroepiploicos | Colon transverso |
| Gastroesplénico (LGE) | Fundus y curvatura mayor del cuerpo-hilio esplénico | Vasos gástricos cortos y gastroepiploicos izquierdos | Bazo |
| Esplenorrenal (LER) | Hilio esplénico-espacio pararrenal anterior izquierdo | Vasos esplénicos | Cola de páncreasColon descendenteRiñón izquierdo |
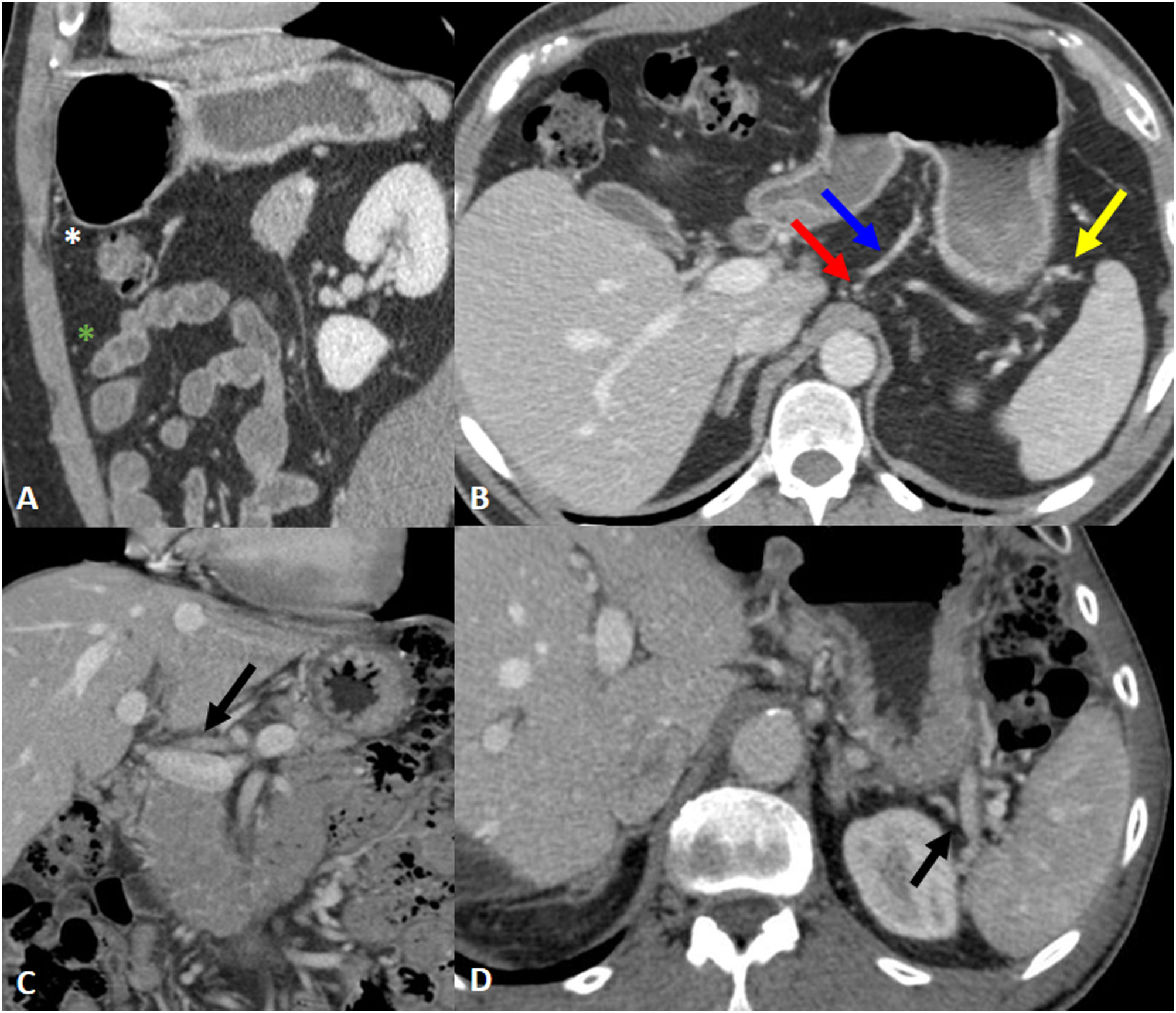
Ligamentos perigástricos y referencias vasculares. A) Ligamento gastrocólico; referencia vascular: vasos gastroepiploicos (asterisco blanco). Omento mayor; referencia vascular: ramas epiploicas (asterisco verde). B) Ligamento gastrohepático; referencia vascular: arteria y vena gástricas izquierdas (flecha roja y azul). Ligamento gastroesplénico; referencia vascular: vasos gastroepiploicos izquierdos (flecha amarilla). C) Ligamento hepatoduodenal; referencia vascular: vena porta y arteria hepática (flecha). D) Ligamento esplenorrenal; referencia vascular: vasos esplénicos (flecha).
El pronóstico del AG se correlaciona con el estadio tumoral determinado en el momento del diagnóstico, que depende de la profundidad de la invasión tumoral (T), afectación ganglionar (N) y metástasis (M)3,14. El cáncer gástrico (CG) se suele clasificar en 2 grupos: CG precoz (CGP) y CG avanzado (CGA)1. El CGP afecta a la mucosa y submucosa (T1), independientemente del tamaño del tumor y de la afectación ganglionar. Tiene una supervivencia a 5 años > 90%. El CGA afecta a capas más profundas (T2-T4) y tiene una supervivencia a 5 años del 7-27%1.
Para la estadificación del CG se utiliza la 8.ª edición de la clasificación TNM de la AJCC y de la Union for International Cancer Control, publicada en 2017, aplicable al adenocarcinoma, al carcinoma neuroendocrino pobremente diferenciado y al carcinoma adenoneuroendocrino mixto14. Antes de abordar la estadificación, se deben conocer los 3 principales cambios en la 8.ª clasificación TNM respecto a la 7.ª.
- -
Se proponen 3 clasificaciones separadas para el CG14,15: un estadio clínico previo al tratamiento (cTNM), un estadio patológico tras la cirugía (pTNM) y un estadio patológico tras resección posneoadyuvancia (ypTNM). Se observó que el diagnóstico preoperatorio del CG era inexacto, sobre todo en la diseminación metástasica ganglionar, por lo que los grupos de estadios patológicos altamente complicados no pueden asignarse legítimamente preoperatoriamente. Por otro lado, existe un aumento del uso de quimioterapia (QT) neoadyuvante, que afecta a los hallazgos patológicos de pacientes resecados posteriormente y por tanto a los estadios p. Estos estadios, por tanto, pueden no reflejar el pronóstico de pacientes resecados sin QT previa.
- -
Se modifican algunos grupos de estadificación anatomopatológicos (pTNM). La estratificación de la supervivencia en los subgrupos de estadio III se ha mejorado al subdividir la categoría pN3 en pN3a (7-15 ganglios positivos) y pN3b (≥ 16 ganglios positivos). Por lo tanto, se sugiere que al menos sean extirpados y valorables anatomopatológicamente 16 ganglios (aunque es deseable que sean más de 30)14,15.
- -
Se realiza un cambio en la clasificación de los tumores de la unión esofagogástrica (UEG): en la clasificación actual, los tumores que afectan a la UEG y cuyo epicentro queda a más de 2cm de la misma (antiguo Siewert tipo III), o, estando en los 2cm primeros no afectan a la UEG, se clasifican y se estadifican como CG14,15.
La estadificación clínica se obtiene con la combinación de las siguientes técnicas:
- -
Endoscopia ± ecografía endoscópica (EE): es útil para valorar cT y cN, pero no sirve para cM. La precisión general de EE para cT es del 65-92% (menor para diferenciar T1a de T1b: 63,6%). La exactitud general para cN es del 66-90%. Esta técnica es menos útil en tumores del antro1,16.
- -
Tomografía computarizada multidetector (TCMD) toraco-abdomino-pélvica: es la prueba de elección en la estadificación clínica preoperatoria1,3.
- -
Resonancia magnética: dada la ausencia de radiación ionizante y la mejor resolución de contraste tisular que nos ofrece una igual o mejor valoración de la cT, es una técnica a tener en cuenta17. Además, existen múltiples estudios que demuestran su utilidad en la detección de metástasis hepáticas y carcinomatosis peritoneal18–21. No obstante, no se utiliza de rutina debido a las limitaciones técnicas y menor disponibilidad1.
- -
PET/TC 18F-FDG: es útil para valorar las metástasis a distancia. Sin embargo, tiene varias limitaciones. Su resolución espacial es baja, por lo que en la valoración de la enfermedad locorregional y las metástasis < 1cm es insuficiente. Por otro lado, los cánceres de tipo mucinoso, células en anillo sello y poco diferenciados suelen mostrar una menor captación de 18F-FDG. Otras entidades. como la inflamación y la infección, pueden darnos falsos positivos. Las guías clínicas no recomiendan su uso rutinario1,3.
- -
Laparoscopia exploradora ± lavado peritoneal: exploración recomendada en pacientes con AG potencialmente resecables (estadios IB-III) para excluir enfermedad metastásica radiológicamente oculta3.
La valoración por un equipo multidisciplinar previa a cualquier tratamiento es obligatoria3. La resección quirúrgica completa del tumor gástrico y de las adenopatías adyacentes, con márgenes negativos, es el único tratamiento curativo probado del AG3. El radiólogo tiene un papel importantísimo en la estadificación clínica prequirúrgica del AG, puesto que los hallazgos visualizados decidirán el manejo del paciente. Las técnicas endoscópicas quirúrgicas menos invasivas se excluyen en presencia de enfermedad ganglionar. La cirugía laparoscópica está excluida si existe afectación de ligamentos perigástricos y la infiltración tumoral de estructuras adyacentes o metástasis limita la resecabilidad del AG1,3.
Estadificación clínica por TCMDEn la tabla 2 se muestra el cTNM de la última clasificación de la AJCC para el CG y sus respectivos hallazgos en TC, y en la tabla 3, los estadios cTNM de la misma clasificación14. Si se analizan los estadios cTNM de la 8.ª clasificación, se observa que la invasión tumoral se divide en 3 grupos: invasión mural superficial (cT1/cT2), profunda (cT3/cT4a) e invasión de estructuras adyacentes (cT4b). El estadio cT4b se clasifica como estadio cIVA incluso en ausencia de metástasis. Esto es excepcional en el actual sistema TNM, en el que el «estadio IV» casi siempre significa enfermedad M1. Por otro lado, la categoría N se divide en cN0 (sin afectación ganglionar) y cN+ (con afectación ganglionar), independientemente del número de ganglios afectados14,15.
cTNM de la 8.ª edición de la clasificación AJCC para el Carcinoma Gástrico y sus hallazgos en TC
| cTNM de la 8.ª edición de la clasificación AJCC del carcinoma gástrico | ||
|---|---|---|
| Categoría | Definición | Hallazgos en TC |
| T1a | Invasión de lámina propia o muscularis mucosa | Sin hallazgos visibles |
| T1b | Invasión de submucosa | Engrosamiento y realce de la mucosaLa línea submucosa hipoatenuante permanece visible |
| T2 | Invasión de muscularis propia | Pérdida de la línea hipodensa submucosa, pero pared gástrica externa lisa |
| T3 | Invasión del tejido conectivo subseroso | No se diferencia la masa gástrica de la capa externa captantePared gástrica externa generalmente lisa o levemente borrosaPosibles pequeñas áreas lineales de reticulación grasaEngrosamiento nodular o en banda de tejido de partes blandas en los ligamentos perigástricos |
| T4a | Invasión de la serosa (peritoneo visceral) | Superficie serosa nodular o irregularInfiltración de la grasa peritoneal circundanteSigno de la serosa hiperdensa |
| T4b | Invasión de estructuras adyacentes (bazo, colon transverso, hígado, diafragma, páncreas, pared abdominal, glándula suprarrenal, riñón, intestino delgado y retroperitoneo) | Invasión directa a órganos y estructuras adyacentes, deformidad o irregularidad en su contorno u obliteración del plano graso entre tumor y órgano adyacentea |
| N0 | Sin afectación ganglionar regional | |
| N+ | Afectación ganglionar regional | > 6mm en ganglios perigástricosb> 8mm en ganglios extraperigástricosbMorfología redondeadaRealce intenso o heterogéneoAgrupación de más de 3 ganglios |
| M0 | Sin enfermedad metastásica | |
| M1 | Metástasis a distancia: ganglios no regionales, extensión no directa a otros órganos, carcinomatosis peritoneal | Metástasis a distancia: adenopatías a distancia (no regionales), extensión indirecta a otros órganos y carcinomatosis peritoneal (ascitis, nódulos, placas, engrosamiento, estriación de la grasa o realce peritoneal) |
Aunque cada centro adapta el protocolo del estudio de TC a sus posibilidades, es conveniente conocer el protocolo propuesto por la Sociedad Española de Diagnóstico por Imagen Abdominal (SEDIA) (tabla 4)22. Existen aspectos controvertidos en lo referente al protocolo óptimo para la valoración mediante TCMD del AG. La bibliografía respalda la realización de un estudio dinámico multifásico basado en la adquisición de 2 o 3 fases1,22–26. Los protocolos que cuentan con 3 fases añaden a la adquisición arterial tardía abdominal (a los 40 s tras la administración de contraste) y portal toracoabdominopélvica (a los 70 s), una fase tardía o de equilibrio abdominal a los 3-4min23-26. Generalmente, se considera que el contraste por vía intravenosa ofrece el máximo realce del tumor en la fase arterial, mientras que la fase venosa se utiliza para valorar la afectación ganglionar y metástasis1,27–29. No obstante, se ha descrito que el patrón de realce en la TC se ve afectado por la histología del tumor, especialmente por el componente de fibrosis23,28. Se ha descrito que la fibrosis intramural de los AG indiferenciados se relaciona con un mayor y máximo realce en la fase tardía23. Por otro lado, aunque es menos utilizada, existen publicaciones que abogan por el uso de la TC-gastroscopia o gastroscopia virtual (GV) mediante la adquisición inicial de una fase sin contraste por vía intravenosa del abdomen superior tras la administración de 3-7g de gránulos efervescentes con 5-10ml de agua para distender el estómago con gas24–26. Varios estudios afirman también que añadir la GV al estudio dinámico de TCMD mejora la precisión de la estadificación preoperatoria del AG, sobre todo en el CGP24,25. Aunque el espectro de protocolos utilizados en la literatura es amplio, la adquisición de fase arterial y portal son constantes.
Protocolo de TC propuesto por la SEDIA para el cáncer gástrico
| Ayuno de 8 h |
| TCMD de al menos 16 detectores |
| Grosor de corte: 0,6-1mm y reconstrucciones multiplanares de 3 mm |
| Distensión de la luz gástrica: |
| Contraste oral neutro: agua (más frecuentemente utilizada. 1-1,5 l 15-30min antes de la prueba) o metilcelulosa |
| Contraste oral negativo: gas (TC-gastroscopia). Menos utilizado |
| Espasmolíticos: bromuro de hioscina o glucagón |
| Posición: decúbito supino, o prono en tumores de cardias y antro |
| Inyección de CIV: yodo de 350 mg/ml (cantidad: 1,8-2 cc/kg) a 4 ml/s + 30ml de suero fisiológico. 2 fases: |
| Arterial tardía a los 40 s de abdomen superior desde el inicio de la administración del contraste. En caso de incluir en esta fase el tórax se excluiría en la fase venosa |
| Venosa portal a los 70 s de tórax + abdomen + pelvis desde el inicio de la administración del contraste |
Los hallazgos de imagen que nos deben hacer sospechar un AG son una lesión polipoidea sin o con ulceración asociada, un engrosamiento mural focal > 15mm, un engrosamiento difuso, un realce mural anormal y la obliteración de las capas de la pared y la afectación extragástrica1. Los AG presentados como lesiones polipoideas pueden confundirse con pólipos gástricos: hiperplásicos o inflamatorios (los más frecuentes), pólipos de glándulas fúndicas y pólipos adenomatosos29,30. Entre las lesiones submucosas que se pueden confundir con el AG se encuentran el tumor carcinoide, el tumor glómico y las metástasis. Todas ellas se pueden presentar en la TC como pequeñas lesiones hiperrealzadas en fase arterial tardía y portal, aunque son menos frecuentes en el estómago que el AG29,31–33. Los tumores del estroma gastrointestinal se originan en la capa muscular y los de pequeño tamaño se observan en la TC como lesiones hipervasculares similares al tumor carcinoide. La mayoría son benignos y, aunque sean malignos, no suelen mostrar una diseminación ganglionar29. El engrosamiento gástrico difuso es típico en el carcinoma de células en anillo de sello, un subtipo de AG que se caracteriza por una infiltración mural que puede pasar desapercibida. Frecuentemente avanza del estómago distal hacia el cuerpo/fundus, produciendo una infiltración escirrosa de la pared (linitis plástica)1,29. En algunos casos el engrosamiento difuso puede ser difícil de diferenciar por imagen de la gastritis o el linfoma y requieren biopsia1,29.
Un correcto informe de TC en un AG debe incluir los siguientes aspectos:
- -
Localización del tumor: anatómica (cardias, fundus, cuerpo, antro y píloro) y circunferencial (anterior, posterior, curvatura menor, curvatura mayor, o afectación circunferencial)22. Es importante ofrecer la distancia a la UEG. Para una gastrectomía subtotal en tumores de los 2/3 distales del estómago, es necesaria como mínimo una distancia entre el borde proximal macroscópico del tumor y la UEG de 5cm, y en el AG de tipo difuso de 8cm3.
- -
Tamaño tumoral: se debe aportar el diámetro máximo del tumor. A pesar de no estar recogido en el TNM, es un importante factor pronóstico. Si el tumor es > 5cm, por lo general requiere tratamiento adyuvante22.
- -
Profundidad de invasión de la pared (cT): aunque históricamente la TC se ha visto limitada en la detección del CGP (T1), las tasas de precisión en la diferenciación de T1 y T2 han mejorado en los últimos años al 65-82% debido a las reconstrucciones multiplanares, cortes finos y una correcta distensión gástrica26,34. La tasa para la detección por TC de CGA (≥ T2) oscila entre el 85 y el 95%26. La diferenciación cT3/T4a puede ser un reto radiológico. La infiltración directa de la grasa perigástrica sugerirá un T4a, aunque se debe hacer diagnóstico diferencial con inflamación, ingurgitación vascular o linfática y reacción desmoplásica1. El «signo de la serosa hiperdensa», visualizado en la TC como un engrosamiento focal o difuso hiperdenso de la capa serosa, sugiere su infiltración y por lo tanto un T4a35,36 (fig. 2). No obstante, aunque la diferenciación T3/T4a es difícil, no se debe olvidar que el papel del radiólogo en el cTNM para el estadio clínico es catalogar la T en cT1/T2 o cT3/T4a. El estadio clínico será el mismo para cT3 y cT4a14,15.
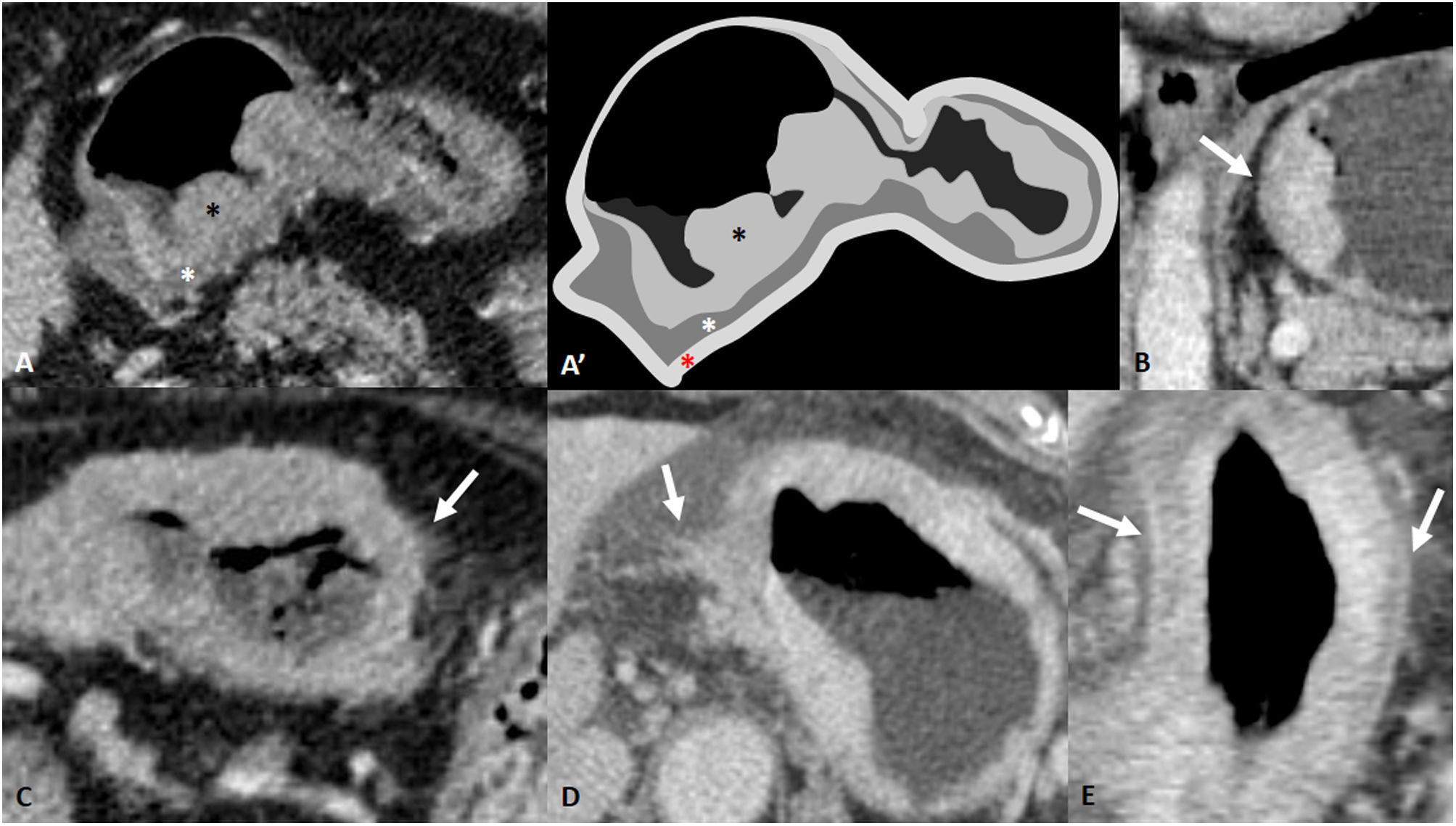
Figura 2.Profundidad de invasión de la pared (cT). A y A’) AG cT1b en TC y dibujo del mismo corte. Engrosamiento polipoideo de la mucosa gástrica (asterisco negro) con conservación de la línea hipodensa submucosa (asterisco blanco). El asterisco rojo marca la capa tenuemente hiperdensa más superficial que corresponde a la muscular, subserosa y serosa. Confirmado tras cirugía: pT1b. B) cT2. Engrosamiento mural gástrico con pérdida de la capa submucosa pero con visualización de un borde liso de la capa externa. C) Mínima borrosidad de la pared externa y mínima reticulación grasa. Dudoso cT3/T4a. Se administró quimioterapia neoadyuvante y se realizó cirugía. Resultó ser un ypT3N0. D) cT4a: superficie de la pared irregular con clara infiltración directa de la grasa. E) cT4a: engrosamiento mural gástrico difuso con signo de la serosa hiperdensa.
(0.21MB). - -
Afectación ganglionar (cN): en la estadificación clínica preoperatoria se debe identificar si existe o no afectación ganglionar regional: cN0 o cN+. No es importante el número, sino si existe afectación ganglionar y la localización de la misma14. Los ganglios linfáticos regionales se dividen en perigástricos y extraperigástricos. La afectación ganglionar a distancia se considera metástasis (M1)14,37 (fig. 3). No existe claro consenso en el umbral del tamaño patológico. Se acepta un umbral > 6mm en ganglios perigástricos y > 8mm en ganglios extraperigástricos. La morfología redondeada, el realce intenso o heterogéneo, y la agrupación de más de 3 ganglios también son signos sospechosos3,14. En general, se acepta que cualquier ganglio > 10mm y mayor de 85-100 UH en fase portal se considera positivo, independientemente de su localización7. La sensibilidad de la TC para la afectación ganglionar es variable, del 63-92%3. Se ampliará la información sobre la afectación ganglionar en el apartado de diseminación linfática.
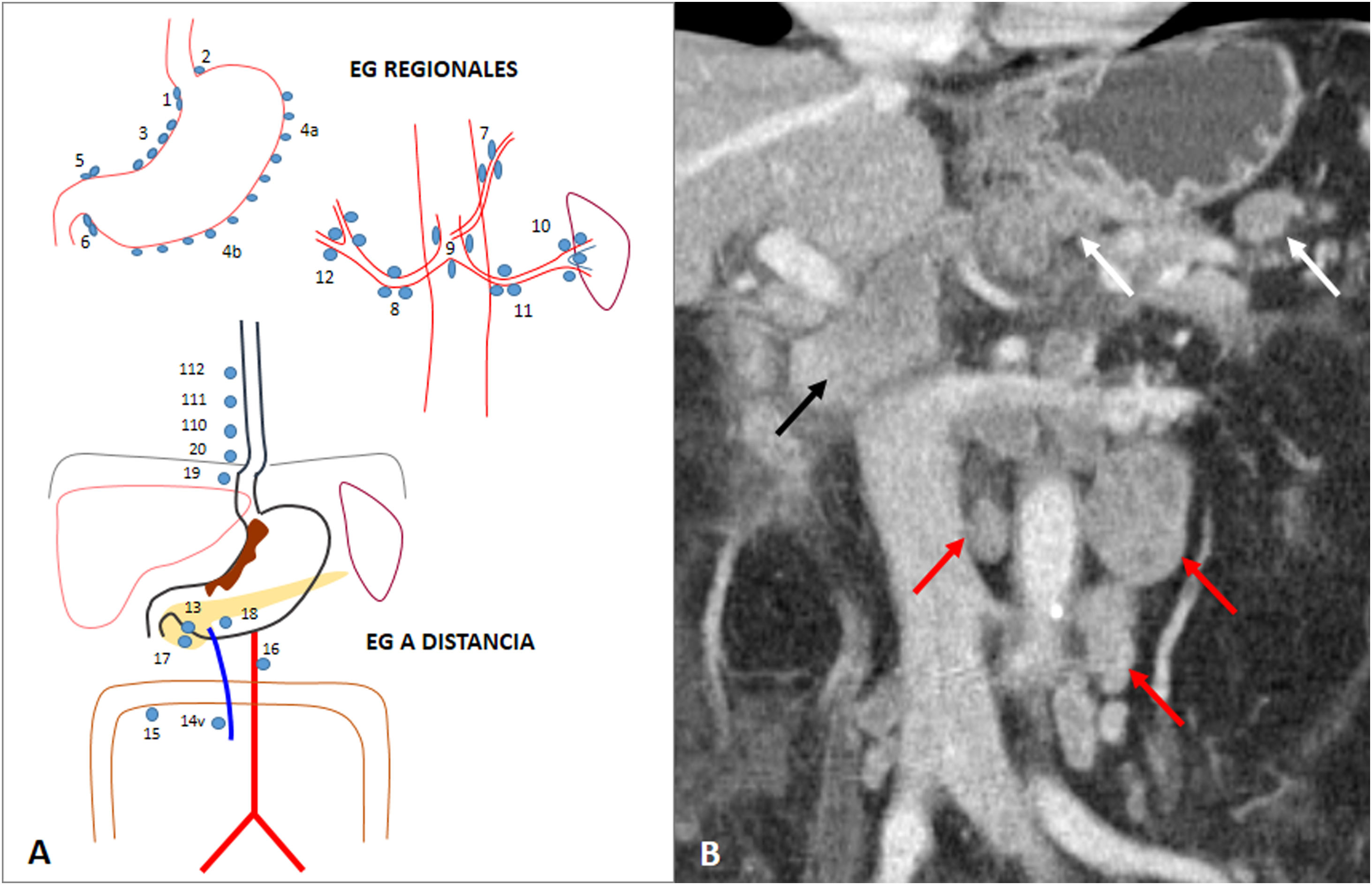
Figura 3.Afectación ganglionar (cN). A) Esquema de las estaciones ganglionares (EG) del carcinoma gástrico, propuestas inicialmente por la asociación japonesa del cáncer gástrico (AJCG) y ampliamente utilizada a día de hoy. EG regionales perigástricos: paracardiales derechas (1), paracardiales izquierdos (2), curvatura menor (3), curvatura mayor (4), suprapilóricos (5), infrapilóricos (6). EG regionales extraperigástricas: arteria gástrica izquierda (7), arteria hepática común (8), tronco celiaco (9), hilio esplénico (10), arteria esplénica (11), ligamento hepatoduodenal (12). EG a distancia: área posterior de la cabeza pancreática (13), vena mesentérica superior (14v), colon transverso (15), paraaórticos (16), área anterior de la cabeza pancreática (17), borde inferior del cuerpo pancreático (18), infradiafragmáticos a lo largo de la arteria subfrénica (19), paraesofágicos en el hiato diafragmático (20), paraesofágicos torácicos inferiores (110), supradiafragmáticos (111), mediastínicos posteriores (112). En caso de que el tumor gástrico invada el esófago, las estaciones 19, 20, 110, y 111 se consideran regionales. La estación 14v se considera regional en la clasificación de la AJCG y a distancia en la 8.ª clasificación de la AJCC. B) AG subcardial con adenopatías regionales perigástricas (flechas blancas), extraperigástricas en hilio hepático (flecha negra) y a distancia interaórtico cava y paraórticas izquierdas (flechas rojas). Estas últimas son compatibles con cM1.
(0.37MB). - -
Metástasis a distancia (cM): la ausencia de afectación metastásica se describe como M0 y la presencia de la misma como M1. Esta última puede presentarse como adenopatías a distancia, extensión indirecta a otros órganos y carcinomatosis peritoneal14. La sensibilidad y especificidad de la TC en la detección de las metástasis hepáticas es del 74 y el 99%, respectivamente1.
- -
Invasión venosa extramural (se desarrollará dentro de las vías de diseminación).
Aunque la localización del tumor en el estómago puede ayudar a predecir el patrón de diseminación de la enfermedad, es necesario conocer las diferentes vías de diseminación del AG para poder realizar una correcta estadificación prequirúrgica.
Diseminación linfáticaEs la vía de diseminación más frecuente del AG. El 74-88% de los pacientes con AG presentan diseminación linfática y se observa en hasta el 14% de los pacientes con CGP con invasión de únicamente la mucosa (T1a)38. El drenaje linfático del estómago depende del tumor primario. Es complejo y multidireccional39. Independientemente de la localización del tumor, las cadenas ganglionares más frecuentemente afectadas son la 3 (curvatura menor), 4 (curvatura mayor) y 7 (gástrica izquierda)9. En caso de afectación ganglionar regional única, la estación ganglionar afectada suele estar en el lado del tumor en el 83-92% de los casos39. La distribución es menos predecible cuanto mayor es la afectación ganglionar. La afectación metastásica en ganglios extraperigástricos sin afectación de ganglios perigástricos se denomina skip metástasis. Se observa en el 5-14% de los casos y existe una mayor incidencia en CGA del tercio superior y medio39 (fig. 4).
A) TC por dolor abdominal. Hidronefrosis derecha con atrapamiento del uréter (flecha) y adenopatías retroperitoneales (cabeza de flecha). Se sospecha neoplasia de origen urológico. B) BAG 18G de adenopatía paraórtica izquierda (cabeza de flecha). La AP sugiere carcinoma de origen gastrointestinal. C y D) Se revisa la TC observando engrosamiento subcardial sospechoso que resulta ser un AG de tipo intestinal (flecha) con metástasis retroperitoneales en relación con skip metástasis (cabeza de flecha).
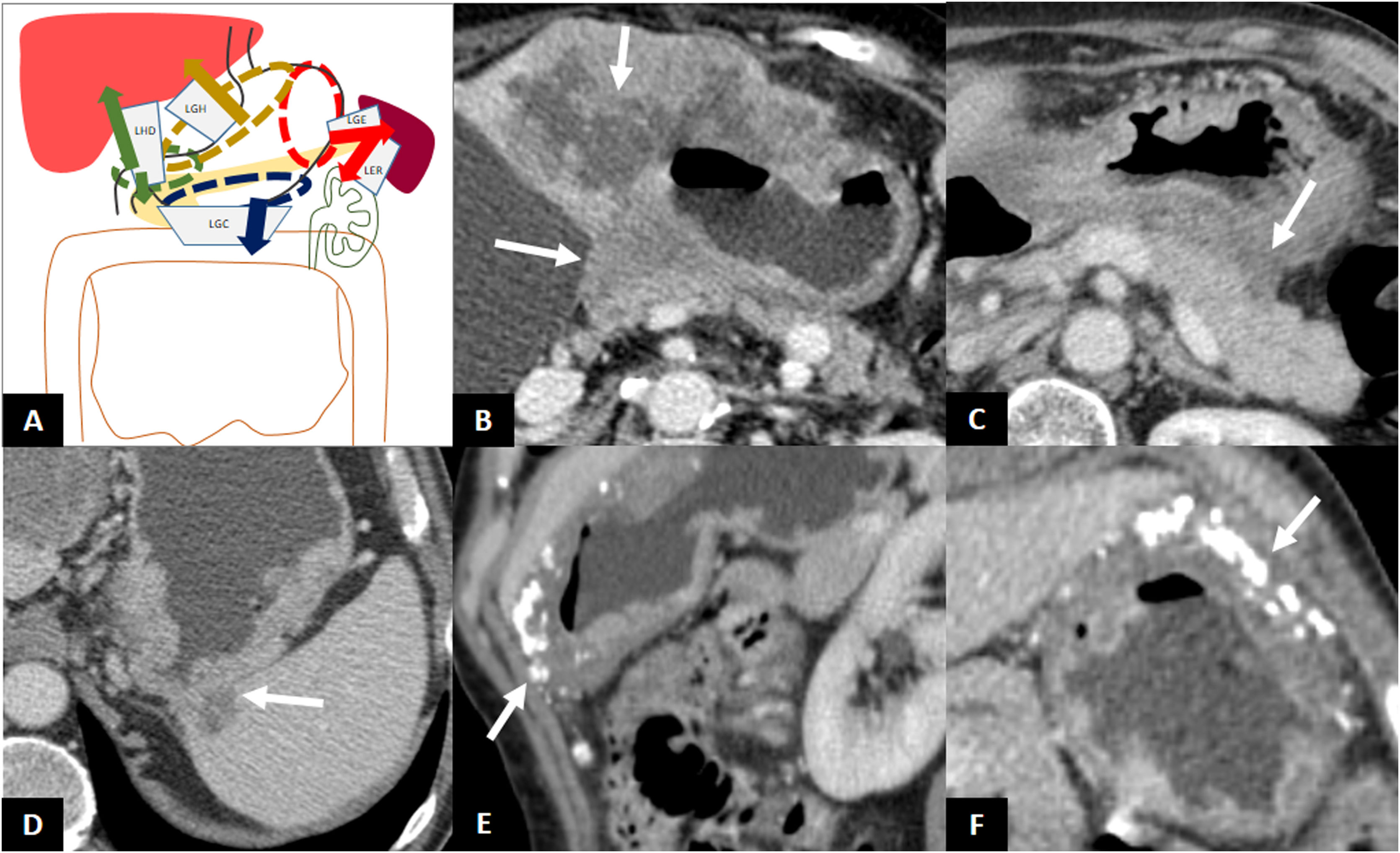
El AG puede diseminarse subperitonealmente entre las capas del peritoneo a lo largo de arterias, venas o nervios dentro de los ligamentos y mesenterio1. El cáncer con diseminación local que penetra desde el tejido conectivo subseroso a los ligamentos perigástricos y omento, sin perforación del peritoneo visceral o capa serosa, es clasificado como T314. La enfermedad a lo largo de los ligamentos perigástricos se puede ver en la TC como un engrosamiento nodular o en banda de tejido de partes blandas dentro de los ligamentos1. En caso de tratarse de un AG operable, este hallazgo excluye la cirugía laparoscópica.
Los AG localizados en el cardias y la curvatura menor pueden diseminarse a través del ligamento gastrohepático (LGH), los localizados a nivel antropilórico a través del ligamento hepatoduodenal (LHD), los de la curvatura mayor a través del ligamento gastrocólico (LGC) (y diseminarse hacia el omento mayor), y los localizados en el fundus y la región superior de la curvatura mayor a través del ligamento gastroesplénico (LGE), y de aquí al ligamento esplenorrenal (LER)1 (fig. 5).
Diseminación subperitoneal. A) Ilustración de los ligamentos perigástricos como posibles vías de diseminación subperitoneal del adenocarcinoma gástrico. LGE: ligamento gastroesplénico; LGC: ligamento gastrocólico; LER: ligamento esplenorrenal; LGH: ligamento gastrohepático; LHD: ligamento hepatoduodenal; 1: neoplasia en cardias y curvatura menor; 2: neoplasia antropilórica; 3: neoplasia en curvatura mayor; 4: neoplasia en fundus y región superior de la curvatura mayor. B) Infiltración del LGH: aumento de densidad nodular rodeando a los vasos gástricos izquierdos. B’) Ilustración de B señalando el tejido de partes blandas rodeando los vasos gástricos izquierdos que sugiere infiltración del ligamento (flecha). C) Infiltración del LHD: tejido de partes blandas rodeando la vena porta y arteria hepática en el hilio hepático. D) Infiltración del LGE: aumento de densidad rodeando los vasos gástricos cortos y gastroepiploicos izquierdos. E) Infiltración del LER: tejido de partes blandas rodeando los vasos esplénicos.
El tumor puede extenderse por contigüidad más allá de la serosa e invadir la grasa perigástrica y los ligamentos adyacentes hasta alcanzar otro órgano. La ubicación anatómica del tumor primario ayuda a predecir qué ligamentos y órganos perigástricos pueden estar invadidos1. Los tumores del cardias, curvatura menor y antro pueden invadir el lóbulo hepático izquierdo a través del LGH. Los tumores del píloro y antro gástrico pueden invadir el hígado o la cabeza pancreática a través del LHD. Los tumores de la curvatura mayor pueden invadir el colon transverso a través del LGC. Los tumores del fundus y la región superior de la curvatura mayor pueden invadir el bazo a través del LGE y la cola pancreática, el colon descendente y el riñón izquierdo a través del ligamento esplenorrenal (LER)1. El hallazgo de invasión directa de un órgano adyacente implica un estadio cT4b14 (fig. 6) (tabla 1).
Invasión directa. A) Ilustración de los ligamentos perigástricos como posibles vías de invasión directa del adenocarcinoma gástrico. B) Invasión directa del lóbulo hepático izquierdo y del cuerpo pancreático. C) Ausencia de plano graso entre el estómago y el cuerpo y la cola pancreáticos indicativo de posible infiltración directa de páncreas. La laparoscopia exploradora demostró ausencia de infiltración. D) Invasión directa del bazo a través del LGE. E y F) Engrosamiento de la curvatura mayor gástrica con calcificaciones e invasión directa del ligamento gastrocólico y omento mayor, sin llegar a invadir el colon.
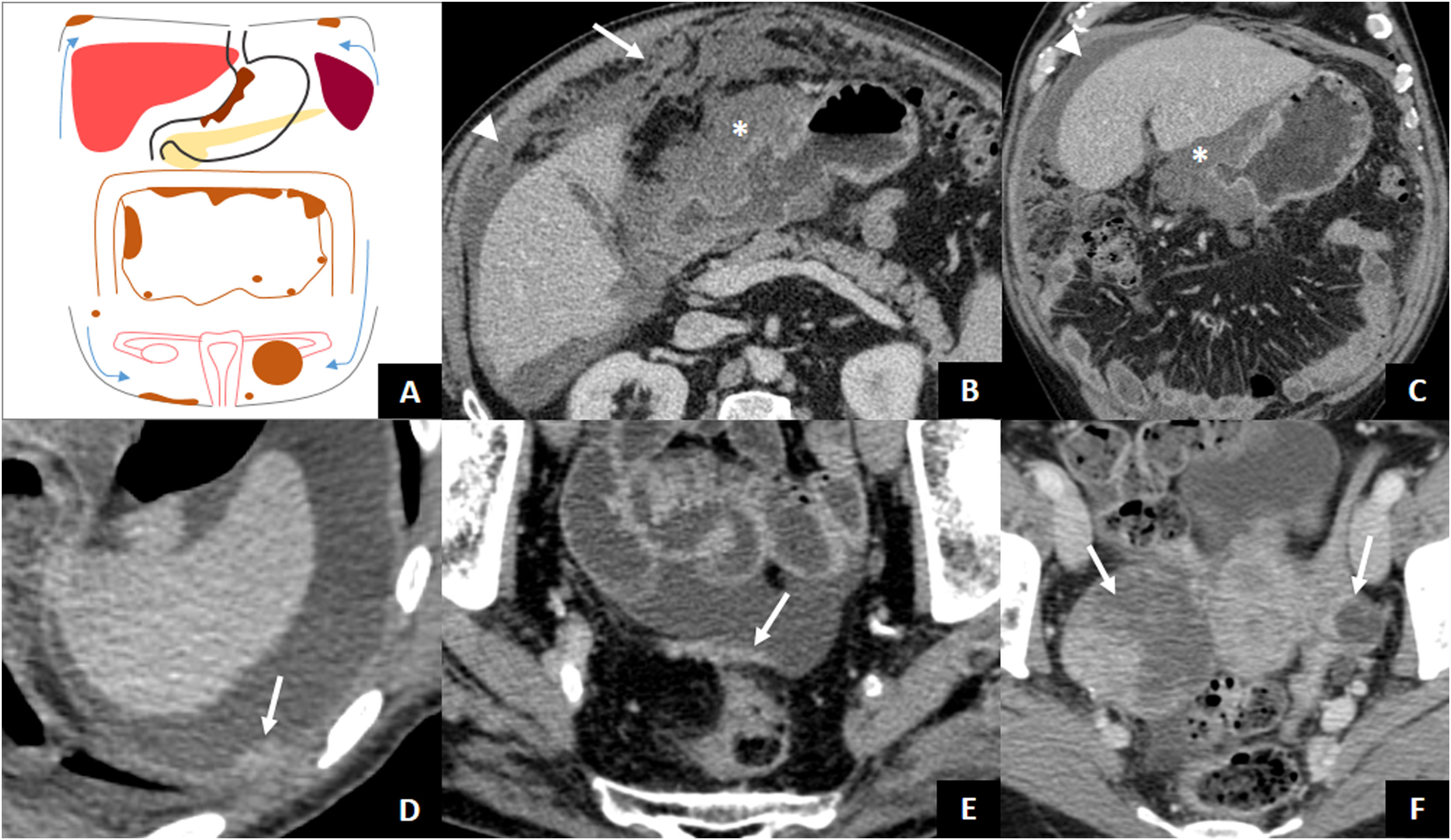
A través de la penetración de las capas peritoneales, el AG puede diseminarse dentro de la cavidad peritoneal. El 50% de los pacientes con tumores que infiltran al menos la capa muscular (≥ T2) presentan diseminación peritoneal al diagnóstico1. Demostrar afectación metastásica peritoneal significa que la enfermedad es incurable, por lo que es esencial una valoración exhaustiva del peritoneo. Los hallazgos en imagen indicativos de carcinomatosis peritoneal son la ascitis (el hallazgo más frecuente), nódulos o placas en la superficie peritoneal, reticulación prominente de la grasa intraabdominal y engrosamiento irregular y realce del peritoneo40. Deben valorarse con especial atención las zonas declives de la cavidad peritoneal, como el saco de Douglas o espacio recto-vesical, o las áreas donde se absorbe abundante cantidad de líquido peritoneal (superficie subdiafragmática y omento), ya que la ascitis favorece la diseminación subperitoneal a estas regiones41,42 (fig. 7). Las metástasis de ovario del AG (tumores de Krukenberg) son generalmente del tipo histológico de células en anillo de sello y pueden deberse a diseminación intraperitoneal del CGA o a diseminación linfática en ausencia de invasión serosa43. Por otro lado, en pacientes con recurrencia tumoral tras realización de cirugía con intención curativa, el tipo de recurrencia más frecuente es la diseminación peritoneal44.
Diseminación transperitoneal. A) Ilustración de un AG con diseminación transperitoneal presentado con carcinomatosis peritoneal (implantes subdiafragmáticos y pélvicos, placa de engrosamiento peritoneal pélvico, omental cake) y tumor de Krukenberg izquierdo. Las flechas señalan la dirección de la ascitis. B y C) AG antropilórico localmente avanzado (asteriscos), tipo difuso con células en anillo de sello, con carcinomatosis peritoneal: ascitis (puntas de flecha) y llamativo engrosamiento omental u omental cake (flecha). D) Implante peritoneal subdiafragmático izquierdo (flecha) y ascitis como recurrencia tumoral de AG operado. E) Engrosamiento peritoneal en placa hiperrealzado (flecha) en relación con carcinomatosis peritoneal. F) AG tipo difuso con células en anillo de sello con tumor de Krukenberg bilateral (flechas).
La principal limitación de la TC es la dificultad para detectar la diseminación peritoneal sutil. Por ello, para evitar la cirugía invasiva en casos con enfermedad peritoneal oculta, se recomienda la laparoscopia diagnóstica en AG potencialmente resecables3. Radiológicamente podemos cuantificar la carcinomatosis con el índice de carcinomatosis peritoneal (ICP), un sistema de puntuación para la evaluación de la distribución y tamaño de los implantes tumorales, cuantificada entre 0 y 39 puntos. Se divide el abdomen en 9 cuadrantes y 4 regiones entéricas, y se seleccionará el implante de mayor tamaño en cada región asignándole un número del 0 al 3 (0: sin implantes, 1: <0,5cm, 2: 0,5-5cm, y 3: > 5cm)45. Varias publicaciones de estudios recientes han reportado mayor sensibilidad y especificidad en la detección de metástasis peritoneales con RM que con TC18–20,45.
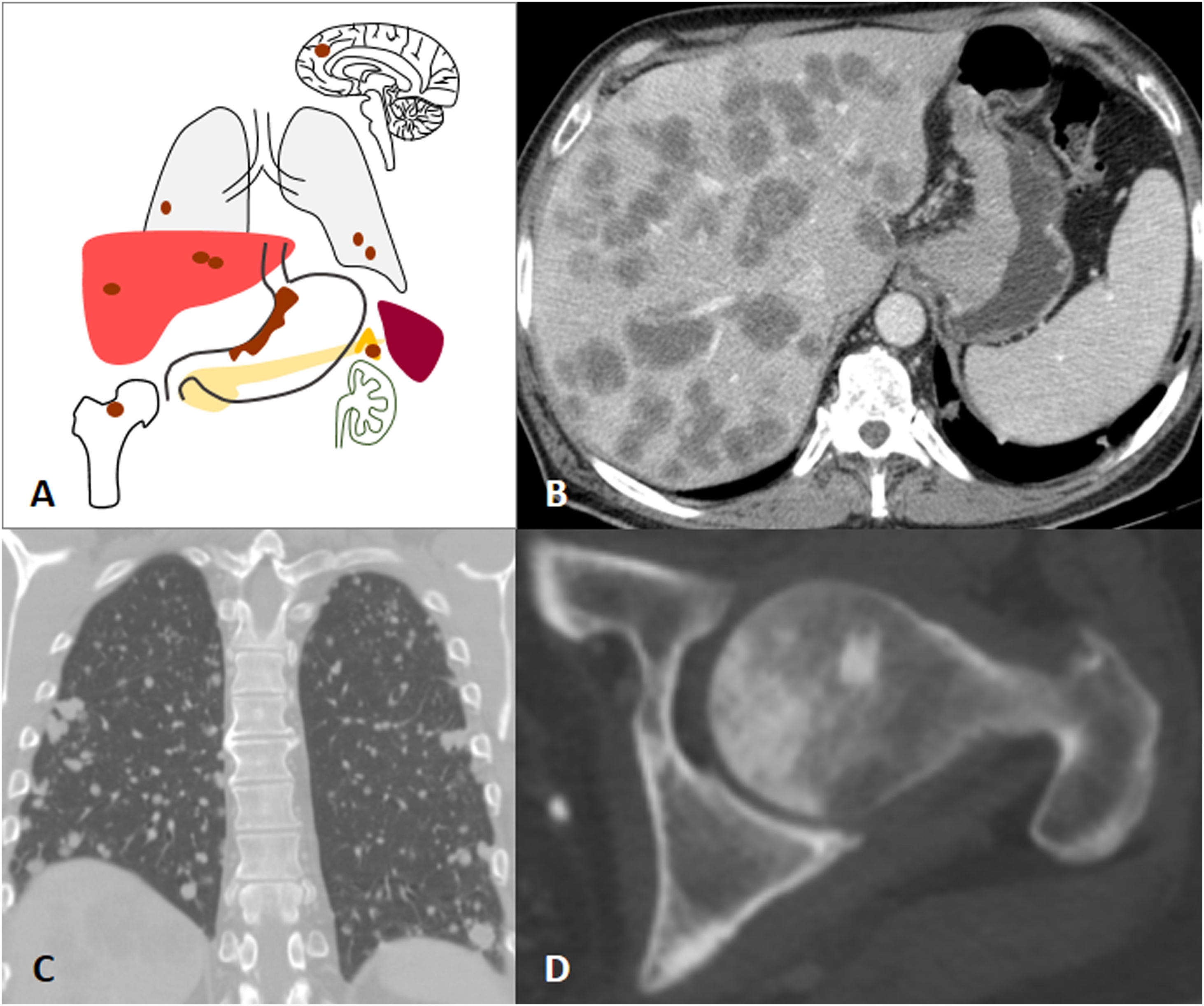
Diseminación hematógenaLa diseminación hematógena depende de factores intrínsecos de las células tumorales y de su posterior comunicación con el microambiente circundante que favorece la formación de un nicho premetastásico. Desde este nicho, las células tumorales invaden la matriz extracelular y se introducen en la luz de los vasos, a través de donde se diseminan por el sistema circulatorio para llegar a otro órgano y desarrollar metástasis a distancia46,47.
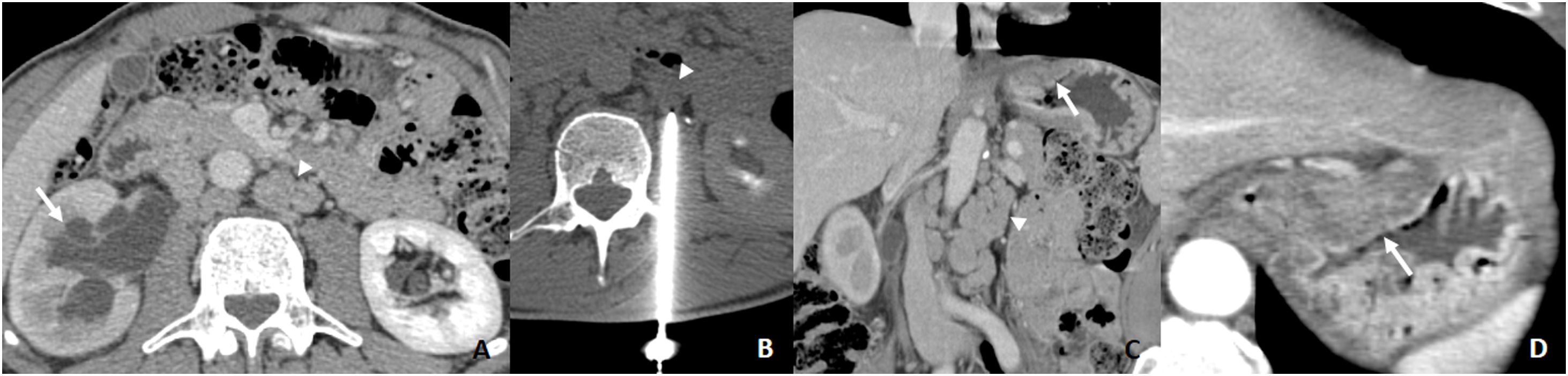
Dado que el estómago drena por el sistema venoso portal, las metástasis hematógenas más frecuentes son las hepáticas. Las guías clínicas recomiendan la TC y en algunas ocasiones la PET-TC como pruebas de imagen de elección para la detección de metástasis3,48. No obstante, recientemente está en auge el valor de la RM en la detección de las metástasis hepáticas. En una revisión y metaanálisis reciente, se demostró que la sensibilidad de la RM con contraste hepatoespecífico era mayor que la de la TC con contraste por vía intravenosa para la detección de metástasis hepáticas en neoplasias primarias gastrointestinales y colorrectales, especialmente en las lesiones inferiores a 10mm21. Las metástasis hepáticas del AG suelen ser hipovasculares y se presentan como lesiones nodulares hipodensas en la TC. La restricción de las metástasis en la secuencia de difusión y la hipointensidad de señal en la fase hepatobiliar con el uso de contraste hepatoespecífico son las principales secuencias diagnósticas para la detección de metástasis hepáticas con la RM18,21,49. Otras localizaciones posibles de metástasis del AG son el pulmón, el hueso, las suprarrenales o el SNC1 (fig. 8).
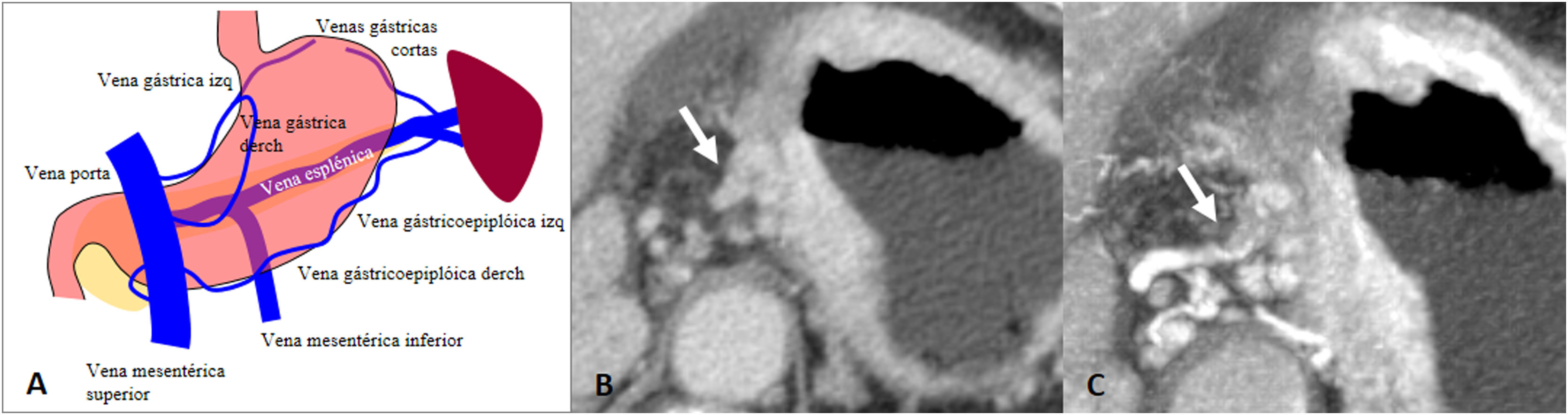
Las venas gástricas intramurales surgen de un lecho capilar de la mucosa que drena en la capa submucosa formando un plexo venoso. Penetran en la serosa gástrica hasta formar las venas gástricas, para finalmente formar las venas gastroepiploicas izquierda y derecha, y las venas gástricas derecha e izquierda. Estás terminan drenando a la vena mesentérica superior, vena esplénica o directamente a la vena porta50.
La infiltración maligna directa de las venas perigástricas o la invasión a través de las mismas que se extiende por fuera de la pared del tracto gastrointestinal se conoce como invasión venosa extramural (IVE). Histológicamente, se define como la presencia de células tumorales en venas más allá de la muscular propia, y aunque su diagnóstico en principalmente histológico, el avance de las técnicas de imagen como la TCMD ha permitido valorar la existencia de la IVE antes de la cirugía50. Se asocia con frecuencia a invasión extramural periarterial, perineural y linfática. No es un criterio del sistema AJCC, pero se considera un factor de mal pronóstico, con asociación a mayor recurrencia y menor tiempo de supervivencia51–53.
Se diferencian 3 tipos de IVE. a) intraluminal (el más frecuente): propagación del tumor dentro del vaso (configuración tubular del vaso), en ocasiones distendiéndolo; b) flotante: tumor dentro de la luz pero con bordes flotantes libres, y c) infiltrativo: el tumor se infiltra en la pared de los vasos por contigüidad50. La IVE se observa generalmente en TC como un engrosamiento tubular o nodular de partes blandas que se extiende desde el tumor a lo largo de los vasos perigástricos50. Para valorar la IVE pueden ayudar las reconstrucciones multiplanares o proyección de máxima intensidad (MIP) (fig. 9). La IVE detectada por TC ha demostrado ser un factor predictor independiente de mala supervivencia en pacientes con CGA52,53.
Invasión venosa extramural. A) Ilustración del sistema venoso gástrico. B) Adenocarcinoma gástrico tipo difuso con IVE de los vasos gástricos izquierdos en el ligamento gastrohepático (flecha). C) Mismo caso que en B con reconstrucción MIP de la fase arterial, donde se observa de forma más evidente el engrosamiento tubular de la vena gástrica izquierda.
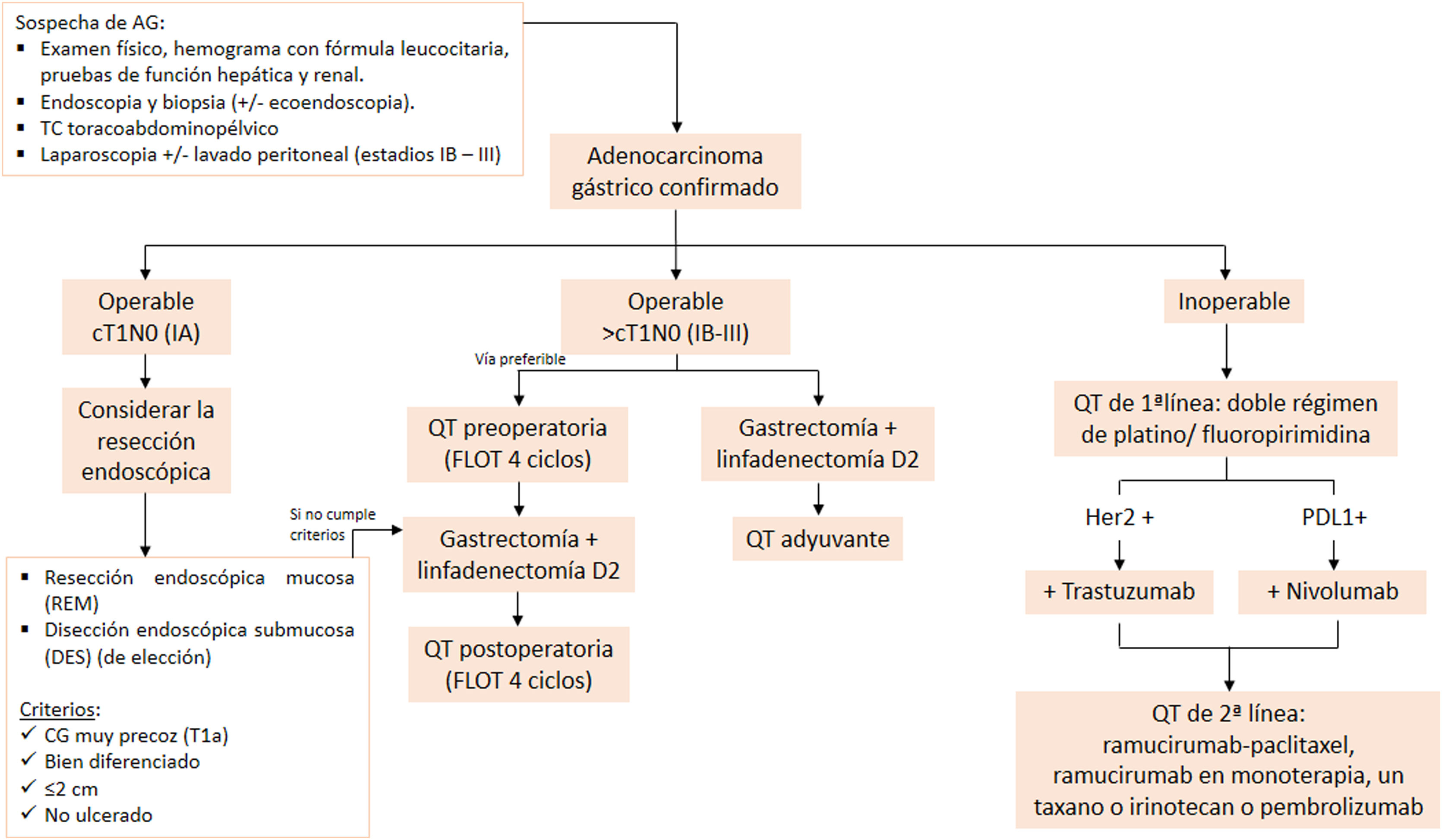
La figura 10 muestra un algoritmo del manejo del AG. Ante toda sospecha de AG se debe realizar una exploración física, análisis de sangre, endoscopia y TC toracoabdominopélvico. El diagnóstico de confirmación debe hacerse mediante una biopsia por gastroscopia o quirúrgica3.
Algoritmo de manejo del AG según el estadio clínico empleado en nuestro centro basado en las últimas actualizaciones de las guías de práctica clínica del cáncer gástrico de la European Society for Medical Oncology (ESMO) y de la National Comprehensive Cancer Network (NCCN). Linfadenectomía D2: resección de ganglios perigástricos y adyacentes a las arterias gástrica izquierda, hepática común, esplénica y tronco celiaco. Fuente: Lordick et al.3 y Ajani et al48.
Una vez confirmado el AG, se ajustará el manejo dependiendo del estadio del tumor según el TNM. Si el paciente es operable con un estadio IA (cT1N0), se puede considerar la resección endoscópica (véanse los criterios de indicación en la figura 10)54.
Si el paciente es operable con un estadio IB-III (> cT1N0), se recomienda una gastrectomía radical con linfadenectomía D2 y QT perioperatoria (QTP) (pre y poscirugía)3. La QTP y la cirugía han demostrado un aumento significativo en la supervivencia frente a la cirugía únicamente y a la cirugía con QT adyuvante55,56. En pacientes con estadio > IB en los que directamente se haya realizado cirugía por problemas en la estadificación prequirúrgica o por urgencia, se debe completar el tratamiento con QT adyuvante57. Actualmente, la RT no se recomienda tras pacientes con cirugía R0 y no ha mostrado beneficio en combinación con QT adyuvante58.
En pacientes con AG avanzado o metastásico no operable (estadio IV), el tratamiento de primera línea recomendado es un doble régimen de QT basado en fluoropirimidina y platino. La combinación con trastuzumab en pacientes con expresión de HER2 y la combinación con nivolumab en pacientes con expresión a PDL1 (combined positive score [CPS] > 5) han demostrado mayor supervivencia que la QT sola59,60. En estos pacientes se recomienda realizar controles de TC toracoabdominopélvica cada 6-12 semanas3. Recientemente, se han publicado varios estudios que muestran aumento de la supervivencia general y supervivencia libre de enfermedad en pacientes seleccionados con carcinomatosis peritoneal limitada tratados con citorreducción y la QT intraperitoneal hipertérmica (HIPEC)61–63. Esto ha propiciado que diversos grupos establezcan una serie de criterios de selección de pacientes subsidiarios a CRS e HIPEC con intención curativa, entre los que destaca el Chicago Consensus Working Group64. En nuestro centro, actualmente se considera como indicación a los pacientes con AG con citología positiva o implantes peritoneales macroscópicos con un ICP ≤ 6 puntos, en los que sea posible alcanzar una citorreducción completa en ausencia de enfermedad extraperitoneal.
ConclusiónUna correcta estadificación clínica por imagen del AG requiere conocer la última actualización del sistema de clasificación TNM y sus vías de diseminación. Los hallazgos radiológicos que afectan al estadio clínico, el tratamiento y el pronóstico de los pacientes con AG son la afectación de la grasa perigástrica, la afectación ganglionar, la afectación de ligamentos perigástricos, la invasión directa de órganos adyacentes y las metástasis.
- •
La 8.ª edición del TNM muestra 3 cambios importantes respecto a la 7.ª edición.
- •
La infiltración de los ligamentos perigástricos implica una diseminación subserosa del tumor (al menos afectación cT3) y excluye la gastrectomía por laparoscopia.
- •
La categoría clínica N se basa en la presencia o ausencia de la afectación ganglionar, sin importar el número de ganglios afectados. La afectación de ganglios no regionales se considera M1.
- •
Existen 6 vías de diseminación: linfática, subperitoneal, invasión directa, transperitoneal, hematógena e invasión venosa extramural.
1. Responsable de la integridad del estudio: PLS, MLE, EII, AAR, MIAO y MZE.
2. Concepción del estudio: PLS, MLE, EII, AAR, MIAO y MZE.
3. Diseño del estudio: PLS, MLE, EII, AAR, MIAO y MZE.
4. Obtención de los datos: PLS, MLE, EII, AAR, MIAO y MZE.
5. Análisis e interpretación de los datos: PLS, MLE, EII, AAR, MIAO y MZE.
6. Tratamiento estadístico: no procede.
7. Búsqueda bibliográfica: PLS, MLE, EII, AAR, MIAO y MZE.
8. Redacción del trabajo: PLS.
9. Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: MLE, EII, AAR, MIAO y MZE.
10. Aprobación de la versión final: PLS, MLE, EII, AAR, MIAO y MZE.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.