Definimos el aneurisma de aorta abdominal como la dilatación de la aorta abdominal mayor de 3cm. Su prevalencia se sitúa entre 1 y 1,5 casos por cada 100 personas, constituyendo una importante causa de morbimortalidad. Raro en mujeres, su frecuencia aumenta con la edad y su localización más frecuente es entre las arterias renales y la bifurcación aorto-ilíaca. Aproximadamente un 5% de los casos va a comprometer las ramas viscerales.
Se trata de un proceso patológico silencioso cuya evolución natural es la rotura, que muchas veces tiene un desenlace fatal y cuyo diagnóstico forma parte de la enfermedad que nos encontraremos en la radiología de Urgencias. La implicación del radiólogo y la elaboración de un informe diagnóstico preciso, lo antes posible, es fundamental para la toma de decisiones por parte del equipo que se encargue de la cirugía del paciente.
Abdominal aortic aneurysm is defined as a dilatation of the abdominal aorta greater than 3cm. Its prevalence is between 1 and 1.5 cases per 100 people, constituting an important cause of morbidity and mortality. Rare in women, its frequency increases with age and its most frequent location is between the renal arteries and the aorto-iliac bifurcation. Approximately 5% of cases will involve the visceral branches.
It is a silent pathological process whose natural evolution is rupture, which often has a fatal outcome and whose diagnosis is part of the pathology that we will find in emergency radiology. The involvement of the radiologist and the preparation of an accurate diagnostic report, as soon as possible, is essential for decision-making by the team in charge of the patient's surgery.
La prevalencia del aneurisma de aorta abdominal (AAA) en la población general es de 1-1,5 casos por cada 100 personas. Sigue siendo una importante causa de morbimortalidad y la mortalidad derivada de su rotura supone el 1-2% de todas las muertes del mundo occidental, y la décima causa de muerte en mayores de 55 años en Estados Unidos1–5.
El desarrollo de un AAA es un proceso silencioso cuya evolución natural es la rotura, la cual muchas veces tiene un desenlace fatal. Con un diámetro de entre 4 y 5cm, el riesgo de rotura es del 1-4%, incrementándose hasta el 10% cuando el aneurisma alcanza el diámetro de 5-6cm. En la literatura, esta enfermedad parece cumplir los criterios para establecer un programa de detección poblacional, con el objetivo de disminuir la muerte directamente atribuible a la existencia del aneurisma6. Existen varios estudios clínicos que determinan que un screening poblacional sería efectivo en algunas economías sanitarias (Reino Unido, Suecia y Dinamarca), pero se tardará hasta 10 años en alcanzar la eventual evidencia científica que apoye su instauración7. Si bien la rotura de los AAA tiene una mortalidad del 85-90%, el tratamiento electivo del aneurisma tiene una mortalidad inferior al 3-5%8.
Hasta el 75% de los AAA son asintomáticos4 y en muchos casos la primera evidencia de que existen surge cuando se rompen y los pacientes acuden al hospital con sintomatología aguda. El manejo del AAA ha variado fundamentalmente en las 3 últimas décadas, desde la cirugía abierta como única alternativa, a la introducción de la técnica de reparación endovascular del aneurisma de aorta (EVAR). Fue en septiembre de 1990 cuando Parodi trató con éxito en Buenos Aires el primer caso de EVAR de la historia9.
Con la introducción del EVAR y las mejoras en el manejo anestésico y perioperatorio ha aumentado la supervivencia de los pacientes tratados. Esta técnica ha permitido la reparación en pacientes de edad más avanzada o con una mayor comorbilidad para la cirugía abierta y hoy en día la mortalidad perioperatoria de los pacientes octogenarios es comparable con la de los pacientes más jóvenes10.
La elaboración de un informe preciso y concreto es de vital importancia para la toma de decisiones en el manejo de estos pacientes, siendo fundamental la implicación del radiólogo. El objetivo del presente trabajo es aportar una guía orientativa a la hora de elaborar el informe radiológico.
Cirugía abierta frente a EVARLa presentación clínica de un AAA roto (AAAr) frecuentemente es sutil y confusa, con signos que abarcan desde el síncope, pérdida de consciencia o hipotensión transitoria, hasta un simple dolor de espalda. La tríada clásica comprende dolor abdominal o lumbar, hipotensión y masa abdominal pulsátil, aunque esta clínica solo está presente en un 25-50% de los pacientes11–14.
En la actualidad, el gold standard como prueba de imagen ante la sospecha de un AAAr es la tomografía computarizada (TC). Una angio-TC abdominopélvica con cortes de 1mm dará la información suficiente para determinar si el paciente es candidato a EVAR y, en ese caso, obtener las medidas necesarias para la planificación del procedimiento. Ha de realizarse este estudio en pacientes estables (recomendación clase I, nivel de evidencia B) e incluso sopesarse en pacientes inestables hemodinámicamente (recomendación clase II, nivel de evidencia B)14. En casos emergentes, el paciente ha de ser llevado a quirófano de forma inmediata para una cirugía abierta o una aortografía intraoperatoria que determine la viabilidad de realizar un EVAR14.
El ensayo IMPROVE15, que comparaba ambas técnicas, no demostró diferencias en la mortalidad a 30 días (35% EVAR, 37% cirugía abierta) ni a un año. Sí demostró mejor calidad de vida, disminución de la estancia hospitalaria y del gasto, y una mayor supervivencia a 3 años con tratamiento endovascular y niveles similares de reintervención en ambas técnicas. En la actualidad las guías europea y americana16,17 recomiendan el tratamiento endovascular siempre que anatómicamente sea factible con evidencia B (moderada, guía europea) y C (baja, guía americana). Las guías NICE18 (Reino Unido) determinan que el EVAR aporta un mayor beneficio para la mayoría de pacientes, especialmente varones por encima de los 70 años y mujeres de cualquier rango de edad, y la cirugía abierta, un mayor equilibrio beneficio-riesgo en menores de 70 años. El EVAR presenta una disminución de la mortalidad precoz, pero este beneficio no se mantiene en el medio y largo plazo debido a la aparición de complicaciones.
Por todo ello, no se recomienda la decisión de realizar EVAR de manera rutinaria, aunque esta sea factible, sino que esta decisión dependerá de la edad, las comorbilidades del paciente, las cirugías abdominales previas, las consideraciones anatómicas y la experiencia del equipo de trabajo.
Tipos de EVAREVAR estándar: se trata de endoprótesis aórticas preformadas que suelen constar de 2 componentes: un cuerpo bifurcado y extensiones. La tela protésica de politetrafluoroetileno (PTFE, registrado como TeflonTM) se cose a una estructura metálica de soporte mediante suturas no reabsorbibles de hilo trenzado de poliéster, polipropileno monofilamento o PTFE expandido/fluoroetileno-propileno laminado. Los stents de soporte se fabrican en alambre de nitinol o de acero inoxidable. Suelen tener unas marcas radiopacas que permiten la comprobación de su posición una vez colocadas.
EVAR con chimeneas (CHEVAR): surge como una técnica de rescate que permite mantener ramas viscerales que se ocluirían con la colocación del cuerpo protésico.
Se solapa una endoprótesis convencional sobre los stents recubiertos, que se encuentran colocados en las ramas viscerales o arterias renales, con el fin de mantener su permeabilidad al mismo tiempo que se consigue una zona de sellado óptima.
Endoprótesis fenestradas (FEVAR): existen ciertas limitaciones con las endoprótesis convencionales en presencia de un aneurisma yuxtarrenal o suprarrenal, en el que no existe una zona sana de pared aórtica donde apoyar los stents del dispositivo. Para ello se han desarrollado las endoprótesis fenestradas. Estas prótesis presentan orificios en el cuerpo, que se corresponden con el ostium de salida de las arterias viscerales y arterias renales involucradas en el aneurisma, con el objetivo de evitar su oclusión. Tras la colocación del cuerpo fenestrado, se coloca el stent recubierto en la arteria correspondiente. Estas prótesis se realizan a medida, ajustándose a los requerimientos anatómicos individuales de cada paciente, por lo que no se podría disponer de ellas para un caso urgente.
Endoprótesis ramificadas (BEVAR): se trata de un cuerpo protésico principal al que se le añaden prótesis secundarias (stents recubiertos) a través de las cuales se canalizan las diferentes arterias implicadas en el aneurisma. Dentro de este grupo, existen prótesis con ramas externas al cuerpo principal y, más recientemente se han desarrollado prótesis con ramas internas. Actualmente existe en el mercado una endoprótesis de ramas internas no customizada que podría abarcar un amplio margen de pacientes con AAAr no subsidiarios de EVAR estándar, por lo que podría ser una alternativa eficaz. De momento, son necesarios estudios prospectivos que determinen su idoneidad (fig. 1).
Informe radiológicoTanto si se va a realizar una cirugía abierta como si el tratamiento del AAAr es mediante reparación endovascular, existen unas consideraciones indispensables que han de reflejarse en el informe diagnóstico de manera sistemática para describir los hallazgos. No obstante, este artículo se centra en la reparación endovascular ya que es en este caso donde el informe radiológico debe ser más específico.
Lo primero que se debe valorar es la identificación del propio aneurisma de aorta roto o, en su defecto, signos de rotura inminente. La sospecha clínica puede ser de ayuda para elaborar el diagnóstico y, en este caso, la presencia de dolor per se asociado a un aneurisma abdominal aumenta la morbimortalidad del paciente, ya que el dolor es un signo asociado a la expansión y rotura del aneurisma6.
Existen diversos signos radiológicos que son de ayuda para diagnosticar si se trata de una rotura inminente, si el aneurisma ya se encuentra roto y está sangrando o si, por el contrario, se trata de una rotura crónica o contenida del mismo (tabla 1)19.
Signos radiológicos en un aneurisma de aorta abdominal
| Signos de alto riesgo de rotura/rotura inminente del AAA | Signos de rotura del AAA | Rotura contenida crónica |
|---|---|---|
| Crecimiento acelerado del saco: 6-12 mm/año | Hematoma retroperitoneal (40-70 UH) | Signo de la aorta caídab: asociado a rotura contenida crónica, que debe de cumplir lo siguiente:– Aneurisma de aorta abdominal conocido– Síntomas agudos previos resueltos– Paciente hemodinámicamente estable con hematocrito normal– Tomografía computarizada que evidencia hemorragia retroperitoneal o aorta caída con un trombo organizado |
| Morfología sacular o muy excéntrica | Hematoma en la raíz del mesenterio | |
| Ausencia de trombo o adelgazamiento de la pared del saco aneurismático | Colección hemática en musculatura del psoas con ausencia del plano de clivaje con el saco aneurismático | |
| Ulceración de la pared aórtica o ulceración de novo del trombo mural. Fragmentación del trombo mural existente | Extravasación activa de contraste fuera del saco aneurismático | |
| Semiluna hiperdensaa | ||
| Signo de la aorta caída o draped aortab | ||
| Discontinuidad del calcio parietal alojado en la capa íntima de la arteria | ||
| Aneurismas micóticos/inflamatorios |
UH: unidades Hounsfield.
La localización del aneurisma es fundamental ya que va a condicionar la elección de la prótesis. Lo más frecuente es que el aneurisma se encuentre alojado entre las arterias renales y la bifurcación aorto-ilíaca. Aproximadamente un 5% de los casos va a comprometer las ramas viscerales20.
Es necesario valorar el número y la localización de arterias viscerales implicadas en el saco del aneurisma abdominal. Fundamentalmente encontraremos que la arteria mesentérica inferior nace de la pared del saco y será una arteria que se excluye tanto en la cirugía abierta como con la implantación del cuerpo protésico. Gracias a la circulación colateral procedente del arco de Riolano esta exclusión no va a generar implicaciones clínicas en la mayoría de los casos (fig. 2).
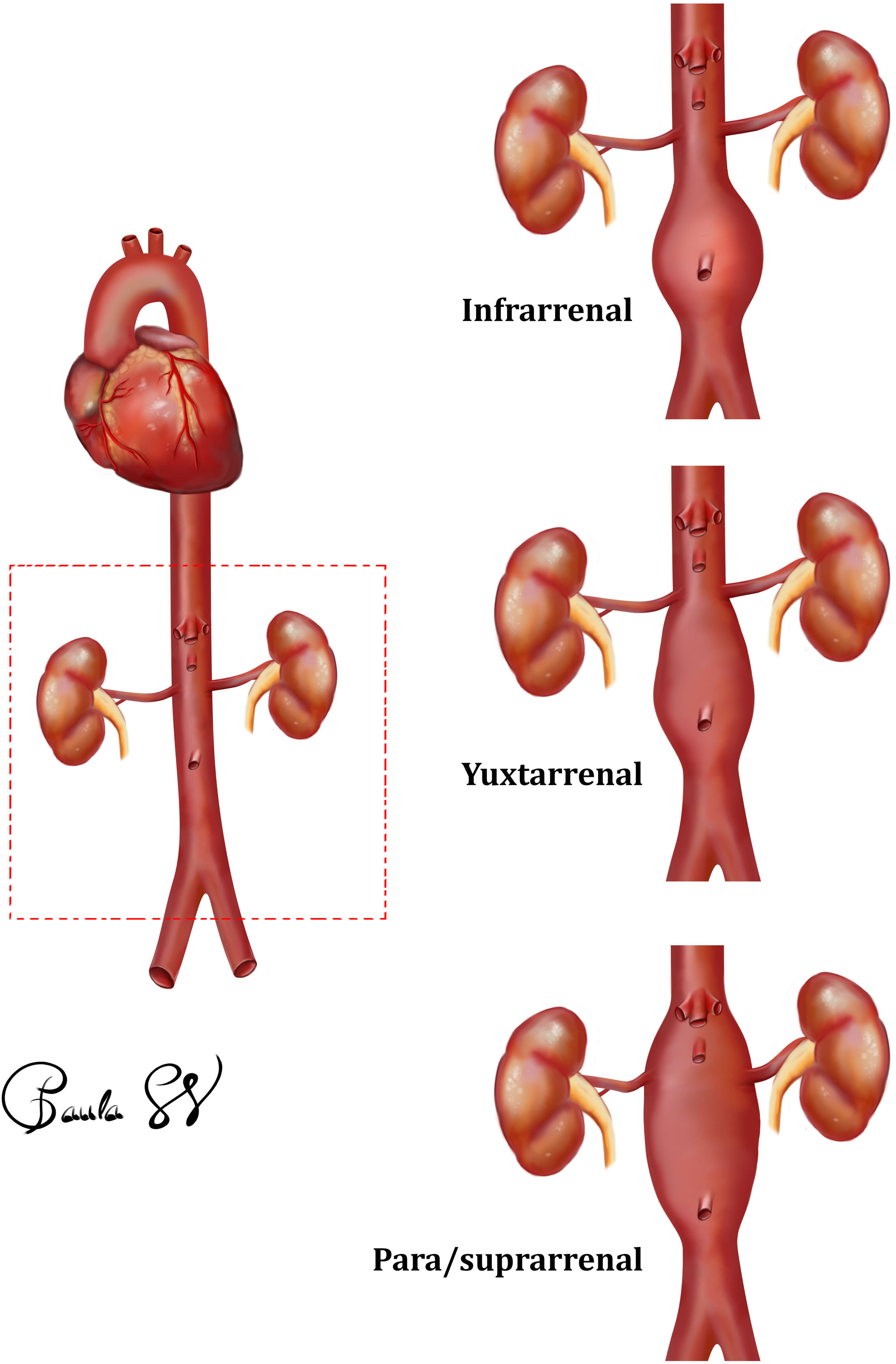
Infrarrenal: el AAA se sitúa por debajo del nacimiento de ambas arterias renales. En este caso es necesario saber cuál es la distancia desde la arteria renal más baja hasta el inicio del saco aneurismático y también conocer si ese espacio, llamado cuello, tiene una pared aórtica sana (libre de trombo y placas de ateroma) o no, ya que es en esta localización donde se va a anclar el stent de fijación del cuerpo de la endoprótesis. Es importante saber qué tipo de morfología presenta el cuello del aneurisma (si es cónico, cónico invertido, qué angulación presenta respecto al eje de la aorta, etc.) y qué diámetro tiene. Con base en las especificaciones de uso de los diferentes dispositivos, el rango de tratamiento abarca de 18 a 32mm; no obstante, un diámetro mayor de 28mm aumenta el riesgo de complicaciones asociadas.
En este punto hemos de conocer el concepto de cuello hostil21. Se trata de aquellos cuellos que cumplan con alguna o todas estas consideraciones:
- –
Longitud de entre 15 y 10mm.
- –
Diámetro mayor de 28mm.
- –
Angulación superior a los 60 grados.
- –
Calcificación de la pared aórtica superior al 50%.
- –
Trombo circunferencial.
- –
Morfología cónica.
En la medición del cuello del aneurisma es necesario conocer que existen 2 ángulos:
- -
El ángulo alfa/α o ángulo suprarrenal: se trata del ángulo que se forma entre el eje central del segmento de aorta suprarrenal y el cuello proximal.
- -
Ángulo beta/β o ángulo infrarrenal: formado entre el eje del cuello proximal y el eje de la luz del saco aneurismático. Nos referimos siempre a este ángulo β cuando afirmamos que la angulación del saco aneurismático respecto al eje de la aorta abdominal debería ser <60 grados.
Yuxtarrenal: si el AAA comienza infrarrenal pero la distancia desde la renal más baja al saco es inferior a los 15mm de longitud, puede no existir una longitud adecuada para la fijación del cuerpo del stent. En algunas ocasiones se trabaja fuera de las instrucciones de uso de los dispositivos, realizando EVAR estándar en cuellos de hasta 10mm. Si esto no es posible, habría que plantearse la reparación endovascular mediante técnica CHEVAR o cirugía abierta.
Para/suprarrenal: el saco aneurismático incluye ambas arterias renales, pudiendo abarcar también la salida del tronco celiaco y de la arteria mesentérica superior (AMS). En este caso, las alternativas son la colocación de una prótesis con chimeneas o la cirugía abierta (resección del aneurisma e interposición de injerto y reimplante o bypass de todas las ramas arteriales implicadas).
SacoSe debe indicar cuál es el tamaño del saco, si presenta trombo mural y, en caso de que exista, si tiene una distribución concéntrica o no y cuál es la luz que deja para el paso de sangre. Es imprescindible valorar la angulación del saco aneurismático respecto al eje de la aorta abdominal, siendo lo recomendable angulaciones inferiores a 60 grados en el EVAR.
Se debe determinar la longitud del saco, indicando dónde empieza (localización para/supra/yuxta o infrarrenal) y dónde finaliza el mismo, y si incluye a la bifurcación ilíaca caudalmente.
El saco aneurismático puede presentar morfología fusiforme, que es la más frecuente, o morfología sacular o en «reloj de arena». Los aneurismas micóticos o inflamatorios pueden evidenciarse como un engrosamiento de la pared aórtica: el aspecto fibrótico, la aparición de una estriación periaórtica o un aneurisma sacular focal de localización atípica deben hacer sospechar un aneurisma micótico o secundario a un proceso inflamatorio, los cuales tienen un riesgo de rotura mayor (53-75%)22 y cuyo tratamiento debe ser valorado cuidadosamente ya que en el caso de realizar un EVAR (material protésico que no deja de ser un cuerpo extraño), se ha de tener en cuenta el eventual proceso infeccioso-inflamatorio subyacente.
Cono aórticoDiámetro del cuello distal. En casos con un cuello aórtico distal inferior a 18mm se debería considerar la colocación de una prótesis aorto-uniilíaca.
Accesos arterialesLa reparación mediante técnica EVAR se realizará mediante abordajes arteriales femorales, por lo que es vital conocer el estado de las arterias femorales e ilíacas. Se debe conocer su morfología y diámetro máximo y medio en ambos lados; si existe oclusión o estenosis de la luz arterial y, en este caso, cuál es el diámetro menor.
Se ha de indicar también si ambas arterias hipogástricas son permeables.
Las condiciones óptimas son que ambas arterias ilíacas comunes dispongan de una longitud de al menos 15mm previa a su bifurcación para obtener una buena longitud de sellado y que presenten entre 8 y 22mm de diámetro.
Se señala también el concepto de ilíacas hostiles:
- -
Excesiva angulación.
- -
Ateromatosis severa de distribución difusa que condicione estenosis.
- -
Arterias ilíacas comunes aneurismáticas: en estos casos suele ser necesaria la embolización de la arteria hipogástrica ipsolateral durante el procedimiento para conseguir el sellado distal en la arteria ilíaca externa.
- -
Variantes anatómicas: venas renales retro o circunaórticas.
- -
Existencia de arterias renales polares, determinando la localización de su origen en el informe.
- -
Las estenosis arteriales: puede condicionar la viabilidad orgánica e incluso la del propio paciente. La preexistencia de estenosis en el tronco celiaco, la AMS o las arterias renales es especialmente importante si la reparación es con técnica CHEVAR, donde se va a manipular endovascularmente estas arterias.
- -
Existencia de aneurismas viscerales.
- -
Existencia de arterias lumbares hipertróficas que puedan dar lugar a endofugas tipo II.
- -
Procesos concomitantes no conocidos: se ha de señalar la existencia de lesiones ocupantes de espacio o complicaciones derivadas de un proceso oncológico o infeccioso abdominal.
- -
En el caso de la cirugía abierta, se puede indicar también en el informe la existencia de cirugías abdominales previas, hecho que aumenta la morbilidad del procedimiento.
Se considera que existe un AAA cuando su diámetro supera los 3cm. La existencia de un aneurisma de 7cm implica un riesgo de rotura de hasta un 25% al año22. A pesar de que no es necesario determinarlo, si se busca el punto de rotura del aneurisma, hay que tener en cuenta que la mayoría ocurren en la cara posterolateral.
Existe una serie de medidas necesarias para valorar, en el caso de que se haya decidido la reparación mediante técnica EVAR, qué tipo de prótesis tendremos que utilizar y de qué dimensiones.
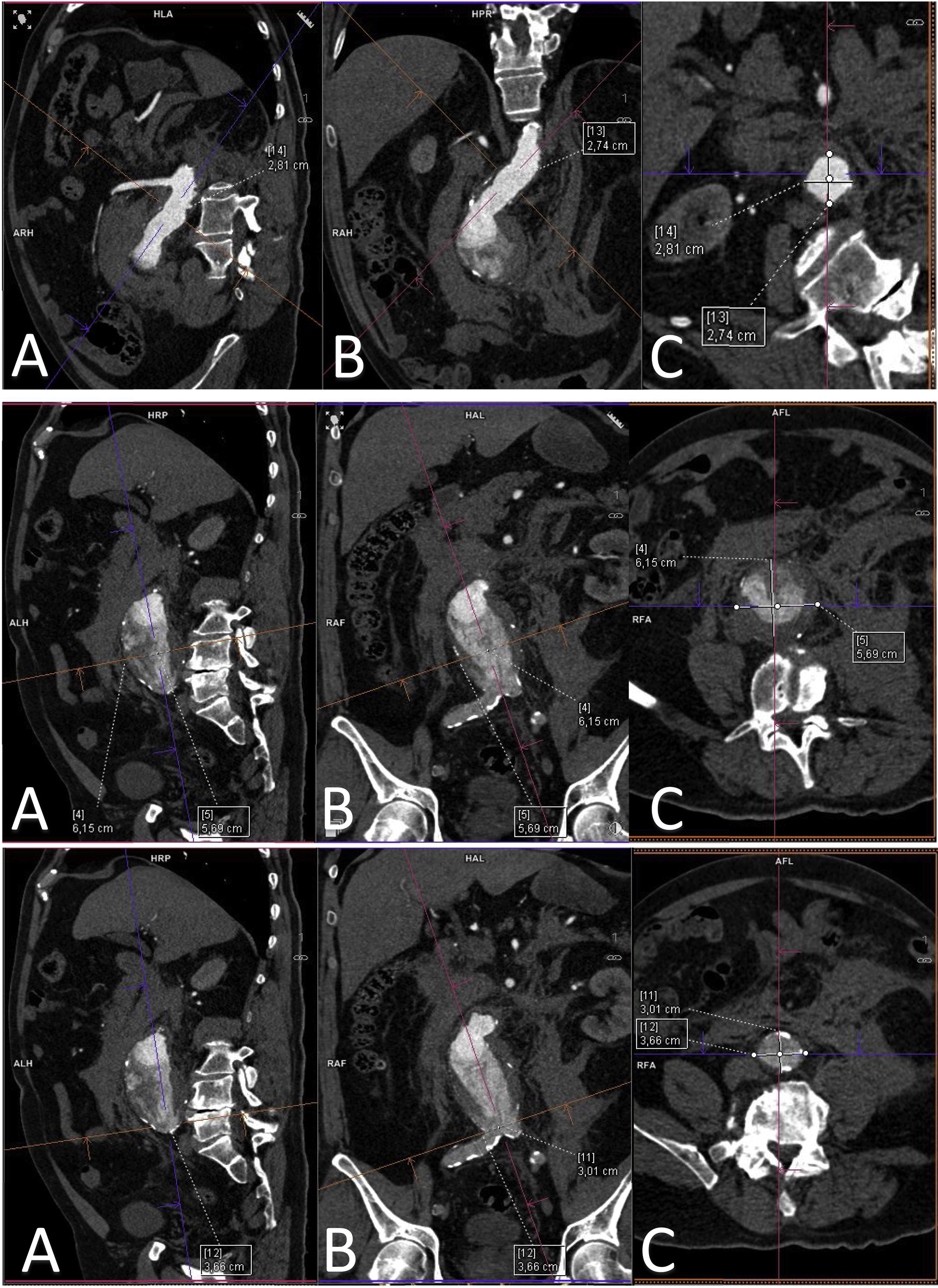
Es fundamental cuando se realiza una medición aórtica, especialmente cuando es preciso valorar un aneurisma para evaluar su crecimiento o establecer las dimensiones en un EVAR, que cada una de las medidas se realice de manera ortogonal con el eje variable de la aorta en cada plano. Esto significa que para cada medida que se realice, tenemos que angular el eje aórtico en los 3 planos del espacio, lo cual proporciona unas medidas reales de las dimensiones (fig. 3).
Aneurisma de aorta abdominal roto con mediciones en planos ortogonales de cuello infrarrenal (imagen superior) y saco aneurismático (imagen central). Aneurisma de aorta abdominal roto con mediciones en planos ortogonales y diámetro del saco previo a la bifurcación ilíaca. Las imágenes se distribuyen en planos sagital (A), coronal (B) y axial (C).
Cabe destacar también los conceptos de reconstrucción multiplanar (MPR), que son imágenes bidimensionales en múltiples planos del espacio y la proyección de intensidad máxima), que permite analizar con mayor precisión la pared del vaso y la distribución del calcio (fig. 3).
Existe una herramienta en la reconstrucción de las imágenes, dentro del análisis curvo con MPR, que es la línea central de la luz (central luz line). Tiene por objetivo la recreación virtual del aneurisma estirado a lo largo del eje central de la luz del vaso. Esta herramienta, útil, ya que nos va a permitir medir diámetros, no deja de ser una medición automática del software, que eventualmente puede incurrir en errores. Las longitudes y los diámetros estimados pueden no coincidir con las longitudes finales de la arteria, por lo que siempre es recomendable su verificación con medición manual para ser muy precisos a la hora de elegir el material protésico.
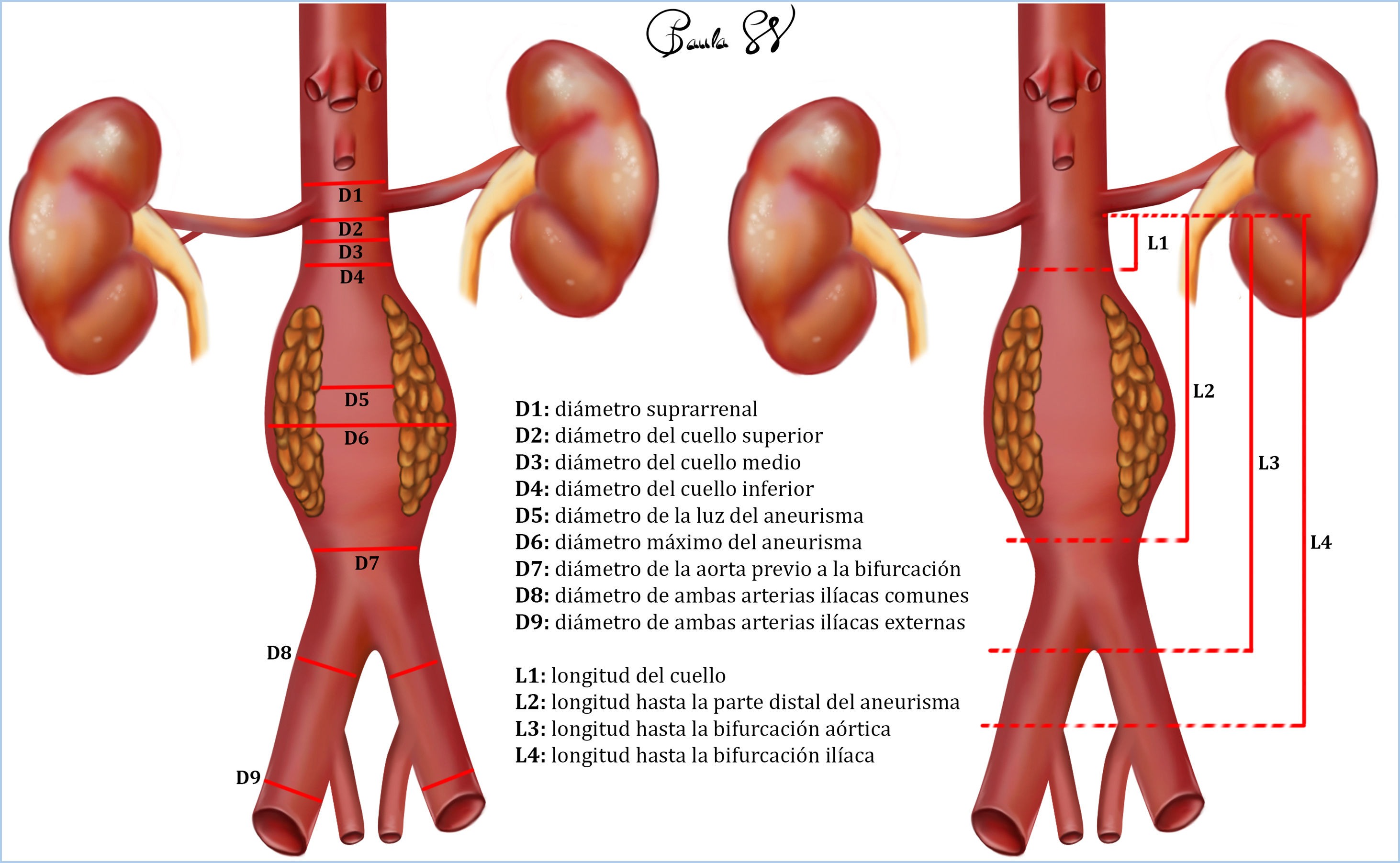
Las medidas necesarias para la planificación de un EVAR se reflejan en el siguiente esquema. Estas mediciones serán realizadas por el facultativo a cargo de la cirugía, para elegir el tipo y la medida de cada prótesis (fig. 4).
De todas ellas, hay unos datos básicos que sí se han de aportar en el informe:
- -
D2: diámetro del cuello infrarrenal.
- -
D7: diámetro de la aorta previo a la bifurcación.
- -
D8: diámetro de ambas arterias ilíacas comunes.
- -
D9: diámetro de ambas arterias ilíacas externas.
- -
Diámetro de ambas arterias femorales comunes.
La toma de decisiones frente a un AAAr ha de ser sistemática y ha de llevarse a cabo con la mayor rapidez posible. Para ello, es necesario tener clara la morfología del aneurisma ya que esto va a condicionar el tipo de intervención y el tipo de prótesis. Con el objetivo de facilitar y esquematizar los hallazgos de la TC abdominal, se propone a continuación un esquema de informe predefinido21,23 que recoja de manera estructurada los datos necesarios (tabla 2).
Propuesta de informe estructurado
| NOMBRE DEL PACIENTE: | |
| NHC: | |
| FECHA: | |
| DIAGNÓSTICO: | |
| Aneurisma de aorta abdominal roto/contenido | |
| LOCALIZACIÓN: | |
| - Infrarrenal: | |
| - Arteria renal más baja: derecha/izquierda | |
| - Longitud desde la arteria renal más baja: ()mm | |
| - Yuxtarrenal: | |
| - Longitud del cuello: ()mm | |
| - Para/Suprarrenal: | |
| - Arterias implicadas: | |
| - Estenosis viscerales: sí/no. | |
| CUELLO: | |
| - Longitud: ()mm | |
| - Estado del cuello: | |
| - Cuello hostil: sí/no | |
| - Trombo /Calcio: sí/no | |
| - Ángulo: > ó < 60 grados | |
| MORFOLOGÍA DEL SACO: | |
| - Fusiforme/Sacular | |
| - Trombo mural: sí/no | |
| Circunferencial: sí/no | |
| Excéntrico: sí/no | |
| - Diámetro de la luz aórtica: ()mm | |
| - Angulación respecto al eje aórtico: ()mm | |
| - Longitud: ()mm | |
| Incluye iliacas: sí/no | |
| - Arterias polares renales implicadas: sí/no | |
| ACCESOS ARTERIALES: | |
| - Diámetro de arterias iliacas externas y arterias femorales comunes: ()mm | |
| Calcio: sí/no | |
| Tortuosidad: sí/no | |
| OTROS HALLAZGOS SIGNIFICATIVOS: | |
| - Variantes anatómicas: sí/no. Localización | |
| - Aneurismas viscerales: sí/no. Localización | |
| - Arterias lumbares hipertróficas: sí/no | |
| - Procesos concomitantes (paciente oncológico, alteraciones abdominales concurrentes): sí/no | |
| - Cirugías abdominales previas: sí/no | |
| - Sospecha aneurisma de aorta abdominal micótico: sí/no | |
| - Calibre de la arteria mesentérica inferior | |
| COMENTARIOS: |
El AAAr constituye una urgencia médica con una alta morbimortalidad y un reto para el radiólogo general. La implicación del radiólogo en un análisis riguroso de la morfología y las características del aneurisma es fundamental en la elaboración de un informe preciso, necesario para la toma de decisiones que van a condicionar el mejor procedimiento que podemos ofrecer a los pacientes.
Autoría- 1.
Responsables de la integridad del manuscrito: SLL, PCÁ y PSV.
- 2.
Concepción del manuscrito: SLL.
- 3.
Diseño del manuscrito: SLL, PCÁ y PSV.
- 4.
Obtención de los datos: no aplicable.
- 5.
Análisis e interpretación de los datos: no aplicable.
- 6.
Tratamiento estadístico: no aplicable.
- 7.
Búsqueda bibliográfica: SLL, PCÁ y PSV.
- 8.
Redacción del trabajo: SLL, PCÁ y PSV.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SLL, PCÁ y PSV.
- 10.
Aprobación de la versión final: SLL, PCÁ y PSV.
Los autores declaran no tener ningún conflicto de intereses.