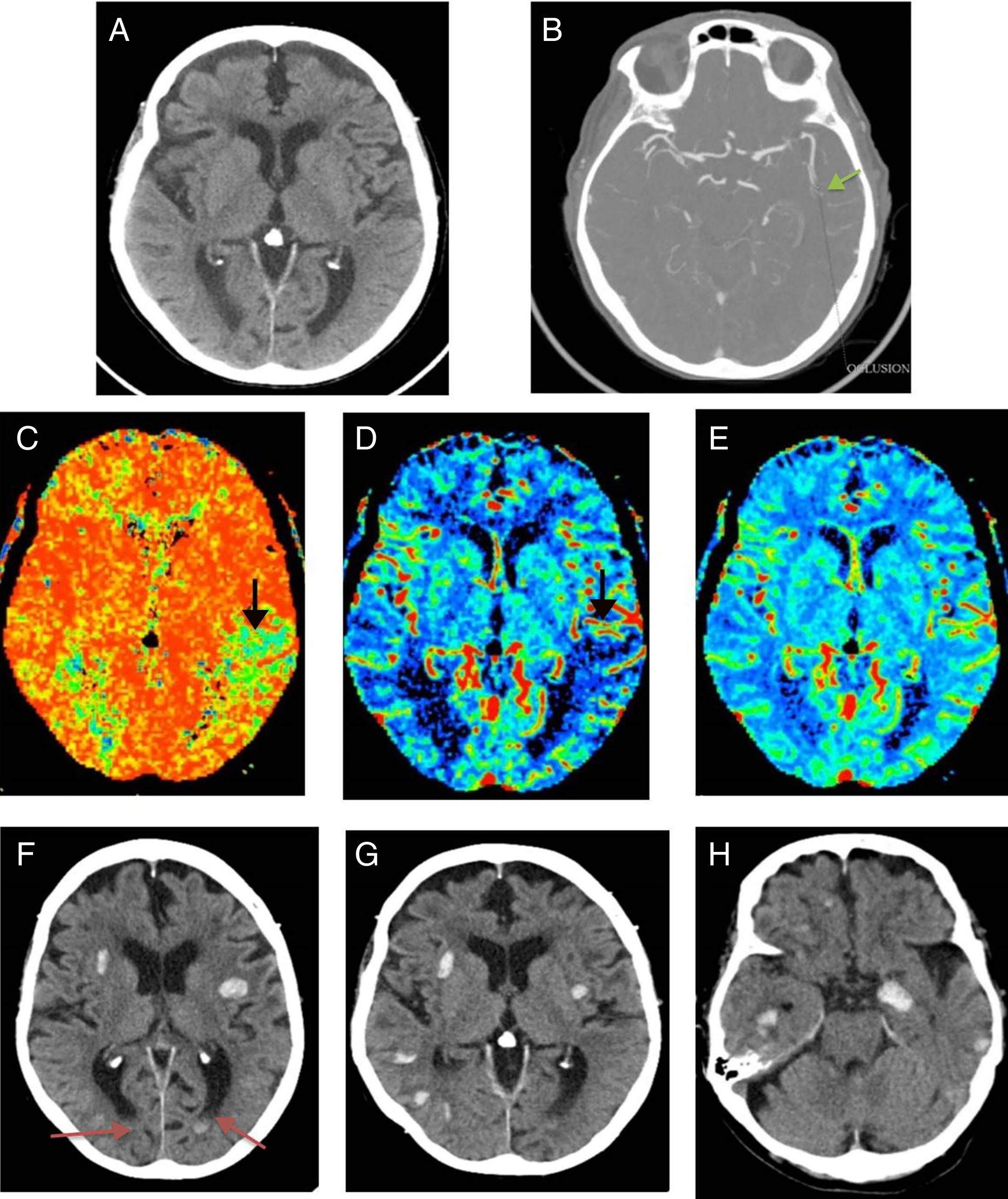
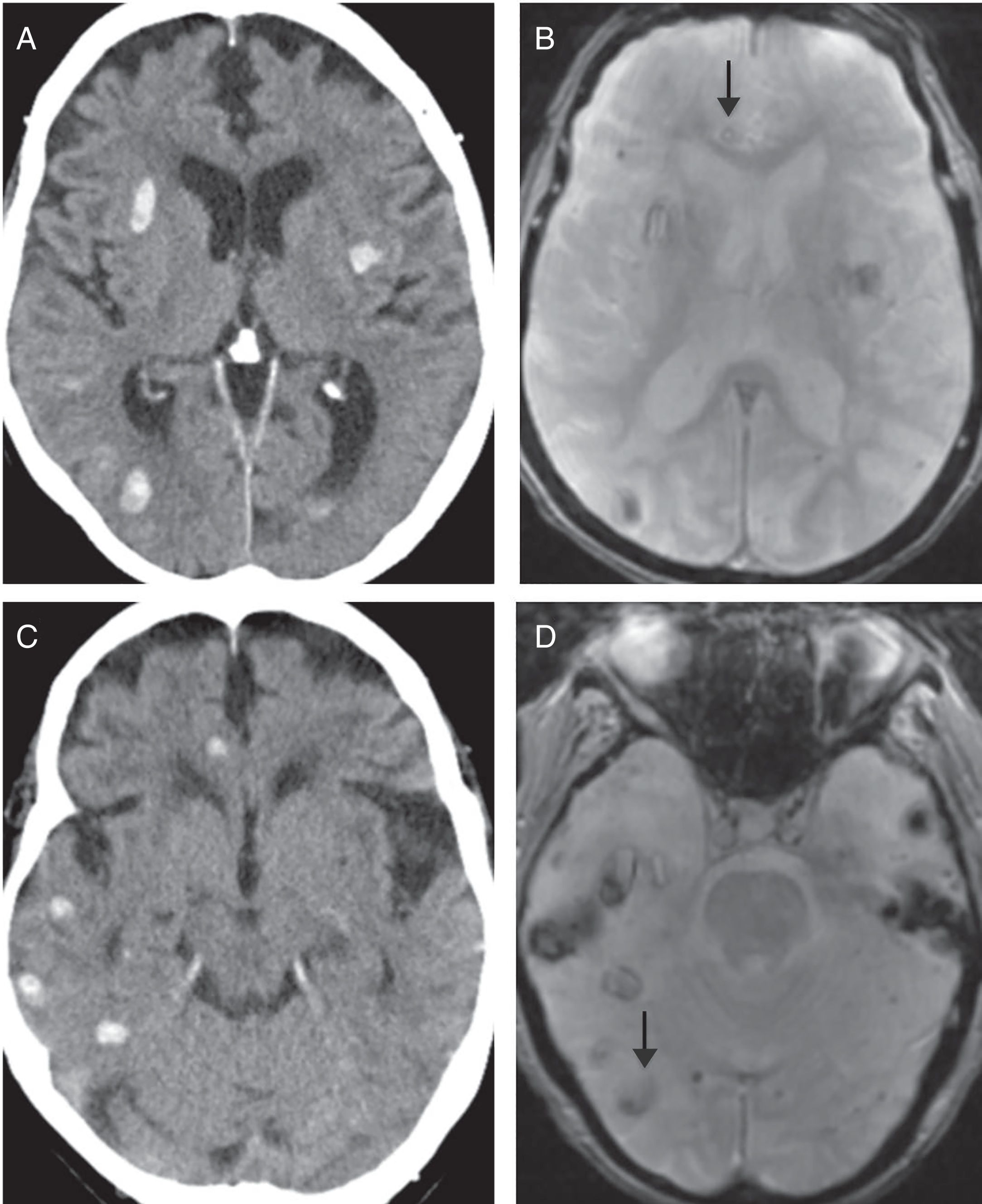
Presentamos el caso de una mujer de 90 años con antecedentes de accidente isquémico transitorio carotídeo izquierdo y estenosis aórtica leve. Acudió a urgencias con afasia motora de inicio desconocido. En la exploración física se obtuvo un NIHSS 5. Se activó el Código Ictus y se realizaron tomografía computarizada (TC) cerebral, TC de perfusión cerebral y angio-TC de troncos supraaórticos-polígono de Willis, que pusieron de manifiesto un estudio basal con ASPECTS 10, un área de penumbra isquémica en el territorio de la arteria cerebral media izquierda y un trombo en el segmento M2 distal ipsilateral (fig. 1 A-E). A pesar de la edad avanzada de la paciente, dada la buena calidad de vida previa y los hallazgos de las pruebas de imagen, se inició terapia fibrinolítica. Pasadas 24 horas postratamiento, la paciente mostró mayor deterioro neurológico. Se solicitó una TC cerebral de control donde se visualizaron múltiples focos de sangrado intraparenquimatosos lobares y difusos (fig. 1 F-H). La distribución de los focos hemorrágicos, alejados del territorio afectado por el área de penumbra, descartó una transformación hemorrágica. Ante la sospecha de angiopatía amiloide (AA) se solicitó una resonancia magnética (RM) cerebral como prueba complementaria. Con base en los criterios de Boston, la RM apoyó el diagnóstico de “probable” AA, al demostrar múltiples focos de sangrados antiguos visibles en la secuencia eco de gradiente T2 (fig. 2). Al alta, la paciente mantenía un cuadro de disfasia mixta.
A-E) Estudios pretratamiento. Tomografía computarizada (TC) de cerebro sin contraste intravenoso (A), angio-TC-polígono de Willis (B) y estudio de perfusión cerebral (C-E) realizados a la paciente ante la sospecha de ictus isquémico. A) En la TC basal no se observan signos de isquemia aguda (ASPECTS 10). B) En la angio-TC-polígono de Willis se identifica un stop en segmento M2 izquierdo sugestivo de la presencia de trombo. C) Aumento del tiempo de tránsito medio (flecha) visible en los mapas de perfusión. D) disminución del flujo sanguíneo (flecha). E) volumen normal, sin variación en el estudio de perfusión. Las alteraciones mencionadas se localizan en la región parietal izquierda, territorio de la arteria cerebral media izquierda, y son sugestivas de penumbra. F-H) TC cerebral sin contraste, cortes axiales, realizada 24 horas tras el inicio del tratamiento fibrinolítico. Se identifican múltiples focos de sangrado, bilaterales, alejados del área de isquemia, de distribución difusa cortical, lobar y de predominio supratentorial. Núcleos grises profundos respetados. La semiología radiológica de los hallazgos descritos es sugestiva de angiopatía amiloide. Niveles hemáticos en astas ventriculares occipitales izquierdas (flechas en panel F).
Estudio comparativo de resonancia magnética (RM) cerebral secuencia eco de gradiente con tomografía computarizada (TC) cerebral sin contraste intravenoso. Debido a la diferente programación y el distinto grosor de corte empleados en los estudios de TC y RM, utilizando la línea orbitomeatal en la TC y la subcallosa en RM, las imágenes obtenidas no coinciden al 100% en su situación. Para orientarnos en la valoración comparativa, tomamos como referencia las astas ventriculares frontales en A, B y la fosa posterior en C y D. Las flechas señalan focos de hemorragia antiguos visibles en RM secuencia de gradiente, pero no en la TC. Estos hallazgos apoyan el diagnóstico de angiopatía amiloide según los criterios de Boston.
La transformación hemorrágica de un área isquémica cerebral es una complicación frecuente tras el tratamiento fibrinolítico, presente en el 5,8%1 de los casos. Los principales factores de riesgo son la edad avanzada, la hipertensión arterial y el bajo peso corporal. Sin embargo, existe una complicación menos discutida, que aumenta la morbilidad de estos pacientes. Se trata de la hemorragia intracraneal alejada del área isquémica o remota (HICr)2. Este tipo de complicación es vista con un porcentaje del 1,3-3,7%3. Estudios realizados proponen dos posibles asociaciones que podrían explicar la causa subyacente a este tipo de sangrado según la localización. La primera se establece entre la hemorragia de localización profunda con la hipertensión arterial y la segunda entre el sangrado lobar con microsangrados previos que actuarían como marcadores de patología de pequeño vaso subyacente (AA)3.
La AA se debe al acúmulo de la proteína β amiloide en pequeños y medianos vasos, lo que condiciona mayor fragilidad vascular. El envejecimiento constituye el principal factor de riesgo, y es más frecuente en personas de edad avanzada4, las cuales presentan mayor incidencia de patología isquémica cerebral. La principal manifestación radiológica de esta entidad (AA) considerada en los criterios de Boston es la presencia de hemorragias agudas/crónicas de distribución cortical y/o corticosubcortical4. El diagnóstico diferencial debe plantearse con otras patologías que pueden causar sangrado cerebral, como hipertensión arterial, malformaciones cavernomatosas múltiples y traumatismos cerebrales previos. Por tanto, debe realizarse un diagnóstico de exclusión, y es importante tener presente que la característica distribución con respeto de los núcleos grises profundos y el tronco del encéfalo permite distinguirla de la hemorragia secundaria a la hipertensión arterial4.
Como ya se ha comentado, estudios realizados han planteado que existe una posible asociación entre angiopatía amiloide y HICr postratamiento2,3. Los focos de microsangrado, visibles en RM pueden actuar como marcadores de AA concomitante. Basándose en esto, la inclusión de una RM cerebral pretratamiento permitiría predecir el riesgo de sangrado postratamiento5, lo que facilitaría la selección de aquellos candidatos a tratamiento fibrinolítico. No obstante, aún no existen evidencias suficientes para probar este hecho y justificar la contraindicación de tratamiento de una patología grave y prevalente como es el ictus isquémico3.
Por esta razón, se considera fundamental continuar con el diseño de estudios que permitan determinar la utilidad de la RM en la valoración de la asociación entre la presencia de microsangrados previos, el sangrado posfibrinólisis y la evolución de los pacientes.